布鲁氏菌种荧光定量PCR快速检测方法的建立
2017-10-12刘丽娅陆桂丽沈辰峰马晓菁易新萍王金泉
刘丽娅,陆桂丽,王 杰,沈辰峰,马晓菁,薛 晶,叶 锋,易新萍,王金泉,钟 旗
(1. 新疆农业大学动物科学学院,新疆乌鲁木齐 830052;2. 新疆畜牧科学院兽医研究所(动物临床医学研究中心),新疆乌鲁木齐 830000)
布鲁氏菌种荧光定量PCR快速检测方法的建立
刘丽娅1,2,陆桂丽2,王 杰2,沈辰峰2,马晓菁2,薛 晶2,叶 锋2,易新萍2,王金泉1,钟 旗2
(1. 新疆农业大学动物科学学院,新疆乌鲁木齐 830052;2. 新疆畜牧科学院兽医研究所(动物临床医学研究中心),新疆乌鲁木齐 830000)
根据荧光定量PCR原理和技术,通过与GeneBank数据库中布鲁氏菌基因组进行序列比对,选择不同种属布鲁氏菌的特异性位点,设计3对引物和Taqman荧光探针。将3对引物进行独立的种特异荧光定量PCR实验优化,最终实现在1次荧光定量PCR反应中完成对牛种、羊种、猪种布鲁氏菌的鉴别和定量。该检测方法特异、敏感、快速,既能实现对布鲁氏菌的分种,又能实现定量快速检测,对于布鲁氏菌病的流行病学调查和防治都具有重要意义。
布鲁氏菌;荧光定量PCR;检测方法
Abstract:In this study,three pairs of primers and Taqman fluorescent probes were designed and the specific loci of different species of Brucella were selected by comparing the sequences of the Brucella genome in the GeneBank database,according to the principle and technique of fluorescence quantitative PCR. Three pairs of primers were used to optimize the specific quantitative PCR. The final identification and quantification of Brucella of cattle,sheep and swine were completed in a fluorescence quantitative PCR reaction. The detection method was specific,sensitive and rapid,and it could not only realize the Brucella species,but also achieve rapid quantitative detection,which was very important for the epidemiological investigation of Brucella bacteria and the prevention and treatment of Brucellosis.
Key words:Brucella;fluorescence quantitative PCR;detection method
布鲁氏菌病是由布鲁氏菌引起的一种慢性人兽共患传染病,在我国归为二类动物疫病,呈全球性流行。该病既给畜牧业带来巨大经济损失,也给人的生命安全带来了极大威胁[1-2]。该病以牛、羊、猪感染为主,每年因此造成的经济损失高达数亿美元。检测技术一直是布鲁氏菌病研究的重要领域。传统的细菌学和血清学检测方法存在着阳性率低、假阳性和假阴性的干扰,应用受到限制。随着分子生物学技术的发展,直接检测布鲁氏菌核酸成为可能。Baily等[3]按B.abortus 31 kDa外膜蛋BCSP31基因选定的1对B4、B5 引物用于布鲁氏菌属检测,扩增产物为223 bp片段。这一方法已被国内外多个实验室重复过,被证明是敏感、特异、可靠的布鲁氏菌检测方法,可用于提取的布鲁氏菌DNA、快速煮沸菌体上清液、含菌病料等的检测。本实验建立了3个独立的种特异荧光定量PCR实验。3个定量PCR热循环参数是一致的,使之可以在1次荧光定量PCR反应中完成对牛种、羊种、猪种布鲁氏菌的鉴别和定量。由于PCR产物片段大小不同,可将本实验的引物和实验条件用于常规PCR实验,对布鲁氏菌进行种水平的鉴别。
1 材料与方法
1.1 材料
1.1.1布鲁氏菌和参考菌。布鲁氏菌菌株(B.abortus 544A、104,B.melitensis l6M,B.suis 1330),购于中国预防医学科学院流行病学微生物学研究所布鲁氏菌病室;参考菌株E.coli O:157,Y.enter O:9,均购于中国预防医学科学院流行病学微生物学研究所。
1.1.2属特异引物和荧光探针。用Primer Express 2.0软件设计牛种、羊种、猪种布鲁氏菌特异性引物和Taqman荧光探针,由上海生工生物技术有限公司合成、标记和纯化(表1)。

表1 引物相关情况
1.1.3试剂和仪器
1.1.3.1主要试剂。DNA Purificcation System质粒提取试剂盒、DNA Purificcation System质粒小量纯化试剂盒、RNA酶(Rnase)、蛋白酶K(Protase K),均为美国Promega公司产品;DNA凝胶回收纯化试剂盒,为杭州维特洁公司产品;SDS、琼脂糖、胰蛋白陈、酵母抽提物、氯化钠、Tris、EDTA等试剂,均为国外产品国内公司分装;Pst I、EcoR I、pMD 18-T载体、ExTaq DNA聚合酶、dNTP,均为宝生物大连有限公司产品。
1.1.3.2主要仪器。Bio-Red IQ Detection System(美国BIO-RAD公司产品);HVE-50自动灭菌高压锅(口本平山公司产品);400 L超低温冰箱(德国贺利氏公司产品);PL5241 K纯水器(美国颇尔公司产品);Biofuge台式高速冷冻离心机(德国贺利氏公司产品);TKP-M/WL凝胶成像系统(法国产品);BS210S分析天平(德国S artorius公司产品);BIO-RAD真空泵(美国伯乐公司产品);FTGENEZD型PCR仪(英国Techgene公司产品);移液器(法国吉尔森公司产品);Gene Quant定量仪(瑞典Pharamacia Biotech公司产品)。
1.2 方法
1.2.1活菌记数。将布鲁氏菌在肝汤琼脂斜面培养48 h,离心弃上清。生理盐水重悬,用标准比浊管制成10亿/mL菌液;10倍系列稀释到1×109、1×108、1×107、1×106、1×105、1×104、1×103、1×102、1×101;每个稀释度取 0.2 mL,接种于3个培养板中,每个平板0.1 mL,涂匀。将平板置于37 ℃温箱中培养,48 h后观察菌落数,计算每个稀释度3个平板的平均菌落数,进而得出CFU/mL。
1.2.2DNA提取。取1.0 mL菌悬液于1.5 mL的离心管中。10 000 r/min离心5 min,弃去上清。按照DNA提取试剂盒说明书进行DNA提取操作,将提取的DNA放置-20 ℃保存备用,并将DNA溶液用Gene Quant定量仪测浓度和纯度。
1.2.3阳性质控标准品制作
1.2.3.1牛、羊、猪属特异片段的扩增。以上述布鲁氏菌提取的DNA为模板进行PCR反应。反应体系:Premix 12.5 µL、Primer F 0.5 µL、Primer R 0.5 µL、模板 2 µL、Water 9.5 µL,总体积 25 µL。扩增反应条件:95 ℃变性4 min,94 ℃变性45 s,52.8 ℃退火1 min,72 ℃延伸2 min,共35个循环,最后72 ℃再延伸10 min,4 ℃终止。PCR产物经1%的琼脂糖凝胶电泳,通过核酸染料染色后,紫外灯下观察PCR扩增结果。按照DNA凝胶回收试剂盒说明,回收PCR产物,将其送往上海生物工程有限公司进行测序。
1.2.3.2牛、羊、猪属阳性重组质粒的克隆。将PCR纯化产物与pMD18-T载体连接。连接反应体系为:pMD18-T Vector 1 µL、DNA 3 µL、SolutionI 5 µL、ddH2O 5 µL。连接反应 16 ℃过夜。次日,取出感受态细胞JM109,置37 ℃水浴中;待细胞融化后,立即把离心管转移到冰浴中放置10 min。将连接产物加入到感受态细胞中,轻轻旋转,混匀,冰浴30 min;42 ℃水浴,热应激90 s,冷却1~2 min。每管加200 µL的LB培养基,用水浴将培养基加温至37 ℃,然后将管转移到37 ℃摇床上,培养60 min;最后转移到Amp平板上进行培养过夜。用灭菌牙签挑取可疑菌落接种于含Amp液体LB培养基的试管中培养过夜。提取质粒进行酶切鉴定。取部分菌液加入终浓度30%的甘油保存菌种。
1.2.3.3酶切鉴定。用所选限制性内切酶,分别对阳性重组质粒进行酶切鉴定。酶切反应体系为内切酶各 1 µL、K-Buffer 2 µL、质粒 DNA 5 µL、ddH2O 12 µL。
1.2.3.4质粒提取。对重组质粒的提取,按照质粒提取试剂盒说明书要求进行操作。
1.2.3.5质粒浓度测定。用DNA quent定量仪测定浓度,将纯化质粒稀释100倍,平行作3管,分别测定浓度和A260/A280值。用含有属特异片段的重组子,用分子生物学软件DNAStar统计碱基数,计算重复组质粒的平均分子量。用超纯水将质粒溶液稀释成含 1×109、1×108、1×107、1×106、1×105、1×104、1×103、1×102、1×101、1×100个拷贝/µL的标准阳性质粒,-20 ℃保存备用。
1.2.4荧光定量PCR实验条件的优化
1.2.4.1引物的最适浓度。根据文献报道,大致确定各组分浓度后逐个进行优化,确定其最适浓度。引物经超纯水稀释后的终浓度分别为200、250、300、350、400、450、500、550 nM 8个浓度水平;将所有成分充分预混,最后加入模板,进行荧光定量PCR反应,观察扩增曲线。
1.2.4.2探针的最适浓度。对牛种、羊种、猪种3个基因分别进行探针浓度优化。3个基因上下游引物浓度分别保持在350 nmol/L,探针浓度分别取 200、250、300、350、400、450、500、550 nM 8个浓度梯度;每个浓度梯度做8个平行样。实时PCR反应参数及最佳浓度的选择同引物浓度优化选择方法。
1.2.4.3最适退火温度。在体系各组分浓度最优化后,将退火温度设置为8个温度梯度(55~65 ℃进行实时荧光PCR扩增;同一模板8个平行样3次重复;对扩增所得数据进行分析,得出反应的最优退火温度。
1.2.5实时多重荧光定量PCR反应条件
1.2.5.1牛种、羊种、猪种单重实时多重PCR反应条件。反应体系为:Premix 12.5 µL、Primer F 0.5 µL、Primer R 0.5 µL、探针 0.5 µL、模板 2 µL、水 9 µL,总体积25 µL。扩增反应条件为:95 ℃变性15 s,95 ℃变性 20 s,52.8 ℃退火 20 s,72 ℃延伸 20 s,共40个循环。退火步骤检测荧光信号。
1.2.5.2牛种、羊种、猪种多重实时多重PCR反应条件。反应体系为:Premix 12.5 µL,3对Primer F 分别为 0.5 µL,3对 Primer R 分别为 0.5 µL,3对探针分别为 0.5 µL、模板 2 µL、水 3.5 µL,总体积25 µL。退火步骤检测荧光信号。
1.2.6荧光定量PCR标准曲线的建立。应先将标准阳性对照管、标准阴性对照管(NTC)、待检测样品管的其他组分,按优化的反应体系充分混匀,进行第1次分装;将标准品、NTC对照、待检模板充分混均,分装各管。此过程要确保相同处理,确保各管反应液的均一性,确保各管加样量一致。将已知拷贝数的质粒10倍稀释后作为模板,进行荧光定量PCR扩增,得到相应的动力学曲线,并计算产生相应的标准曲线。
1.2.7重复性试验。用荧光定量PCR仪对3份不同拷贝数的标准品进行重复检测,每个样品重复3次;根据每个稀释度标准品的Ct值进行变异系数计算,以确定该方法的重复性。
1.2.8引物探针特异性检验。应用建立的多重PCR反应体系,分别扩增布鲁氏菌标准菌株和阴性对照菌株的DNA,以检测试验的特异性。
1.2.9实时多重荧光PCR敏感性检测
1.2.9.1单重实时荧光PCR的敏感性检测。分别对牛种、羊种、猪种基因进行检测。将以3个基因为模板克隆的质粒进行10倍稀释制得的梯度标准品,分别取2 µL进行实时荧光PCR。每个稀释度做3个平行样。
1.2.9.2多重实时荧光PCR敏感性检测。在1个多重实时荧光PCR反应体系中,将上述牛种、羊种、猪种3种基因的梯度标准品,分别取2 µL进行实时荧光PCR。
1.2.10临床样品检测。将临床送检的58份血样,用常规SAT、RBPT、常规PCR以及荧光定量PCR方法进行检测。
2 结果与分析
2.1 重组质粒的PCR鉴定
以提取的质粒为模板,对牛种、羊种、猪种布鲁氏菌重组阳性质粒进行常规PCR鉴定。电泳可见有不同长度的特异条带出现(图1)。通过设计特异性引物,能够将牛种、羊种、猪种布鲁氏菌检测出来。PCR扩增大小为牛种86 bp、羊种67 bp、猪种80 bp。
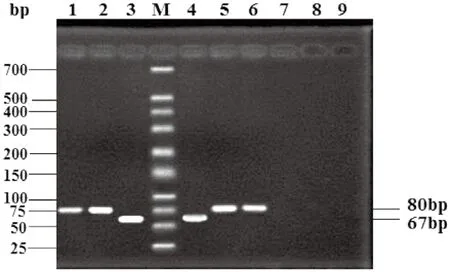
图1 含不同种属的布鲁氏菌重组质粒PCR鉴定
2.2 重组质粒的酶切鉴定
重组质粒经限制性内切酶酶切后,获得相应大小的酶切片段(图2)。
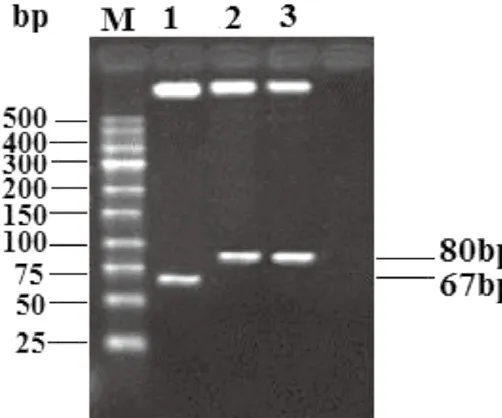
图2 含不同种属的布鲁氏菌重组质粒酶切鉴定
2.3 重组质粒的测序结果
结果显示,布鲁氏菌目的片段已成功克隆在pMD18-T中,测序的3个布鲁氏菌株PCR产物序列具有很高的同源性;该片段具有高度保守性;获得的3个布鲁氏菌重组质粒可作为荧光定量PCR标准阳性对照品。将获得的重组质粒分别命名为pMD18-A、pMD18-M、pMD18-S。以下为测序结果:
pMD18-A(牛种布鲁氏菌):
tgtctgcctgcaggtcgacgattgcatgcgctatgatctggttacgtt aaatgcagacacgccctagaacgcctttcggaaggtcagattaagccgaa acggccccagccgctcatgctcgccagacttcaatggtagaataccgtga tagaaaagcaatctctagaggatc
pMD18-M(羊种布鲁氏菌):
cttgcatgcctgcaggtcgacgattcatgcgctatgatctggttacg ttgaatgcagacacgccctaggggtgaatctggaaattgtcagaaagaca gtgcttcgtcacgctagagcgctcgctgccatacttgcaacagtgacagcg ataattgccgttattggctggtggcagggcgaagattggcgggtaagctatt ccaatctcgctattgttaatggcgtctattggatattactgctctaccttctgtgg attattctgagccgaaacactaatctctagaggatcc
pMD18-S(猪种布鲁氏菌):
gccaagcttgcatgcctgcaggtcgacgattcatgcgctatgatct ggttacgttaaatgcagacacgccctaaaacccctgaaccttcagaaaac cgcgctttgcgcgttttccagaaacttgcccccaagcgataatgcattcacc accgcataagtagggtctaagccggatcgcagcaatcgtcatttgcatgttc cggtaatctctagaggatc
测序结果表明,用3种特异引物扩增的片段是特异序列。其中,pMD18-A(牛种布鲁氏菌)与GeneBank公布牛种布鲁氏菌(ACCESSION:CP009099)序列同源性为100%;pMD18-M(羊种布鲁氏菌)与GeneBank公布牛种布鲁氏菌(ACCESSION:CP002931)序列同源性为100%;pMD18-S(猪种布鲁氏菌)与GeneBank公布牛种布鲁氏菌(ACCESSION:CP003128)序列同源性为99%。
2.4 质粒浓度和纯度的测定
提取的质粒经核酸蛋白分析仪测定,pMD18-A质量浓度为389.5 ng/μL,其拷贝数为8.21×1010拷贝/μL;pMD18-M质量浓度为412.4 ng/μL,其拷贝数为 6.45×1010拷贝 /μL;pMD18-S质量浓度为367.6 ng/μL,其拷贝数为7.89×1010拷贝/μL;D260/D280值不低于1.80,符合纯度要求。经稀释,制成1×1010~1×100的标准阳性对照品,-20 ℃保存备用。
2.5 属特异荧光定量PCR反应条件优化
2.5.1引物浓度优化。对牛种BCSP31基因引物浓度优化结果进行分析比较,发现8组浓度梯度的Ct值存在一定差异。根据最小Ct值和最小Ct值标准偏差观察,发现350 nmol/L试验组扩增曲线明显优于其他试验组的扩增曲线,因此确定牛种的最佳引物浓度为350 nmol/L(表2、图3)。
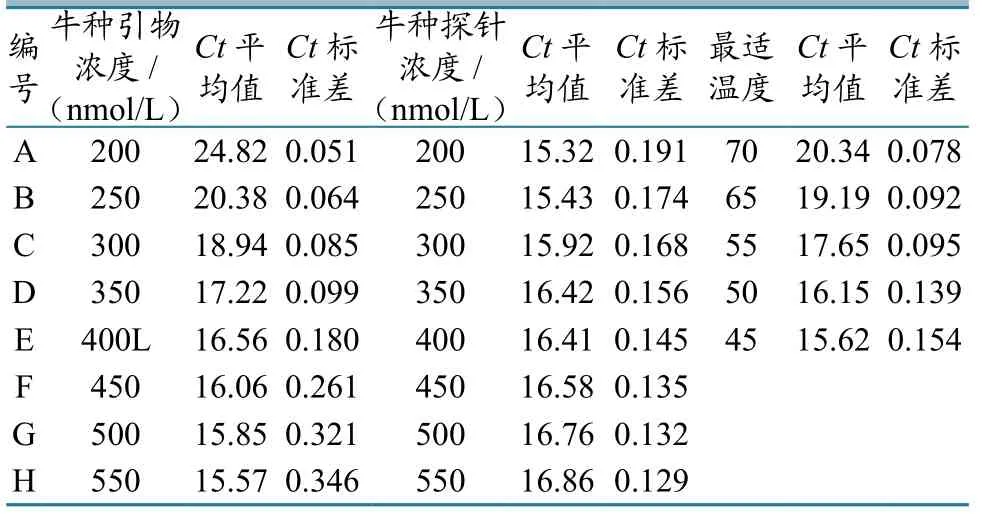
表2 不同引物、探针、dNTP浓度下PCR反应条件优化

图3 牛种布鲁氏菌引物浓度优化结果
以同样的方式确定猪种最佳引物浓度为350 nmol/L,羊种为300 nmol/L。
2.5.2探针浓度优化。对牛种BCSP31基因探针浓度优化结果进行分析比较,发现5组浓度梯度的Ct值中,350 nmol/L试验组的Ct值和Ct值标准偏差最小,扩增曲线明显优于其他试验组的扩增曲线,因此确定牛种的最佳探针浓度为350 nmol/L(表2、图4)。以同样的方式确定猪种的最佳探针浓度为200 nmol/L,羊种为200 nmol/L。
图4 牛种布鲁氏菌探针浓度优化结果
2.5.3退火温度优化。在体系各组分浓度最优化后,将退火温度设置为8个温度梯度(55~65 ℃)进行实时荧光PLR扩增;同一模板8个平行样,进行3次重复;对扩增所得数据进行分析,得出反应的最优退火温度(图5)。

图5 退火温度优化荧光定量PCR试验结果
2.5.4实时荧光定量PCR标准曲线。用3组引物和探针,分别检验了牛种、羊种、猪种布鲁氏菌和其他细菌的DNA,结果上述引物探针只对相应种别的布鲁氏菌DNA有特异荧光曲线生成,并给出了定量结果,对其他细菌和无模板对照(NTC)均无荧光曲线生成,亦无定量结果。选择107、106、105、104、103拷贝/μL 6个梯度浓度的质粒为模板,制作标准曲线。牛种特异性荧光定量PCR的相关系数R为0.996,扩增效率不低于99%(图6)。
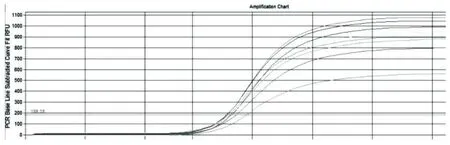
图6 标准品3次重复荧光定量PCR试验结果
2.6 引物探针特异性检测
基于BCSP31基因片段设计的引物探针,对牛种、羊种、猪种布鲁氏菌都有较好的扩增信号,阴性菌株对照和空白对照均无扩增信号(图7、图8)。

图7 引物特异性扩增曲线
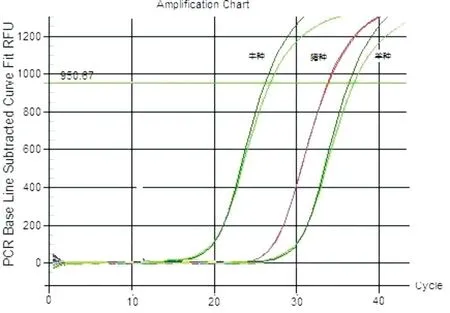
图8 种属特异性扩增曲线
2.7 实时单重荧光定量PCR敏感性试验
将已定量的牛种、羊种、猪种布鲁氏菌阳性质粒 DNA 的 10 倍稀释(1.0×106~1.0×101拷贝 /μL)为模板进行扩增。每个浓度3个重复,并对结果进行统计分析。结果1.0×102拷贝/μL仍有荧光曲线,表明该方法检测灵敏度为1.0×102拷贝/μL,并且重复性试验的变异系数均小于5%,说明该方法具有良好的重复性(表3)。
表3 荧光定量PCR重复性试验结果(3次重复循环阈值)
2.8 实时多重荧光定量PCR敏感性试验
将已定量的牛种、羊种、猪种布鲁氏菌阳性质粒 DNA 的 10 倍稀释(1.0×106~1.0×101拷贝 /μL)为模板进行扩增。每个浓度3个重复,并对结果进行统计分析。结果1.0×102拷贝/μL仍有荧光曲线,表明该方法检测灵敏度为1.0×102拷贝/μL,并且重复性试验的变异系数均小于5%,说明该方法具有良好的重复性(图9)。
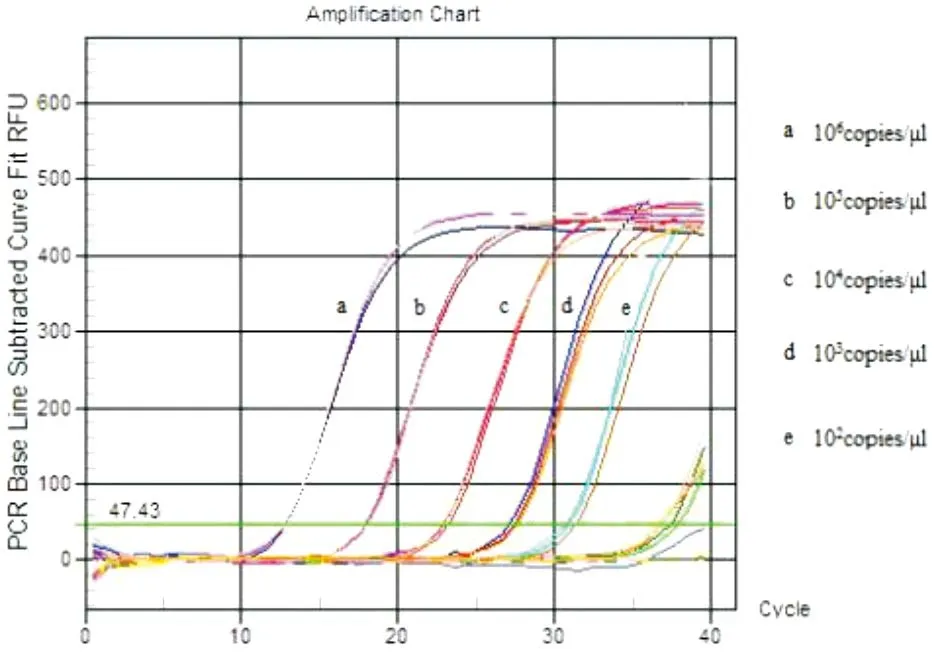
图9 实时多重荧光定量PCR敏感性试验
2.9 实时多重荧光PCR临床应用检测
将临床送检的58份血样,用常规SAT、RBPT、常规PCR以及荧光定量PCR方法检测,结果见表4和图10。
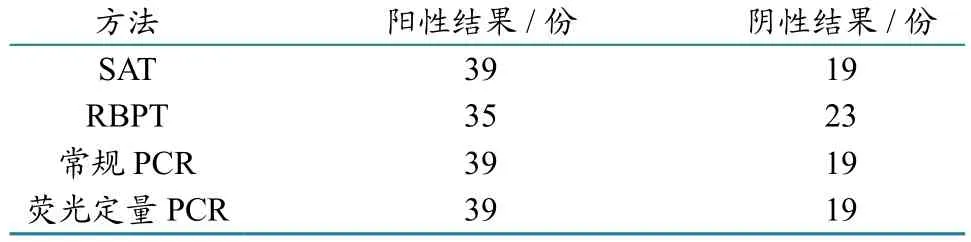
表4 常规SAT、RBPT、常规PCR以及荧光定量PCR方法检测结果
图10 布鲁氏菌实时荧光定量PCR扩增曲线
上述检测结果可知,在病原学检测方面,普通PCR与荧光定量PCR检测结果一致,没有表现出优势,可能存在的主要原因:(1)血清中布鲁氏菌的含量较高,达到普通PCR的检测水平;(2)样品采集的范围小,相对较集中,群体之间没有反应出显著差异。但与常规方法相比,荧光定量PCR可以通过1次反应就能区分出各种属布鲁氏菌,省时省力,且降低了人为感染病原的风险。而常规方法则需要进一步鉴定,才能达到区分种属的目的。
3 讨论
近年来,布鲁氏菌病疫情呈反弹趋势。据《兽医公报》统计,布鲁氏菌病为我国牛羊源人兽共患病发病报告最多的传染病,且感染率与发病率呈现明显上升趋势[4]。自2000年以后,人间布鲁氏菌病已成为报告发病数上升速度最快的传染病之一[5]。带菌动物是其他动物和人类布鲁氏菌病的主要传染源。病原学监测显示,在我国引起人发病的布鲁氏菌主要是羊种3型,其次是牛种[6]。在不同的国家和地区,以至在同一个国家的不同地区,各种动物作为传染源的意义也不尽相同[7]。因此,建立快速、灵敏、准确性高的布鲁氏菌种检测方法,对于不同地区的流行病学、防控及风险分析具有重要意义。荧光定量 PCR 技术自建立以来,发展迅速、应用广泛。由于其具有定量、特异、灵敏和快速等特点,成为目前检测目的核酸拷贝数的可靠方法,被广泛应用于动物医学和分子生物学研究领域。
我国用于布鲁氏菌病诊断的方法大体有3类:一是血清学检测方法,也是主要的诊断方法,有平板凝集试验、试管凝集试验、补体结合试验及酶联免疫吸附试验(ELISA)等。但血清学检测存在特异性不强、敏感性差或操作烦琐等缺点,且易受主观意识影响,易出现假阴性或假阳性结果。二是细菌分离培养技术。它虽是细菌检测的金标准,但病原菌的分离耗时长、技术复杂、检出率低,也存在生物安全隐患。三是分子生物学诊断技术,如PCR方法以其灵敏、高效、省时省力、安全等优点已被广泛应用于布鲁氏菌鉴定。
本研究根据布鲁氏菌保守基因,设计引物、合成探针,并建立了荧光定量分析体系。该检测体系准确性高、重复性好,且表现出较好的检测敏感性。当血液中布鲁氏菌病血清抗体水平或菌体载量较低时,血清学检测和普通PCR会存在假阴性结果。荧光定量PCR快速检测方法灵敏性高,在样本中菌体含量很低的情况下,仍能检测出菌体核酸,并且可对大量样本进行定性和定量分析[8]。其不仅可区分不同种属布鲁氏菌,而且能够对组织样本中布鲁氏菌载量进行定量,同时在实验操作中减少了与病原接触的几率,降低了生物安全风险,因此该方法具有较好的潜在应用价值。
[1] ARIZA J. Brucellosis:An update. The perspective from the Mediterranean basin[J]. Reviews in medical microbiology,1999,10(3):125-135.
[2] 丁家波,毛开荣,程君生,等. 布氏杆菌病疫苗的应用和研究现状[J]. 微生物学报,2006(5):856-859.
[3] BAILY G G,KRAHN J B,DRASAR B S,et al.Detection of Brucella melitensis and Brucella abortus by DNA amplification[J]. Journal of tropical medicine & hygiene,1992,95(4):271.
[4] 郭爱珍,任宁宁,邓明亮,等. 我国牛羊源人畜共患病的防控现状[J]. 中国动物检疫,2015,32(1):53-56.
[5] 崔步云. 关注中国布鲁杆菌病疫情发展和疫苗研究[J].中华地方病学杂志,2012,31(4):355-356.
[6] 钱振宇,姜霞,贾肇一,等. 河北省布鲁菌流行菌株生物学特征分析[J]. 现代预防医学,2013(17):3266-3268.
[7] 卿燕,牛新玲,邰新萍,等. 不同生物型羊种布鲁氏菌在新疆布鲁氏菌病流行病学中的意义[J]. 地方病通报,1988(3):62-66.
[8] 石丽瑞,李秀华,韩惠瑛,等. 布鲁氏菌实时定量荧光PCR 检测体系的建立及应用[J]. 中国动物检疫,2014,31(1):57-60.
(责任编辑:朱迪国)
Establishment on Rapid Detection Method for Quantitative PCR of Brucella Strains
Liu Liya1,2,Lu Guili2,Wang Jie2,Shen Chenfeng2,Ma Xiaojing2,Xue Jing2,Ye Feng2,Yi Xinping2,Wang Jinquan1,Zhong Qi2
(1. College of Veterinary Medicine,Xinjiang Agricultural University,Urumqi,Xinjiang 830052;2. Veterinary Research Institute(Animal Clinical Medicine Research Center),Animal Science Academy of Xinjiang,Urumqi,Xinjiang 830000)
S851.3
A
1005-944X(2017)10-0065-07
10.3969/j.issn.1005-944X.2017.10.019
新疆自治区公益性科研院所基本科研业务经费资助项目(KYGY2016020);新疆自治区公益性科研院所基本科研业务经费资助项目(KY2017004)
王金泉、钟 旗
