红鳍东方鲀组织蛋白酶L表达载体的构建及表达结果验证
2017-10-11李妍钰汤奇龙张鲁嘉谢静莉王文利
李妍钰,汤奇龙,张鲁嘉,谢静莉,王文利,刘 源,3,*
红鳍东方鲀组织蛋白酶L表达载体的构建及表达结果验证
李妍钰1,汤奇龙1,张鲁嘉2,谢静莉2,王文利1,刘 源1,3,*
(1.上海海洋大学食品学院,上海 201306;2.华东理工大学生物工程学院,上海 200237;3.上海交通大学农业与生物学院,上海 200240)
红鳍东方鲀味道鲜美,已从其体内发掘了系列鲜味肽,但其形成机制尚未明确。组织蛋白酶L可通过降解肌原纤维蛋白及肌钙蛋白发挥着重要的滋味形 成作用。为了探索其对红鳍东方鲀呈味肽的形成机制,本研究通过查找NCBI数据库得到一条全长为1 336 bp的红鳍东方鲀组织蛋白酶L的序列,从红鳍东方鲀肌肉中提取RNA并转录为cDNA作为模板克隆,选择pET-28a(+)作为表达载体、E. coli BL21作为重组工程菌进行克隆表达,成功得到大小为36 kD的重组组织蛋白酶L,并验证了其可在大肠杆菌表达系统中成功克隆表达。本研究为进一步研究红鳍东方鲀组织蛋白酶L酶学特性及其对滋味形成提供了理论支持。
红鳍东方鲀;组织蛋白酶L;呈味肽;大肠杆菌表达系统
红鳍东方鲀(Takifugu rubripes)属鲀形目、鲀科、鲀属,因其味道鲜美、肉质鲜嫩、营养丰富,素有“百鱼之首”的美称,是河鲀的一种,深受消费者喜爱[1-2]。研究表明呈味肽是决定河鲀鲜美悠长滋味的决定性成分[3]。呈味肽是指从食物中提取或由氨基酸合成得到的对食品风味具有一定贡献的分子质量低于3 000 D的寡肽类[4-5]。目前已从大豆[6]、花生[7]、牛肉汤[8]、鸡肉[9]、巴马火腿[10]等多种食品中鉴定了42 种鲜味肽[11],其中13 种来自河鲀[3,12-14]。生物细胞中含有蛋白质降解系统,包括蛋白酶体、溶酶体组织蛋白酶、钙质蛋白酶、金属蛋白酶等。在鱼体内,学者普遍认为钙蛋白酶和组织蛋白酶的协同作用对鱼宰后肌肉蛋白质的降解发挥着重要的作用[15]。在pH值为酸性至中性的条件下,组织蛋白酶L可非常活跃的参与降解肌球蛋白、α-非辅肌动蛋白、肌钙蛋白T和I以及I型胶原蛋白[16-18],并且它降解肌球蛋白的能力是组织蛋白酶B的10 倍[19]。组织蛋白酶L在高温条件下活性较高,Jia Airong等[20]发现组织蛋白酶L是高温条件下降解箭齿鲽比目鱼肌肉的主要蛋白酶。组织蛋白酶有内肽酶的活性[16],研究发现其与干腌火腿[21]、盐水鸭[22]和干烟香肠[23]中具有呈味特性的氨基酸和小分子肽的形成有关,在食品风味物质形成中发挥了重要作用[24]。
通过研究红鳍东方鲀体内对呈味肽形成具有重要作用的组织蛋白酶类,可以明确红鳍东方鲀内蛋白质降解成为呈味肽的断裂位点及其酶切位点,探索呈味肽的形成过程。本研究通过查找红鳍东方鲀体内全基因组序列得到组织蛋白酶L的全基因序列,将肌肉及肝脏中的提取的RNA转录成cDNA,并作为模板克隆组织蛋白酶L。选择大肠杆菌表达系统克隆表达获取组织蛋白酶L,从而为进一步分析其对呈味肽的形成提供理论支持。
1 材料与方法
1.1 材料与试剂
4 条2 a生红鳍东方鲀(Takifugu rubripes)购于大连天正集团;E. coli BL21及pET-28a(+)为华东理工大学生物工程学院实验室保存;限制性内切酶HindⅢ和NdeⅠ、T4连接酶 赛默飞世尔科技公司。
1.2 仪器与设备
Avanti J-26XP冷冻离心机、T10 basic高速分散机、电泳仪 北京六一仪器有限公司;FP-6200荧光分光光度计、HDL型超净工作台、WD-9413B凝胶成相分析仪、HD-1核酸蛋白检测仪、酶标仪 美国BioTek公司。
1.3 方法
1.3.1 引物设计
根据GenBank数据库中报道的红鳍东方鲀组织蛋白酶L(TrCTSL)的基因序列(登录号:XM_003962503.2),全长1 336 个核苷酸编码含335 个氨基酸的蛋白,5’(5’ UTR)有165 个核苷酸,3’(3’ UTR)有166 个核苷酸,由1 005 个核苷酸的开放阅读框(ORF)可以推断TrCTSL蛋白的分子质量大约为36.87 kD。利用Primer Premier 5.0软件设计扩增TrCTSL及重组质粒所用的引物。引物由上海捷瑞生物有限公司合成,实验所用引物见表1。

表1 构建红鳍东方鲀组织蛋白酶L表达载体所用引物序列Table 1 Nucleotide sequences of primers used to construct recombinant vector TrCTSL
1.3.2 红鳍东方鲀总RNA提取
参照GB/T 27624—2011《养殖红鳍东方鲀鲜、冻品加工操作规范》对红鳍东方鲀活体进行宰杀,并分别取4 条红鳍东方鲀的肝脏及肌肉组织[19-20]。将肌肉与肝脏组织剪碎,取1 g放入于装有200 μL RNA保存液的1.5 mL离心管中,于4 ℃过夜处理,使保存液充分浸润组织。红鳍东方鲀肌肉与肝脏中的总RNA提取方法参考华东理工大学生物工程实验室建立的提取方法[25-26]。
1.3.3 cDNA的合成及TrCTSL基因序列的扩增
取出RNA样品置于冰上,测定抽提RNA的浓度及纯度。
消化RNA:使用Promega公司DNA消化酶进行消化,反应体系(10 mL):1 mg RNA,1 mL酶,1 mL 10×缓冲液,加适量DNase/RNase-free去离子水至反应体系为10 mL。反应条件:将反应液置于37 ℃恒温水浴锅中保温30 min后加入1 mL终止液,于65 ℃恒温水浴锅中保温10 min。
逆转录反应体系(20 μL):10 μL RNA消化液,1 μL PrimeScript®RT Enzyme Mix I,4 μL 5×PrimeScript®RT Buffer,1 μL Oligo dT Primer,1 μL Random 6 mers,3 μL DNase/RNase-free去离子水。反应条件:将反应液置于37 ℃恒温水浴锅中保温15 min,随后放入85 ℃水浴锅中反应5 s以终止反应。将逆转录产物放入-80 ℃超低温冰箱中保存待用。
以上述逆转录后红鳍东方鲀cDNA为模板,采用设计好的引物进行PCR扩增,之后采用质量分数1%琼脂糖凝胶电泳鉴定片段大小。
1.3.4 TrCTSL-pET-28a重组质粒的构建
本实验选取pET-28a(+)作为表达载体,重组质粒构建见图1。采用限制性内切酶NdeⅠ、HindⅢ分别双酶切pET-28a(+)与TrCTSL的PCR扩增产物,用1%琼脂糖凝胶电泳分离酶切片段,切胶后用DNA回收试剂盒回收酶切片段。将回收酶切后pET-28a(+)与TrCTSL片段放入连接仪16 ℃过夜进行连接。将TrCTSL基因插入到pET-28a(+)的多克隆位点,得到重组质粒-20 ℃保存用于后续表达。
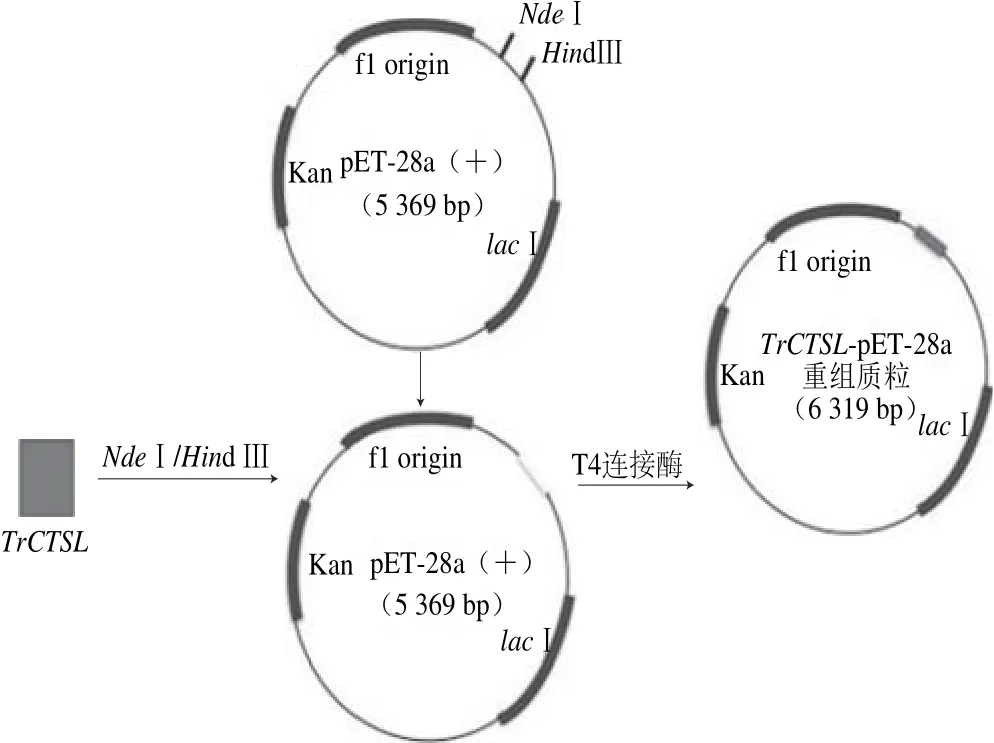
图1 红鳍东方鲀组织蛋白酶L重组质粒的构建流程Fig. 1 Flow chart showing the construction of recombinant plasmid
1.3.5 TrCTSL-pET-28a 重组质粒的鉴定
将1.3.4节所得连接液通过热激法转化至DH5α感受态细胞中。取灭菌1.5 mL EP管并加入10 μL灭菌水,用枪头挑取LB固体(含1 μL/mL卡那霉素)平板上长出的单菌落,与灭菌水充分混匀,取2 μL作为阳性克隆验证PCR模板,剩余8 μL加入液体LB(含1 μL/mL卡那霉素)放入摇床培养1~2 h,提取质粒并选取通用T7引物对重组质粒进行测序并用体积分数50%甘油保存。
1.3.6 Tr CTSL-pET-28a重组质粒转化E. coli BL21
取1.3.5节中测序正确的重组质粒1 μL,稀释10倍后与E. coli表达菌株BL21(DE3)感受态细胞轻轻混匀,冰浴30 min,42 ℃水浴锅热激90 s,冰上放置2 min,加入900 μL液体LB(不含卡那霉素),37 ℃摇床45 min,12 000×g离心30 s后涂布于固体LB(含1 μL/mL卡那霉素)平板,37 ℃培养箱倒置培养约16 h。
1.3.7 重组工程菌的构建及表达
随机挑取8 个转化平板上的单菌落,接种于LB液体培养基(含1 μL/mL卡那霉素),在37 ℃、200 r/min条件下培养约10 h后按1%接种量转接新鲜液体LB(含1 μL/mL卡那霉素)中培养约1 h至OD600nm约为1,加入终浓度为0.2 mmol/mL的异丙基-β-D-硫代半乳糖苷(IPTG),继续培养20 h。
将诱导后的菌液加入50 mL离心管中,4 ℃、7 000 r/min离心5 min,收集菌体,再用生理盐水清洗菌体,振荡重复离心,收集菌体于冰上用于破碎。将菌体加入10 mL PBS,振荡混匀,超声3 s、间隔5 s破碎,8 000 r/min离心10 min后分别取沉淀和上清液保存验证。
1.3.8 十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(sodium dodecyl sulfate polyacrylamide gel electrophoresis,SDSPAGE)检测重组蛋白酶
沉淀用超纯水等体积溶解,分别取沉淀溶解液与上清液20 μL与等体积SDS-PAGE缓冲液混匀并将样品煮制5 min,加入配制好的蛋白胶,80 V约30 min待样品从浓缩胶进入分离胶后调为120 V进行SDS-PAGE PBS分析。
1.3.9 重组蛋白酶活性检测
重组组织蛋白酶L活性的测定,反应体系由50 μL 0.1% Brij35,500 μL 50 mmol/L PBS含5 mmol/L乙二胺四乙酸,5 mmol/L L-Cys(缓冲液pH 5.5)和 100 μL酶液组成。激发波长设置为360 nm,发射波长设置为460 nm。将荧光分光光度计设置在40 ℃条件下预热2 min后加入50 μL 20 μmol/L的底物Z-Phe-Arg-AMC,以20 s为间隔检测其实时释放的荧光强度变化。并设置200 μL纯酶液、200 μL纯底物与200 μL纯缓冲液作为对照组。
2 结果与分析
2.1 TrCTSL基因的扩增
为得到红鳍东方鲀组织蛋白酶L的基因片段,以转录后cDNA为模板,进行PCR后得到图2中约1 000 bp大小的条带,与数据库中的序列碱基数1 008 bp几乎一致。
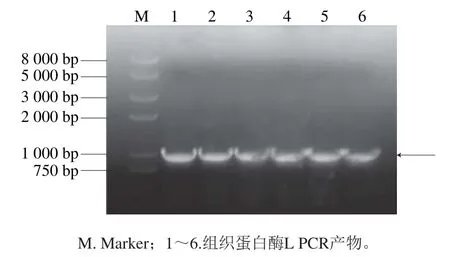
图2 组织蛋白酶L产物电泳图Fig. 2 Electrophoresis analysis of PCR products of TrCTSL gene
2.2 重组质粒的鉴定
为了鉴定目的基因是否成功克隆至pET-28a(+)载体,对转化后的菌落进行菌落PCR扩增。图3为菌落PCR电泳图,根据pET-28a(+)和目的基因的序列,克隆成功的阳性转化子通过菌落PCR后,可以扩增出一条1 008 bp的片段。图3中转化子PCR产物泳道显示,均出现碱基数大约为1 000的条带,而以原始pET-28a(+)为模板进行PCR后未出现任何条带。由此可以初步确定红鳍东方鲀组织蛋白酶L基因已经克隆到pET-28a(+)上。

图3 菌落PCR电泳图Fig. 3 Electrophoresis analysis of PCR products with different plasmids as template
2.3 重组质粒测序鉴定
将初步确定成功克隆的重组质粒进行测序,翻译后与数据库中的原始序列进行比对,结果如图4所示,发现仅有1 个氨基酸的突变,且离活性中心较远,有可能是因为个体差异造成,说明红鳍东方鲀组织蛋白酶L的基因已成功克隆至表达载体pET-28a(+)上。

图4 重组红鳍东方鲀组织蛋白酶L质粒序列对比图Fig. 4 Sequence alignment of recombinant plasmid
2.4 重组质粒转化E. coli BL21
将测序成功的转化子质粒转入感受态E. coli BL21以获得重组蛋白,所得到的菌落平板菌落与原始E. coli BL21平板对比如图5所示。说明重组质粒已成功转入感受态细胞中。

图5 重组质粒转化平板Fig. 5 Transformation of recombinant plasmid
2.5 SDS-PAGE检测重组蛋白
将含重组质粒的大肠杆菌诱导表达后,收集菌体经破碎离心得到上清液作为样品进行SDS-PAGE表达检测,根据数据库中的序列可知,目的重组蛋白大小为36 kD,将样品上清液与诱导后野生型pET-28a(+)上清液进行比对,结果如图6所示,野生型pET-28a(+)表达产物在36 kD大小的位置未出现明显条带,而重组pET-28a(+)表达产物在36 kD出现了明显条带,说明重组红鳍东方鲀组织蛋白酶L成功胞外分泌表达。所得条带与原核表达所得重组大黄鱼组织蛋白酶L[27],重组中国对虾组织蛋白酶L[28],重组日本七鳃鳗组织蛋白酶L[29]的大小相似,可以确定实验所得为重组红鳍东方鲀组织蛋白酶L,为后续实验进一步对比其特性及功能奠定了基础。
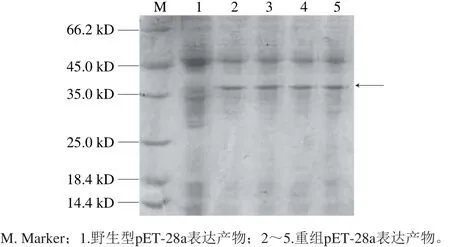
图6 重组蛋白酶SDS-PAGE电泳图Fig. 6 SDS-PAGE profi le of recombinant protein
2.6 重组蛋白酶活性检测结果

图7 重组蛋白酶活性测定Fig. 7 Enzymatic activity of recombinant cathepsin L
将诱导后破碎离心的上清液样品用荧光分光光度计进行酶活性检测,由图7可知,只有重组蛋白酶L与底物的反应液随着时间的变化所释放的荧光强度不断增加。初步证明了重组表达组织蛋白酶L有活性,为之后的纯化以及酶学性质研究提供依据。
3 结 论
为了探究红鳍东方鲀体内呈味肽的形成机制,以组织蛋白酶类中的组织蛋白酶L为研究对象,从GenBank中查找序列,并用从鲜活的红鳍东方鲀中提取的RNA反转录成的cDNA作为模板进行PCR,并成功将其克隆在pET-28a(+)载体上,转入E. coli BL21建立大肠杆菌异源表达系统,诱导后成功分泌表达并有活性为之后的纯化、酶学特性的鉴定以及呈味肽与内源蛋白酶之间的相互作用关系研究提供了依据。
[1] 邓捷春, 王锡昌, 刘源. 暗纹东方鲀与红鳍东方鲀气味成分差异研究[J]. 食品科学, 2009, 30(22)∶ 335-339. DOI∶10.3321/j.issn∶1002-6630.2009.22.080.
[2] 苗晓丹, 刘源, 马垒, 等. 结合感官评价与电子舌技术优化酶水解养殖暗纹东方鲀肌肉制备呈味肽[J]. 现代食品科技, 2015(8)∶ 268-272.
[3] ZHANG M X, WANG X C, LIU Y, et al. Isolation and identifi cation of flavour peptides from puffer fish (Takifugu obscurus) muscle using an electronic tongue and MALDI-TOF/TOF MS/MS[J].Food Chemistry, 2012, 135(3)∶ 1463-1470. DOI∶10.1016/j.foodchem.2012.06.026.
[4] 仇春泱, 王锡昌, 刘源. 食品中的呈味肽及其分离鉴定方法研究进展[J]. 中国食品学报, 2013, 13(12)∶ 129-138.
[5] WU H C, CHEN H M, SHIAU C Y. Free amino acids and peptides as related to antioxidant properties in protein hydrolysates of mackerel(Scomber austriasicus)[J]. Food Research International, 2003,36(9/10)∶ 949-957. DOI∶10.1016/S0963-9969(03)00104-2.
[6] ARAI S, YAMASHITA M, FUJIMAKI M. Glutamyl oligopeptides as factors responsible for tastes of a proteinase-modifi ed soybean protein[J].Agricultural & Biological Chemistry, 1972, 36(7)∶ 1253-1256.DOI∶10.1271/bbb1961.36.1253.
[7] SU G, CUI C, ZHENG L, et al. Isolation and identification of two novel umami and umami-enhancing peptides from peanut hydrolysate by consecutive chromatography and MALDI-TOF/TOF MS[J]. Food Chemistry, 2012, 135(2)∶ 479-485. DOI∶10.1016/j.foodchem.2012.04.130.
[8] YAMASAKI Y, MAEKAWA K. A peptide with delicious taste[J].Agricultural & Biological Chemistry, 1978, 42(9)∶ 1761-1765.DOI∶10.1271/bbb1961.42.1761.
[9] MAEHASHI K, MATSUZAKI M, YAMAMOTO Y, et al. Isolation of peptides from an enzymatic hydrolysate of food proteins and characterization of their taste properties[J]. Bioscience Biotechnology& Biochemistry, 1999, 63(3)∶ 555-559. DOI∶10.1271/bbb.63.555.
[10] 党亚丽, 张中健, 闫小伟, 等. 巴马火腿酶解物中呈味肽的分离纯化及其结构研究[J]. 食品科学, 2010, 31(13)∶ 127-131.
[11] YU X, ZHANG L, MIAO X, et al. The structure features of umami hexapeptides for the T1R1/T1R3 receptor[J]. Food Chemistry, 2016,221∶ 599-605. DOI∶10.1016/j.foodchem.2016.11.133.
[12] ZHANG M, WANG X, LIU Y, et al. Species discrimination among three kinds of puffer fish using an electronic nose combined with olfactory sensory evaluation[J]. Sensors, 2012, 12(9)∶ 12562-12571.DOI∶10.3390/s120912562.
[13] 刘源, 仇春泱, 王锡昌, 等. 养殖暗纹东方鲀肌肉中呈味肽的分离鉴定[J]. 现代食品科技, 2014(8)∶ 38-42.
[14] 刘源, 马垒, 仇春泱, 等. 热加工暗纹东方鲀肌肉中呈 味肽分离鉴定及呈味特性研究[J]. 现代食品科技, 2016(3)∶ 152-157.
[15] DELBARRE-LADRAT C, VERREZ-BAGNIS V, NOËL J, et al.Relative contribution of calpain and cathepsins to protein degradation in muscle of sea bass (Dicentrarchus labrax L.)[J]. Food Chemistry,2004, 88(3)∶ 389-395. DOI∶10.1016/j.foodchem.2004.01.053.
[16] HUGHES M C, O’NEILL E E, MCSWEENEY P L H, et al.Proteolysis of bovine F-actin by cathepsin B[J]. Food Chemistry,1999, 64(4)∶ 525-530. DOI∶10.1016/S0308-8146(98)00161-7.
[17] SHAHIDI F, KAMIL Y V A J. Enzymes from fish and aquatic invertebrates and their application in the food industry[J]. Trends in Food Science & Technology, 2001, 12(12)∶ 435-464. DOI∶10.1016/S0924-2244(02)00021-3.
[18] 李琳, 王正全, 张晶晶, 等. 暗纹东方鲀肌肉组织蛋白酶B提取工艺优化[J]. 食品科学, 2016, 37(3)∶ 91-96. DOI∶10.7506/spkx1002-6630-201603018.
[19] 李琳, 王正全, 张晶晶, 等. 内源蛋白酶对肉类食品风味的影响[J]. 食品与发酵工业, 2015, 41(2)∶ 237-241. DOI∶10.13995/j.cnki.11-1802/ts.201502042.
[20] JIA A R, ZHANG X H. cDNA cloning, characterization, and expression analysis of the Rac1 gene from Scophthalmus maximus[J]. Comparative Biochemistry & Physiology Part B Biochemistry & Molecular Biology, 2009, 154(1)∶ 80. DOI∶10.1016/j.cbpb.2009.05.002.
[21] TOLDRÁ F, FLORES M. The role of muscle proteases and lipases in flavor development during the processing of dry-cured ham[J].Critical Reviews in Food Science and Nutrition, 1998, 38(4)∶ 331-352.DOI∶10.1080/10408699891274237.
[22] 李艳逢. 盐水鸭复卤卤水基本品质特性的研究[D]. 南京∶ 南京农业大学, 2009∶ 23.
[23] 张红梅. 蛋白酶在发酵香肠成熟中的作用[J]. 肉类工业, 2009(10)∶52-53. DOI∶10.3969/j.issn.1008-5467.2009.10.020.
[24] CHERET R, DELBARRELADRAT C, MDE L A, et al. Calpain and cathepsin activities in post mortem fish and meat muscles[J].Food Chemistry, 2007, 101(4)∶ 1474-1479. DOI∶10.1016/j.foodchem.2006.04.023.
[25] 刘晓红. 两种重要鱼类致病菌感染及减毒活疫苗接种途径的研究[D].上海∶ 华东理工大学, 2014∶ 11-34.
[26] BAOPRASERTKUL P, PEATMAN E, ABERNATHY J, et al.Structural characterisation and expression analysis of toll-like receptor 2 gene from catfish[J]. Fish & Shellfish Immunology, 2007, 22(4)∶418-426. DOI∶10.1016/j.fsi.2006.04.005.
[27] 杨志军. 大黄鱼组织蛋白酶B、L、S的分子克隆和半胱氨酸蛋白酶抑制剂cystatins的初步功能研究[D]. 青岛∶ 国家海洋局第三海洋研究所, 2011∶ 44-61.
[28] 卜兴江. 中国对虾组织蛋白酶L和溶菌酶的重组表达及性质研究[D].济南∶ 山东大学, 2006∶ 3-23.
[29] 杨东辉. 日本七鳃鳗组织蛋白酶L的克隆表达及功能分析[D]. 大连∶辽宁师范大学, 2013∶ 17-21.
Construction and Verifi cation of Expression Vector for Takifugu rubripes Cathepsin L Gene
LI Yanyu1, TANG Qilong1, ZHANG Lujia2, XIE Jingli2, WANG Wenli1, LIU Yuan1,3,*
(1. College of Food Science and Technology, Shanghai Ocean University, Shanghai 201306, China;2. School of Biotechnology, East China University of Science and Technology, Shanghai 200237, China;3. College of Agriculture and Biology, Shanghai Jiao Tong University, Shanghai 200240, China)
Takifugu rubripes has a delicious taste. To date, a series of umami peptides have been separated and identifi ed from T. rubripes, but their formation mechanism is not yet clear. Cathepsin L degrades myofi brillar protein and troponin during muscle degradation and thus plays an important role in the flavor formation. This study aimed to elucidate the possible mechanism of flavor peptide formation. We obtained a 1 336 bp sequence of cathepsin L gene from the NCBI database, and extracted RNA from the muscle of T. rubripes, and then reverse-transcribed it into cDNA. PET-28a (+) as the expression vector and E. coli BL21 as engineering bacteria was used to clone and express the cathepsin L gene. Recombinant cathepsin L was obtained with a molecular mass of 36 kD, and the E. coli expression system was also successfully validated.This study can provide useful information for further studies on enzymatic characteristics and of cathepsin L and its role in taste formation in T. rubripes.
Takifugu rubripes; cathepsin L; fl avor peptide; E. coli expression system
TS254.5
A
1002-6630(2017)20-0001-05
李妍钰, 汤奇龙, 张鲁嘉, 等. 红鳍东方鲀组织蛋白酶L 表达载体的构建及表达结果验证[J]. 食品科学, 2017, 38(20)∶ 1-5.DOI∶10.7506/spkx1002-6630-201720001. http∶//www.spkx.net.cn
LI Yanyu, TANG Qilong, ZHANG Lujia, et al. Construction and verifi cation of expression vector for Takifugu rubripes cathepsin L gene[J]. Food Science, 2017, 38(20)∶ 1-5. (in Chi nese with English abstract) DOI∶10.7506/spkx1002-6630-201720001. http∶//www.spkx.net.cn
2017-04-01
国家自然科学基金青年科学基金项目(31622042;31371790;31271900);
“十三五”国家重点研发计划重点专项(2016YFD040083)
李妍钰(1992—),女,硕士研究生,研究方向为肉品风味与品质评价。E-mail:sosalee92@hotmail.com
*通信作者:刘源(1979—),男,教授,博士,研究方向为肉品风味与品质评价。E-mail:509925@qq.com
DOI∶10.7506/spkx1002-6630-201720001
