巴马香猪氨基肽酶N截短基因的克隆与原核表达
2017-10-11王文秀王宝琴谢金文沈志强
王文秀,张 艳,王宝琴,谢金文,刘 博,沈志强*
( 1.山东省滨州畜牧兽医研究院,山东滨州 256600;2.海南省农业科学院畜牧兽医研究所,海南海口 571100;3.滨州学院生物工程学院,山东滨州 256600)
巴马香猪氨基肽酶N截短基因的克隆与原核表达
王文秀1,张 艳2,王宝琴3,谢金文1,刘 博1,沈志强1*
( 1.山东省滨州畜牧兽医研究院,山东滨州 256600;2.海南省农业科学院畜牧兽医研究所,海南海口 571100;3.滨州学院生物工程学院,山东滨州 256600)
为获得猪流行性腹泻病毒(PEDV)受体猪氨基肽酶N(pAPN)抗原,提取巴马香猪小肠绒毛上皮的总RNA,PCR扩增获得pAPN基因的主要抗原区片段,并将其克隆至原核表达载体pET-32a中,将重组质粒pET-32a-pAPN转化大肠埃希菌BL21,通过不同浓度的IPTG、不同诱导时间进行诱导表达,以确定目的蛋白表达的最佳条件。经SDS-PAGE和抗组氨酸标签的单抗进行Western blot检测重组蛋白在大肠埃希菌中的表达,结果显示,原核表达产物在诱导温度37℃、IPTG浓度为0.8 mmol/L,诱导4 h可获得最佳表达,产物分子质量约为45 ku,获得的目的蛋白大小与预期一致。
巴马香猪;氨基肽酶N;克隆;原核表达
1971年在英国猪群首次发生猪流行性腹泻(Porcine epidemic diarrhea,PED),6年后才被证实病原为猪流行性腹泻病毒(Porcine epidemic diarrhea virus,PEDV),该病以腹泻、呕吐和脱水为主要特征,病死率高,尤其7日龄内哺乳仔猪病死率可达100%。该病近年来在泰国、日本等多个国家流行,对养猪业造成严重危害[1-2],2015年美国也遭遇PED的大规模暴发[3-5]。PEDV难以在体外培养,自病原发现以来,研究者尝试多种方法试图体外培养该病毒均未获得成功,成为病毒学上的难题。1988年Hofmann H等首次将胰酶加入Vero传代细胞培养液中,经过5次连续传代后细胞发生病变[6-7],解决PEDV体外细胞培养的难题。但近年来,PEDV的体外分离再次遇到困难,很多来自临床典型病例的样品,经PCR检测确定为阳性,却无法从原来的Vero细胞中分离到病毒。推测流行毒株有可能发生了一定变异或流行毒株与过去的毒株间生物学特性产生了一定差异,从而影响了病毒在Vero 细胞增殖的适应过程。
氨基肽酶N(amibopeptidase N,APN)广泛分布于哺乳动物的多种组织细胞表面,尤其大量存在于小肠的微绒毛表面[8]。研究证实,APN是Ⅰ型冠状病毒的主要细胞受体,病毒S蛋白与APN具有种属特异性的氨基酸识别,并通过黏附结合进而感染宿主细胞[9-11]。李宝贤等[12]通过脂质体介导将pAPN基因转染PEDV的非容许性细胞MDCK,进一步通过PEDV感染细胞,结果证实pAPN是PEDV的受体,为PEDV的体外增殖及提高滴度提供了试验依据。已有研究报道[13-16]在PEDV培养体系中添加pAPN后滴度明显提高,推测PEDV在细胞中的增殖与氨基肽酶的分布和含量有关系,但为什么添加外源受体后PEDV的病毒产量会增加?其机制尚不清楚。目前尚未见关于研究pAPN在不同细胞的表达和分布及其与PEDV增殖之间关系的报道。
由于pAPN全基因的表达存在一定困难,本研究采用截短表达的策略,对pAPN全基因进行蛋白表位分析,并选取pAPN抗原决定簇表位相对密集的片段进行截短表达,为获得pAPN的多克隆抗体并检测pAPN在细胞中的分布及其表达量,进一步研究PEDV的受体与病毒之间相互作用机制奠定基础。
1 材料与方法
1.1 材料
1.1.1 载体和细胞 原核表达载体pET-32a和BL21(DE3)均由山东省滨州畜牧兽医研究院、预防兽医学与动物生物技术重点开放实验室保存。
1.1.2 主要试剂 RNA提取试剂盒、高纯质粒小量抽提试剂盒、DNA纯化回收试剂盒,北京百泰克生物技术有限公司产品;反转录试剂盒、限制性内切酶BamHⅠ和HindⅢ、rTaqDNA聚合酶、T4DNA连接酶、DNA标准DL 2 000 和预染蛋白分子质量标准等,NEB公司产品。
1.2 方法
1.2.1 截短pAPN引物设计与合成 根据Genbank发表的pAPN基因序列(XM-005653524),选择pAPN的主要功能域片段设计1对引物,上游引物:F:5′-ATCGGGATCCATGGTCCCTGTCACCCTG-3′,下游引物R:5-′CCGAAGCTTGCTGTGCTCTATGAAC-3′,其中下划线部分表示引入的BamHⅠ和HindⅢ酶切位点,引物送至上海捷瑞生物工程有限公司进行合成。
1.2.2 总RNA的提取和目的片段pAPN的扩增 取新鲜的富含肠绒毛的一段猪小肠用液氮快速研磨成粉末状,并迅速将粉末刮入-80℃预冷的EP管中,按试剂盒说明书提取总RNA并反转录合成cDNA。以反转录后得到的cDNA为模板进行PCR扩增。PCR反应总体系为25 μL:cDNA 2.0 μL,上、下游引物各1 μL,10×PCR buffer 2.5 μL,2.5 mmol/L dNTP 2 μL,5 U/μL的rTaqDNA 聚合酶0.25 μL,ddH2O调节使总体积达25 μL。PCR反应程序为:95℃ 5 min;95℃ 45 s,58 ℃ 1 min,72℃ 50 s,共30个循环;72℃ 10 min,4℃结束反应,预计片段大小882 bp。PCR扩增产物于琼脂糖凝胶电泳观察。
1.2.3 表达载体pET-32a-pAPN的构建及鉴定 将pAPN PCR回收产物和表达载体pET-32a(+)分别用BamHⅠ和HindⅢ双酶切,并回收目的片段,用T4 DNA连接酶连接并转化到DH5α感受态细胞中,从含有氨苄的LB平板中挑取单克隆,经PCR和双酶切鉴定的阳性菌株送上海捷瑞生物工程有限公司测序,测序正确的质粒命名为pET-32a-pAPN。
1.2.4 重组蛋白的诱导表达及优化 将重组表达质粒pET-32a-pAPN转入到大肠埃希菌BL21(DE3)感受态细胞,挑取单菌落接种于含氨苄青霉素(Amp)(100 μg/mL)的 LB 液体培养基中培养,取PCR鉴定为阳性的菌液50 μL接种于5 mL新鲜LB液体培养基中,并添加同浓度的Amp,37℃条件下以180 r/min振荡培养,当OD 600 nm值达0.6左右时,分别加入不同终浓度的IPTG(0.2 mmol/L~1.2 mmol/L) 至培养液中,诱导后每间隔1 h收集2 mL菌液样品,于12 000 r/min离心5 min后弃上清,收集沉淀用PBS洗2次,加入200 μL PBS重悬,置冰上超声破碎后,离心使上清和沉淀分离。加上样buffer至上清中,煮沸10 min,取诱导的空载体菌及未诱导的重组菌作为对照,进行SDS-PAGE。
1.2.5 重组蛋白表达形式的鉴定 根据1.2.4结果选取最佳时间点进行目的蛋白的大量诱导表达,菌液以12 000 r/min离心5 min,收集菌体沉淀,用PBS重悬并洗涤2次,菌体重悬于适量PBS,冰浴条件下进行超声破碎。分别收集沉淀和上清,进行SDS-PAGE电泳。
1.2.6 重组蛋白的免疫印迹检测 pAPN重组蛋白经SDS-PAGE电泳后,相应条带转印至PVDF膜,再将膜置于脱脂奶粉(50 g/L)中,在4℃条件下过夜封闭,然后转入用PBST 1∶2 000稀释的鼠源抗His标签一抗中,室温摇床孵育2 h,用PBST 液将膜洗3次。再转入1∶5 000稀释的HRP标记的羊抗鼠IgG中,室温摇床孵育1 h,PBST洗膜3次,DAB显色后于凝胶成像系统中观察结果。
2 结果
2.1 pAPN截短基因片段的PCR扩增
pAPN PCR扩增产物于10 g/L凝胶电泳后,可见在882 bp处有一特异性扩增条带,与预期扩增片段大小相符(图1)。
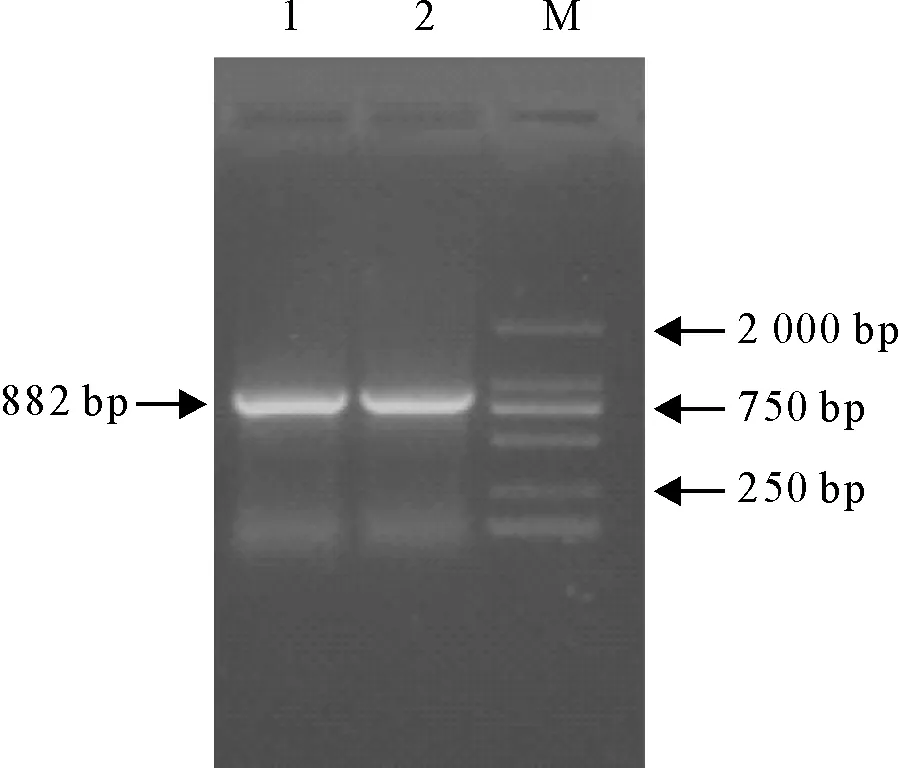
M.DNA标准DL 2 000; 1、2.pAPN PCR扩增产物
M.DNA Marker DL 2 000; 1,2.pAPN PCR products
图1 pAPN PCR扩增结果
Fig.1 PCR Amplification result of pAPN gene
2.2 pET32a-pAPN的鉴定
pET32a-pAPN质粒经BamHⅠ和HindⅢ双酶切后获得2个片段,与预期大小一致(图2),阳性质粒pET32a-pAPN送公司测序后的结果与参考序列相同,阅读框正确。
2.3 重组蛋白表达条件的优化、可溶性分析及鉴定
将含有重组表达载体pET-32a-pAPN的表达菌液按1.2.4所述诱导条件诱导表达后,离心菌体沉淀,超声破碎细胞,通过SDS-PAGE电泳表明重组蛋白以包涵体形式表达(图3);诱导2 h蛋白开始表达,但表达量少,3 h~6 h各组蛋白表达量明显增加,可将诱导时间定为6 h(图4);诱导的IPTG浓度可定位0.8 mmoL/L(图5)。
2.4 重组蛋白的Western blot分析
鼠抗His单抗作为一抗,表达载体在45 ku处有目的条带,大小与预期结果一致;空载体在预期大小处未见条带。结果表明表达载体带有His标签,重组蛋白与His标签融合表达(图6)。
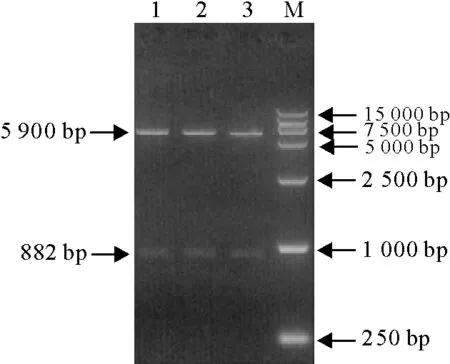
M.DNA 标准DL 15 000; 1~3.重组质粒pET-32a-pAPNBamHⅠ/HindⅢ酶切
M.DNA Marker DL 15 000; 1-3.Recombinant plasmid pET-32a-PAPN digested byBamHⅠ/HindⅢ
图2重组质粒pET-32a-pAPN双酶切鉴定
Fig.2 Identification of recombinant plasmid pET-32a-PAPN by double enzyme digestion

1.诱导的pET-32a空载体对照;2.蛋白分子量标准;3.pET-32a-pAPN未诱导对照;4.pET-32a-pAPN诱导表达产物超声破碎后上清;5.重组质粒pET-32a-pAPN诱导表达产物超声破碎后沉淀
1.Induced vector pET-32a; 2.Protein molecular weight Marker; 3.Uninduced vector of pET-32a; 4.Supernatant after ultrasonic disruption of induced pET-32a-pAPN expression products; 5.Precipatate after ultrasonic disruption induced pET-32a-pAPN expression products
图3重组质粒pET-32a-pAPN表达产物可溶性分析
Fig.3 Solubility analysis of expression products of recombinant plasmid pET-32a-pAPN

1.诱导的pET-32a空载体;2.蛋白分子量标准;3~9.分别为 37℃条件下以1.0 mmol/L IPTG终浓度诱导2、3、4、5、6、7、8 h的pAPN重组表达载体
1.Induced vector pET-32a; 2.Proteins moleculer weight Marker; 3-9.Protein inducted by different time(2,3,4,5,6,7,8 h)
图4不同诱导时间pAPN重组蛋白的SDS-PAGE分析
Fig.4 SDS-PAGE analysis of expression products of recombinant pAPN vectors induced in different time

1.诱导的pET-32a载体;2.蛋白分子量标准;3~9.分别为 37 ℃条件下以终浓度0.2、0.4、0.6、0.8、1.0、1.2 mmol/L 的IPTG诱导6 h的pET-32a-pAPN
1.Induced pET-32a vector; 2.Protein moleculer weight Marker; 3-9.Recombinant pAPN expression vector induced for 4 h with 0.2,0.4,0.6,0.8,1.0,1.2 mmol/L IPTG at 37 ℃
图5不同浓度IPTG诱导的pAPN重组蛋白SDS-PAGE分析
Fig.5 SDS-PAGE analysis of expression products of recombinant pAPN vectors induced in different IPTG concentrations
3 讨论
猪流行性腹泻病毒能引起猪腹泻等肠道疾病,对7日龄仔猪致死率接毒与特异性受体相互作用是病毒感染并增殖的前提,有报道[13-16]表明PEDV的培养体系中添加pAPN会明显提高病毒滴度,但pAPN在细胞中的含量和密度会影响病毒的增殖[16]。为进一步研究近100%。自1971年在英国发现PEDV,其体外培养就一直是病毒学上的难题,直到1988年Hoffman通过在培养液中添加胰酶的方法才首次成功获得病毒的体外培养。然而近几年新流行的PEDV再次遇到体外分离困难的问题。已经有证据表明[12],氨基肽酶是冠状病毒大多数成员的细胞感染受体,病这一影响机制,离不开pAPN的特异性抗体。本研究旨在利用原核表达系统大量表达pAPN蛋白,为进一步制备多克隆抗体,建立pAPN表达量的快速血清学检测方法,为构建和筛选pAPN高表达的细胞系提供前期基础。

M.预染蛋白分子质量标准;1.重组蛋白pET-32a-pAPN;2.pET-32a空载体
M.Prestained protein Marker; 1.Recombinant protein pET-32a-pAPN;2.pET-32a vector
图6重组蛋白Western blot鉴定
Fig.6 Western blot analysis of recombinant pAPN
本试验对pAPN全基因进行了分析,选择了抗原表位集中的区域设计了1对扩增pAPN截短基因的特异性引物,经PCR扩增获得pAPN截短基因,利用原核表达系统对pAPN进行表达,本试验选取原核表达载体pET-32a,是因为其具有T7强启动子和组氨酸标签,便于目的蛋白的纯化。通过改变诱导条件等影响因素,确定了获得最为理想的蛋白表达量的表达条件,为将来大量获取pAPN提供了参考数据。为鉴定重组融合蛋白,应用抗组氨酸标签的单克隆抗体检测到重组蛋白在大肠埃希菌中的表达,为pAPN抗体的制备和pAPN蛋白表达检测奠定了基础。
[1] Van D N,Norimine J,Sueyoshi M,et al.US-like isolates of porcine epidemic diarrhea virus from Japanese outbreaks between 2013 and 2014[J].Springer Plus,2015,4:756.
[2] Cheun-Arom T,Temeeyasen G,Srijangward A,et al.Complete genome sequences of two genetically distinct variants of porcine epidemic diarrhea virus in the Eastern region of Thailand[J].
Genome Announc,2015,3(3):e00634-00615.
[3] Bowman A S,Krogwold R A,Price T,et al.Investigating the introduction of porcine epidemic diarrhea virus into an Ohio swine operation[J].BMC Vet Res,2015,1:38.doi:10.1186/s12917-015-0348-2.
[4] Pasick J,Berhane Y,Ojkic D,et al.Investigation into the role of potentially contaminated feed as a source of the first-detected outbreaks of porcine epidemic diarrhea in Canada [J].Transb Emerg Dis,2014,61(5):397-410.
[5] Anbalagan S,Peterson J,Wassman B,et al.Genome sequence of torovirus identified from a pig with porcine epidemic diarrhea virus from the United States[J].Genome Announc,2014,2(6):pii:e01291-14.doi:10.1128/genome A.01291-14.
[6] Hofmann H,Pyrc K,van der Hoek L,et al.Human coronavirus NL63 employs the severe acute respiratory syndrome coronavirus receptor for cellular entry[J].Proc Natl Acad Sci USA,2005,102(22):7988-7993.
[7] Lu G,Hu Y,Wang Q,et al.Molecular basis of binding between novel human coronavirus MERS-CoV and its receptor CD26[J].Nature, 2013,500(7461):227-231.
[8] Delmas B,Gelfi J,Kut E,et al.Determinants essential for the transmissible gastroenteritis virus-receptor interaction reside within a domain of aminopeptidase-N that is distinct from the enzymatic site[J].J Virol,1994,68(8):5216-5224.
[9] Tusell S M,Schittone S A,Holmes K V.Mutational analysis of aminopeptidase N,a receptor for several group Ⅰcoronaviruses,identifies key determinants of viral host range [J].J Virol,2007,81(3):1261-1273.
[10] Reguera J,Mudgal G,Santiago C,et al.A structural view of coronavirus-receptor interactions[J].Virus Res,2014,194:3-15.
[11] Bonavia A,Zelus B D,Wentworth D E,et al.Identification of a receptor-binding domain of the spike glycoprotein of human coronavirus HCoV-229E [J].J Virol,2003,77(4):2530-2538.
[12] Li B X,Ge J W,Li Y J.Porcine aminopeptidase N is a functional receptor for the PEDV coronavirus[J].Virology,2007,365(1):166-172.
[13] Carvajal A,Lanza I,Diego R,et al.Differentiation between porcine epidemic diarrhea virus and transmissible gastroenteritis virus[J].J Vet Diagon Invest,1995,108(1):41-47.
[14] Nam E,Lee C.Contribution of the porcine aminopeptidase N(CD13) receptor density to porcine epidemic diarrhea virus infection[J].Vet Microbiol,2010,144(1/2):41-50.
[15] Cong Y,Li X,Bai Y,et al.Porcine aminopeptidase N mediated polarized infection by porcine epidemic diarrhea virus in target cells [J].Virology,2015,478:1-8.
[16] 李宝贤,马广鹏,葛俊伟,等.猪流行性腹泻病毒功能受体的鉴定[J].病毒学报,2009,25(3):220-225.
Abstract:To obtained the expression products of porcine aminopeptidase N (pAPN), which is reported as receptor gene of porcine epidemic diarrhea virus, the total RNA was extracted from mucous membrane of small intestine in Bama miniature pig, and cDNA was synthesized and the truncated pAPN genes were amplified by PCR using it as a template,. Then the truncated pAPN gene was cloned into a prokaryotic expression vector pET-32a (+), and then transformed intoE.coliBL21 (DE3). After induction by different concentrations of IPTG and different time to determine the optimal conditions to express the target protein.The expression products were analyzed by SDS-PAGE using anti-histidine-tagged monoclonal antibody.The optimal conditions of the prokaryotic expression of pAPN were determined as 0.8 mmol / L IPTG treated 4 h at 37 ℃. The molecular weight of the expressing productes was 45 ku. The protein size is consistent with the expected size.
Keywords:Bama miniature pig; porcine aminopeptidase N; clone; prokaryotic expression
CloningandProkaryoticExpressionofAminopeptidaseNTruncationGeneinBamaMiniaturePig
WANG Wen-xiu1,ZHANG Yan2,WANG Bao-qin3,XIE Jin-wen1,LIU Bo1,SHEN Zhi-qiang1
(1.ShandongBinzhouAnimalScience&VeterinaryMedicineAcademy,Binzhou,Shangdong,256600,China; 2.InstituteofAnimalHusbandryandVeterinaryMedicine,HainanAcademyofAgriculturalSciences,Haikou,Hainan,571100China; 3.SchoolofBioengineering,BinzhouUniversity,Binzhou,Shandong,256600,China)
S858.28:Q786
A
1007-5038(2017)08-0029-05
2016-12-19
国家自然科学基金地区科学基金项目(31560696);海南省热带动物繁育与疫病研究重点实验室开放课题(HKL201601);滨州学院实验技术研究项目(BZXYSYXM201408)
王文秀(1978-),女,新疆伊宁人,副研究员,主要从事分子病原学与免疫学研究。*
