药品委托生产中变更的分析及管理策略研究
2017-10-10唐文燕颛孙燕李建平
唐文燕+颛孙燕+李建平

摘 要 本文通过对近期药品委托生产的检查情况及变更情况进行汇总,结合企业调研情况及国外委托生产和变更控制的监管机制分析,探讨我国药品委托生产中变更管理的策略,以此提高药品委托生产现场检查的检查效率,为保证检查质量和药品质量安全提供技术支持,也为药品生产企业提供有效的技术指导。药品委托生产是产业发展的必然趋势,但当前的委托生产仍然存在一些问题,发生变更是一个常见现象,监管部门应从技术监管方面加以严格管理,不断完善相关法规政策,解决实施过程中出现的问题,以便更好的规范药品委托生产,确保药品质量安全。
关键词 药品委托生产 变更 评价分析 策略
中图分类号:R951 文献标识码:C 文章编号:1006-1533(2017)17-0042-04
Change analysis and management strategy in contract manufacturing of drugs
TANG Wenyan*, ZHUANSUN Yan, LI Jianping**
(Shanghai Center for Drug Evaluation and Inspection, Shanghai 201203, China)
ABSTRACT Strategies for change management in contract manufacturing of drugs in China were discussed based on the recent inspection of contract production of drugs and the change summary analysis combined with the supervision mechanism of domestic and foreign enterprises in contract production of drugs so as to improve the inspection efficiency of the commissioned production site inspection and provide technical support for ensuring the quality of inspection and drug quality and safety and also effective technical guidance for the pharmaceutical production enterprises. Contract production of drugs is the inevitable trend of industrial development, however, there still exist some problems in it. So the change is a common phenomenon, strict management should be implemented from technical supervision by government regulators, and the relevant regulations and policies should be constantly improved to solve the problems happened in the implementation process so as to better regulate the contract production of drugs and to ensure drug quality and safety.
KEy WORDS contract manufacturing of drugs; change; evaluation and analysis; strategy
藥品委托生产是指药品生产企业在因技术改造暂不具备生产条件和能力或产能不足不能保障市场供应的情况下,将其持有药品批准文号的药品委托其他药品生产企业全部生产的行为。委托方和受托方均是持有与委托生产药品相适应的GMP证书的药品生产企业。药品委托生产因其能够有效整合社会资源、降低生产成本、盘活现有资源等优势被越来越多的药品生产企业采用。
但是,在我国药品委托生产起步较晚,在1999年10月8日国家局发布的《关于药品异地生产和委托加工有关规定的通知》中才首次明确管理[1]。虽然之后陆续出台了药品委托生产相关的管理规定,但大都是对审批环节的行政要求规定,而相应的技术要求较少。尤其在委托生产中,由于生产主体发生了变化常常导致变更的发生,对于变更的评价工作往往根据企业自身的理解水平进行,是否接受则依赖于不同检查员的经验及理解。因此,在现阶段开展对药品委托生产中现场检查情况和变更管理情况的调研,分析总结在委托生产实施过程中的问题,并提出解决问题的方法和建议,对更好地实施药品委托生产有非常重要的意义。
1 委托生产现场检查情况汇总
自2014年10月1日《国家食品药品监督管理总局关于发布药品委托生产监督管理规定的公告(2014年第36号)》[2]实施以来,截至2016年8月31日,上海市局已完成的药品委托生产现场检查共计32家次:其中上海市内委托生产9家次(均为首次委托),委托生产的剂型8家次为口服制剂、1家次为外用制剂;跨省市委托23家次(首次委托10家次,延期委托13家次),委托生产的剂型15家次为无菌制剂(含大容量注射剂、小容量注射剂、粉针剂)、7家次为口服制剂、1家次为外用制剂。
在已完成委托生产现场检查中(实际检查为30家次,因有两家企业申请首次委托和延期委托生产的品种合并现场检查),通过对企业申报资料的审查情况、现场检查情况进行分析,已明确受托方与委托方处方工艺等方面发生变更的共计15家次,共发现变更19个,占委托生产现场检查总家次的50%。其中首次委托发生变更的为9家次,占发生变更家次的60%,延期委托发生变更的为6家次,占发生变更家次的40%。由此可知,委托生产中发生变更是一个较常见的现象。endprint
2 委托生产企业变更管理情况调研分析
为了更深入了解企业对委托生产中变更管理的认知情况,分析委托生产中变更产生的原因、企业的变更控制策略等,选择了自2014年10月1日以来接受过上海市局委托生产现场检查的委托方药品生产企业作为调研对象,对企业在委托生产中变更管理情况的认知情况进行了调研。
从单位性质看,调研对象涵盖了国有或国有控股企业、民营或民营控股企业、中外(港澳台)合资企业、外商独资企业、国内有限合资企业;从单位规模来看,调研对象的注册资金从不到1 000万元到1亿元以上不等,平均年销售额从1 000万元到5亿元以上不等;从企业员工总数来看,调研对象员工总数从80到4 000人不等;从企业质量人员数量占员工总数比例来看,调研对象质量人员数量占比最低2.78%,最高28.09%。由以上分析可知,本次調研对象具有一定的广泛性,调研样本来源具有一定代表性,所采集的信息数据有参考价值。
2.1 委托生产中变更发生情况及程度
从反馈的调研问卷中,共发生15次变更,其中工艺变更6次、药品和包装规格变更2次、包装材料和容器变更2次、原辅料或成品贮存条件变更1次、批量变更1次、药典升级说明书变更1次、生产许可证变更1次、原料新增供应商1次。对企业调研问卷中反馈的发生工艺变更的程度进一步分析,结果见表1。
2.2 企业针对变更的评价工作
调研问卷显示企业针对以上变更情况进行了一些相关的评价工作。例如对于工艺变更,有33%的企业说明了变更的原因及具体变更情况、对变更后生产工艺和设备进行了验证研究、对变更前后样品进行比较研究、对至少3批生产规模样品进行3~6个月加速及长期稳定性考察,并与原产品稳定性情况进行比较;有17%的企业说明了变更情况、进行了验证并对变更前后产品进行了比较研究;17%的企业说明了变更情况、进行了验证;也有33%的企业仅对3批生产规模样品进行了3~6个月加速及长期稳定性考察,并与原产品稳定性进行比较。
2.3 对委托生产变更管理的理解
针对委托生产中的变更,67%的调研对象认为处方不能发生变更,只有非关键工艺参数可以由受托方在委托方监督指导下完成验证工作才进行变更,29%的调研对象认为处方工艺必须保持一致,不能发生变更,仅有4%的调研对象认为处方工艺只要完成必要的研究工作后均可进行变更。
对于委托生产中变更的管理,88%的调研对象认为应该委托方和受托方都对委托生产产品的质量负责,应由双方共同进行变更评估和控制,在双方质量管理体系中进行记录和管理;12%的调研对象认为应由委托方负责;没有调研对象认为应该由受托方负责。
企业认为委托生产中发生变更的原因中,认为委托生产设施发生了变化必然引起变更的占50%,认为变更更有利于保证产品质量可控的占29%,认为委托生产产品属于老产品技术资料移交不全而引起变更的占11%,认为受托方也有相同的自有产品生产,按照自有产品处方工艺生产更为熟练和易于操作的占10%。
2.4 对委托生产中变更的认知情况分析
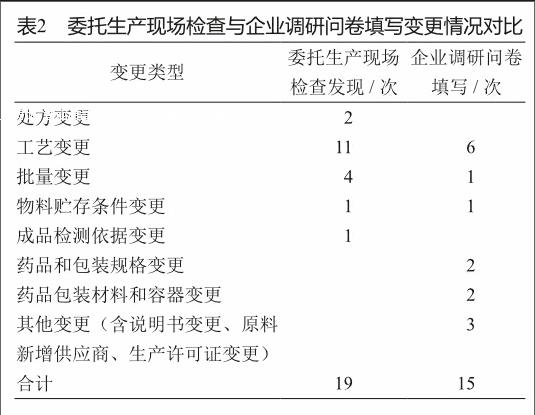
通过以上企业调研情况的分析,我们初步了解了在委托生产过程中,企业对于变更的理解、控制以及评价的情况。进一步,我们将委托生产现场检查中发现的变更情况与企业调研问卷中反映的变更情况进行了对比,以期能深入了解企业是否能够真正理解委托生产中的变更,对比情况见表2。
由以上对比结果可知,对于处方、工艺以及批量这些更可能影响委托产品质量的变更情况,企业的认知不是特别充分,或者并不认为在委托生产中发生的处方工艺以及批量的变化是一种变更,而仅仅认为是因为设备不同进行的调整,这往往也影响了企业对于变更的评价工作。
这尤其体现在企业针对工艺变更进行的评价工作中,表1中汇总了企业调研问卷反馈的工艺变更发生的程度,目前尚无针对委托生产中变更研究的指导原则,已经颁布的《已上市化学药品变更研究的技术指导原则(一)》[3]针对的是同一生产企业的产品发生变更的情况,借鉴上述指导原则,表1所列出的工艺变更类型均为Ⅱ类变更以上,在该指导原则中已经明确了各类变更应该进行的验证评价工作。但是在反馈的调研问卷中,企业针对变更的评价工作不一,往往是根据自身的理解进行。
3 委托生产中变更监督管理策略探讨
通过以上的分析可知,在目前的药品委托生产的变更管理中仍然存在一些问题:委托生产变更管理相关技术要求不明确,导致企业在实际生产过程中无规可循,从而也带来了一些质量风险隐患和监管难度;委托生产变更管理认知情况不足,未将产品委托生产过程中的处方工艺变化视为变更,并将其纳入变更管理程序;委托生产各方沟通不够,这体现在委托方与受托方之间、被检查企业与检查员之间、不同地区的检查员之间等等。
3.1 国外委托生产变更管理相关规定
委托生产因为生产主体发生了变化,往往是不同生产企业的两个质量体系同时负责一个委托生产产品,所以与一般的变更补充申请有所区别。2013年5月,FDA出台了药品委托生产质量协议的指南草案[4],对委托生产的质量协议进行了详细规定,对于变更应该如何进行评价,FDA于2004年4月的已批准NDA或ANDA的变更指南[5]中进行了说明。而欧盟药品委托加工不需行政许可,强调药品委托加工立项前研究,欧洲药品局在2011年5月19日颁布实施外包服务的步骤标准操作规程[6],该标准将药品委托加工的启动程序规范化、标准化,保证欧洲药品管理局对委托加工有一致性和持续性了解。相比之下,与美国和欧盟相比,我国的规定略显粗糙,对申报材料的要求较低,同时委托加工合同不具有药品委托加工特殊性,美国和欧盟[7]都分别为委托生产提供了一个严谨、完整的合同样本,涵盖从合同建立、执行、终止的各个环节,覆盖整个药品委托加工周期。不仅更加规范,也使委托生产中的各项内容更具操作性。endprint
3.2 对委托生产中变更监督管理检查策略的建议
3.2.1 完善相关法律法规,使监管有法可依
对于委托生产,受托方与委托方的处方工艺一致性是检查的重点。国家局分别于2008年4月和2011年11月发布了《已上市化学药品变更研究技术指导原则》[3]和《已上市中药变更研究的技术指导原则》[8],用于指导申请人开展已上市化药和中药制剂在生产、质量控制、使用等方面的变更研究。结合上述国外委托生产相关的法规要求以及企业调研反馈的情况,我国应尽快完善相应的政策法规,尤其是对于委托生产中的常见问题如处方工艺的变更及其评价,应制定相关的技术指导原则或操作指南,使委托生产更加趋于合法化和规范化,让监管人员在日常监管中有法可依。
3.2.2 加强有针对性的培训,提高认知程度
《国家食品药品监督管理总局关于发布药品委托生产监督管理规定的公告(2014年第36号)》实施日期自2014年10月1日起,实施日期并不长,因此不论是药品生产企业还是监管机构对法规的理解不甚相同。应扩大委托生产培训的范围,开展委托生产实际操作的培训,最好是在培训中提供一些实际案例以供参考,解答企业在委托生产中遇到的共性问题。组织检查人员和药品生产企业相关人员进行研讨,交流各地委托生产管理的实施情况,总结经验,推动委托生产实施更加规范化。
3.2.3 加强各方沟通,减少监管屏障
委托生产因其特殊性,各方面的沟通对委托生产的顺利进行具有非常重要的意义。美国甚至要求将委托双方的沟通机制和沟通计划在质量协议中进行明确,以保证在委托生产过程中委托生产产品的质量得到保证。而药品生产企業与监管机构之间建立长期专门的双向交流平台,不仅能让监管机构了解企业委托生产的实施情况,同时也通过企业及时反馈在委托生产过程中遇到的问题,监管部门能够从实际操作层面提供可行的建议。同样,委托和受托企业双方的监管部门更应加强沟通,时时互通有无,以确保双方的生产工艺均为注册批准的生产工艺,确保产品的均一、有效和稳定,也有利于统一不同区域的检查标准,提高检查效率。
4 结语
药品委托生产将各主体的优势资源集中在优势领域,是一种全球化发展的资源合理配置形式,是产业发展的必然趋势。但当前的委托生产仍然存在一些问题,例如相关技术要求不明确、变更管理认知情况不足、委托生产各方沟通不够等。所以监管部门应从技术监管方面加以严格管理,不断完善相关法规政策,适当修改、制定药品委托生产相关的法律法规,解决实施过程中出现的问题,以便更好的规范药品委托生产,确保药品质量安全。
参考文献
[1] 国家食品药品监督管理总局. 关于药品异地生产和委托加工有关规定的通知[EB/OL]. (1999-10-08)[2017-05-08]. www.sda.gov.cn/WS01/CL0058/9297.html.
[2] 国家食品药品监督管理总局. 国家食品药品监督管理总局关于发布药品委托生产监督管理规定的公告(2014年第36号)[EB/OL]. (2014-08-14)[2017-05-08]. www.sda.gov. cn/WS01/CL0087/104895.html.
[3] 国家食品药品监督管理总局. 关于印发已上市化学药品变更研究的技术指导原则的通知[EB/OL]. (2008-05-13)[2017-05-08]. www.sda.gov.cn/WS01/CL0055/30232.html.
[4] FDA. Contract Manufacturing Arrangements for Drugs: Quality Agreements[EB/OL]. [2017-05-08]. www.fda.gov/downloads/ Drugs/GuidanceComplianceRegulatoryInformation/Guidances/ UCM353925.pdf.
[5] FDA. Changes to an Approved NDA or ANDA[EB/OL].[2017-05-08]. http://fdaguidance.net/drug-guidances/fdaguidance-for-changes-to-an-approved-nda-or-anda/.
[6] EMA. Steps involved in outsourcing of services[EB/ OL]. [2017-05-08]. http://www.ema.europa.eu/docs/en_ GB/document_library/Standard_Operating_Procedure_-_ SOP/2011/05/WC500106488.pdf.
[7] EMA. Draft Framework service contract for outsourcing[EB/ OL]. [2017-05-08]. http://www.ema.europa.eu/docs/en_GB/ document_library/Procurement/2014/10/WC500175334.pdf.
[8] 国家食品药品监督管理总局. 关于印发已上市中药变更研究技术指导原则(一)的通知[EB/OL]. (2011-11-16)[2017-05-08]. www.sda.gov.cn/WS01/CL0844/67188.html.endprint
