流式鞘液流速对调节性T细胞和CXCR4+细胞亚群检测结果的影响
2017-10-10朱红王成宝
朱红 王成宝
论 著
流式鞘液流速对调节性T细胞和CXCR4+细胞亚群检测结果的影响
朱红 王成宝
目的观察不同的鞘液流速对检测调节性T细胞(Treg)和CXCR4+细胞亚群细胞比例的结果是否有影响。方法取15例体检人员的新鲜抗凝外周血,分别用低速,中速和高速3种不同的鞘液流速来检测Treg和CXCR4+细胞亚群的细胞比例,采用配对比较来分析组间差异。结果对于两种细胞亚群的细胞比例,3种鞘液流速检测出来的结果之间均没有显著性差异〔Treg(%):低速:2.28±0.76,中速:2.22±0.74,高速:2.43±0.93;CXCR4+(%):低速:90.04±4.18,中速:90.08±4.19,高速:90.15±4.17;均P>0.05〕。结论鞘液流速不会影响两种细胞亚群比例的结果。
流式细胞术; 调节性T细胞; CXCR4
流式细胞术(flow cytometry,FCM)是近代细胞生物学、分子生物学、分子免疫学、流体力学、激光技术、电子计算机技术等学科和技术结合和发展的结晶,是一种在蛋白水平上对单细胞或其他细胞粒子、抗原物质进行快速检测分析和分选的技术。流式细胞仪(fluorescence-activated cell sorter,FACS)能够快速分析单个细胞或粒子的多种特性,既可以定性,也可以定量,尤其适用于大量样品检测。
在流式细胞仪上,细胞由鞘液带动流过管路的速度一般有低速档、中速档和高速档3档。在临床检测中,由于临床样本数量大,对检测效率要求高,且对被检测样本特性熟悉,一般使用高速档进行检测。不过,在进行基础研究时,由于对检测样本特性不熟悉,一般建议采用低速档进行检测,这样做的目的是提高准确性,但同时也牺牲了效率。
调节性T细胞(regulatory T cell,Treg)是CD4+T细胞亚群,通过抑制自身反应性淋巴细胞来保持机体的自身耐受状态。叉头框蛋白P3(forkhead box protein P3,Foxp3)是其特异标志物[1],目前一般接受CD4+CD25+Foxp3+细胞亚群是Treg细胞。CXC趋化因子受体4型(C-X-C chemokine receptor type 4,CXCR4),即CD184,是一种七次跨膜的G蛋白偶联受体[2-3],其在体内分布非常广泛。目前认为其在体内的唯一配体是趋化因子配体12 〔chemokine(C-X-C motif) ligand 12,CXCL12〕。CXCR4/CXCL12轴参与多个与免疫相关的生物学活动,如B细胞的抗体分泌[4]、整合蛋白的激活[5]和对淋巴细胞的趋化[6]。
为了大量检测样本中的Treg和CXCR4+细胞,能否在保证数据准确性的前提下,采用流式细胞仪的高速档进行检测?为此,我们对不同的流速下的检测结果进行了比较。
1 对象与方法:
1.1 研究对象 收集15例体检人员新鲜肝素锂抗凝外周血。
1.2 实验方法 采用美国BD公司的FACSCalibur流式细胞仪进行分析。
1.2.1 Treg淋巴细胞的流式检测 按照Treg(美国eBioscience公司,货号:88-8999-40)说明书的步骤操作。过程简述如下:取新鲜抗凝全血100 μL,再加入稀释后的红细胞裂解液(美国BD公司)2 mL Vortex旋涡混匀器混匀,室温避光孵育10 min,300×g离心力室温离心5 min,去上清,试管内保留约50 μL残留液;向管中加20 μL CD4/CD25混合染液,4℃避光孵育30 min;用2 mL冷的磷酸盐缓冲液(PBS)洗涤;离心,弃上清;加1 mL Foxp 3固定/透化缓冲液,混匀;在4 ℃避光孵育30~60 min;加入2 mL透化缓冲液,离心,弃上清;用染色缓冲液(staining buffer)重悬浮细胞至500 μL,混匀,4℃避光放置至上机检测。
1.2.2 CXCR4+细胞亚群的流式检测 取新鲜抗凝全血200 μL,加入人CD184(即CXCR4+,德国Miltenyi Biotec公司)荧光抗体10 μL,将样本用Vortex旋涡混匀器混匀,室温避光孵育15 min,加稀释后的红细胞裂解液2 mL,混匀,避光孵育10 min,300×g离心力离心5 min后,弃上清,用2 mL PBS洗涤1次,混匀,离心,弃上清,加入500 μL PBS重悬浮,Vortex旋涡混匀器混匀,4 ℃避光放置至上机检测。
1.3 统计学分析 用FlowJo 7.6软件分析流式数据,采用SPSS 19.0统计软件进行统计分析。3组间比较采用重复测量的方差分析,P<0.05代表差异具有统计学意义。
2 结果
2.1 不同检测速度对Treg细胞占CD4+淋巴细胞比例的影响 我们将15例样本分别采用低速、中速和高速3种流速分析表型为CD4+CD25+Foxp3+的Treg细胞占CD4+淋巴细胞的比例,每个样本每种流速分别检测3次,再取平均值。实验结果表明,低速、中速和高速3种不同的流速下,检测到的Treg细胞占CD4+淋巴细胞的比例之间没有统计学差异(P>0.05)。图1~2。
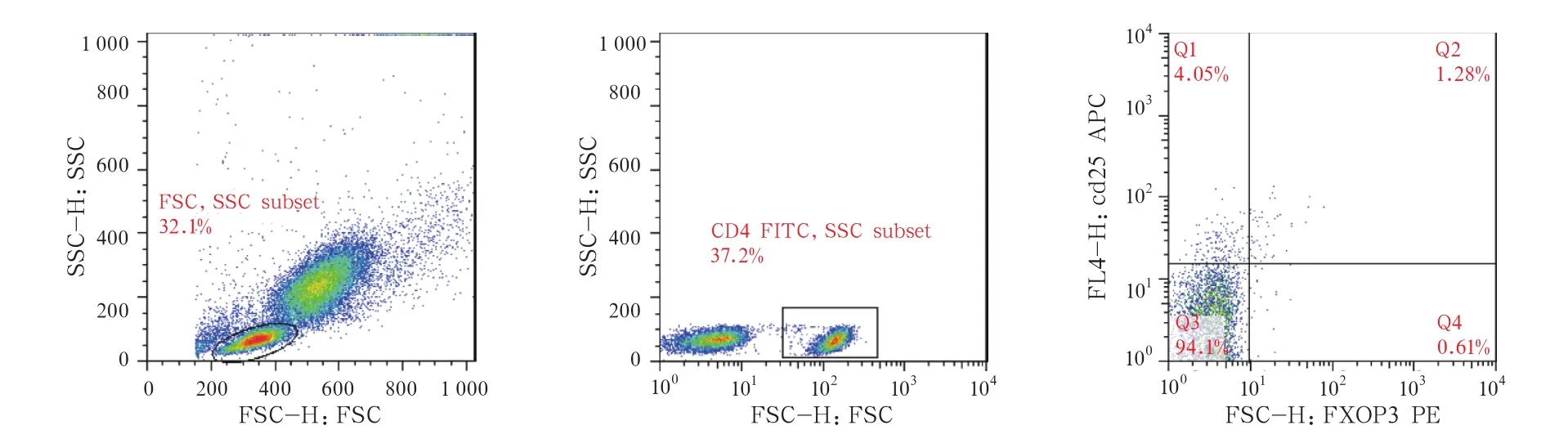
图1 全血中的淋巴细胞亚群(左椭圆形门内)和亚群中的CD4+细胞亚群(中方形门内),以及CD4+细胞亚群中的Treg(右Q2,右上象限)
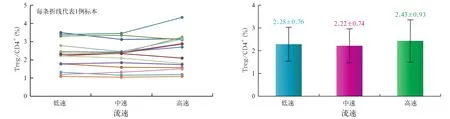
图2 在不同检测速度时,标本中Treg占CD4+细胞亚群比例的变化(左)及均值(右)比较
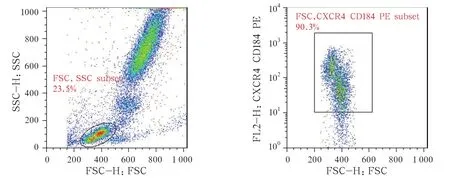
图3 全血中的淋巴细胞亚群(左,椭圆形门内)及亚群中的CXCR4+细胞亚群(右,方形门内)
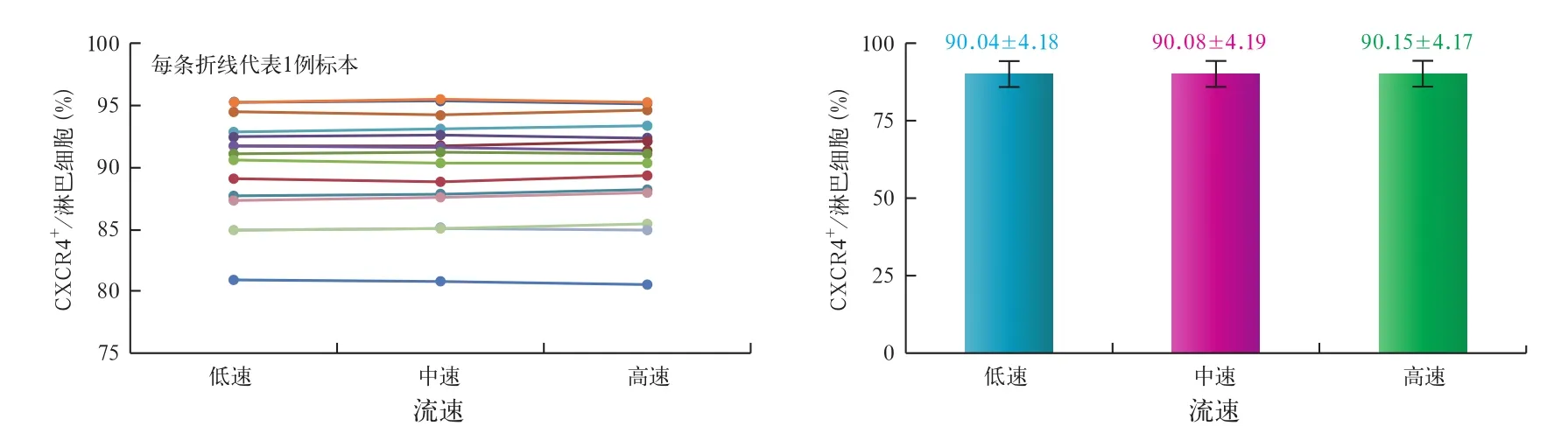
图4 在不同检测速度时,标本中CXCR4+细胞占淋巴细胞亚群比例的变化(左)及均值(右)比较
2.2 不同检测速度对CXCR4+阳性细胞占淋巴细胞比例的影响 我们将15例样本分别采用低速,中速和高速3种流速分别检测CXCR4+(即CD184+)细胞占淋巴细胞的比例,每个样本每种流速分别检测3次,再取平均值。实验结果表明,低速,中速和高速3种不同的流速下,检测到的CXCR4+细胞占淋巴细胞的比例之间没有统计学差异(P>0.05)。见图3~4。
3 讨论
流式细胞术具有测量速度快、灵敏度高、分辨率高、操作简便等特点[7]。目前流式细胞术在临床上主要用于检测淋巴细胞亚群、HLA-B27抗原、肿瘤标志物、进行白血病免疫分型、微生物检测等。另外,流式细胞术也应用到外周血血细胞分析和尿沉渣分析中。而在基础医学的研究中,流式细胞术的应用则更加广泛。
由于基础医学研究的样本不像临床研究样本数量大,样本的特点也很陌生,所以,在使用流式细胞仪进行基础研究时,常常要对仪器进行重新调试和校准,对实验条件进行摸索才能找到稳定的检测条件。本研究就是因为研究指标并不是经常检测的临床指标,所以,需要考察不同流速对检测结果的影响。从上述两个指标的检测结果可以看出,低速、中速和高速3种不同的进样速度,不会对我们的结果产生差异。所以,我们在后面的研究中,放心地采用了高速档进行检测,这样在保证实验结果准确性的同时提高了检测的效率。
1 Fontenot JD,Gavin MA,Rudensky AY. Foxp3 programs the development and function of CD4+CD25+regulatory T cells [J]. Nat Immunol,2003,4(4):330-336.
2 Lefranois M,Lefebvre MR,Saint-Onge G,et al. Agonists for the chemokine receptor CXCR4 [J]. ACS Med Chem Lett,2011,2(8):597-602.
3 Zhan W,Liang Z,Zhu A,et al. Discovery of small molecule CXCR4 antagonists [J]. J Med Chem, 2007,50(23):5655-5664.
4 Nagasawa T,Hirota S,Tachibana K,et al. Defects of B-cell lymphopoiesis and bone-marrow myelopoiesis in mice lacking the CXC chemokine PBSF/SDF-1 [J]. Nature,1996,382(6592):635-638.
5 Peled A,Kollet O,Ponomaryov T,et al. The chemokine SDF-1 activates the integrins LFA-1, VLA-4, and VLA-5 on immature human CD34+cells: role in transendothelial/stromal migration and engraftment of NOD/SCID mice [J]. Blood, 2000,95(11):3289-3296.
6 Bleul CC,Fuhlbrigge RC,Casasnovas JM,et al. A highly efficacious lymphocyte chemoattractant, stromal cell-derived factor 1 (SDF-1)[J]. J Exp Med, 1996,184(3):1101-1109.
7 胡小倩,王素霞,曹明善.肺癌患者外周血DNT细胞和T淋巴细胞亚群检测的临床意义[J].实用检验医师杂志,2015,7(3):157,180-181.
Effects of the sheath fluid stream flow rate on the detection of regulatory T cells and CXCR4+cell subsets
Zhu Hong, Wang Chengbao.
Department of Clinical Laboratory, Xuzhou Central Hospital, Xuzhou 221009,Jiangsu, China
ObjectiveTo investigate the effects of different sheath flow rates on the detection of regulatory T cells and CXCR4+cell subsets.MethodsFifteen cases of fresh blood coagulation of peripheral blood were taken from physical examination staff, the percentage of the regulatory T cells and the CXCR4+subpopulations were detected by low-speed, medium-speed and high-speed in three different sheath fluid flow rates. Pairwise comparisons were used to analyze differences between groups.ResultsThere was no significant difference between the results of the three sheath flow rates detected for the cell proportions of the two cell subsets [Treg(%): low-speed: 2.28±0.76, medium-speed: 2.22±0.74, high-speed: 2.43±0.93; CXCR4+(%): low-speed:90.04±4.18, medium-speed: 90.08±4.19, high-speed: 90.15±4.17; both P > 0.05].ConclusionThe flow rate of the sheath fluid does not affect the results of the two cell subsets.
Flow cytometry; Regulatory T lymphocyte; C-X-C chemokine receptor type 4
2017-06-17)
(本文编辑:杨程伍 李银平)
221009 江苏徐州,徐州市中心医院检验科
朱红,Email:feiyv1234@126.com
10.3969/j.issn.1674-7151.2017.03.005
Corresponding author: Zhu Hong, Email: feiyv1234@126.com
