文冠果叶片离体再生体系的优化研究
2017-10-10张凌郭帅张芸香郭晋平
张凌,郭帅,张芸香,郭晋平
(1.山西农业大学 林学院,山西 太谷 030801;2.山西农业大学 城乡建设学院,山西 太谷 030801)
文冠果叶片离体再生体系的优化研究
张凌1,郭帅1,张芸香1,郭晋平2*
(1.山西农业大学 林学院,山西 太谷 030801;2.山西农业大学 城乡建设学院,山西 太谷 030801)
[目的]探明不同处理对文冠果叶片离体再生体的反应。[方法]以成熟文冠果叶片作为外植体,通过诱导和培养的方法,研究不同培养基激素配比对文冠果离体培养的影响。[结果]2,4-D及其与BA组合诱导的愈伤组织不适宜进行间接不定芽诱导;MS培养基中添加2.0 mg·L-1KT和0.2 mg·L-1NAA时,愈伤组织诱导率最高,且在愈伤组织上可分化出不定芽,是叶片通过愈伤组织诱导不定芽再生的一条最佳途径。IBA与NAA、IAA组合中,NAA、IAA浓度为1.0 mg·L-1时,为最佳生长素配比;生长素速蘸方法不适宜进行试管苗生根培养。[结论]不同组合和配比生长系,对文冠果再生体有不同效果。
文冠果;叶片外植体;间接器官发生;增殖;生根
Abstract:[Objective]To ascertain the reaction of different treatments. [Methods]The effects of hormone ratio on the culture ofXanthocerassorbifoliawere studied by induction and culturemethod . The conditions of indirect adventitious bud induction, adventitious bud proliferation and rooting culture were studied.[Results]The results showed that the 2,4-D and BA combination were not suitable for callus indirect adventitious bud induction. MS culture medium with 2.0 mg·L-1KT and 0.2 mg·L-1NAA, were the highest callus induction rate and callus differentiation of adventitious buds. The best way of regeneration was that leaves through callus induction of adventitious buds. The best auxin ratio was NAA, IAA concentration of 1.0 mg·L-1,IBA the combination with NAA and IAA. The auxin fast dipmethod was not suitable for the test tube rooting culture.[Conclusion]Different combination and proportions of auxin have different effect on regenetion.
Keywords:Xanthocerassorbifolia, Leaf explants, Indirect organogenesis, Proliferation, Rootage
文冠果(Xanthocerassorbifolia),又名文冠花、文登阁、崖木瓜等,为无患子科植物,落叶乔木或灌木[1]。文冠果是中国特有的温带木本油料植物[2],其种子含油率达30%~60%, 种仁含油率高达55%~66%,被誉为“北方油茶”[3]。文冠果油为半干性油,透明,气味芳香,是一种优良食用、药用和生物柴油原料[4],具有很大的开发利用价值。文冠果适应性强,是绿化荒山的先锋树种,根系发达、根萌蘖性强,也是很好的水土保持树种。
目前文冠果种质资源缺乏、繁殖困难、后代变异分化严重,且文冠果种子繁殖个体性状差异显著,进而影响产量。此外,文冠果的嫁接繁殖成活率也较低[5],因此,研究文冠果组织培养及营养器官立体再生,可以快速繁殖文冠果苗,培育性状稳定且优良的树种。
对于文冠果无性器官离体培养的研究已有一些报道,如王玉珍[6]、柳金凤[7]、任如意[8]采用文冠果的嫩茎作为外植体进行培养;柳金凤[7]、宋群雁[9]用文冠果的叶片作为外植体进行培养;黄永伟[10]、兰士波[11]、王非[12]等对文冠果生根的激素配比进行了研究。
本研究以成熟文冠果叶片作为外植体,通过器官间接再生途径对不定芽进行诱导,并对不定芽的增殖和生根问题进行了研究,旨在通过研究文冠果组织培养及营养器官的离体再生,快速繁殖优良性状的文冠果品种。
1 材料与方法
1.1 试验材料
试验所用叶片采自山西农业大学林学院苗圃栽培的7年生文冠果实验林,挑选健康、无病虫害植株,采集其叶片作为试验所用的外植体。将采回的叶片用流水冲洗过后,放置在超净台上进行消毒。先用75%酒精处理30 s,无菌蒸馏水冲洗3次,再用0.1%升汞消毒4 min,无菌水冲洗5~6次,去掉叶片边缘,准备接种,所有叶片以远轴面接触培养基。
1.2 试验方法
试验所用培养基中均添加蔗糖3%,琼脂4.3 g·L-1,pH调至5.8~5.9,121 ℃高压灭菌15 min。所有培养物均于(25±2)℃的恒温培养箱中培养。
1.2.1 叶片间接愈伤组织的诱导
(1)不同浓度2,4-D及其与BA对叶片愈伤组织诱导的影响
将灭菌后的叶片外植体接种于MS基本培养基上,并添加不同浓度的2,4-D(0.1,0.5,1.0,2.0,5.0 mg·L-1)及其分别与1.0 mg·L-1BA组合。本阶段叶片接种于培养皿中,每个培养皿接种20个叶片,每个组合接种3个培养皿,重复3次。30 d后统计叶片愈伤组织诱导率和不定芽诱导率。
(2)不同浓度KT与NAA组合对叶片愈伤组织诱导的影响
将灭菌后的叶片外植体接种到添加0.02 mg·L-1NAA的MS培养基上,并添加不同浓度的KT(1.0,2.0,3.0,5.0 mg·L-1),共4个组合。本阶段叶片接种于培养皿中,每个培养皿接种20个叶片,每个组合接种3个培养皿,重复3次。30 d后统计文冠果叶片愈伤组织诱导率和不定芽诱导率。
1.2.2 叶片不定芽分化培养
将诱导出愈伤组织的叶片转接于MS培养基上,并添加2.0 mg·L-1BA和0.2 mg·L-1NAA,进行不定芽的诱导培养。
1.2.3 试管苗的生根培养
(1)不同浓度NAA、IAA与IBA组合对试管苗生根培养的影响
将继代增殖的试管苗转接于上述筛选出的最佳基本培养基,添加0.5 mg·L-1IBA与不同浓度(0.5, 1.0, 2.0 mg·L-1)的NAA与IAA组合,30 d后统计试管苗的生根率、生根数及根长。
(2)生长素速蘸法对试管苗生根培养的影响
将继代增殖的试管苗分别在含有不同浓度的NAA和IBA溶液中速蘸,其浓度分别为:50、100和200 mg·L-1,然后转接到不含任何生长素的基本培养基中进行培养,30 d后统计生根率、生根数及根长。
2 结果与分析
2.1 2,4-D对叶片愈伤组织及不定芽诱导的影响
在所有的培养基中均观察到,外植体有所膨大,30 d后,在叶脉或切口边缘处均诱导出淡黄、疏松愈伤,以叶脉数居多,有些外植体的整个叶脉都被愈伤组织覆盖,少数外植体分化出雪白或淡黄粘稠状的愈伤组织(图1)。方差分析表明,2,4-D浓度对叶片愈伤组织诱导影响显著(P=0.034)。

图1 淡黄、疏松的愈伤组织图Fig.1 Pale yellow, loose callus
2,4-D浓度为0.1 mg·L-1时,愈伤组织诱导率达96.67%,但愈伤量较少;2,4-D升高至0.5 mg·L-1,愈伤组织诱导率高达100.00%,而且愈伤量最多;继续升高,诱导率仍高达100.00%,但愈伤量逐渐减少,见表1。
表1 2,4-D浓度对叶片愈伤组织诱导的影响因素
Table1 Effect of different concentration of 2,4-D on callus induction
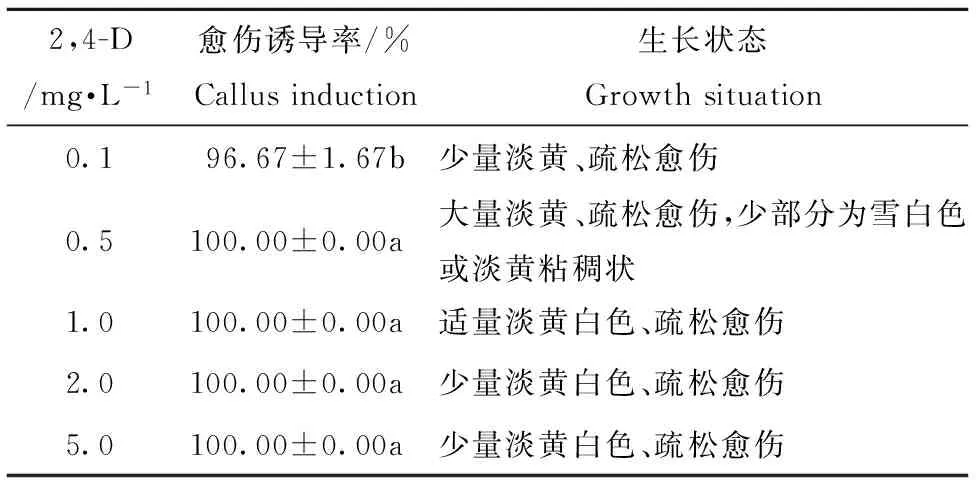
2,4-D/mg·L-1愈伤诱导率/%Callusinduction生长状态Growthsituation0.196.67±1.67b少量淡黄、疏松愈伤0.5100.00±0.00a大量淡黄、疏松愈伤,少部分为雪白色或淡黄粘稠状1.0100.00±0.00a适量淡黄白色、疏松愈伤2.0100.00±0.00a少量淡黄白色、疏松愈伤5.0100.00±0.00a少量淡黄白色、疏松愈伤
将诱导的白色、结构疏松的愈伤组织转接到MS培养基并添加2.0 mg·L-1BA和0.2 mg·L-1NAA,愈伤组织未分化出不定芽;随着时间的延长,会出现轻微褐化现象。因此,通过2,4-D诱导的愈伤组织不能间接诱导出不定芽。
2.22,4-D与BA组合对叶片愈伤组织及不定芽诱导的影响
所有2,4-D与BA组合中均观察到,在叶脉与切口处分化出淡黄、松软的愈伤组织,甚至整个叶片外植体也被愈伤组织包围,见图2。方差分析表明,2,4-D与BA组合对愈伤组织的诱导率影响显著(P=0.007)。

图2 松软的愈伤组织Fig.2 Soft callus
培养基中添加低浓度的2,4-D,愈伤组织诱导率较低,且愈伤量较少;随着2,4-D浓度的不断增加,愈伤组织诱导率逐渐升高。2,4-D浓度升高至1.0 mg·L-1,愈伤组织诱导率达到最高,达98.41%,愈伤量也较多;继续升高,诱导率略有下降,见表2。

表2 2,4-D与BA组合对叶片愈伤组织诱导的影响Table 2 Effect of the combination of 2,4-D and BA on callus induction
将淡黄、松软愈伤组织转移至分化培养基中也未能分化出不定芽。因此,通过2,4-D与BA组合诱导的愈伤组织不适宜进行间接不定芽诱导。
2.3KT与NAA组合对叶片愈伤组织及不定芽诱导的影响
所有KT与NAA组合中,均诱导出淡黄、松软或淡绿、致密愈伤组织(图3)。方差分析表明,KT与NAA组合对叶片愈伤组织诱导率影响显著(P<0.001)。
研究结果表明,培养基增加1.0 mg·L-1KT和0.2 mg·L-1NAA,愈伤组织的诱导率较低,达78.70%;随着KT浓度的升高,愈伤组织诱导率亦逐渐升高。当KT浓度为2.0 mg·L-1时,愈伤组织的诱导率最高,达88.32%;继续升高,愈伤组织诱导率呈下降趋势,见表3。

图3 淡绿、致密的愈伤组织Fig.3 Light green, dense callus
30 d后,将淡绿、致密愈伤组织转接到新鲜培养基中继续培养,可分化出不定芽芽点,继而进一步生长。
因此,MS培养基中添加2.0 mg·L-1KT和0.2 mg·L-1NAA时,愈伤组织诱导率最高,且在愈伤组织上可分化出不定芽,为叶片通过愈伤组织途径诱导不定芽再生的最佳途径。
2.4不同浓度NAA、IAA与IBA组合对试管苗生根培养的影响
1/2MS作为基本培养基,将0.5 mg·L-1IBA与不同浓度的NAA和IAA组合,进行试管苗生根培养。观察发现,试管苗诱导的根部部分呈膨松状,而且逐渐变黄、枯死,其余生长正常,见图4。

表3 KT与NAA组合对叶片愈伤组织诱导的影响Table 3 Effect of the combination of KT and NAA on callus induction

图4 生根苗Fig.4 Rooting seedlings
方差分析表明,生长素组合对试管苗的生根率(P=0.019)、生根数(P=0.001)和根长(P=0.005)均有显著性影响。
IBA与NAA组合中,NAA浓度为1.0 mg·L-1,生根率最高,达30.60%,高于或低于此浓度,生根率均有所降低;生根数与生根率呈相同趋势,NAA浓度为1.0 mg·L-1,生根数达到最大,为5.90,高于或低于此浓度,生根数均有所降低;NAA浓度为0.5 mg·L-1,根长最长,为1.59 cm,见表4。
IBA与IAA组合中,IAA浓度为1.0 mg·L-1,生根率最高,达33.63%,高于或低于此浓度,生根率均有所降低;生根数与生根率呈相同趋势,IAA浓度为1.0 mg·L-1,生根数达到最大,为3.00,高于或低于此浓度,生根数均有所降低;IAA浓度为0.5 mg·L-1,根长最长,为3.78 cm,见表4。另外,当IAA浓度为1.0 mg·L-1时,发现有少量侧根出现,生根苗可以正常生长。
2.5 生长素速蘸法对试管苗生根培养的影响
试管苗经不同浓度的生长素速蘸后,培养于未添加任何生长素的1/2MS培养基进行培养,观察发现(表5),所有试管苗均未诱导生根,且当生长素的浓度高于50 mg·L-1时,出现轻微玻璃化现象,见图5,这种现象随着生长素浓度的升高而加剧。因此,生长素速蘸方法不适宜进行试管苗生根培养。
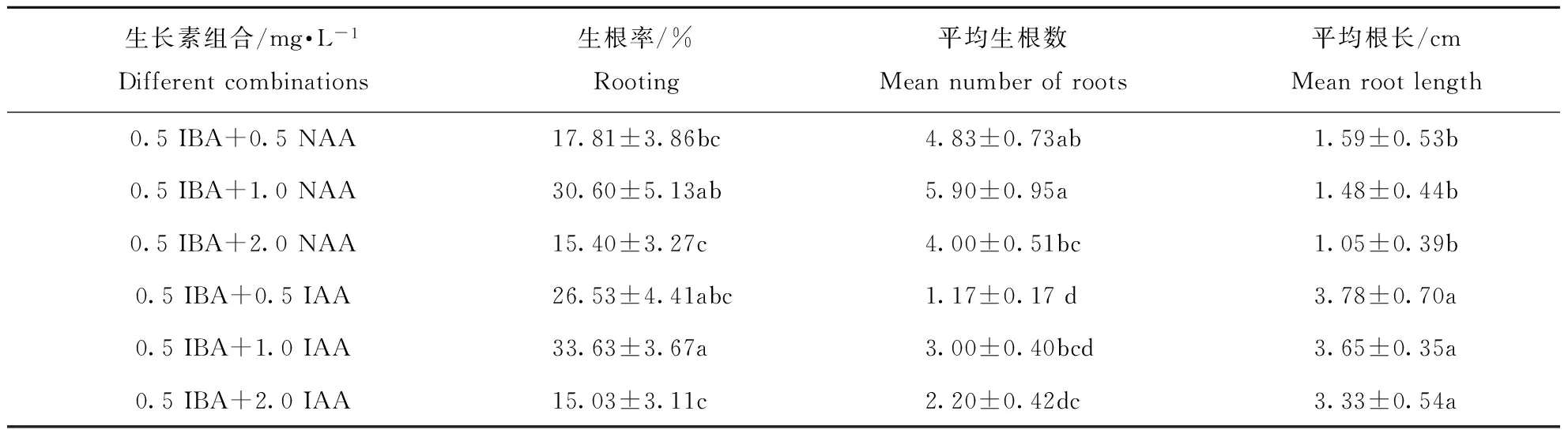
表4 不同浓度NAA、IAA与IBA组合对文冠果生根培养的影响Table 4 Effect of different NAA、IAA combination with IBA on rooting of in vitro regenerated shoots

图5 玻璃化的试管苗Fig.5 Test tube seedling
表5生长素浓度速蘸对试管苗生根的影响
Table5 Effect ofspeed-dip in auxins method on rooting of in vitro regenerated shoots

生长素/mg·L-1Auxins生根率/%Rooting生长状况GrowthsituationNAA500.00未诱导出根,逐渐枯黄NAA1000.00出现轻微玻璃化现象,未诱导出根NAA2000.00出现玻璃化现象,未诱导出根IBA500.00未诱导出根,逐渐枯黄IBA1000.00出现轻微玻璃化现象,未诱导出根IBA2000.00出现玻璃化现象,未诱导出根
3 讨论与结论
愈伤组织的诱导与植物生长调节剂的种类和密度密切相关。一般来说,诱导愈伤组织产生及增殖最常用的植物生长调节剂是2,4-D[13]。但长时间使用高浓度的2,4-D反而会影响愈伤组织的形态特征,限制愈伤组织的再分化。因此,筛选植物生长调节剂的种类和浓度就显得尤为重要。
本试验单独添加2,4-D,研究其对叶片愈伤组织及不定芽的诱导,结果表明,所有的培养基中均诱导出白色、结构疏松的愈伤组织,但诱导的愈伤量有所差别。将诱导的愈伤组织转接到分化培养基中,均未能诱导出不定芽,说明2,4-D诱导的愈伤组织不能进行不定芽再生。此结论与王慧梅[14]在喜树愈伤组织的诱导和不定芽再生研究结论一致。也有研究表明,较高浓度的2,4-D对Chinese Leymus 组织培养再生芽的诱导非常有效[15]。
为实现叶片间接不定芽诱导,本试验对2,4-D与1.0 mg·L-1BA组合进行了研究,结果表明,所有培养基均诱导出淡黄、松软的愈伤组织。将诱导的淡黄、松软愈伤组织转接到分化培养基进行培养,均未能诱导出不定芽。由此可见,2,4-D与1.0 mg·L-1BA组合也不适宜用于叶片间接不定芽诱导。在复叶槭组织培养研究中发现,MS培养基添加1.0 mg·L-1BA和0.01 mg·L-12,4-D,叶片外植体分化出黄绿色、致密愈伤组织,尤其在叶脉处分化愈伤组织较多[16]。在草莓体外培养再生研究中发现,不同浓度的2,4-D与BA组合,诱导出的愈伤组织为淡黄色或黄色,颗粒状,紧实,较干燥或湿润,转移到分化培养基进行培养,约70.5%的愈伤组织可分化出不定芽[17]。
本研究对KT和NAA组合进行叶片愈伤组织诱导及不定芽再生研究,结果表明,所有培养基中,均诱导出淡黄、松软或淡绿、致密愈伤组织;培养基添加2.0 mg·L-1KT和0.2 mg·L-1NAA,愈伤组织诱导率最高,继续培养可分化出不定芽。草莓叶片外植体在KT和NAA的组合下,诱导的愈伤组织为淡黄或黄色,颗粒状,紧实,较干燥或湿润,在分化培养基中也可分化出不定芽[17],而对高山红景天叶片外植体进行愈伤组织诱导研究时得出,培养基添加KT和NAA,愈伤组织诱导率最低,诱导效果最差[18]。以上现象可能是由于不同树种因其内源激素不同,对同种激素组合的反应也有所差异。
NAA、IBA和IAA是目前最常用的生长素。通常认为,同时使用两种或两种以上的生长素,对生根培养的效果要好于单独使用某一种生长素。将IBA与NAA、IAA组合,结果表明, IBA与NAA组合,NAA浓度为1.0 mg·L-1,生根率最高,生根数达到最大,根长适宜生长,IBA与IAA组合,IAA浓度为1.0 mg·L-1,生根率最高,生根数达到最大,根长适宜生长。
试验采用不同浓度的NAA和IBA速蘸后,培养与为添加任何生长素的1/2MS培养基中,研究发现,所有的试管苗均未诱导生根。可见,高浓度的生长素速蘸对试管苗生根是无效的。而对翅果油树的生根研究发现,在200 mg·L-1IBA溶液中浸泡30 min,生根效果较好。这可能是不同树种对生长素刺激的反应不同。
[1]张娜,郭晋平.文冠果组织培养技术关键环节研究进展与展望[J].中国农学通报,2009,25(8):113-116.
[2]陈淼.文冠果组织培养再生体系的建立[D].呼和浩特:内蒙古大学,2014.
[3]杨建民,黄万荣.经济林栽培学[M].北京:中国林业出版社,2004:330-334.
[4]高伟星,那晓婷,刘克武.生物质能源植物——文冠果[J].中国林副特产,2007(1):93-94.
[5]任皎,芦静,李岩,等.文冠果离体培养技术研究[J].吉林林业科技,2011(6):13-16.
[6]王玉珍,李霞,张弛.文冠果组培快速繁殖方法[P].中国专利,101032226,2007-9-12.
[7]柳金凤,吴建华,闵丽霞.文冠果组培快繁技术研究[J].江苏农业科学,2010(2):52-54.
[8]任如意,王书臻,司徒琳莉,等.噻重氮苯基脲对文冠果愈伤组织诱导与分化的影响[J].北方园艺,2011(6):127-129.
[9]宋群雁,王丽艳,矫洪双,等.文冠果组织培养和植株再生研究[J].北方园艺,2013(7):121-124.
[10]黄永伟,贾明仁,王洪波,等.影响文冠果组织培养苗离体生根的因素[J].北方果树,2010(4):7-9.
[11]兰士波,崔云英,李秀兰.文冠果优异种质选择及茎段离体培养技术[J].黑龙江生态工程职业学院学报,2011,24(3):16-18.
[12]王非,孙赟璐,李在善,等.取材时期对文冠果优树芽启动的影响[J].东北林业大学学报,2012,40(4):11-13,30.
[13]Hsiang C H,Wang J T,Chen S P,et al.Plant regeneration from callus and organ culture[J].Plant Cell Reports,2003,75:95-98.
[14]王慧梅.喜树组织培养与遗传转化的研究[D].哈尔滨:东北林业大学,2004.
[15]Liu G S,Liu J S,Qi D M,et al.Factors affecting plant regeneration from tissue cultures of Chinese Leymus (Leymus Chinensis)[J].Plant Cell Tissue Organ Culture,2004,76(2):175-178.
[16]张彦妮.复叶槭组织培养再生体系建立及其遗传转化初步研究[D].哈尔滨:东北林业大学,2005.
[17]李新江,郑永春,迟丽华.草莓组培苗继代培养基筛选试验[J].吉林农业科学,2013,38(4):63-65.
[18]安桂花.高山红景天组织培养及预算组织解剖组织观察[D].延吉:延边大学,2007.
(编辑:梁文俊)
StudyonoptimizationofXanthocerassorbifolialeafregenerationsystem
Zhang Ling1, Guo Shuai1, Zhang Yunxiang1, Guo Jinping2*
(1.CollegeofForestry,ShanxiAgriculturalUniversity,Taigu030801,China;2.CollegeofUrbanandRuralConstruction,ShanxiAgriculturalUniversity,Taigu030801,China)
S792.99
A
1671-8151(2017)10-0707-06
2017-04-15
2017-06-25
张凌(1972-),女(汉),硕士,实验师,研究方向:森林培育、森林生态
*通信作者:郭晋平,教授,博士生导师,Tel:0354-6288227;E-mail: jinpguo@126.com
山西省留学基金(2014041);山西省科技攻关项目(20120311015-3)
