EGCG-Cu络合物与牛血清蛋白相互作用研究
2017-10-10张亮亮徐曼胡新宇汪咏梅
张亮亮,徐曼,胡新宇,汪咏梅
(江苏省生物质能源与材料重点实验室,中国林业科学研究院林产化学工业研究所,南京 210042)
EGCG-Cu络合物与牛血清蛋白相互作用研究
张亮亮,徐曼,胡新宇,汪咏梅
(江苏省生物质能源与材料重点实验室,中国林业科学研究院林产化学工业研究所,南京 210042)
表没食子儿茶素没食子酸酯(EGCG)为茶叶中主要活性成分之一,具有抑制细胞增殖,诱导细胞凋亡,抑制肿瘤血管生成等多种生理活性功能。EGCG能够与蛋白质及金属离子形成络合物,从而影响其各种生理活性功能。笔者利用荧光猝灭法分别研究了EGCG及其Cu(Ⅱ)络合物(EGCG-Cu)与牛血清白蛋白(BSA)的相互作用,并分析了Cu(Ⅱ)的存在对EGCG与BSA相互作用的影响。利用Stern-Volmer曲线分析了EGCG及其Cu(Ⅱ)络合物分别与BSA络合反应中不同的荧光猝灭机理,采用Stern-Volmer方程及不同Stern-Volmer修正方程计算得到3种不同反应体系中EGCG与BSA相互作用的结合常数。结果表明:随EGCG和EGCG-Cu络合物样品浓度的增加,BSA出现典型的荧光猝灭现象,表明EGCG和EGCG-Cu络合物均与BSA发生了相互作用。反应溶液中Cu(Ⅱ)的存在会改变EGCG与BSA的相互作用形式,并降低EGCG与BSA相互作用的结合常数。此外,EGCG与Cu(Ⅱ)络合后能够提高EGCG与BSA之间的结合常数。研究结果可为深入分析EGCG在体内的各种生理活性功能提供参考。
表没食子儿茶素没食子酸酯(EGCG);牛血清白蛋白(BSA);荧光猝灭法;Stern-Volmer方程
血清白蛋白是血浆中含量最丰富的蛋白质之一,分布于全身组织和体液中,占血液蛋白总量的60%以上。此类蛋白能与许多药物和生物活性小分子进行可逆非共价结合,从而发挥其储存、转运等重要的生理功能。表没食子儿茶素没食子酸酯(Epigallocatechin-3-gallate,EGCG)是茶叶中最具生理活性的化学成分之一,在抑菌、消炎、抗突变、降压、调节内分泌、镇静、护肝、抗氧化、抗癌、抑制脂肪氧化酶等方面有显著效果[1]。血清白蛋白分子中的色氨酸(Trp)、酪氨酸(Tyr)和苯丙氨酸(Phe)残基能吸收紫外光,且能够发射荧光,所以血清白蛋白具有天然荧光[2]。由于Trp、Tyr和Phe的侧链基团不同,三者的荧光光谱也不同,Trp的荧光强度最大,Phe的荧光强度较小。血清白蛋白的内源荧光主要是Trp和Tyr残基发射的,因此,通常利用Trp的荧光研究蛋白质分子的构象及与小分子的相互作用[3-4]。
荧光猝灭法是研究生物大分子与小分子、离子相互作用的主要手段[5-6]。研究蛋白质的荧光猝灭过程能够得到小分子与蛋白质作用的结合常数、作用区域及位置信息。研究表明,激发波长为280 nm时,蛋白质的荧光来自Trp和Tyr二者的贡献,但主要是Trp的贡献[7]。荧光猝灭过程可以分为两种:一种是动态猝灭,另一种是静态猝灭。动态猝灭是猝灭剂和荧光物质的激发态分子之间所发生的相互作用过程,如能量转移或电子转移过程。静态猝灭的特征是猝灭剂和荧光物质分子在基态时发生配合反应,产生配合物。使用Stern-Volmer方程可判断药物分子对蛋白质荧光的猝灭机理。不同的猝灭机理反应需用不同的Stern-Volmer修正方程来计算药物分子对蛋白质络合反应的结合常数。血浆中的一些金属离子可影响血清白蛋白和药物小分子的相互作用[8]。极微量的金属离子通过与血清白蛋白形成复合体影响蛋白质的构象[9]。笔者所在实验室研究发现Cu(Ⅱ)能够改变EGCG对牛血清白蛋白(β-lactoglobulin)的荧光猝灭能力及其络合反应的结合常数[10]。研究金属离子对小分子药物与血清白蛋白之间相互作用的影响对深入了解药物在体内的运输及代谢过程具有重要意义。笔者采用荧光猝灭法分别研究了EGCG及其Cu(Ⅱ)络合物(EGCG-Cu)与牛血清白蛋白(BSA)的相互作用,以及Cu(Ⅱ)的存在对EGCG与BSA相互作用的影响,并分别使用不同的Stern-Volmer修正方程计算3种不同反应体系中EGCG与BSA相互作用的结合常数。
1 材料与方法
1.1 仪器和试剂
LS55型荧光/磷光/发光分光光度计(PerkinElmer公司,美国),UV-1750紫外-可见分光光度计(岛津公司,日本)。
牛血清白蛋白(BSA)(Sigma-Aldrich公司)用20 mmol/L醋酸盐缓冲液(pH 7.4)配成浓度为0.03 mmol/L储备液,于4℃保存备用;表没食子儿茶素没食子酸酯(EGCG,纯度≥95%),由立顿茶叶公司提供。将EGCG溶于50%甲醇水溶液中配成浓度约为0.2 mmol/L的反应溶液。溶液中BSA和EGCG浓度分别经紫外分光光度计在各自的摩尔消光系数下进行校正:ε280(BSA)=43 000 L/(mol·cm),ε280(EGCG)=9 700 L/(mol·cm)。分别称取一定量的CuCl2·3H2O溶于0.1 mol/L盐酸溶液配成浓度为0.2和0.5 mmol/L的Cu(Ⅱ)溶液。分别取等体积的0.2 mmol/L EGCG溶液和0.2 mmol/L Cu(Ⅱ)溶液混合后得到0.1 mmol/L的EGCG-Cu络合物溶液。本试验所用缓冲液为磷酸盐缓冲液(pH 7.4),所用试剂均为分析纯,试验用水为一级水。
1.2 荧光光谱测定
1.2.1 EGCG-BSA反应
移取2.8 mL醋酸盐缓冲溶液(pH 7.4)于1 cm石英池中,加入200 μL浓度为0.03 mmol/L的BSA溶液。充分混匀后用移液器逐次加入经50%甲醇水溶液稀释后浓度为0.07 mmol/L的EGCG溶液进行荧光滴定反应,每次加入EGCG溶液40 μL,EGCG加入总量为200 μL。反应溶液中BSA的终浓度为1.88 μmol/L。每次加入溶液后混合均匀,以280 nm为激发波长(λex),在荧光分光光度计上记录290~450 nm波长范围内的发射光谱。反应均在常温(23℃)下进行。每次滴定试验重复3次。
1.2.2 [EGCG-Cu]-BSA反应
移取2.8 mL醋酸盐缓冲溶液(pH 7.4)于1 cm石英池中,加入200 μL浓度为0.03 mmol/L的BSA溶液。充分混匀后用移液器逐次加入浓度为0.1 mmol/L的EGCG-Cu络合物溶液进行荧光滴定反应,每次加入EGCG-Cu络合物溶液40 μL,加入总量为200 μL。每次加入后,充分混合,并按照1.2.1部分所述方法记录反应溶液的发射光谱。
1.2.3 EGCG-反应
移取2.8 mL醋酸盐缓冲溶液(pH 7.4)于1 cm石英池中,加入200 μL浓度为0.03 mmol/L的BSA溶液,混匀,再加入40 μL浓度为0.5 mmol/L的CuCl2溶液。充分混匀后用移液器逐次加入经50%甲醇水溶液稀释后浓度为0.07 mmol/L的EGCG溶液进行荧光滴定络合反应,每次加入EGCG溶液40 μL,加入总量为200 μL。每次滴定反应后按照1.2.1部分所述方法记录反应溶液的发射光谱。
2 结果与分析
2.1 EGCG、EGCG-Cu络合物对BSA荧光光谱影响
BSA分子中因存在色氨酸、酪氨酸及苯丙氨酸残基使其本身具有较强的内源荧光。在280 nm波长激发下得到的为蛋白质分子色氨酸和酪氨酸的荧光发射光谱,其峰值在350 nm左右,而在同一条件下,EGCG均不产生荧光。EGCG和EGCG-Cu络合物对BSA的荧光光谱影响如图1所示。从图1A和B中可以看出,固定BSA浓度,随样品浓度增加,BSA在350 nm处的荧光发射峰强度明显减弱,出现典型的荧光猝灭现象,表明EGCG和EGCG-Cu络合物均与BSA发生了相互作用。同时,可以发现在猝灭过程中BSA荧光发射光谱最大峰值波长均产生了明显的红移。当BSA溶液中EGCG和EGCG-Cu浓度分别达到4.67和6.67 μmol/L后,BSA荧光发射光谱最大峰值波长分别红移了约15和16 nm。这表明在pH为7.4时,随EGCG浓度增加,BSA发色团的微环境发生了变化[11]。在Cu(Ⅱ)存在条件下,EGCG对BSA的荧光发射光谱的影响如图1C所示。从图1C可以看出,保持反应溶液中BSA和Cu(Ⅱ)浓度不变,逐渐增加反应溶液中EGCG浓度,BSA在350 nm处的荧光发射峰强度也出现了明显减弱,呈现典型的荧光猝灭现象,表明反应溶液中Cu(Ⅱ)存在情况下EGCG可以继续与BSA发生络合反应。但与EGCG-BSA及[EGCG-Cu]-BSA荧光猝灭过程不同,在EGCG-荧光猝灭过程中,BSA荧光发射光谱最大峰值波长未发生明显的红移。因此,结合文献[12]分析,推测Cu(Ⅱ)与BSA络合反应后蛋白质的二级结构可能发生了改变,从而改变了EGCG与BSA的相互作用关系。
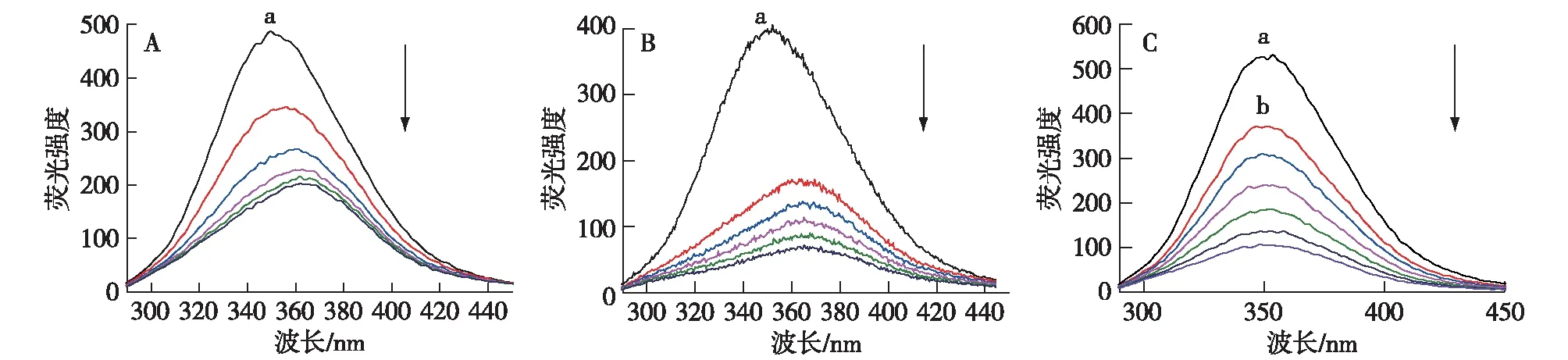
a:BSA浓度=1.88 μmol/L;b:Cu2+浓度=6.67 μmol/L图1 不同浓度下EGCG(A)和EGCG-Cu(B)络合物对BSA荧光光谱的影响以及Cu(Ⅱ)存在条件下EGCG对BSA荧光光谱的影响(C)(pH 7.4,λex=280 nm)Fig.1 Quenching effects of different concentrations of EGCG (A) and [EGCG-Cu] complex (B) on BSA fluorescence intensity as well as quenching effects of different concentrations of EGCG on BSA fluorescence intensity in the presence of Cu(Ⅱ) (C) (pH 7.4,λex=280 nm)
2.2 结合常数计算
小分子化合物对生物大分子的荧光猝灭方式分为静态猝灭和动态猝灭两种。动态猝灭其作用过程遵循Stern-Volmer方程[13]:
F0/F=1+Kqτ0[Q]=1+Ksv[Q]
(1)
式中:F和F0分别为猝灭剂存在和不存在时的荧光强度;Kq为双分子猝灭过程速率常数,L/(mol·s);Ksv为动态猝灭常数,L/mol;τ0为无猝灭剂时生物大分子的平均寿命,一般约1×10-8s[14];[Q]为猝灭剂浓度,mol/L。
pH为7.4时EGCG和EGCG-Cu络合物对BSA荧光猝灭的Stern-Volmer曲线如图2所示。从图2可以看出,在3种反应体系中Stern-Volmer曲线呈现不同变化趋势。其中,EGCG-Cu络合物浓度对BSA荧光猝灭的Stern-Volmer曲线呈较好的线性关系(图2B),其猝灭常数可由Stern-Volmer方程计算得到(图3B),结果见表1。当EGCG浓度较高时,BSA荧光猝灭的Stern-Volmer曲线会向X轴弯曲(图2A),这表明EGCG在高浓度下只能猝灭部分BSA上的发色基团[5]。在这种情况下,EGCG对BSA的猝灭常数可由修正的Stern-Volmer方程[13]计算得到。
F0/ΔF=(1/(fa×Ka)×(1/[Q])+1/fa
(2)
式中:ΔF=F0-F,F和F0分别为猝灭剂存在和不存在时的荧光强度;fa为猝灭剂可以接近的荧光基团的百分比;[Q]为猝灭剂浓度,mol/L;Ka为修正的Stern-Volmer猝灭常数,即结合常数Ksv,L/mol。以F0/ΔF为纵坐标,1/[Q]为横坐标作图(图3A)可以得到方程的截距1/fa和斜率1/(fa×Ka)。根据方程的截距和斜率值可以计算出fa和Ka。
可利用以上修正的Stern-Volmer方程(2)计算得到EGCG与BSA的结合常数Ksv(表1)。

图2 EGCG(A)和EGCG-Cu(B)络合物对BSA荧光猝灭Stern-Volmer曲线变化趋势及EGCG对BSA-Cu荧光猝灭Stern-Volmer曲线变化趋势(C)Fig.2 Stern-Volmer plots for BSA fluorescence quenching by EGCG (A) and [EGCG-Cu] complex (B) as well as Stern-Volmer plot for fluorescence quenching by EGCG (C)

图3 EGCG(A)和EGCG-Cu络合物(B)对BSA荧光猝灭Stern-Volmer修正方程曲线及EGCG对BSA-Cu荧光猝灭Stern-Volmer修正方程曲线(C)Fig.3 Modified Stern-Volmer plot for EGCG (A) and [EGCG-Cu] (B) quenching of BSA fluorescence as well as modified Stern-Volmer plot for EGCG quenching of fluorescence (C)
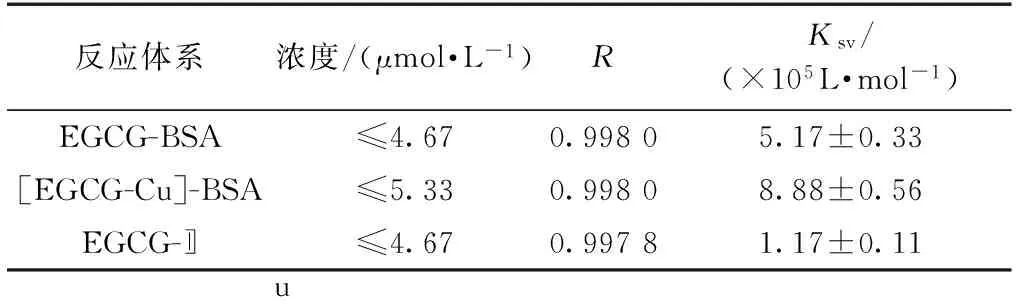
表1 不同Stern-Volmer修正方程计算得到的结合常数(Ksv)Table 1 Modified Stern-Volmer quenching constants (Ksv)
注:Cu(Ⅱ)浓度为6.67 μmol/L;试验数据表示为平均值±SD(n=3)。
有些情况下,因同时存在分子间碰撞(动态猝灭)和形成复合物(静态猝灭),血清蛋白的荧光被多酚类化合物猝灭。在BSA溶液中存在Cu(Ⅱ)条件下,当反应溶液中存在高浓度EGCG时,Stern-Volmer曲线会向Y轴弯曲(图2C),Stern-Volmer方程(1)可修正为F0/F=(1+KD[Q])(1+KS[Q]),并进一步改写为Stern-Volmer修正方程(3)[13]:
[(F0/F)-1](1/[Q])=(KD+KS)+KDKS[Q]
(3)
式中:KS和KD分别为静态和动态猝灭常数,L/mol;[Q]为猝灭剂的浓度,mol/L;以[(F0/F)-1](1/[Q])为纵坐标,[Q]为横坐标作图(图3C),可计算得到KS和KD值。KS和KD相加即得结合常数Ksv。
可通过以上Stern-Volmer修正方程(3)计算得到EGCG与的结合常数Ksv(表1)。由表1可见,EGCG与的结合常数(1.17×105L/mol)小于EGCG与BSA的结合常数(5.17×105L/mol),而[EGCG-Cu]与BSA的结合常数(8.88×105L/mol)则大于EGCG与BSA的结合常数。由此说明,反应溶液中Cu(Ⅱ)的存在会降低EGCG与BSA相互反应的结合常数,相反,EGCG络合Cu(Ⅱ)后能够提高EGCG与BSA相互作用的结合常数。
3 结 论
利用荧光猝灭法分别研究了EGCG及其Cu(Ⅱ)络合物与BSA的相互作用,以及Cu(Ⅱ)存在条件下对EGCG与BSA相互作用的影响,分析了不同络合反应的荧光猝灭机理。利用不同的Stern-Volmer方程的修正方程分别计算得到EGCG-BSA、[EGCG-Cu]-BSA、EGCG-络合反应体系的结合常数。研究发现反应溶液中Cu(Ⅱ)的存在会改变EGCG与BSA的相互作用形式,并降低EGCG与BSA相互反应的结合常数,相反,EGCG络合Cu(Ⅱ)后能够提高EGCG与BSA相互作用的结合常数。本研究结果对了解茶多酚在体内的状态和药理作用具有重要意义。此外,对利用荧光猝灭法研究小分子化合物与蛋白质相互作用过程中不同Stern-Volmer修正方程的选择具有指导意义。
[1]SINGH B N,SHANKAR S,SRIVASTAVA R K.Green tea catechin,epigallocatechin-3-gallate (EGCG):mechanisms,perspectives and clinical applications[J].Biochemical Pharmacology,2011,82(12):1807-1821.
[2]JALDAPPAGARI S,BALAKRISHNAN S,HEGDE A H,et al.Interactions of polyphenols with plasma proteins:insights from analytical techniques[J].Current Drug Metabolism,2013,14(4):456-473.
[3]HU Y J,LIU Y,SHEN X S,et al.Studies on the interaction between 1-hexylcarbamoyl-5-fluorouracil and bovine serum albumin[J].Journal of Molecular Structure,2005,738(1):143-147.
[4]SKRT M,BENEDIK E,PODLIPNIK C,et al.Interactions of different polyphenols with bovine serum albumin using fluorescence quenching and molecular docking[J].Food Chemistry,2012,135(4):2418-2424.
[5]BOSE A.Interaction of tea polyphenols with serum albumins:a fluorescence spectroscopic analysis[J].Journal of Luminescence,2016,169:220-226.
[6]DUFOUR C,DANGLES O.Flavonoid-serum albumin complexation:determination of binding constants and binding sites by fluorescence spectroscopy[J].Biochimica et Biophysica Acta (BBA)-General Subjects,2005,1721(1/2/3):164-173.
[7]CARTER D C,HO J X.Structure of serum albumin[J].Advances in Protein Chemistry,1994,45(6):153-176.
[8]YANG F,WANG J,LIU C,et al.Metal ions enhance the affinities of flavonoids for human serum albumininvitro[J].Journal of Solution Chemistry,2012,41(6):976-993.
[9]BAL W,SOKOOWSKA M,KUROWSKA E,et al.Binding of transition metal ions to albumin:sites,affinities and rates[J].Biochimica et Biophysica Acta (BBA)-General Subjects,2013,1830(12):5444-5455.
[10]ZHANG L L,SAHU I D,XU M,et al.Effect of metal ions on the binding reaction of (-)-epigallocatechin gallate toβ-lactoglobulin[J].Food Chemistry,2017,221:1923-1929.
[11]LI M,HAGERMAN A E.Role of the flavan-3-ol and galloyl moieties in the interaction of (-)-epigallocatechin gallate with serum albumin[J].Journal of Agricultural and Food Chemistry,2014,62(17):3768-3775.
[12]ROY A S,TRIPATHY D R,GHOSH A K,et al.An alternate mode of binding of the polyphenol quercetin with serum albumins when complexed with Cu(Ⅱ)[J].Journal of Luminescence,2012,132(11):2943-2951.
[13]LAKOWICZ J R.Principles of fluorescence spectroscopy[M].3rd ed.New York:Kluwer,2006.
[14]NI Y,LIU G,KOKOT S.Fluorescence spectrometric study on the interactions of isoprocarb and sodium 2-isopropylphenate with bovine serum albumin[J].Talanta,2008,76(3):513-521.
Study on binding of EGCG-Cu complex to bovine serum albumin
ZHANG Liangliang,XU Man,HU Xinyu,WANG Yongmei
(Key Lab.of Biomass Energy and Material,Jiangsu Province, Institute of Chemical Industry of Forest Products, CAF,Nanjing 210042,China)
Epigallocatechin-3-gallate (EGCG),the major polyphenolic constituent of green tea,has a variety of biological functionsinvitro,including the inhibition of cell proliferation,induction of cell cycle arrest or apoptosis,and inhibition of tumor angiogenesis and vascular tumor growth.The potential chelating activity of EGCG for metal ions,especially transitional metal ions,has significant effects on the bioactivity of EGCG.Binding interactions between EGCG and its copper complex and bovine serum albumin (BSA) were investigated through fluorescence spectroscopy in this study.The effect of copper on the interaction between EGCG and BSA was also analyzed.The different quenching mechanisms in the binding interaction were studied and the binding constants of EGCG,EGCG-Cu(Ⅱ) to BSA were obtained by using different modified Stern-Volmer equations.The results showed that,when EGCG and EGCG-Cu(Ⅱ) were added to the BSA solution,the fluorescence was quenched,indicating that interactions happened between EGCG,EGCG-Cu(Ⅱ) and BSA.The fluorescence intensity gradually decreased with the increasing concentration of EGCG with an obvious red-shift of the maximum of BSA.When EGCG was continuously added to BSA solution containing Cu(Ⅱ) at pH 7.4,the fluorescence of BSA decreased.There was no spectral shift when the EGCG was added to BSA containing Cu(Ⅱ),indicating that the mode of EGCG-BSA interaction is expected to be altered by Cu(Ⅱ).Additionally,the binding constant between EGCG and BSA increased significantly after EGCG was modified by Cu(Ⅱ) to form EGCG-Cu(Ⅱ) complex.Our results suggest that after chelating with copper,the interaction mode of EGCG with BSA is altered and this could have various implications on its other physicochemical activities.
EGCG;BSA;fluorescence spectroscopy;Stern-Volmer equation
Q614.33
A
2096-1359(2017)05-0046-05
2016-12-03
2017-01-25
国家重点研发计划(2017YFD0601000);江苏省生物质能源与材料重点实验室基本科研业务费项目(JSBEM-S-201707)。
张亮亮,男,博士,副研究员,研究方向为植物单宁(多酚)化学。E-mail:zhll20086@163.com
