蚜科专化菌暗孢耳霉对竹蚜种群动态的影响及控蚜作用
2017-10-10刘奕来王江宏朱丹妮毛嘉俊
刘奕来,王江宏,张 静,朱丹妮,毛嘉俊,周 湘
(1.浙江农林大学 农业与食品科学学院,浙江 临安 311300;2.浙江农林大学 林业与生物技术学院 生物农药高效制备技术国家地方联合工程实验室,浙江 临安311300)
蚜科专化菌暗孢耳霉对竹蚜种群动态的影响及控蚜作用
刘奕来1,王江宏2,张 静1,朱丹妮1,毛嘉俊1,周 湘2
(1.浙江农林大学 农业与食品科学学院,浙江 临安 311300;2.浙江农林大学 林业与生物技术学院 生物农药高效制备技术国家地方联合工程实验室,浙江 临安311300)
通过观察蚜科Aphididae专化菌暗孢耳霉Conidiobolus obscurus在3个温度和光周期处理(20~28℃,光照12~15 h)下对竹纵斑蚜Takecallis arundinariae,竹梢凸唇斑蚜Takecallis taiwanus,竹后粗腿蚜Metamacropodaphis bambusisucta和竹色蚜Melanaphis bambusae等4种竹蚜的种群动态的影响,来探究控蚜作用。暗孢耳霉对竹蚜种群在不同温光处理和竹蚜种类间都表现出抑制作用。模型分析结果显示:接菌组竹蚜种群动态趋势拟合Log-logistic模型,对照组拟合Logistic方程。健康组竹蚜种群动态呈现爆发特性,模型参数计算显示竹蚜种群密度最高值是起始虫口密度的18.4~139.2倍,显示其对竹林的潜在危害性。暗孢耳霉对竹蚜种群发育初期具有明显的抑制效应,寄主种群密度倍增天数比对照组多延长10.0倍以上,显示该生防菌对竹蚜种群发生具有调控作用,抑制竹蚜种群高峰的出现,达到控制竹林蚜害的效果。图3表2参23
森林保护学;竹蚜;暗孢耳霉;种群动态;控蚜;昆虫病原真菌
Abstract:To determine the regulation of Conidiobolus obscurus on population dynamics of four species of bamboo aphids,specifically,Metamacropodaphis bambusisucta,Takecallis taiwanus,Melanaphis bambusae,and Takecallis arundinariae,three temperature-photoperiod regimes of 20-28 ℃ were used along with 12-15 h of light.Results showed that C.obscurus inhibited bamboo aphid populations with the temperature-photoperiod regimes.Data fit models well with C.obscurus-inoculated groups fitting to log-logistic models and the control groups fitting to logistic models.Results also showed outbreak characteristics of population dynamics for healthy aphids with peak aphid densities 18.4-139.2 times larger than initial densities.Especially in the first observation week,bamboo aphids infected with C.obscurus inhibited population development with the number of days needed to double population densities being ten times more than healthy aphid populations.Thus,C.obscurus could help regulate host populations,delay the occurrence of the bamboo aphid population peaks,and provide potential aphid control in bamboo forests. [Ch,3 fig.2 tab.23 ref.]
Key words:forest protection;bamboo aphids;Conidiobolus obscurus;population dynamics;aphid control;entomopathogenic fungi
竹林占中国森林面积的6%,多分布于南方,有北松南竹之说,在地区经济和生态效益上发挥着不可替代的作用。竹林不但提供各种原材料用于饮食、建材、纺织和生物能等,也广泛应用于城市绿化、水土保持、森林固碳等[1-4],竹炭加工副产物还可制成杀虫剂和杀螨剂等[5]。不过,竹林生态系统往往由于植被成分简单,导致系统内生物多样性偏低[6]。尤其是,南方多采用林下覆盖秸秆粉末等措施来提高冬日竹林土壤温度,以便提早出笋,利于春节前销售。而覆盖物往往残留林间,危及林下植被生长,加剧林间生物多样性破坏。同时,大量高纤维的覆盖物又引发竹林土壤退化,从而进一步影响竹林的生态健康[7-8]。竹林的生态现状导致其易受到各种病虫害侵袭,其中就包括多种竹蚜。已知的竹蚜种类就有40余种,多危害竹子茎叶[9]。竹蚜的危害多体现在其种群的快速增长,大量消耗竹子营养,以及其取食过程伴生引发的植物病原传播和霉污病,导致竹林产值下降。竹蚜种群的增长跟竹蚜生殖力和环境温度等内外因具有密切的联系[10-11]。过冬复苏或迁移定殖的蚜虫凭借其发育快,行孤雌生殖,可在春季数周内形成庞大种群。竹蚜的群居特性往往有利于寄生菌在其种群内的流行,尤其是虫霉门下的30余种蚜虫专化病原真菌[12-14]。广泛分布的蚜科Aphididae专化病原菌暗孢耳霉Conidiobolus obscurus对竹蚜具有致死快、死亡率高等优势[11]。不过,以往的研究大多通过生物测定菌株毒力的实验来反映生防菌的应用潜能,很少从种群动态水平上分析生防菌对寄主种群的调控作用。本研究将针对4种危害竹叶的常见蚜虫,包括竹纵斑蚜Takecallis arundinariae,竹梢凸唇斑蚜Takecallis taiwanus,竹后粗腿蚜Metamacropodaphis bambusisucta和竹色蚜Melanaphis bambusae,利用暗孢耳霉在不同温度和光周期处理下对该4种竹蚜种群动态发生的影响,通过筛选拟合度高的生物模型评估其控蚜作用和生防潜能。
1 材料与方法
1.1 供试菌株和竹蚜饲养
暗孢耳霉菌株取自美国昆虫病原真菌库(RW Holley Center for Agriculture and Health,Tower Road,Ithaca,NY,USA;编号7217)。该菌分生孢子悬液长期保存于实验室内-80℃超低温冰箱[15]。
供试4种常见竹蚜(包括竹纵斑蚜、竹梢凸唇斑蚜、竹后粗腿蚜和竹色蚜)采自当年野外竹林。取健壮有翅蚜数头于室内盆栽桂竹Phyllostachys bambusoides植株新叶上。在24℃光14 h∶暗10 h下饲养备用。
1.2 菌种培养和接种竹蚜
将暗孢耳霉的菌株冻存管直接浸没于37℃水浴至解冻,孢子悬液转接至加富营养的萨氏培养基平板(体积分数为80.0%萨氏培养基,11.5%蛋黄,8.5%牛奶)上,24℃和光12 h∶暗12 h下活化培养7 d[15]。将平板上的菌块接入装有50 mL的萨氏培养液的锥形瓶中,在24℃下150 r·min-1摇荡培养3 d。所获菌丝液用漏斗和无菌滤纸过滤菌丝,随后将滤干菌丝铺满直径90 mm的平板[11]。24℃下放置过夜,平板上的菌丝进入弹孢高峰,计算弹孢速度即1 min在1 mm2面积内落下来的孢子数,用于定量接种竹蚜。弹孢速率(孢子数·mm-2·min-1)通过将一盖玻片置于弹孢平板下方收集沉降的孢子10 min,在400倍下5点取样镜检(视野面积为0.159 mm2)并计数孢子来计算。
用蘸水的柔软毛笔头轻轻挑取30头大小一致的健康新生母蚜置于竹叶平板上使其自然取食,4种竹蚜分别置于不同平板。竹叶平板的制作[11],即剪取新鲜的桂竹叶片背面朝上将边缘包埋入直径90 mm或150 mm的水琼脂平板,叶面面积占平板面积约80%。将产孢平板倒扣在载有母蚜的平板上,使它们暴露于分生孢子 “淋浴”之中,其中竹梢凸唇斑蚜、竹纵斑蚜和竹后粗腿蚜所接孢子浓度为100个·mm-2,竹色蚜由于体表有蜡质覆盖不易感染,采用300个·mm-2。通过弹孢速率来计算所需的接种时间,为使孢子尽可能均匀地落到蚜虫体表,产孢平板每1/4接种时间顺时针旋转90°。将接种后的母蚜,10头·组-1转移到含新鲜竹叶的直径150 mm的水琼脂平板上饲养观察,3个重复。对照组取健康母蚜,10头·组-1饲养于150 mm竹叶平板上,每竹蚜设3个平板重复。
1.3 竹蚜种群动态观察
为探知不同温度和光周期组合条件下暗孢耳霉对4种竹蚜种群发育的影响,设置3个温光处理:20℃(光 12 h∶暗 12 h), 24℃(光 14 h∶暗 10 h), 和 28℃(光 15 h∶暗 9 h)。 各个温光处理下包含接种组和对照组,重复3个·组-1。逐日观察记录每个平板上的成蚜数和若虫数,以及起始母蚜的存活天数。根据蚜群发育和竹叶状况,观察天数为16~18 d。同时记录每个竹叶平板的叶面积,用于计算100 cm2竹叶面积上的蚜虫数, 即种群密度(头·100 cm-2)。
1.4 数据分析
3个温光处理下每种竹蚜种群密度(y经对数转换)随观察天数(t)的变化数据,对照组用Logistic方程 y=c1/[1+exp(c2+c3t)]进行拟合, 其中 c3值来反映种群发育速率, c1值为理论上最大的蚜群密度; 接种组用 Log-logistic 方程拟合 y=c1-ln[1+c2exp(-c3t)]。 拟合曲线分别用 F-test和 Student’s t test进行拟合度和参数检验。蚜群倍增天数通过各方程拟合参数进行计算,来反映各竹蚜种群自然增长的速率及暗孢耳霉的抑制影响。所有模型模拟和数据分析均采用DPS软件处理[16]。
2 结果与分析
2.1 模型分析各温光处理下竹蚜种群动态
20~28℃(12~15 h光照)温光处理下,观察期内4种竹蚜种群均呈现显著增长。接种暗孢耳霉的竹蚜和对照组(未接菌)的种群增长趋势存在明显差异。通过模型分析,健康组(表1)拟合Logistic方程(0.861≤R2≤0.992),显示4种竹蚜种群呈爆发式增长,种群密度最高值是起始虫口密度的18.4~139.2倍。24~28℃下,除竹后粗腿蚜外,其余3种竹蚜种群密度增长1.0倍所需天数均小于1.0 d,增长10.0倍仅需3.1~5.4 d。20℃下增长速率有所下降,除竹梢凸唇斑蚜外,其余3种种群增长10.0倍所需天数都超过了10.0 d。
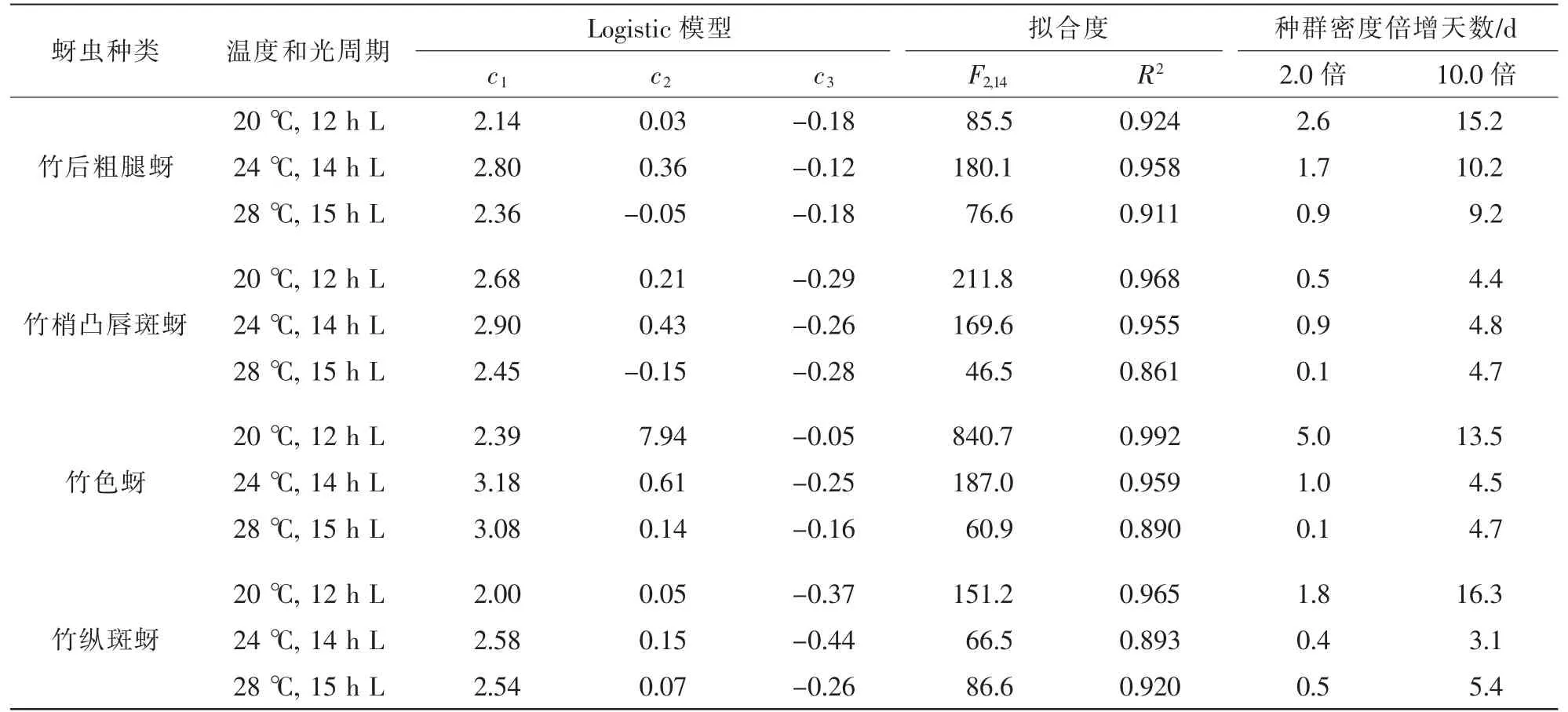
表1 模型分析4种健康竹蚜的种群动态规律Table 1 Modeling analysis of population dynamics of the four species of healthy bamboo foliar aphids
从各温光组合下的种群增长速率来看,竹梢凸唇斑蚜种群爆发的潜能最大。从模型参数c1中计算理论种群密度上限,不同温光处理下4种竹蚜的种群密度上限值各有不同,最低的为竹纵斑蚜在20℃下为100.0头·dm-2, 最高的为竹色蚜, 在24℃下为1 513.0头·dm-2。
接菌组竹蚜种群增长受暗孢耳霉抑制影响明显,增长趋势呈现先抑后扬。数据拟合Log-logistic方程(0.835≤R2≤0.991),经参数(表2)计算种群密度增长1.0倍所需天数在1.4~14.3 d,比对照组所需天数大多延长10.0倍以上,其中竹梢凸唇斑蚜在28℃下比对照组延长了58.0倍,从0.1 d到5.9 d。种群增长10.0倍所需天数与对照组差异缩小,延长1.0~4.1倍不等。结果表明:暗孢耳霉在种群发育初期作用明显,可显著抑制种群的增长,但后期影响减退。
2.2 不同温光处理下4种竹蚜种群的变化趋势
2.2.1 20℃下的种群增长趋势 图1所示:20℃(光照12 h)条件下,4种竹蚜在观察后期均可达到各自理论上最高的种群密度。除竹色蚜外,其余3种竹蚜种群变化趋势上,接菌组和对照组拟合曲线都有明显差异,对照组先扬后平,接菌组则先平后扬,显示出病原菌对寄主种群增长的调控作用。暗孢耳霉的控蚜作用还体现在发育历期上,接菌组均出现延迟。如竹梢凸唇斑蚜对照组只需8.0 d发育至成虫,而接菌组新生成虫出现时间要晚2.0 d。种群内若虫与成虫比例也反映出种群增长趋势,如竹梢凸唇斑蚜对照组中若成虫比在第3~8天维持在12.2~43.1的高位,伴随种群迅速扩张,而接菌组在第6~9天出现一个小高峰(11.6~27.8)。接菌组后期种群大幅攀升,除了病原菌影响消退外,新增成虫大量孤雌生殖使若成虫比在第14~16天再次出现小高峰(11.0~20.7),同时接菌组早期占用竹叶少,给后期种群爆发提供了空间,而对照组因生长空间受限进入到平稳期,有些甚至开始进入种群消亡,如竹纵斑蚜。从图1中可以看出:竹色蚜在此温光条件下与对照组的模拟曲线高度重合,无明显差异。
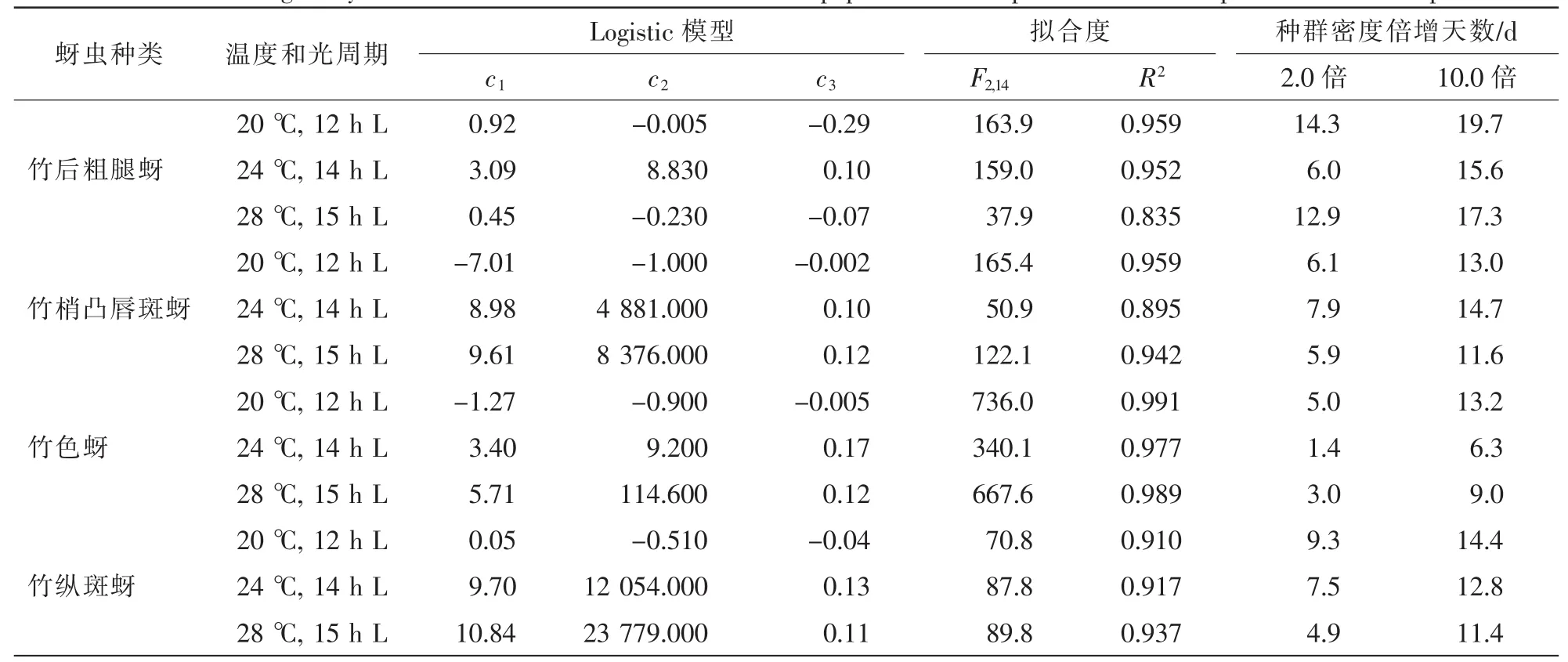
表2 模型分析暗孢耳霉对4种竹蚜种群增长的影响Table 2 Modeling analysis of the influence of C.obscurus on the population development of the four species of bamboo aphids
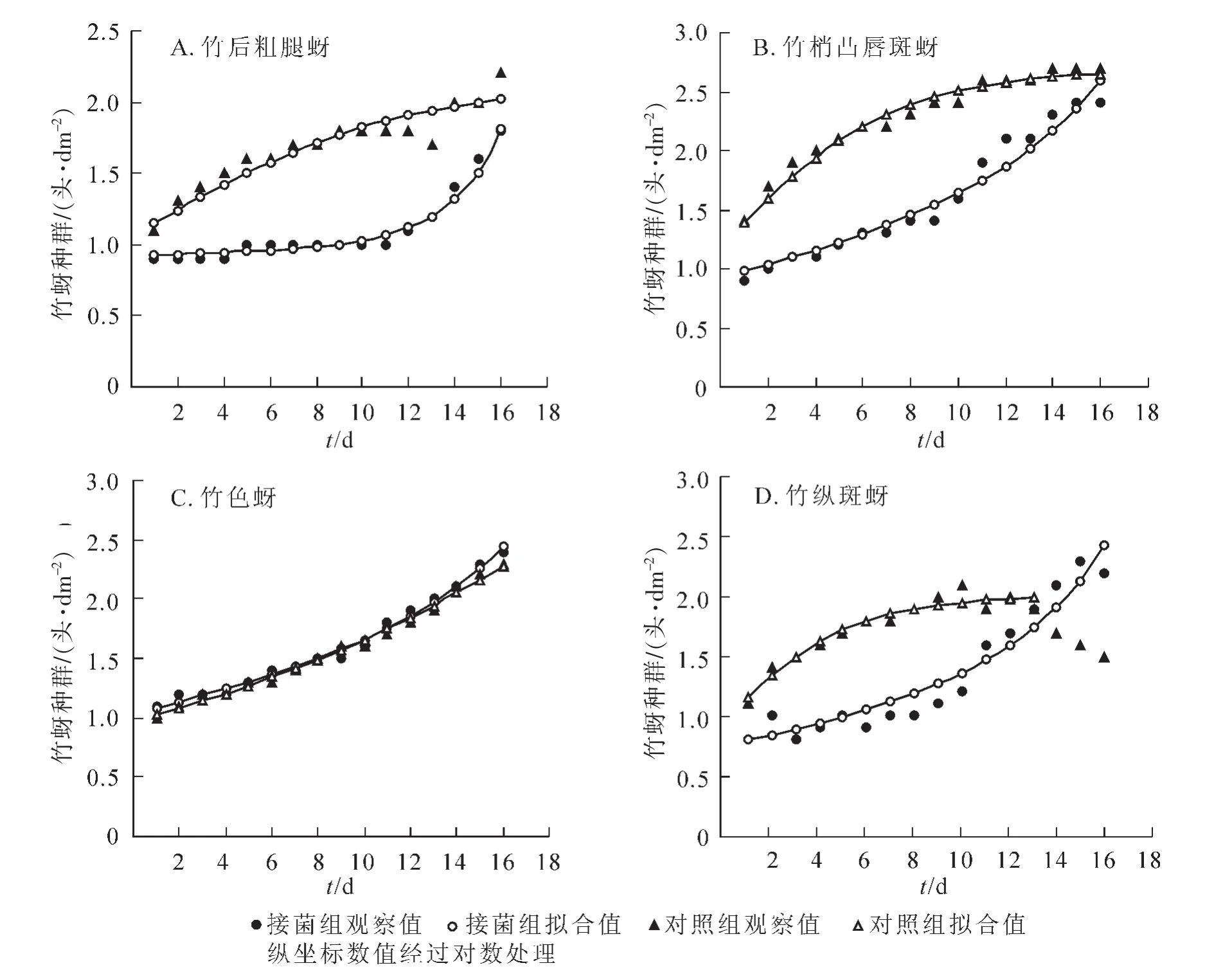
图1 20℃(光照12 h)下4种竹蚜的种群增长趋势Figure 1 Trends of population densities of the four species of bamboo aphids under 20 ℃ (photoperiod:light 12 h)
2.2.2 24℃下的种群增长趋势 图2所示:24℃(光照14 h)条件下,4种竹蚜的增长曲线与20℃条件下的相比有所不同,对照组仍呈先扬后平的趋势,而接菌组近似线型。从种群动态上看,对照组始终高于接菌组,说明暗孢耳霉仍发挥调控竹蚜种群增长的作用。温度的提升缩短了竹蚜的发育历期,使得种群增长速率有所加快,最高的种群密度也有所抬升。如竹纵斑蚜只需7.0 d发育至成虫,比20℃条件下减少了2.0 d,第10天就达到了理论最高种群密度(380.0头·dm-2)。接菌组线型增长表明该温光条件下,暗孢耳霉对竹蚜种群的抑制影响不如20℃条件下明显,主要可能是该温度利于竹蚜生长发育和繁殖,抵消了部分病原菌的控制作用。从控蚜效果来看,暗孢耳霉对竹梢凸唇斑蚜和竹纵斑蚜的控制比其他2种竹蚜显著,得利于暗孢耳霉对该2种竹蚜的致死快,在观察期3.0 d内初始10头母蚜均死亡。
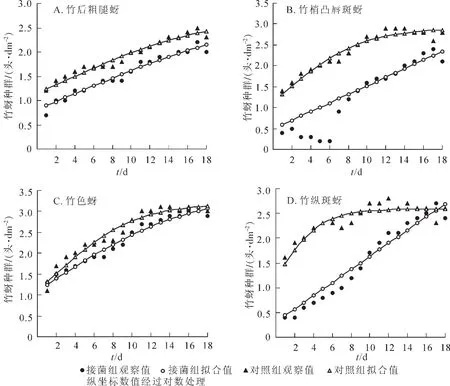
图2 24℃(光照14 h)下4种竹蚜的种群增长趋势Figure 2 Trends of population densities of the four species of bamboo aphids under 24 ℃ (photoperiod:light 14 h)
2.2.3 28℃下的种群增长趋势 图3所示:28℃(光照15 h)条件下,除竹后粗腿蚜外,其他3种竹蚜种群动态类似于24℃条件,暗孢耳霉对4种竹蚜种群增长都起到了抑制作用。该温光条件下4种竹蚜的种群增长速率和最高种群密度都较24℃条件下有所下降,如竹梢凸唇斑蚜理论上最高种群密度仅281.8头·dm-2,明显低于24℃条件下的794.0头·dm-2,与实际观察虫数一致。暗孢耳霉对于竹色蚜的控制作用有所提升,比20℃和24℃条件下与对照组差异有所扩大,可能较高温对竹蚜的负面影响大于对暗孢耳霉的影响。
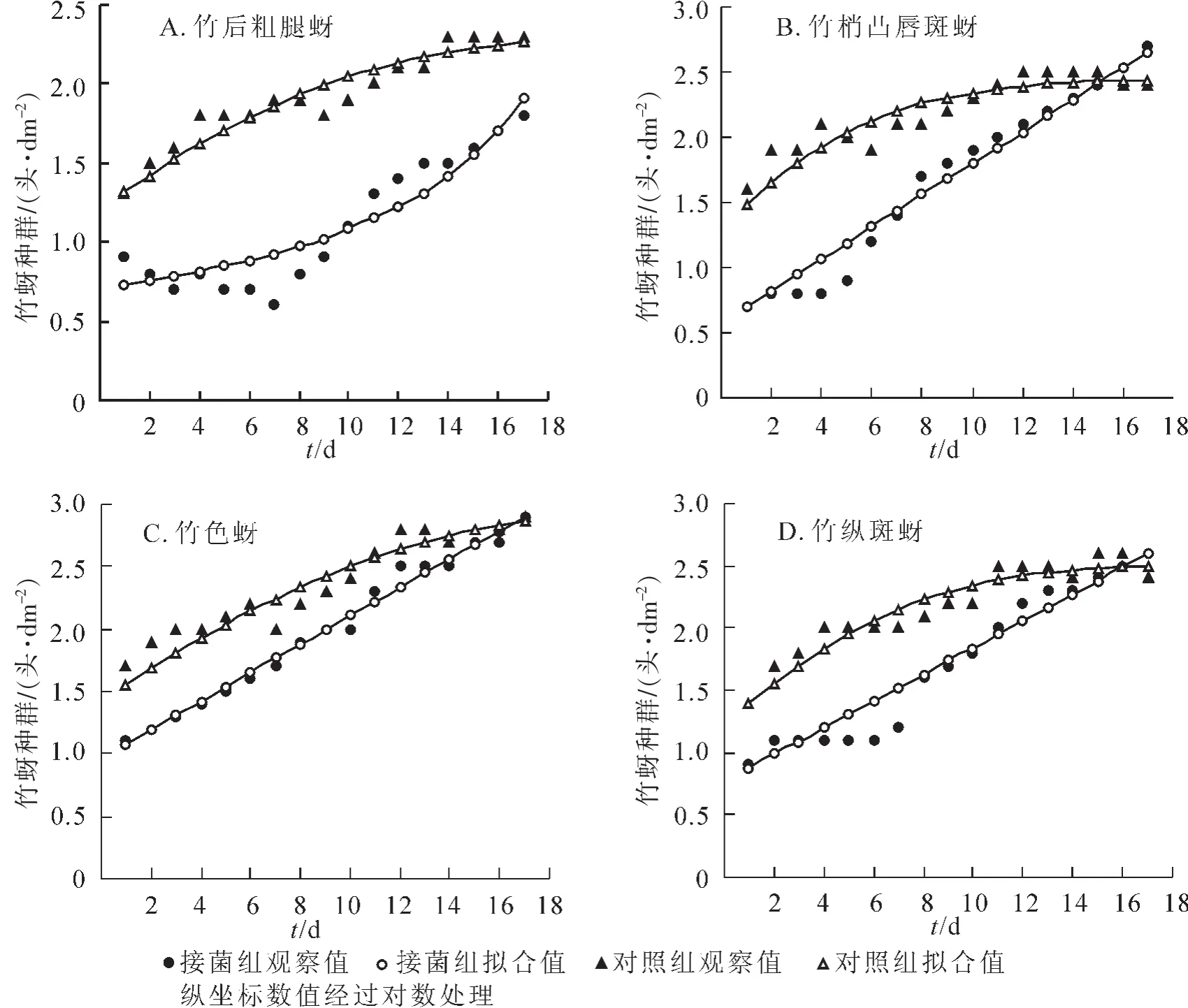
图3 28℃(光照15 h)下4种竹蚜的种群增长趋势Figure 3 Trends of population densities of the four species of bamboo aphids under 28 ℃ (photoperiod:light 15 h)
3 讨论
本研究结果显示:常见的4种危害竹叶的蚜虫均可在短期内将种群密度扩大十几到上百倍,具有暴发性的种群增长能力。温度对竹蚜种群的影响明显。本研究结果显示:24℃最为适宜竹蚜种群的增长,过高或过低都会影响增长速率。预实验中显示竹蚜在32℃下出现滞育,种群增长停滞并自然消亡。种群密度的增长除了受外因如温度和生长空间的影响外,蚜虫不同种类之间在个体大小、发育历期、生殖力、迁移倾向和对种群空间拥挤的耐受力等多方面都有差异,影响着最终可达到的种群密度上限[17-18]。本研究中,竹纵斑蚜较低的种群密度(100.0~380.0头·dm-2)跟其生殖力关联不大,先前报道指出它与竹梢凸唇斑蚜在生殖力上并无差异[11]。竹纵斑蚜个体较大,对种群拥挤的耐受性差和易迁移等特性导致其种群密度偏低,因此,它在野外竹林中分布广,但危害相对有限。有别于其他3种竹蚜成虫,竹色蚜具有两型性,即有翅和无翅型兼有发生[9],但以无翅型为主,少迁移且适应种群的高密度,在本研究中达到最高种群密度。由于竹色蚜体表生成蜡质覆盖,抑制病原菌孢子萌发侵入,感病率低[11]。本研究中暗孢耳霉对其抑制作用相对有限。不过,竹色蚜种群的高度集中特性,使得其危险范围较小,程度较低。竹梢凸唇斑蚜和竹后粗腿蚜兼有迁飞扩散能力,又能耐受高密度种群,对竹子植株危害暗孢耳霉较大。
天敌(包括病原菌)对蚜群的种群增长具有天然的调控作用,天敌数量与蚜群动态呈现高度相关性[18-19]。本研究显示出暗孢耳霉在种群发育的初期(即母蚜定殖的第1周)可有效控制种群的过快增长,但随后影响消退。这很可能与暗孢耳霉在寄主体内易形成休眠孢子有关。休眠孢子在寄主体内的形成往往导致真菌病在寄主种群内传播的中断[20-21]。即便如此,暗孢耳霉仍可有效延缓寄主竹蚜种群的增长,在控制蚜害上具有积极意义。尤其在20℃下,温度和病原菌协同作用达到了比其他2组温度处理更好的控蚜效果。从物候学的角度看,虫害发生与植物生长都受到环境气候因子的影响,多数虫害的发生往往需要昆虫的发生期与寄主植物生长周期相契合,在林业生态系统中表现尤为突出[22]。2015-2016年受厄尔尼诺现象影响,浙江省竹林蚜虫种群发生与竹林营养生长出现不同步现象,总体发生水平比往年大幅下降。因此,竹叶蚜害发生需与其取食部位竹叶的生长期相同步。病原菌对寄主的侵染及对种群的抑制作用导致竹蚜种群增长趋势的后滞,有利于干扰竹蚜在林间发生。从本研究结果看,可在春季竹林新抽竹叶及蚜群发生时,或根据需要隔周多次释放生防菌起到控蚜作用。
由于天敌的自然发生往往迟于害虫爆发,农作物耕作周期较短,单纯依赖生物防治难以确保产出,导致虫害防治高度依赖化学防治措施。森林系统得益于其长期维持,人为干扰少,可大范围的采用生物防治手段来调控林间有害生物的发生,减少化学药剂的使用,利于环境生态安全[23]。研究天敌包括各种病原菌与寄主种群动态的互作关系则是实现植被虫害生态治理的必要前提,对进一步林间实际应用具有指导意义。
[1] SCURLOCK J M O,DAYTON D C,HAMES B.Bamboo:an overlooked biomass resource? [J].Biomass Bioenergy,2000,19(4):229-244.
[2] FU S G,YOON Y,BAZEMORE R.Aroma-active components in fermented bamboo shoots [J].J Agric Food Chem,2002,50(3):549-554.
[3] LI Yongfu,ZHANG Jiaojiao,CHANG S X,et al.Long-term intensive management effects on soil organic carbon pools and chemical composition in Moso bamboo (Phyllostachys pubescens) forests in subtropical China [J].For Ecol Manage,2013,303:121-130.
[4] ZHOU Benzhi,FU Maoyi,XIE Jinzhong,et al.Ecological functions of bamboo forest:research and application [J].J For Res,2005,16(2):143-147.
[5] WANG Pinwei,MALIANG Huidong,WANG Caihong,et al.Bamboo charcoal by-products as sources of new insecticide and acaricide [J].Industr Crops Prod,2015,77:575-581.
[6] 余树全,姜春前,周国模,等.雷竹林生态系统健康的研究[J].北京林业大学学报,2003,25(5):15-19.YU Shuquan,JIANG Chunqian,ZHOU Guomo,et al.Study on Phyllostachys praecox forest ecosystem health [J].J Beijing For Univ,2003,25(5):15-19.
[7] 陈珊,陈双林,郭志武.林地覆盖经营对雷竹鞭根主要养分内循环的影响[J].生态学报,2015,35(17):5788-5796.CHEN Shan,CHEN Shuanglin,GUO Ziwu.Effects of mulching management on the internal cycling of nutrients in the rhizomatous roots of Phyllostachys violascens [J].Acta Ecol Sin,2015,35(17):5788-5796.
[8] 陈双林.毛竹林地覆盖竹笋早出技术应用的问题思考[J].浙江农林大学学报,2011,28(5):799-804.CHEN Shuanglin.Thoughts on related problems of mulched technique with organic materials in Moso bamboo forest for early shooting [J].J Zhejiang A&F Univ,2011,28(5):799-804.
[9] 方燕,乔格侠,张广学.竹类植物叶片上八种蚜虫的形态变异分析[J].昆虫学报,2006,49(6):991-1001.FANG Yan,QIAO Gexia,ZHANG Guangxue.Morphometric variation of eight aphid species feeding on the leaves of bamboos [J].Acta Entomol Sin,2006,49(6):991-1001.
[10] 徐华潮,施祖华.温度对竹梢凸唇斑蚜种群增长的影响[J].浙江大学学报(农业与生命科学版),2003,29(4): 439-443.XU Huachao,SHI Zuhua.The influence of temperature on the population increase of Takecallis taiwanus(Takahashi) [J].J Zhejiang Univ Agric Life Sci,2003,29(4):439-443.
[11] ZHOU Xiang,WANG Dawei,ZHANG Xin,et al.The influence of aphid-specific pathogen Conidiobolus obscurus(Entomophthoromycota:Entomophthorales) on the mortality and fecundity of bamboo aphids [J].J For Res,2014,19(4):388-394.
[12] PELL J K,EILENBERG J,HAJEK A E,et al.Biology,ecology and pest management potential of Entomophthorales[G] //BUTT T M,JACKSON C,MAGAN N.Fungi as Biocontrol Agents Progress Problems&Potential.Wallingford:CABI Publishing,2001:71-153.
[13]BARTA M,CAGÁˇN L.Aphid-pathogenic entomophthorales(their taxonomy,biology and ecology)[J].Biologia,2006,61(supp 21):S543-S616.
[14] HAJEK A E,DELALIBERA I Jr.Fungal pathogens as classical biological control agents against arthropods [J].Bio-Control,2010,55(1):147-158.
[15] ZHOU Xiang,FENG Mingguang,HUANG Zhihong.Effects of cryopreservation at-80 ℃ on the formulation and pathogenicity of the obligate aphid pathogen Pandora nouryi[J].Pol J Microbiol,2014,63(2):211-215.
[16] 唐启义.DPS数据处理系统:实验设计、统计分析及数据挖掘[M].2版.北京:科学出版社,2010:124-156.
[17] 李学军,郑国,王淑贤,等.大豆蚜自然天敌种群动态及其控蚜作用研究[J].应用昆虫学报,2011,48(6):1613-1624.LI Xuejun,ZHENG Guo,WANG Suxian,et al.The population dynamics and control effect of important natural enemies of the soybean aphid,Aphis glycines [J].Chin J Appl Entomol,2011,48(6):1613-1624.
[18] HOPKINS G W,THACKER J I,DIXON A F G.Limits to the abundance of rare species:an experimental test with a tree aphid [J].Ecol Entomol,1998,23(4):386-390.
[19] STRAW N A,TIMMS J E L,LEATHER S R.Variation in the abundance of invertebrate predators of the green spruce aphid Elatobium abietinum (Walker) (Homoptera:Aphididae) along an altitudinal transect [J].For Ecol Manage,2009,258(1):1-10.
[20] ZHANG Guozhong,FENG Mingguang,CHEN Chun,et al.Opportunism of Conidiobolus obscurus stems from depression of infection in situ to progeny colonies of host alatae as disseminators of the aphid-pathogenic fungus [J].Environ Microbiol,2007,9(6):1612-1621.
[21] 徐梦晨,朱诚棋,徐桑尔,等.温度对蚜科专化菌暗孢耳霉休眠孢子形成的影响[J].生态学报,2015,35(15): 5248-5253.XU Mengchen,ZHU Chengqi,XU Sanger,et al.The effect of temperature on in vivo resting spore formation of the aphid-specific pathogen Conidiobolus obscurus [J].Acta Ecol Sin,2015,35(15):5248-5253.
[22] SAMPAIO T,BRANCO M R,GUICHOUX E,et al.Does the geography of cork oak origin influence budburst and leaf pest damage? [J].For Ecol Manage,2016,373:33-43.
[23] JI Lanzhu,WANG Zhen,WANG Xiaowei,et al.Forest insect pest management and forest management in China:an overview [J].Environ Manage,2011,48(6):1107-1121.
Influence of aphid-specific pathogen Conidiobolus obscurus on population dynamics of bamboo aphids and the aphid-control effect
LIU Yilai1,WANG Jianghong2,ZHANG Jing1,ZHU Danni1,MAO Jiajun1,ZHOU Xiang2
(1.School of Agricultural and Food Science,Zhejiang A&F University,Lin’an 311300,Zhejiang,China;2.National Joint Local Engineering Laboratory of Biopesticide High-efficient Preparation,School of Forestry and Biotechnology,Zhejiang A&F University,Lin’an 311300,Zhejiang,China)
S763.3
A
2095-0756(2017)05-0907-08
2016-10-17;
2016-12-12
国家自然科学基金资助项目(31300550)
刘奕来,从事害虫生物防治研究。E-mail:353995785@qq.com。通信作者:周湘,副教授,博士,从事森林保护、害虫生物防治等研究。E-mail:xzhou@zafu.edu.cn
