基于培养学科素养的课堂教学实践和反思
——以“氧化还原反应”(高三一轮复习)为例
2017-10-09丛高
丛 高
(如东县教师发展中心 江苏如东 226400)
基于培养学科素养的课堂教学实践和反思
——以“氧化还原反应”(高三一轮复习)为例
丛 高
(如东县教师发展中心 江苏如东 226400)
以设计的三个循序渐进的学生活动为主线:“观察体验——敲铁成铜”、“推理验证——原电池反应”、“理性分析——电解CuCl2溶液”,借助感性、理性认识,加深对氧化还原反应的理解,同时寓学科相关素养的培养于学生思维品质的优化中。
实验探究;证据推理;宏微结合;模型认知;平衡思想
一、设计理念
氧化还原反应的学习一直贯穿于整个中学的始终,从学生认知水平发展看:北师大胡久华老师在《促进学生认识发展的化学1模块氧化还原专题的单元整体教学研究》一文中将其分为5个阶段,本节课的教学正是处于水平5:即“高考复习,达到应用氧化还原反应解决分析综合实际问题的能力。如综合应用物质的氧化性和还原性强弱,解决分析定量计算、物质制备、能量转化、实验设计等综合问题,甚至还要跟其他相关的知识联系共同解决问题。”[1]
大学无机化学通过讨论电极电势[2]和氧化还原反应的关系,从根本上解决了氧化还原反应发生的条件及其主要影响因素,那么能不能在高中教学的最后阶段,充分基于电化学基础知识,将氧化还原反应拆解为“半反应”作为过渡,并就此初步讨论氧化还原反应发生的条件及其主要影响因素,从而建立新的视角认识氧化还原反应呢?本节课正是按照这种构思,由学生熟悉的我国古代湿法炼铜的原理入手,讨论氧化还原反应的发生及其影响因素,结合落实学生学科核心素养的培养,整节课的教学思维导图可表示如下。
二、教学过程
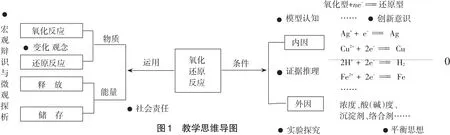
图1 教学思维导图
1.观看视频——化学小魔术“敲铁成铜”
[师]我们先来观看一段视频:将已钝化处理过的铁圈下端浸入硫酸铜溶液中片刻,取出。见证奇迹的时刻:轻轻敲打铁圈——瞬间“变红”!神奇吗?谁来揭秘?
[生]板演湿法炼铜的原理:Fe+Cu2+====Fe2++Cu。分析化合价变化以及电子转移情况。并写出微粒表现为氧化性和还原性的两个半反应式:Fe-2e-====Fe2+;Cu2++2e-====Cu)
[师]它们是同时发生的,但在2000多年前,当时还只是提出了“还原”这一概念(可谓古老),而直到200多年前(1777年),拉瓦锡否定“燃素说”后才提出“氧化”这个概念(可谓年轻),一直到100多年前(1897年)汤姆生发现电子后,氧化还原反应的本质才得以揭示。
设计意图:感受氧化还原反应概念的建立和完善经历了漫长的证伪和证实的过程,同时梳理氧化还原反应中几组对立统一的概念。而半反应的书写也为后面从新的视角认识氧化还原反应打下伏笔。
2.推理和验证
[师]如何设计实验检测电子在氧化还原反应中发生了转移呢?
[生]利用原电池装置。
[师]如何将此反应设计为原电池?
[生]从电极材料、电解质、盐桥等角度分析。
[师]展示铜铁原电池图片,同时和铜银原电池进行比较。“实验才是最高法庭”!
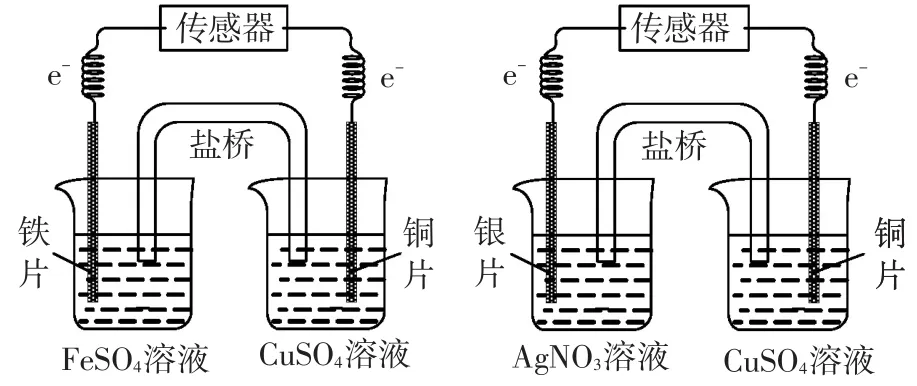
图2 铜铁原电池与铜银原电池比较
演示铜银原电池:(操作:装液、盐桥、电极、介绍“微电流传感器”:用于检测电流的大小和方向,采集的数据同步显示在这个坐标系上,其横坐标是时间,纵坐标表示电流的大小和方向)。
设计意图:感受同一铜电极在两个不同原电池中“半反应”方向的不同,再次为讨论氧化还原反应的方向做好铺垫。
设计意图:从学生已有的金属活动性顺序出发,变金属活动左右排序为半反应的上下排序,并将“以强制弱”的规则延伸至从半反应看氧化还原反应的方向,从而提升至一个全新的视角认识溶液中发生的氧化还原反应。
[师]演示实验:运用多量程电流计,测定c(Fe3+)=电流强度。
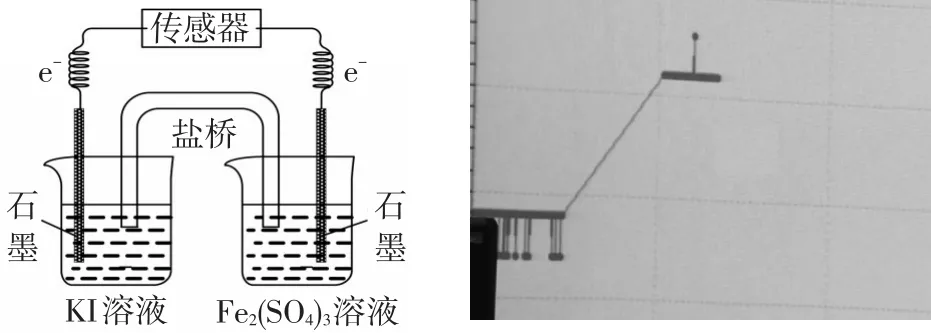
图3 两种Fe3+浓度所对应的微电流强度比较
[师]引导分析:浓度的改变对物质的氧化性(或还原性)的影响,进而影响氧化还原反应的方向。
设计意图:旨在说明某些半反应的发生可通过改变浓度等因素控制反应方向,限于学生现有认知水平(尚不足以深入的细节),开个窗口,留给学生日后去达到,同时又遵循学科知识的科学性和严谨性,通过适度的“解释”,以给学生今后的学习留有发展空间,符合“以人为本”的教学要求。
[师]对于有些反应,改变方向是很困难的,仅仅靠改变浓度等是难以实现的,唯有采用最强有力的氧化还原手段——电解。
3.完成电解氯化铜溶液实验,并交流实验报告
问题讨论:要使I-和Br-的混合液中I-被氧化而Br-不被氧化,可选择哪些氧化剂?
设计意图:从实验的角度丰富了制备铜的方法,也呼应了课开始的湿法炼铜。可通过加液后在V型管两端自然形成的液面高度差判断装置的气密性,另外装置在密闭体系中检验Cl2,减少了其污染,本身就体现了绿色思想。同时针筒内试纸颜色的变化及其解释也为比较物质的氧化性强弱提供了极佳的例证。
拓展延伸:通过“84消毒液”的生产和使用注意事项(不能和洁厕灵混合使用),认识酸碱性对物质氧化性(或还原性)的影响。
设计意图:让学生理解化学法制备强氧化剂一般选择碱性介质的根本原因。
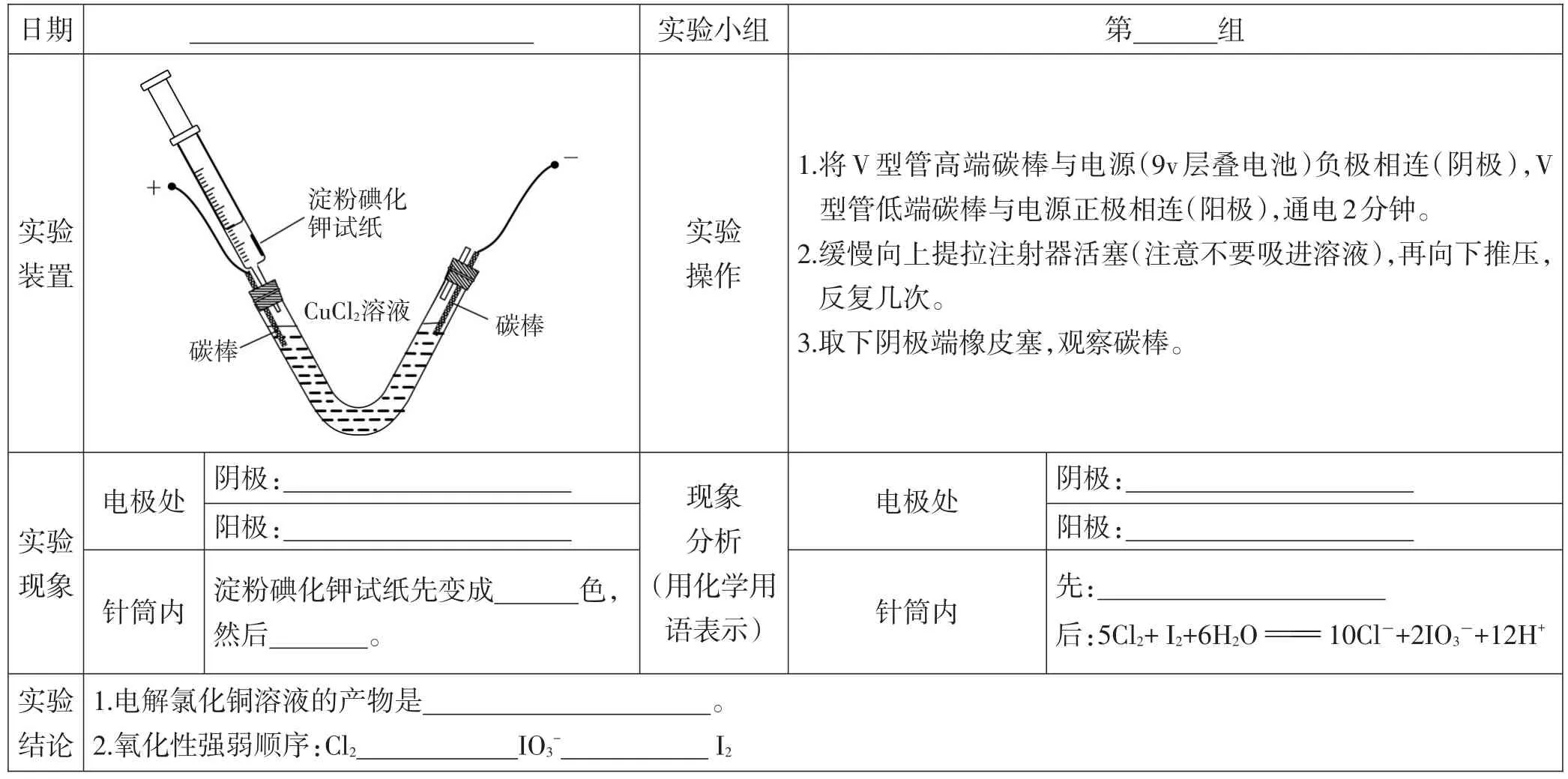
表1 实验记录
课堂小结:形成思维导图。
课后思考与拓展:
(1)控制温度,钠可置换出熔融氯化钾中的钾,为什么?科学合理地运用本节课中的“序”要注意哪些问题?
(2)整理本节课中你感兴趣的某个点或未能完全弄清楚的问题,查阅资料,独立或和同学讨论深入探讨这些问题。
三、教学反思
本节课的设计有点“剑走偏锋”,没有走寻常路,而是大胆地让学生走进一个相对陌生的视角——从电极电势看氧化还原反应,也可谓是一种尝试,从现场教学效果看,学生转换一个新的视角还是具有一定的难度,也需要一个过程,更需要教者教育的智慧,有人说伟大的教师在于启发,这也正是我所追求的,尽管我现在可能还没有上路,但我坚信彼岸就在不远的前方。
[1] 胡久华.促进学生认识发展的化学1模块氧化还原专题的单元整体教学研究[J].化学教育,2010(3):25
[2] 无机化学教研室.面向21世纪课程教材.无机化学(上册第四版)[M].北京:高等教育出版社,2005
1008-0546(2017)10-0041-03
G633.8
B
10.3969/j.issn.1008-0546.2017.10.014
*本文系江苏省南通市中小学教学研究课题(2015年度第十一期)的研究成果之一。
