平均相对分子质量对化学平衡判断的数学证明
2017-10-09张宁云
张宁云
(江苏省无锡市第一中学 江苏无锡 214000)
平均相对分子质量对化学平衡判断的数学证明
张宁云
(江苏省无锡市第一中学 江苏无锡 214000)
化学平衡的判断一直是高考热点、难点,需要较强的逻辑思辨能力,文章力图从源头上探究化学平衡的判断方法,并用数学方法来证明平均相对分子质量对化学平衡的判断,让学生在理解的基础上掌握,培养理科的思维。
平均相对分子质量;化学平衡;数学证明
化学平衡是高中化学重要的知识点之一,概念抽象复杂,较难理解,而化学平衡标志的判断是其中的基础知识点,对平衡的移动及其它平衡知识的理解起铺垫作用。化学平衡的判断是高考中的高频考点,考查的形式多种多样,选择题,反应终点的判断,反应过程的理解,转化率的计算、平衡的移动等都会有化学平衡的身影。笔者在教学过程中也发现学生较难掌判断方法,如果出现比较陌生的化学平衡的文字描述,比如气体的平均密度,平均相对分子质量等,部分学生更是一头雾水,无从下手,甚至到了高三仍有部分学生不能正确掌握。如何确定反应达到平衡状态、如何认识化学平衡的建立、哪些物理量可以作为建立平衡的标志,笔者认为从源头出发,回归教材,回归到平衡的本质,回归化学作为“理科”,采用数学证明的方式,这样更好理解平衡的标志。
化学平衡的标志通常有三种:直接标志、间接标志和特殊标志[1]。下面由一个具体题目来解释这3个标志。
例题:在一定条件下,将2mol A和1mol B两种气体混合于固定容积为2L的密闭容器中,发生如下反2min后。
一、直接标志——化学平衡的定义
教材中:可逆反应在一定条件下进行到一定程度时,正反应速率与逆反应速率相等,反应物和生成物的浓度不再发生变化,反应达到化学平衡(chemical equilibrium)状态[2]。由这样的描述可以得出判断平衡的直接标志,也是判断化学平衡的源头,也是可逆反应达到平衡时的2个特点:
1.等:正反应速率等于逆反应速率,即v(正)=v(逆)。
用速率表征平衡时,一定是相反方向的反应速率,即 v(正)和v(逆)相伴相生,还要注意是同一种物质的正反应速率等于逆反应速率,如v(正)A=v(逆)A,如果是不同种物质来说,既要相反方向的反应速率,又要依据化学计量数的倍比关系确定速率关系,如v(正)A=2v(逆)B,均说明反应达到平衡。
2.定:在化学平衡状态下化学反应仍在进行,但反应混合物的组成保持不变[3]。
当反应达到平衡时,各物质的浓度不再发生变化。如c(A)、c(B)、c(C)的浓度保持不变,达到平衡,当满足条件c(B)=c(C),则不能说明化学反应达到平衡,可能是反应过程中出现的一种特殊情况。由于物质D是固态,浓度视为定值,因此不可用D的浓度来表征化学平衡的标志。判断时注意物质的状态。
二、间接标志——由浓度保持不变延伸
化学反应达到平衡时,各物质的浓度保持恒定不变,由此延伸出其它物理量保持恒定不变,实际上是浓度不变的另一种表现形式。
1.各物质(包括反应物、生成物,下同)的质量、各物质的质量分数、各物质的物质的量、各物质的物质的量分数保持恒定不变。如例题中的m(A)、m(B)、m(C)、m(D)、m(A)%等保持不变,n(A)、n(D)、n(D)%等保持不变,达到平衡,此时不需要考虑物质的状态,因为质量、物质的量与状态无关。
2.具有特殊颜色的物质,其气态或在溶液中的颜色间接反应了浓度的相对大小,所以对于有颜色的物质来说,如果体系的颜色保持恒定不变,达到平衡,如色不变则I2蒸汽的浓度不变,反应达到平衡。
三、特殊标志——与物质的状态、前后计量数之和相关
还有一些标志来判断反应是否达到平衡,而这些物理量通常与反应物、生成物的状态有关,还可能与气体的前后计量数之和是否相等有关,涉及的物理量越多,考虑的因素通常就越多,判断的难度通常也越大。
1.气体分子总数(气体物质的量):例题中:
2.压强:压强是形容气体性质的物理量。依据阿伏伽德罗定律的推论:当容器的体积一定时,气体压强与气体分子总数(气体总物质的量)成正比,即气体的压强是一定体积下气体分子总数的体现。例题中气体物质的前后计量数之和不等,压强不变,则2D(s),压强始终不变。
3.平均密度(p)仅适用于气体。(总),气体的总质量与容器体积的比值即为气体的平物质的总质量随着固体D质量的增加(减少)而相应减少(增加),容器的体积保持固定不变(题干中的信息),所以气体的平均密度随反应的进行而改变,若平均密度不变,则反应达到平衡。若有恒容下的反应:是恒定量,始终不变。
公式1:(总)/n(总),气体的总质量除以气体总的物质的量;
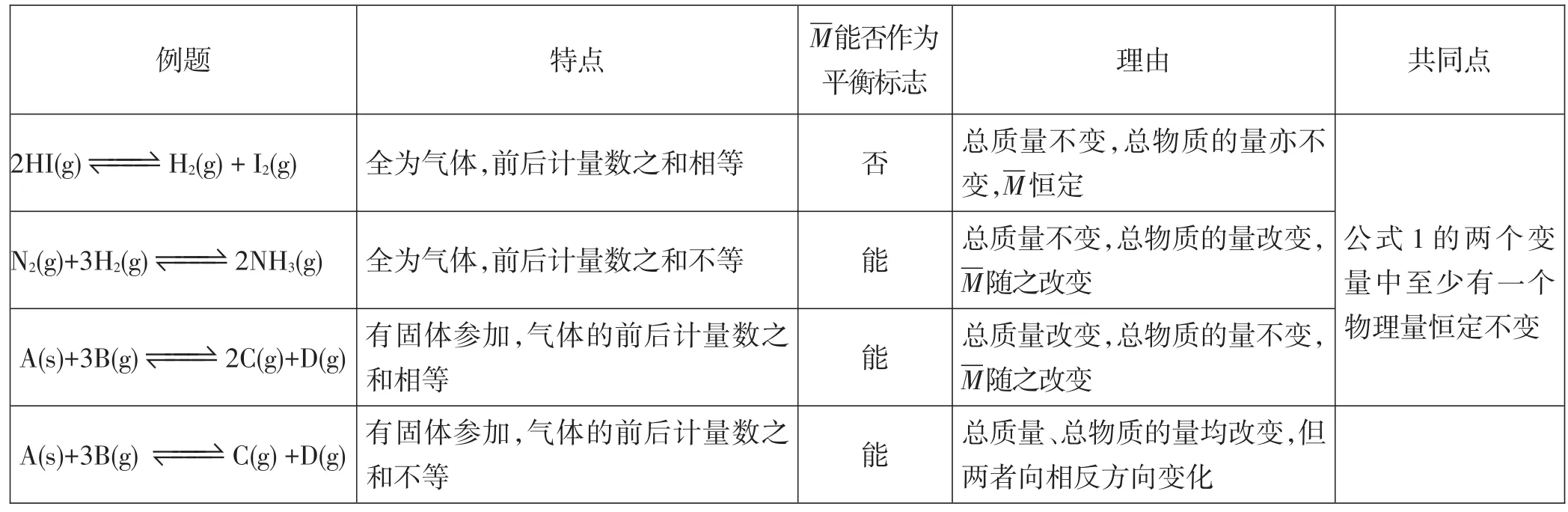
表1 不同信息下M对化学平衡的判断
若m(总)、n(总)同时发生改变,且向一个方向改变,公式2可解决这一类题型,如例题中2A(g)+B(g)B的相对分子质量,讨论法决定物质C的相对分子质量,最终来确定的变化趋势。假设A、B的相对分子质量M(A)=20,M(B)=40(起始)=20×2/(2+1)+40×1/(2+1)≈26.7,假设反应了xmolB,根据“三段式法”计算达平衡时的平衡):
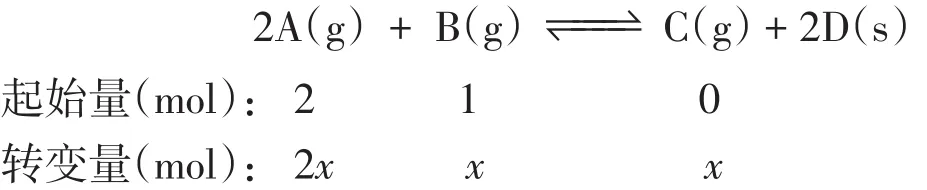
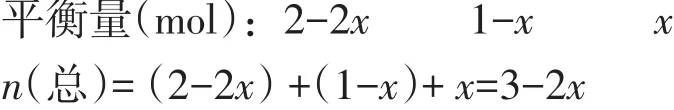
讨论1:假设M(C)=50,比A、B的相对分子质量都大
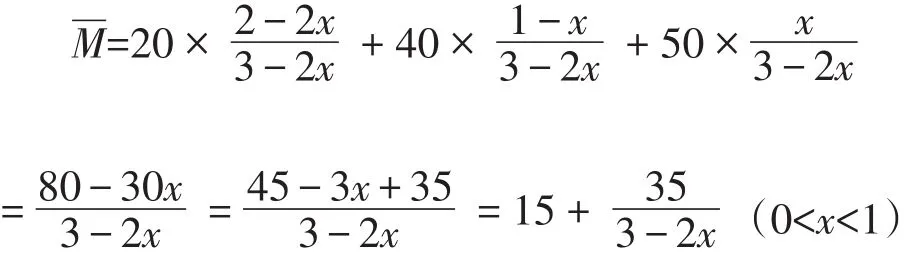
此为单调增函数,当x=0时≈26.7;当x=1时50,所以26.7<<50,不可取等号,当M保持不变时,可逆反应达到平衡,在二维坐标系中M的取值如图1所示。

图1
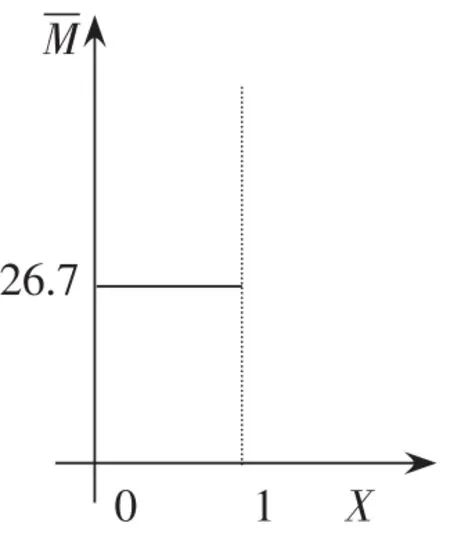
图3
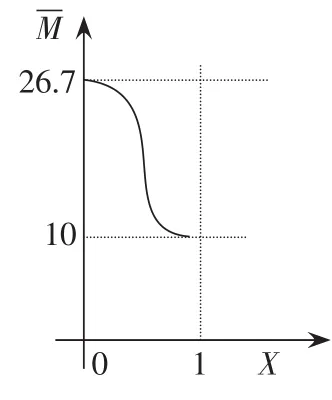
图2
讨论2:假设M(C)=10,比A、B的相对分子质量都小
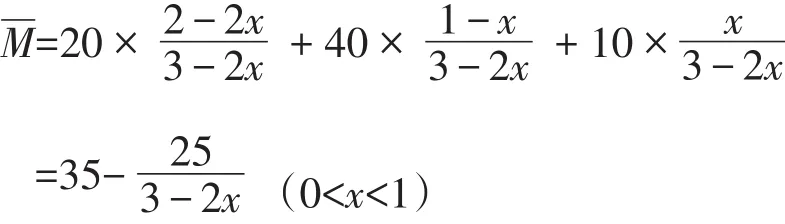
此为单调减函数,当x=0时≈26.7;当x=1时=10,所以10<<26.7,不可取等号,当保持不变时,可逆反应达到平衡,在二维坐标系中的取值如图2所示。
讨论3:假设M(C)=26.7,与A、B的平均相对分子质量相等,
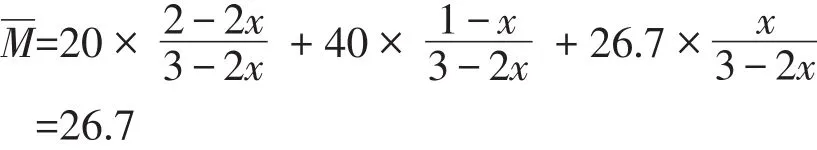
当保持不变时,不可证明反应达到平衡,在二维坐标系中的取值如图3所示。
化学平衡标志的判断实际上是一个逻辑思辨的过程,整合信息的过程,而这种过程在构建这些知识时是必不可少的,不同的信息下,采用不同的思维方式,因此就会出现纷繁多样的判断方法,如何有效地帮助学生搭建信息与思维方法之间的通道,“授之于渔”发挥学生的主体作用,从源头上找到信息与方法的通道。当然总结成一句让学生容易理解、原则性比较强的一句话也是一个不错的选择:在一定条件下的可逆体系平衡建立的过程中,如果一个量是变化的,这个量一旦不变,则化学平衡建立,那么这个量就可以作为判断该可逆体系是否平衡的标志,也就是变化量不变时平衡建立,该量可作平衡标志[4]。
[1] 魏红.化学平衡标志的判断[J].中学化学教学参考,2014(6):51
[2][3]王祖浩.化学2(必修)第4版[M].南京:江苏教育出版社,2007(6):33
[4] 姜宏.浅谈化学平衡标志的判断[J].中学化学教学参考,2015(7):30
1008-0546(2017)10-0016-03
G633.8
B
10.3969/j.issn.1008-0546.2017.10.006
