葡萄乙醛脱氢酶VvALDH10A9基因的克隆、表达及酶活性分析
2017-10-09邢启凯燕继晔富春元李兴红
邢启凯, 燕继晔, 张 玮, 刘 梅, 富春元, 李兴红
(北京市农林科学院植物保护环境保护研究所, 北京 100097)
葡萄乙醛脱氢酶VvALDH10A9基因的克隆、表达及酶活性分析
邢启凯, 燕继晔, 张 玮, 刘 梅, 富春元, 李兴红*
(北京市农林科学院植物保护环境保护研究所, 北京 100097)
由葡萄座腔菌科Botryosphaeriaceae真菌引起的葡萄溃疡病Botryosphaeria dieback是葡萄上的主要枝干病害,严重影响葡萄产量和品质。鉴定和分析参与葡萄与葡萄溃疡病菌互作的基因,有助于揭示和阐明葡萄抗溃疡病的信号通路。本研究根据葡萄溃疡病菌侵染后的葡萄转录组数据信息,利用逆转录聚合酶链式反应技术(RT-PCR)克隆了一个受葡萄溃疡病菌诱导上调表达的乙醛脱氢酶基因VvALDH10A9(Vitisviniferaaldehyde dehydrogenase 10A9)。系统进化树分析表明,该基因编码的蛋白与拟南芥AtALDH10A8亲缘关系最近。利用实时荧光定量PCR分析VvALDH10A9的表达结果表明:VvALDH10A9的表达具有组织特异性,在茎、叶和花中表达量最高,在根中表达量相对较低;葡萄溃疡病菌侵染后,VvALDH10A9在葡萄抗病品种中表达变化不明显,而在葡萄感病品种中该基因显著上调表达。利用原核蛋白表达系统诱导合成的VvALDH10A9蛋白,经纯化后可降解乙醛,表明VvALDH10A9蛋白具有乙醛脱氢酶活性。
葡萄; 葡萄溃疡病; 乙醛脱氢酶;VvALDH10A9; 原核表达
葡萄Vitisvinifera不仅可以鲜食还可以酿酒、制干和制汁等,是全世界重要的水果之一,其产量和面积在世界水果中均位居前列[1]。改革开放以来,中国葡萄产业迅速发展,截至2013年底,中国葡萄栽培面积已达715.5万hm2,葡萄总产量超1 150万t(2014年度葡萄产业技术发展报告)。葡萄病害是影响葡萄产量和品质的最重要因素之一,据统计,危害我国葡萄的病害有40余种[2]。由葡萄座腔菌科真菌引起的葡萄溃疡病作为一种严重的枝干病害近几年才引起人们的重视,在世界上主要的葡萄栽培区域均有分布[3-5]。在我国,李兴红研究组2009年首次发现并报道了由葡萄座腔菌引起的葡萄溃疡病,目前引起葡萄溃疡病的病原菌共分离到5种,分别是Botryosphaeriadothidea、Diplodiaseriata、Lasiodiplodiatheobromae、Neofusicoccumparvum、Lasiodiplodiapseudotheobromae和Neofusicoccummangiferae[6-9]。通常认为,葡萄溃疡病主要通过自然孔口或修剪伤口侵入,感病植株出现枝枯、溃疡和果腐等现象,严重者发生根腐,致使整株枯死。葡萄溃疡病已成为中国葡萄生产的重大障碍[6-7]。
醛是一类生物体内常见的生物分子,根据来源方式,可将其分为内源醛和外源醛。内源醛主要来自氨基酸、碳水化合物、维生素和脂类等物质的新陈代谢[10-11]。外源醛主要是指逆境环境胁迫过程中膜脂的过氧化反应产生的醛类[10-11]。由于其自身羰基基团的亲电特性,这些代谢过程产生的醛很容易与细胞内的亲和物质发生作用,对生物体造成一些严重的遗传毒害[12]。因此,醛的选择性代谢对机体功能至关重要。醛脱氢酶(aldehyde dehydrogenases, ALDHs)是一类通过氧化各种内源性和外源性等多种醛的酶类,在烟酰型辅酶(NAD(P)+)的协助下,不可逆地将醛氧化形成相对应的羧酸,从而达到解毒的目的[13-14],该类蛋白质都含谷氨酸、半胱氨酸活性位点[15]。
到目前为止,在所有生物体中共发现超过550个不同的ALDH基因,根据蛋白质序列差异可分成22个醛脱氢酶家族[16-17],而植物中的醛脱氢酶分布于14个家族,并且其中的7个家族(ALDH11、ALDH12、ALDH19、ALDH21、ALDH22、ALDH23和ALDH24)为植物所特有[18]。张玉成等[19]从酿酒葡萄基因组中共筛选到23个醛脱氢酶基因,并将其分成10个家族,证实一些VvALDH基因在寄主葡萄和病原菌的互作以及果实的发育等过程中起着重要的作用。本研究前期以L.theobromae菌株CSS-01s、葡萄‘夏黑’(高感)为研究对象,采用RNA-seq技术对CSS-01s诱导后的‘夏黑’枝干进行转录组分析,通过差异表达基因的筛选与注释,从转录组水平上分析感病葡萄对葡萄溃疡病菌防御反应以及早期病程相关基因的表达,发现乙醛脱氢酶VvALDH10A9基因在诱导后的样品中高表达。因此,本试验通过对VvALDH10A9基因克隆、原核表达并测定其酶活,初步验证VvALDH10A9蛋白的功能,旨在为揭示VvALDH10A9基因在葡萄溃疡病菌侵染过程中的作用机理奠定理论基础。
1 材料与方法
1.1 供试材料
供试材料:大肠杆菌Escherichiacoli菌株DH5α和BL21购自北京全式金生物技术有限公司,根癌农杆菌Agrobacteriumtumefaciens菌株EHA105及野生型L.theobromae菌株CSS-01s均由本实验室保存。一年生‘梅鹿辙’(Merlot)和‘品丽珠’(Cabernet Franc)绿枝条由山西省农业科学院果树研究所提供。
供试药剂:各种限制性内切酶、LATaqDNA聚合酶、T4 DNA连接酶和SYBR Premix Ex TaqTM购自宝生物工程有限公司。反转录酶SuperScript®Ⅲ购自Invitrogen公司。DNA胶回收试剂盒购于Qiagen。抗生素以及异丙基硫代半乳糖苷(IPTG)购自上海生工生物工程有限公司。其他常规化学药品均为分析纯。
1.2 同源与进化分析
利用NCBI数据库分别下载拟南芥Arabidopsisthaliana(NP_565094.1)、二穗短柄草Brachypodiumdistachyon(XP_003574495.1)、衣藻Chlamydomonasreinhardtii(XP_001699134.1)、大麦Hordeumvulgare(BAB62846.1)、苜蓿Medicagotruncatula(XP_003608928.1)、水稻Oryzasativa(NP_001061833.1)、毛杨Populustrichocarpa(XP_002322147.2)、高粱Sorghumbicolor(AGZ15751.1)、节节麦Aegilopstauschii(EMT10403.1)、团藻Volvoxcarteri(XP_002947147.1)、玉米Zeamays(NP_001157804.1)、华东葡萄Vitispseudoreticulata(AAZ79355.1)和酿酒葡萄Vitisvinifera(XP_002283132.1、XP_002263479.1、XP_002274863.1、CBI16844.3、CBI32134.3、XP_002273358.1、XP_002285866.1、XP_002273730.2、XP_002285466.1、XP_002265514.1、XP_002265402.1、XP_002265354.1、XP_002266390.1、XP_002266616.1、XP_002266379.1、XP_002278093.1、XP_002272544.1、XP_002281984.1、XP_002285286.1、XP_002279374.1、XP_002273569.1、XP_002282355.1、XP_002273256.1和XP_002277743.1)乙醛脱氢酶蛋白全长序列与VvALDH10A9进行比对,得到其同源结构域,运用 ClustalX进行比对,利用MEGA6软件构建Neighbor-Joining系统进化树。
1.3 葡萄组织RNA提取及cDNA第一链的合成
取一年生葡萄‘夏黑’开花期的茎、叶、花,以及组培苗的根,液氮冻存,放于-80℃冰箱中备用,用于基因组织特异性表达分析。参考úrbez-Torres等[20]和Yan等[6]测定葡萄溃疡病菌致病力的方法,选用L.theobromae菌株CSS-01接种一年生葡萄‘梅鹿辙’和‘品丽珠’绿枝条,于0、2、4、6和12 h,取葡萄枝条表皮,液氮冻存后于-80℃冰箱中保存,用于分析基因的诱导表达。采用TRIzol法(Qiagen)提取各组织样品总RNA,经DNaseⅠ消化处理后,采用SuperScript®Ⅲ反转录酶(Invitrogen)反转录得到第一链cDNA,-20℃保存,用于基因克隆与荧光定量分析。
1.4 表达分析
依据VvALDH10A9序列设计特异性引物(正向引物Primer F:5′-AGAGGTGTGA ACGTGTGTCA-3′和反向引物Primer R:5′-TACCAGCCCCATGGTTCATT-3′),以VvEF1α(正向引物为5′-GCGGGCAAGAGATACCTCAA-3′;反向引物为5′-TCAATCTGTCTAG GAAAGGAAG-3′)作为内参基因,进行荧光定量PCR分析。采用SYBR GreenⅠ荧光染料法,反应体系参照TaKaRa说明书。反应体系为:反转录产物0.5 μL,引物(0.5 μmol/L) 3.5 μL,2×SYBR Premix ExTaqⅡ (Tli RNaseH Plus) 7 μL,ROX Reference Dye Ⅱ 0.3 μL,加水至总体积14 μL。PCR仪为ABI 7500。根据溶解曲线以及凝胶电泳确定PCR产物是否特异。每个反应得到相应的Ct值。每个样品进行3个平行反应,取平均值后,用2-△Ct方法算出基因的相对表达水平。
1.5 原核表达载体的构建与鉴定

将连接产物转化到BL21(DE3)中,涂布于含氨苄青霉素的LB固体培养基上,37℃过夜培养。挑取单克隆菌落摇培,取菌液进行PCR扩增,经琼脂糖凝胶电泳验证判断菌体是否含有重组质粒。重组质粒委托北京博迈德基因技术有限公司进行测序。
1.6 重组蛋白诱导表达及纯化
1.6.1 蛋白诱导表达
取1 mL菌液转接至100 mL LB(含100 mg/L Amp)液体培养基中,37℃ 180 r/min摇培至OD600为0.4~0.6;取1 mL菌液加入100 μL IPTG至其终浓度为0.1 mmol/L,16℃ 120 r/min诱导过夜,取1 mL诱导后的菌液,于4℃ 8 000 r/min离心10 min收集菌体,用PBS缓冲液(137 mmol/L NaCl, 2.7 mmol/L KCl, 10 mmol/L Na2HPO4, 2 mmol/L KH2PO4,pH=7.4)冲洗1次,加10 mL PDT(PBS,0.1%Triton X-100,1 mmol/L PMSF,1 mmol/L DTT,pH=7.4)将菌体悬浮,超声波裂解细胞(功率250 W,工作时间10 s,间隔10 s,工作10次)。4℃ 12 000 r/min离心10 min,取上清,沉淀用10 mL PDT悬浮。取上清及沉淀,与诱导前后总蛋白样品一起进行SDS-PAGE电泳。
1.6.2 诱导蛋白的纯化
取1 mL混匀的Ni-NTA琼脂糖加入至Bio-Rad层析柱中,加入3倍体积的Binding buffer(50 mmol/L NaH2PO4, 0.3 mol/L NaCl, 10 mmol/L咪唑,pH=8.0)洗涤5次;缓缓加入待纯化的上清蛋白,4℃孵育30 min;加入3倍体积的Wash buffer (50 mmol/L NaH2PO4, 0.3 mol/L NaCl, 20 mmol/L 咪唑,pH=8.0)洗涤3次;最后用0.5 mL的Elution buffer (50 mmol/L NaH2PO4, 0.3 mol/L NaCl, 250 mmol/L咪唑,pH=8.0) 洗脱蛋白。
1.7 重组乙醛脱氢酶活性测定
参考刘峰等[24]提供的乙醛脱氢酶活性测定方法。将10 μg纯化蛋白加入到含1.5 mmol/L NAD (Sigma), 100 mmol/L磷酸钠缓冲液(pH 8.5)的反应液中,用ddH2O定容至100 μL;加入20 μg乙醛,用酶联仪 (GE Versamax)测定460 nm处的吸光度,每隔20 s测定1次,持续2 min。以pET-32a空载体诱导表达的蛋白作为对照。
2 结果与分析
2.1 VvALDH10A9的序列分析及进化分析
以VvALDH10A9为候选基因,设计特异性引物,利用RT-PCR从葡萄‘品丽珠’茎组织中获得该基因全长ORF(open reading frame)片段,经测序比对,与NCBI公布的XM_002283654.4 (accession number)序列完全一致。该基因位于葡萄第17号染色体上,共有15个外显子(exon)和14个内含子(intron) (图1),cDNA开放阅读框为1 512 bp,碱基组成为A(25.3%)、T(27%)、C(27.5%)、G(20.2%)。编码含503个氨基酸的多肽,属于乙醛脱氢酶第10家族[19],负电荷残基(Asp + Glu)有50个,正电荷残基(Arg + Lys)有60个(图2)。EditSeq软件分析结果显示,VvALDH10A9理论分子量为55 kD,理论等电点pI为5.5。系统进化树分析表明,该基因编码的蛋白与拟南芥AtALDH10A8 (NP_565094.1)蛋白的同源性较高、亲缘关系最近(图3),推测可能与该蛋白具有相似的功能。

图1 VvALDH10A9结构图Fig.1 Gene structure of VvALDH10A9

图2 VvALDH10A9核酸序列及推测的氨基酸序列Fig.2 Nucleotide sequence of VvALDH10A9 and its deduced amino acid sequence

图3 VvALDH10A9与其他植物ALDH蛋白的系统进化树Fig.3 Phylogenetic tree analysis of VvALDH10A9 and ALDHs from other plants
2.2 VvALDH10A9的表达分析
为了研究VvALDH10A9基因在生物胁迫下的表达特征,利用Real-time PCR分析葡萄溃疡病菌CSS-01接种后该基因的表达模式,结果表明,VvALDH10A9在抗病葡萄品种‘梅鹿辙’中的表达变化不明显,而在感病葡萄品种‘品丽珠’的表达量随着处理时间的延长而上升,并且在处理6 h时表达量迅速上升达到最大值,随后表达量又呈现下降趋势(图4a),以上结果表明该基因对葡萄溃疡病菌表现出一定的适应性,表达受到精细调控。
同时对该基因的组织表达特征进行了分析,结果显示,VvALDH10A9 在葡萄的各个组织中均有表达,在茎、叶和花中表达量最高,而在根中表达量相对较低(图4b)。
2.3 VvALDH10A9的原核表达
当将基因全长序列构建至pET-32a时,未诱导出目的蛋白;随后将去除信号肽的VvALDH10A9基因序列(73 bp~1 509 bp)构建至pET-32a上,片段长度为1 437 bp,编码479个氨基酸,经计算其分子量约为51.7 kD,而pET-32a编码的蛋白为20.1 kD,因此推定该融合蛋白分子量约为71.8 kD。为了获得能够可溶性表达的目的蛋白,在16℃,用终浓度为0.1 mmol/L IPTG诱导过夜,诱导完成后进行SDS-PAGE电泳检测。结果表明,超声波破碎后沉淀中无明显诱导条带,而上清液在70 kD处有一蛋白质条带,与重组质粒推测的表达蛋白大小相近(图5)。为了进一步鉴定该蛋白,将诱导获得的粗蛋白用Ni-NTA进行亲和纯化,以250 mmol/L咪唑将蛋白洗脱,SDS-PAGE电泳发现在70 kD左右有一条明显的蛋白质条带(图5),其大小与推测的融合蛋白大小一致,测定浓度为0.9 mg/mL。
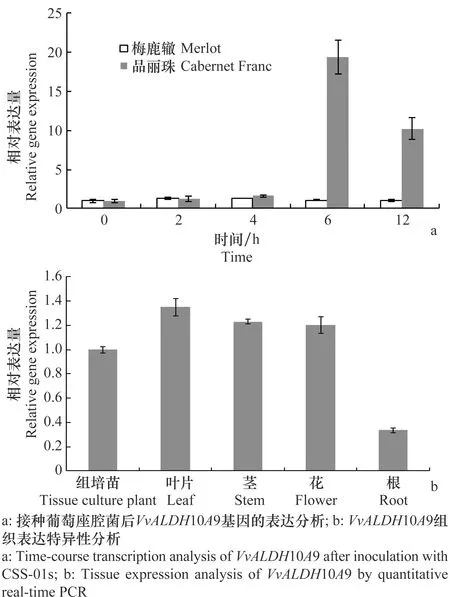
图4 VvALDH10A9的表达分析Fig.4 Expression analysis of VvALDH10A9 in grapevine
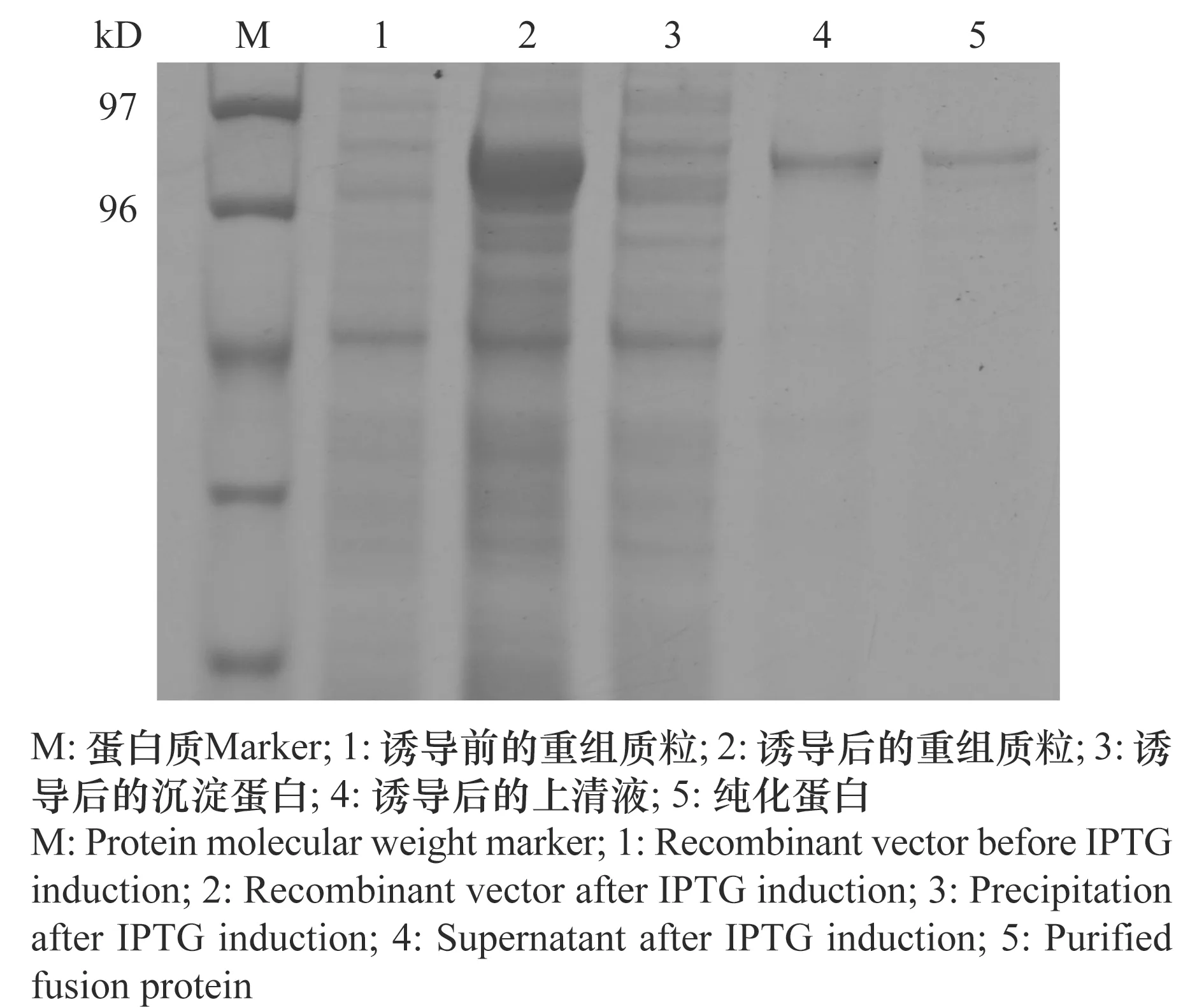
图5 VvALDH10A9基因重组蛋白在大肠杆菌的表达和纯化Fig.5 Expression and purification analysis of recombinant VvALDH10A9/pET32a protein in Escherichia coli BL21
2.4 纯化蛋白乙醛脱氢酶活性测定
为了确定VvALDH10A9蛋白是否编码一个有功能的乙醛脱氢酶蛋白,对纯化蛋白的体外活性进行测定。结果表明,在乙醛存在时,pET-32a测定值基本没有发生变化,而ALDH10A9/pET-32a的测定值增加了2.5倍(图6)。与此相反,对照pET-32a中仅检测到背景。由此推断,在NAD+的辅助下,VvALDH10A9蛋白可将底物乙醛分解,具有乙醛脱氢酶活性。
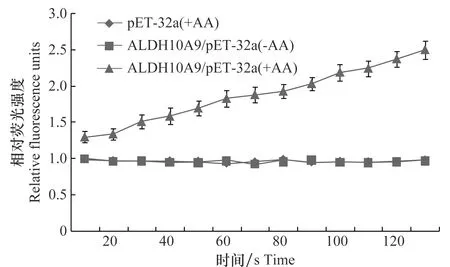
图6 VvALDH10A9重组蛋白体外酶活性测定Fig.6 Aldehyde dehydrogenase activity assay of purified recombinant VvALDH10A9/pET32a protein
3 讨论
醛脱氢酶是一类氧化各种内源性和外源性醛的酶类,在NAD(P)+的协助下,将醛氧化形成相对应的羧酸,从而保护植物不被醛类毒害。近几年,关于ALDHs家族的研究已取得很大进展,然而,大多数的研究集中在植物的花器官发育过程,关于非生物胁迫过程中醛脱氢酶的研究也主要集中在拟南芥[16]、水稻[21]和玉米[22]等模式植物,而葡萄中关于该家族成员与植物抗病的研究报道相对较少。依托转录组分析数据,本研究采用RT-PCR技术克隆到编码醛脱氢酶的VvALDH10A9基因。经测序发现,该基因片段为1 512 bp,能编码含有503个氨基酸残基的蛋白。通过氨基酸序列比对发现,VvALDH10A9蛋白与VvALDH10B1、拟南芥AtALDH10A8蛋白亲缘关系最近(图 3),推测可能与该分支蛋白具有相似的功能。
研究发现,醛脱氢酶除了具有催化醛类的作用之外,在植物的生长发育和逆境响应中具有重要的生理功能。水稻OsALDH7基因受氧胁迫和非生物胁迫强烈诱导,对水稻种子的成熟和种子的活性至关重要[23]。玉米rf2a基因编码一个线粒体ALDH2B2基因,与玉米花粉发育有关,且在玉米功能性雄配子体产生过程中发挥重要作用[24]。有研究指出,ALDH3I1和ALDH7B4这两个基因分别被脱水、高盐和脱落酸(ABA)不同程度地在不同组织中特异激活,可显著提高拟南芥对上述胁迫的抵抗能力[25]。玉米ZmALDH22A1基因在烟草中的过量表达可显著提高转基因植株对ABA、盐、甘露醇和脱水等的抗胁迫能力[26]。脱水、高盐、脱落酸和UV照射都可诱导念珠藻ALDH21A1基因的表达[27]。为揭示醛脱氢酶VvALDH10A9基因的相关功能,对该基因的组织特异性表达情况进行了研究。试验结果显示,该基因在葡萄叶片、茎和花中的表达量比较高,在根中的表达量最低,推测其可能参与葡萄花的发育等生理过程。此外,醛脱氢酶基因在植物应对病原菌胁迫上也发挥着重要的作用[18,28]。野生葡萄VpALDH2B4基因编码蛋白定位于细胞线粒体,并受到病原菌Erysiphenecator和Plasmoparaviticola诱导表达。该基因在拟南芥中的过量表达可显著提高植株对病原菌Hyaloperonosporaarabidopsidis和Golovinomycescichoracearum的抵抗能力[30]。本研究也发现,葡萄VvALDH10A9基因对葡萄溃疡病菌的侵染有应答,推测该基因在葡萄溃疡菌侵染初期发挥着一定的作用。VvALDH10A9基因如何行使功能目前还不清楚,因此本研究进一步构建原核表达 VvALDH10A9蛋白的载体,并诱导其在大肠杆菌中高量表达、纯化获得了 VvALDH10A9原核表达蛋白。本试验选择表达的蛋白是去掉信号肽,因为真核生物蛋白在原核系统中表达时,信号肽的存在很容易导致原核表达蛋白的失败[25]。本研究表达获得的纯化蛋白表现出乙醛脱氢酶活性,这与此前关于这一酶类的报道相吻合,为其功能研究奠定了基础。但关于其具体生物学功能,有待于获得超表达和RNAi干扰转基因植株后做进一步分析。
[1] 田东, 冯建英, 陈旭, 等. 世界葡萄产业生产及贸易形势分析[J]. 世界农业, 2010(6): 46-50.
[2] 霍立强, 张建发, 王素娟. 葡萄病害的发生及防治方法[J]. 现代农村科技, 2011(1): 21.
[3] Bertsch C, Larignon P, Farine S, et al. The spread of grapevine trunk disease [J]. Science, 2009, 324(5928): 721.
[4] Bertsch C, Ramírez-Suero M, Magnin-Robert M, et al. Grapevine trunk diseases: complex and still poorly understood [J]. Plant Pathology, 2013, 62(2): 243-265.
[5] Phillips A J L, Alves A, Abdollahzadeh J, et al. The Botryosphaeriaceae: genera and species known from culture [J]. Studies in Mycology, 2013, 76: 51-167.
[6] Yan Jiye, Xie Yue, Yao Shengwei, et al. Characterization ofBotryosphaeriadothidea, the causal agent of grapevine canker in China[J]. Australasian Plant Pathology, 2012, 41(4): 351-357.
[7] Yan Jiye, Xie Yue, Zhang Wei, et al. Species of Botryosphaeriaceae involved in grapevine dieback in China [J]. Fungal Diversity, 2013, 61(1): 221-236.
[8] Dissanayake A J,Zhang Wei,Li Xinghong,et al.First report ofNeofusicoccummangiferaeassociated with grapevine dieback in China [J].Phytopathologia Mediterranea,2015,54(2):414-419.
[9] Dissanayake A J, Zhang Wei, Liu Mei, et al.Lasiodiplodiapseudotheobromaecauses pedicel and peduncle discolouration of grapes in China [J]. Australasian Plant Disease Notes, 2015, 10(1): 1-5.
[10] Sophos N A, Vasiliou V. Aldehyde dehydrogenase gene superfamily: the 2002 update [J]. Chemico-Biological Interactions, 2003, 143: 5-22.
[11] Sunkar R, Bartels D, Kirch H H. Overexpression of a stress-inducible aldehyde dehydrogenase gene fromArabidopsisthalianain transgenic plants improves stress tolerance[J]. The Plant Journal, 2003, 35(4): 452-464.
[12] Lindahl R. Aldehyde dehydrogenases and their role in carcinogenesis [J]. Critical Reviews in Biochemistry and Molecular Biology, 1992, 27(4/5): 283-335.
[13] Yoshida A, Rzhetsky A, Hsu L C, et al. Human aldehyde dehydrogenase gene family[J]. European Journal of Biochemistry, 1998, 251(3): 549-557.
[14] Vasiliou V, Bairoch A, Tipton K F, et al. Eukaryotic aldehyde dehydrogenase (ALDH) genes: human polymorphisms, and recommended nomenclature based on divergent evolution and chromosomal mapping [J]. Pharmacogenetics and Genomics, 1999, 9(4): 421-434.
[15] Perozich J, Nicholas H, Wang Bicheng, et al. Relationships within the aldehyde dehydrogenase extended family [J]. Protein Science, 1999, 8(1): 137-146.
[16] Kirch H H, Bartels D, Wei Yanling, et al. The ALDH gene superfamily ofArabidopsis[J]. Trends in Plant Science, 2004, 9(8): 371-377.
[17] Vasiliou V, Nebert D W. Analysis and update of the human aldehyde dehydrogenase (ALDH) gene family [J]. Human Genomics, 2005, 2(2): 138-143.
[18] 张玉成, 牛姣, 徐晓召, 等. 葡萄醛脱氢酶(ALDH2) 基因进化、表达及启动子功能的生物信息学分析[J]. 西北农林科技大学学报(自然科学版), 2012, 40(9): 169-180.
[19] Zhang Yucheng, Mao Linyong, Wang Hua, et al. Genome-wide identification and analysis of grape aldehyde dehydrogenase (ALDH) gene superfamily [J]. PLoS ONE, 2012, 7(2): e32153.
[20] úrbez-Torres J R, Gubler W D. Pathogenicity of Botryosphaeriaceae species isolated from grapevine cankers in California[J]. Plant Disease, 2009, 93(6): 584-592.
[21] Gao Chenxi, Han Bin. Evolutionary and expression study of the aldehyde dehydrogenase (ALDH) gene superfamily in rice (Oryzasativa) [J]. Gene, 2009, 431(1): 86-94.
[22] Liu Feng, Schnable P S. Functional specialization of maize mitochondrial aldehyde dehydrogenases[J]. Plant Physiology, 2002, 130(4): 1657-1674.
[23] Shin J H, Kim S R, An G. Rice aldehyde dehydrogenase 7 is needed for seed maturation and viability [J]. Plant Physiology, 2009, 149(2): 905-915.
[24] Liu Feng, Cui Xiangqin, Horner H T, et al. Mitochondrial aldehyde dehydrogenase activity is required for male fertility in maize [J]. The Plant Cell, 2001, 13(5): 1063-1078.
[25] Kotchoni S O, Kuhns C, Ditzer A, et al. Over-expression of different aldehyde dehydrogenase genes inArabidopsisthalianaconfers tolerance to abiotic stress and protects plants against lipid peroxidation and oxidative stress [J]. Plant, Cell & Environment, 2006, 29(6): 1033-1048.
[26] Huang Weizao, Ma Xinrong, Wang Qilin, et al. Significant improvement of stress tolerance in tobacco plants by overexpressing a stress-responsive aldehyde dehydrogenase gene from maize (Zeamays) [J]. Plant Molecular Biology, 2008, 68(4/5): 451-463.
[27] Chen Xinbo, Zeng Qin, Wood A J. The stress-responsiveTortularuralisgeneALDH21A1 describes a novel eukaryotic aldehyde dehydrogenase protein family[J]. Journal of Plant Physiology, 2002, 159(7): 677-684.
[28] Kim N H, Hwang B K. Pepper aldehyde dehydrogenase CaALDH1 interacts withXanthomonaseffector AvrBsT and promotes effector-triggered cell death and defence responses [J]. Journal of Experimental Botany, 2015, 66(11): 3367-3380.
[29] Wen Yinqiang, Wang Xiping, Xiao Shunyuan, et al. Ectopic expression ofVpALDH2B4, a novel aldehyde dehydrogenase gene from Chinese wild grapevine (Vitispseudoreticulata), enhances resistance to mildew pathogens and salt stress inArabidopsis[J]. Planta, 2012, 236(2): 525-539.
(责任编辑: 田 喆)
Cloning,expressionandenzymeactivityanalysisofanaldehydedehydrogenasegeneVvALDH10A9ingrapevine
Xing Qikai, Yan Jiye, Zhang Wei, Liu Mei, Fu Chunyuan, Li Xinghong
(InstituteofPlantandEnvironmentalProtection,BeijingAcademyofAgriculturalandForestrySciences,Beijing100097,China)
Botryosphaeria dieback caused by pathogens of the fungal family Botryosphaeriaceae is currently one of the most important trunk diseases in the world’s primary grape production areas. This disease had seriously affected the grape yield and quality. Investigating the genes that play roles in grape-Botryosphaeriaceae interactions helps us understand the defense mechanism in grapevine. In this study, depending on the transcription analysis, an aldehyde dehydrogenase geneVvALDH10A9 was cloned using reverse transcription polymerase chain reaction (RT-PCR) based on the transcriptome information. Phylogenetic analysis ofVvALDH10A9 and other 37 characterized ALDH proteins revealed that VvALDH10A9 was more closely related to AtALDH10A8. Quantitative real-time PCR assays showed thatVvALDH10A9 was preferentially expressed in leaf blades, stem and flower. Additionally,VvALDH10A9 was rapidly induced byLasiodiplodiatheobromaeCSS-01s in susceptible cultivar but not in resistant cultivar. Further analysis indicated that purified VvALDH10A9 protein showed enzyme activities to acetaldehydeinvitro.
grape; Botryosphaeria dieback; aldehyde dehydrogenase;VvALDH10A9; prokaryotic expression

研究报告ResearchReports
S 436.631
: ADOI: 10.3969/j.issn.0529-1542.2017.05.005
2016-10-31
: 2017-01-17
国家葡萄产业技术体系( CARS-30);北京市博士后工作经费;北京市农林科学院博士后基金
* 通信作者 E-mail: lixinghong1962@163.com
