弓形虫微线蛋白16抗原表位区的预测及酵母表面展示
2017-10-09黄炳成魏庆宽
孙 慧,李 瑾,肖 婷,徐 超,尹 昆,黄炳成,雷 战,魏庆宽
DOI:10.3969/j.issn.1002-2694.2017.09.004
弓形虫微线蛋白16抗原表位区的预测及酵母表面展示
孙 慧1,李 瑾1,肖 婷1,徐 超1,尹 昆1,黄炳成1,雷 战2,魏庆宽1
目的应用生物信息学软件预测弓形虫微线蛋白16(TgMIC16)B/T细胞抗原表位并对抗原表位区进行酿酒酵母菌的表面展示。方法利用DNAStar和IEDB对TgMIC16进行B细胞抗原表位预测,利用SYFPEITHI和BIMAS预测其T细胞抗原表位。参照预测结果,采用pCTCON2/EBY100展示系统对抗原表位区进行酵母表面展示,利用间接免疫荧光(IFA)和流式细胞仪检测表达情况。结果TgMIC16存在潜在的B/T细胞抗原表位且集中在aa343-625区域;该抗原表位区成功展示到酵母细胞表面,最佳诱导时间为24~36 h。结论为下一步酵母载体疫苗的研制及疗效评价奠定基础。
酵母细胞表面展示;抗原表位;微线蛋白-16
弓形虫可以感染所有温血动物,引起严重危害人类健康的人兽共患弓形虫病。人类误食被弓形虫卵囊污染的食物、水源或摄取含有弓形虫包囊的未煮熟的肉制品都能引起弓形虫的感染,因此,美国和法国已将弓形虫列为继沙门氏菌和李斯特菌后的第三大食源致死性病原[1-2]。怀孕妇女感染弓形虫,可导致早产、流产、死胎或胎儿致畸(小脑畸形、小眼畸形等)、胎儿脑积水,严重影响新生儿人口素质[3]。
弓形虫入侵宿主细胞是多种蛋白协调作用的结果,在其黏附入侵过程中,伴随着细胞器(微线体、棒状体和致密颗粒)蛋白的顺序释放[4];微线蛋白(Microneme protein, MIC)是首先释放的蛋白,在虫体和宿主细胞间形成移动链接,抑制微线蛋白的表达会严重影响虫体的附着和入侵。以TgMIC1、TgMIC3、TgMIC4和TgMIC6作为候选抗原的DNA疫苗、重组亚单位疫苗已有报道[5-8],制备的各类型的疫苗能激发一定的特异性细胞免疫和体液免疫,在抗弓形虫感染试验中,各种疫苗虽然仅能提供部分免疫保护、延迟攻虫小鼠的死亡,但仍然为弓形虫的免疫预防提供了新方向。TgMIC16是近年来新发现的一种微线蛋白,以其作为候选抗原的基因工程疫苗未见报道。
筛选合适的疫苗递送系统对基因工程疫苗的制备显得尤为重要,酵母菌具有天然的抗菌、抗炎症和中和毒素的功能,能够刺激机体的天然免疫;酵母载体疫苗在抗菌、抗病毒的防治研究中具有良好的应用前景[9]。目前,酵母载体疫苗在弓形虫的免疫预防中未见报道。本研究基于酵母表面展示系统,筛选TgMIC16的B/T细胞抗原表位并对该功能区进行酵母表达,间接免疫荧光和流式细胞仪检测表明该功能区蛋白成功表达,为下一步酵母载体疫苗的研制及疗效评价奠定基础。
1 材料与方法
1.1 载体与菌株 酵母展示质粒pCTCON2和酿酒酵母株EBY100[MATaGAL1-AGA1::URA3ura3-52trp1leu2Δ1his3Δ200pep4::HIS2prb1Δ1.6Rcan1GAL]由山东农业大学赵孝民教授馈赠;大肠杆菌(E.coli)感受态细胞TOP10由本实验室保存。
1.2 主要试剂 限制性内切酶(NheI/BamHI)、T4 DNA连接酶购自TaKaRa公司;胶回收试剂盒、质粒DNA提取试剂盒购自北京全式金有限公司;FITC标记羊抗兔IgG (H+L)购自北京博森生物科技有限公司;兔源TgMIC16多抗由本实验室制备。
1.3 B/T细胞抗原表位预测 利用DNAStar和IEDB(http://tools.iedb.org/bcell/)预测TgMIC16的B细胞抗原表位,利用BIMAS(https://www-bimas.cit.nih.gov)和SYFPEITHI(http://www.syfpeithi.de/bin/MHCServer.dll/EpitopePrediction.htm)预测其T细胞抗原表位。
1.4 TgMIC16抗原表位区的PCR扩增 以前期构建的pET28a-TgMIC16为模板[10],P1: 5′-CCCGCTAGCCGTTTCTGTCCC-3′和P2: 5′-CCCGGATCCGCTTTCTTCGCA-3′为引物进行PCR扩增,目的片段为855bp,下划线部分为NheI和BamHI酶切位点。
1.5 酵母表达载体pCTCON2-TgMIC16T的构建 将纯化的PCR产物和酵母表达载体pCTCON2分别进行NheI/BamHI双酶切,于16 ℃连接1.5 h后转化TOP10感受态细胞。筛选阳性克隆命名为pCTCON2-TgMIC16T。
1.6 酵母细胞的转化 利用醋酸锂法进行酵母转化,挑取EBY100单菌落于3 mL YPD液体培养基30 ℃过夜培养;按照1∶100的比例接种于10 mL新鲜YPD液体中,30 ℃培养至OD600约0.5左右,回收菌体;分别用2 mL灭菌水、1 mL 1.1×TE/LiAC洗菌体1遍,离心5 min;300μL 1.1×TE/LiAC重悬沉淀,分装50 μL/管,即为酵母菌感受态;每管感受态分别加入5 μL pCTCON2-TgMIC16T和pCTCON2,轻轻混匀,30 ℃孵育30 min;每管加入1 mL 40% PEG3350,42 ℃水浴中,热激15 min;离心弃上清;加入1 mL YPD液体培养基,30 ℃孵育2 h,涂布于SD/-Trp筛选平板,30 ℃培养2~3 d。
1.7 酵母表面展示TgMIC16 挑取单菌落EBY100/pCTCON2-TgMIC16T和EBY100/pCTCON2于10 mL SDCAA培养基(0.67% YNB,0.5% Casein acids Hydrolysate,2%葡萄糖)中30 ℃培养至OD600约2左右,收集菌体转移至50 mL SGCAA培养基(0.67% YNB, 0.5% Casein acids Hydrolysate,2%半乳糖)中,调整菌液浓度OD600约为0.8左右,于28 ℃诱导至72 h,分别于诱导后12 h、24 h、36 h、48 h吸取1.0 mL菌液,离心后-80 ℃保存备用。
1.8 间接免疫荧光(IFA)鉴定 预冷PBS洗涤菌体;2% BSA37 ℃封闭30 min;100μL 1∶800稀释的兔源TgMIC16多抗,4 ℃孵育2 h;PBS洗涤后,100μL 1∶200稀释的FITC标记的羊抗兔IgG(G+L),避光孵育1 h;1 mL预冷PBS洗涤菌体2遍,荧光显微镜观察。
1.9 流式细胞仪检测 将免疫荧光染色的EBY100/pCTCON2-TgMIC16T和EBY100/pCTCON2细胞,用300μL PBS重悬,300目筛网过滤后,进行流式细胞仪检测。
2 结 果
2.1 B细胞抗原表位预测结果 采用IEDB在线预测B细胞线性表位,我们将阈值上调至0.5,由图1A可见,线性表位区集中在aa340~580之间,采用DNAStar对TgMIC16的亲水区、蛋白表面可能性以及表面抗原指数进行预测,分值较高的区域集中在aa450~625(图1B)。

A. Prediction of IEDB,B. Prediction of DNAStar图1 IEDB 和 DNAStar预测B细胞表位结果Fig.1 Prediction of B cell epitope using IEDB and DNAStar
2.2 T细胞抗原表位预测结果 采用在线软件BIMAS和SYFPEITHI对TgMIC16进行T细胞表位预测,分别选取了两者预测结果中分值较高的17个抗原表位(表1,2),统计两个软件高分值的相同区域共计7个(aa13~21、aa61~69、aa315~323、aa413~421、aa415~423、aa467~475、aa485~493),其中,有4个T细胞抗原表位(aa413~421、aa415~423、aa467~475、aa485~493)存在于B细胞抗原表位集中区域。基于B/T细胞抗原表位区预测结果和保持TSR功能区的完整性考虑,我们选取aa343~625进行下一步的蛋白表达。
2.3 TgMIC16T的PCR扩增及pCTCON2-TgMIC16T酶切鉴定结果 PCR 扩增产物经1%琼脂糖凝胶电泳检测得到约1 000 bp的条带,与预期的855 bp的理论值相符(图2)。利用NheI/BamHI双酶切鉴定pCTCON2-TgMIC16T,电泳结果表明,重组质粒pCTCON2-TgMIC16T构建成功(图2)。

1:PCR product of TgMIC16T 2:pCTCON2-TgMIC16T digested with NheⅠand BamHⅠ M:Trans 5K DNA marker图2 TgMIC16T的PCR扩增及pCTCON2-TgMIC16T酶切结果Fig.2 Amplification of TgMIC16T and digestion identification of pCTCON2-TgMIC16T
表1 BIMAS 预测的T细胞表位
Tab.1 Prediction of T cell epitope using BIMAS
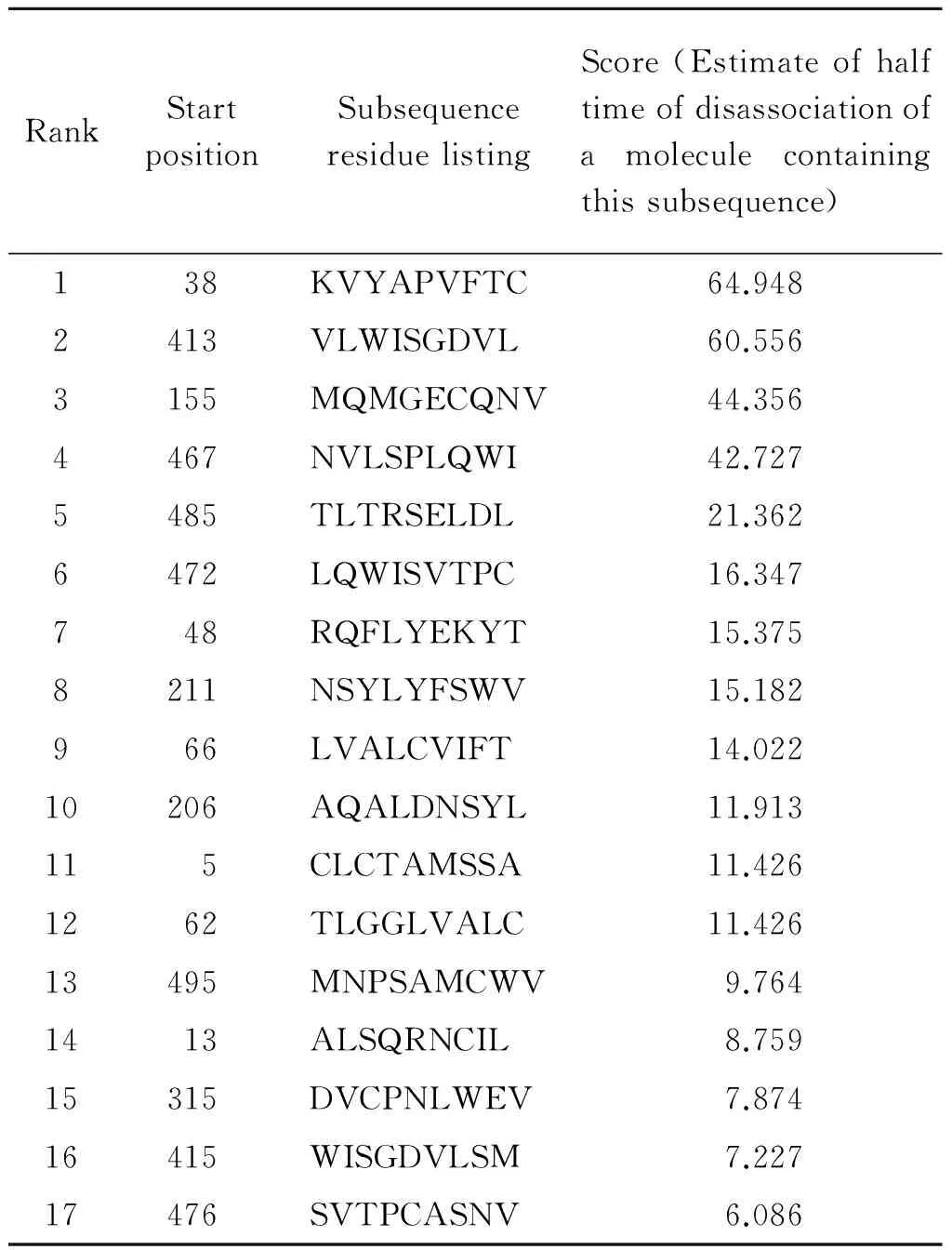
RankStartpositionSubsequenceresiduelistingScore(Estimateofhalftimeofdisassociationofamoleculecontainingthissubsequence)138KVYAPVFTC64.9482413VLWISGDVL60.5563155MQMGECQNV44.3564467NVLSPLQWI42.7275485TLTRSELDL21.3626472LQWISVTPC16.347748RQFLYEKYT15.3758211NSYLYFSWV15.182966LVALCVIFT14.02210206AQALDNSYL11.913115CLCTAMSSA11.4261262TLGGLVALC11.42613495MNPSAMCWV9.7641413ALSQRNCIL8.75915315DVCPNLWEV7.87416415WISGDVLSM7.22717476SVTPCASNV6.086
表2 SYFPEITHI 预测的T细胞表位
Tab. 2 Prediction of T cell epitope using SYFPEITHI

RankStartPositionSubsequenceresiduelistingScore161TTLGGLVAL27213ALSQRNCIL223413VLWISGDVL224315DVCPNLWEV215415WISGDVLSM216485TLTRSELDL20762TLGGLVALC19890SDLSPPATV199138IRFPNQASV1910243DVEDCLVDV1911467NVLSPLQWI1912566FVSCGTGCV191355YTRRRCTTL1814162NVYWGKKEL1815289GVKGRFREL1816397ILNPLHACP1817546SCASSEVSL18
2.4 IFA鉴定结果 从蛋白诱导表达开始每隔12 h取样进行IFA鉴定。结果表明,EBY100/pCTCON2-TgMIC16T诱导12 h后有点状绿色荧光散在出现,24~36 h整个酵母细胞表面呈亮绿色荧光(图3),此后,随着表达时间的延长,荧光的强度逐渐减弱。
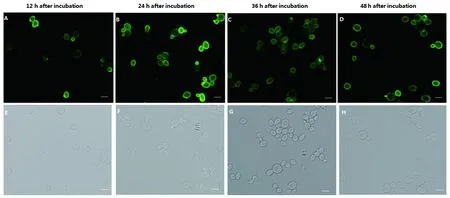
A-D: EBY100/pCTCON2-TgMIC16T under FITC filter from 12 h to 72 h after induced expressionE-H: EBY100/pCTCON2-TgMIC16T under normal white light from 12 h to72h after induced expression 图3 EBY100/pCTCON2-TgMIC16T的IFA鉴定结果Fig.3 Indirect immunofluorescence detection of EBY100/pCTCON2-TgMIC16T
2.5 流式细胞仪鉴定结果 利用流式细胞仪进一步检测EBY100/pCTCON2-TgMIC16T的表达。结果显示,在诱导表达后24 h和36 h的展示效率高于12 h和48 h,与IFA鉴定结果一致。
3 讨 论
抗原表位,又称抗原决定基或抗原决定簇(antigenic determinant,AD)指抗原分子中决定抗原特异性的特殊化学基团[11]。抗原通过抗原表位与相应的抗体或淋巴细胞表面的抗原受体结合,从而引起免疫应答。表位既然是蛋白抗原可产生免疫性的最小区域,因此在疫苗制备中为提高蛋白的免疫原性往往需要筛选候选抗原的抗原表位。随着生物信息学的发展和结构数据库的不断更新,计算机虚拟预测筛选抗原表位逐渐代替了传统的表位筛选[12]。
细胞表面展示技术是指利用DNA重组技术将外源蛋白定位表达于细胞表面。多数的生物技术都经历了从原核生物到真核生物的发展应用,该技术从噬菌体表面展示发展到细菌表面展示、再到现在的酵母菌表面展示,经历了一系列的技术变革[13]。酵母菌被公认为是安全的且广泛应用于食品制造业和制药业,抗体可以识别酵母表面表达的外源抗原表位并与之特异地结合[14],能有效地诱导抗原特异性的免疫应答;本研究将筛选的TgMIC16抗原表位区展示在酵母菌表面,IFA和流式细胞仪检测表明,外源蛋白从诱导12 h后开始表达,诱导24 h和36 h的表达效率高于12 h和72 h。本研究为后续构建抗原表位疫苗及免疫诊断奠定实验基础。
[1] Saouros S, Dou Z, Henry M, et al. Microneme protein 5 regulates the activity ofToxoplasmasubtilisin 1 by mimicking a subtilisin prodomain[J]. J Biol Chem, 2012, 287(43): 36029-36040. DOI: 10.1074/jbc.M112.389825
[2] Wang T, Tang ZH. Toxoplasmosis: tHe spread of tachyzoites, cysts and oocysts[J]. Chin J Zoonoses, 2012, 28(11): 1133-1136. (in Chinese)
汪涛,汤自豪. 弓形虫病:速殖子、包囊和卵囊的传播[J]. 中国人兽共患病学报, 2012, (11):1133-1136.
[3] Torrey EF, Bartko JJ, Yolken RH.Toxoplasmagondiiand other risk factors for schizophrenia: an update[J]. Schizophr Bull, 2012, 38(3): 642-647. DOI: 10.1093/schbul/sbs043
[4] Hoff EF, Cook SH, Sherman GD, et al.Toxoplasmagondii: molecular cloning and characterization of a novel 18-kDa secretory antigen, TgMIC10[J]. Exp Parasitol, 2001, 97(2): 77-88. DOI:10.1006/expr.2000.4585
[5] Lourenco EV, Bernardes ES, Silva NM, et al. Immunization with MIC1 and MIC4 induces protective immunity againstToxoplasmagondii[J]. Microbes Infect, 2006, 8: 1244-1251. DOI:10.1016/j.micinf.2005.11.013
[6] Fang R, Nie H, Wang ZS, et al. Protective immune response in BALB/c mice induced by a suicidal DNA vaccine of the MIC3 gene ofToxoplasmagondii[J]. Vet Parasitol, 2009, 164: 134-140. DOI: 10.1016/j.vetpar.2009.06.012
[7] Peng GH, Yuan ZG, Zhou DH, et al.Toxoplasmagondiimicroneme protein 6 (MIC6) is a potential vaccine candidate against toxoplasmosis in mice[J]. Vaccine, 2009, 27: 6570-6574. DOI: 10.1016/j.vaccine.2009.08.043
[8] Liu MM, Yuan ZG, Peng GH, et al.Toxoplasmagondiimicroneme protein 8 (MIC8) is a potential vaccine candidate against toxoplasmosis[J]. Parasitol Res, 2010, 106: 1079-1084. DOI: 10.1007/s00436-010-1742-0
[9] Shin MK, Yoo HS. Animal vaccines based on orally presented yeast recombinants[J]. Vaccine, 2013, 31(40): 4287-4292. DOI: 10.1016/j.vaccine.2013.07.029
[10] Li J, Cui Y, Yin K, et al. Prokaryotic expression, purification and immunological characterization of micronemal protein 16 oftoxoplamagondii[J]. Chin J Parasitol Parasit Dis, 2016, 34(3): 198-202. (in Chinese)
李瑾,崔勇,尹昆,等. 刚地弓形虫微线蛋白16基因片段原核表达、纯化及免疫反应性分析[J]. 中国寄生虫学与寄生虫病杂志, 2016, 34(3):198-202.
[11] Li YJ, Wang J, Zhao H, et al. Bioinformatics prediction on eg95 antigen epitopes ofEchinococcusgranulosus[J]. Chin J Zoonoses, 2011, 27(10): 892-896, 900. (in Chinese)
李玉娇,王晶,赵慧,等. 细粒棘球绦虫Eg95抗原表位的生物信息学预测[J]. 中国人兽共患病学报,2011,(10):892-896,900.
[12] He SW, Wei XX. Prediction of epitopes of the myophilin protein fromEchinococcusgranulosus[J]. J Pathog Biol, 2017, 12(1): 42-45,50. (in Chinese)
何顺伟,魏晓星. 细粒棘球绦虫myophilin的抗原表位预测[J]. 中国病原生物学杂志,2017,(01):42-45,50.
[13] Lee SY, Choi JH, Xu Z. Microbial cell-surface display[J]. Trends Biotechnol, 2003, 21(1): 45-52. DOI: 10.1016/S0167-7799(02)00006-9
[14] Boder ET, Wittrup KD. Yeast surface display for screening combinatorial polypeptide libraries[J]. Nat Biotechnol, 1997, 15: 553-557. DOI: 10.1038/nbt0697-553
PredictionandyeastsurfacedisplayofantigenicepitoperegionofTgMIC16ofToxoplasmagondii
SUN Hui1, LI Jin1, XIAO Ting1, XU Chao1, YIN Kun1, HUANG Bing-cheng1, LEI Zhan2,WEI Qing-kuan1
(1.ShandongAcademyofMedicalSciences,ShandongInstituteofParasiticDiseases,Jining272033,China;2.ShandongAcademyofMedicalSciences,ShandongLaboratoryAnimalCenter,Jinan250000,China)
The bioinformatics software was used to predict the B cell and T cell epitopes ofToxoplasmagondiimicroneme 16 (TgMIC16) followed by epitopes display on the yeast ofSaccharomycescerevisiae. B and T cell epitopes of TgMIC16 were predicted by DNAStar and IEDB, and software of SYFPEITHI and BIMAS, respectively. According to the predicted results, the antigenic epitope region was expressed with pCTCON2/EBY100 display system. The expression protein was detected by indirect immunofluorescence (IFA) and flow cytometry. Results showed that there were potential B/T cell epitopes in TgMIC16 and concentrated in the aa343-625 region. The epitope region was successfully displayed on the surface of yeast cells, and the optimal induction time was 24 hours. The study would lay the foundation for the development and efficacy evaluation of the yeast carrier vaccine in the further research.
yeast surface display; antigen epitope; microneme protein-16
Wei Qing-kuan, Email: wqkzlj@sina.com
国家自然科学基金(No. 81501770);山东省自然科学基金(No. ZR2015YL051, No. ZR2015YL033, No ZR2016CP18);山东省医学科学院医药卫生科技创新工程
魏庆宽,Email: wqkzlj@sina.com
1.山东省医学科学院,山东省寄生虫病防治研究所,济宁 272033; 2.山东省医学科学院,山东省实验动物中心,济南 250000
R382.5
:A
:1002-2694(2017)09-0774-05
2017-04-20编辑:刘岱伟
Supported by the National Natural Science Foundation of China (No. 81501770), the Shandong Natural Science Foundation (Nos. ZR2015YL051, ZR2015YL033 and ZR2016CP18), and the Innovation Project of Shandong Academy of Medical Sciences
