差异光周期下野牛草相连分株内源激素的日节律
2017-09-29钱永强孙振元
李 伟,钱永强,韩 蕾,孙振元
(1.中国林业科学研究院林业研究所,国家林业局林木培育重点实验室,北京 100091;2.青岛农业大学园林与林学院,山东 青岛 266109)
差异光周期下野牛草相连分株内源激素的日节律
李 伟1,2,钱永强1,韩 蕾1,孙振元1
(1.中国林业科学研究院林业研究所,国家林业局林木培育重点实验室,北京 100091;2.青岛农业大学园林与林学院,山东 青岛 266109)
为了分析野牛草(Buchloedactyloides)相连克隆分株在差异光周期下内源激素的变化,利用酶联免疫吸附测定法(ELISA)对野牛草相连克隆分株在相反光照条件下的植物内源激素生长素(IAA)、赤霉素(GA)、脱落酸(ABA)、玉米素核苷(ZR)含量进行了测定,探讨植物内源激素在生物节律调控过程中的作用机理。结果表明,野牛草内源激素IAA、GA、ABA及ZR含量在一天内呈现节律性变化规律,同时,在差异光周期下,野牛草相连克隆分株叶片的内源激素水平趋向于同步化,并且倾向于内源生物节律较强的分株。其中,差异光周期处理1周后,在全光照条件下,野牛草克隆分株在断开状态时,叶片中IAA、GA、ABA及ZR含量在24 h内基本呈现相反的变化趋势,而野牛草克隆分株叶片中IAA、GA、ABA及ZR含量在24 h内的变化趋于一致。
野牛草;相连分株;差异光周期;内源激素;节律同步化
生物钟是生物体内部的“计时”系统,驱动着生物体的生命活动以约24 h的周期节律性振荡。作为生物体的内源性调节机制,生物钟调控生物体内部的生物学过程与外界周期性的昼夜交替相互协调[1]。生物钟在很大程度上取决于每天的光/暗振荡,即授时因子(zeitgeber,ZT)。迄今为止,生物钟至少进化了4次[2],因此它提供了一种选择性的优势,使得生物体能够预测环境的节律性变化,增强了对环境的适应性。
植物生物钟通过门控(clock-dependent gating)机制预测黎明和黄昏信号以及环境中的其它日变化,从而最大限度地提高了代谢效率[3-5],同时植物生物钟系统通过控制基因表达、激素调控、气孔开放和光周期现象等的节律性振荡[6-7],实时监测周围的环境,使其进化出广泛感知周围环境响应的机制,从而增加了植物对不断变化的外界条件的适应性。植物激素是一类简单小分子有机化合物,对植物的生长发育具有重要的调节作用。同时,植物对环境因子的响应也主要依赖激素调控网络。这些植物激素主要包括细胞分裂素(CTK)、生长素(IAA)、脱落酸(ABA)、赤霉素(GA)等[8-9],前人的研究发现,采用赤霉素(GA3)、吲哚丙酸(IBA)等激素可打破纳罗克非洲狗尾草(Setariasphacelatacv. Narok)种子休眠,促进种子萌发和幼苗生长[10]。并且激素引发作用还可以有效改善种子的萌发状态,提高植物的抗逆性[11]。单个激素能调节多个生物学过程,同样,多个激素之间也存在着交互作用,如光照信号的交替能够改变CTK、ABA、GA等的水平,从而导致一系列生理响应。在整个植物的生长发育过程中,生物钟介导很多植物激素发挥作用[12-13],其中生物钟调节生长素的运输和响应[14],而CTK、IAA和ABA在昼夜交替的条件下发生不同水平的积累[15]。研究表明,拟南芥(Arabidopsisthaliana)生物钟基因PIF4(phytochrome-interacting factor 4)和PIF5调节了几种生长素诱导基因的表达,而这一过程则依赖光周期发生[16]。GA受光线和生物钟的调控[17-18],光照直接调节GA的生物合成[19],同时在植物的光形态建成、细胞延伸等过程中发挥作用[20]。有证据表明,ABA信号途径也受到植物内源生物节律的调控[4-5,13],而光照则直接诱导ABA的降解[21]。激素突变体中玉米素核苷(ZR)水平的下降表明光对细胞分裂素的积累具有积极的作用[22],在大麦(Hordeumvulgare)[23]和胡萝卜(Daucuscarota)[24]中也发现细胞分裂素呈现昼夜波动现象。由此可见,生物钟在激素调节通路中发挥着重要作用,反之,植物激素信号网络则反作用于生物钟,将不同的代谢信号和外界环境信号传递给内源生物钟系统[13,25-28],进而形成一个复杂的调控网络。
野牛草(Buchloedactyloides)为禾本科野牛草属植物,原产于北美大平原的半干旱地区,具有极强的抗逆性和再生能力,广泛用于水土保持及园林绿化,同时,野牛草是一种典型的匍匐茎克隆植物,通过其克隆生长形成大量的匍匐茎和相对独立的同基因型克隆分株,实现地面均匀覆盖,且相连克隆分株间通过节间子的连接,实现了水分、矿质营养、能量等的传递与共享,即生理整合[29-30]。因此,本研究拟以野牛草相连克隆分株为材料,研究差异光周期下野牛草相连克隆分株内源激素的变化规律,以期证明内源激素在生物节律调控过程中的作用,为进一步揭示克隆分株间生理整合作用及生物节律调控机理提供依据。
1 材料与方法
1.1试验材料
试验于中国林业科学研究院林业研究所的光照培养箱中进行。野牛草幼苗来自于一粒种子萌发后产生的无性繁殖群体,保证了所用试验材料基因型完全相同。从中选取长势基本一致的相连克隆分株, 移栽于装有基质(草炭土中加入适量鸡粪)的营养钵内(直径为7 cm,高度为8 cm),相连克隆分株分别种植于两个钵内,中间由节间子相连,在光照培养箱中培养。培养条件为:光照/黑暗=12 h/12 h,白天和夜晚的温度分别为25 ℃/20 ℃,湿度为70%,培养箱室内光照强度约为200 μmol·(m2·s)-1。每隔3 d每钵浇水50 mL,保证其正常生长。预培养4周,当相连克隆分株生长状态一致时, 进行差异光周期处理。
1.2光周期处理
培养4周后的野牛草相连克隆分株进行差异光周期处理,野牛草相连克隆分株标记为O(O分株Old ranet)和Y(Y分株Young),试验设置为连接组和断开组(图1)。连接组野牛草O和Y分株通过节间子相连,O分株光周期设置为光照/黑暗=12 h/12 h,Y分株光周期设置为黑暗/光照=12 h/12 h(恰好与O分株相反),断开组O和Y分株光周期设置同连接组,但O和Y分株间的节间子被剪断,光照培养箱的温度、湿度和光照强度同前文1.1所示。连接组和断开组样本经过7 d的光周期处理后进行3 d全光照条件(24 h光照)稳定培养,为了保证取样条件的一致,随后在全光照条件下48 h内每隔4 h取叶片,取样时间分别为08:00、12:00、16:00、20:00,次日00:00、次日04:00,次日08:00、次日12:00、次日16:00、次日20:00,第3天00:00、第3天04:00、第3天08:00,所有样本液氮速冻后保存于-80 ℃备用。
1.3激素提取
取0.2 g新鲜野牛草叶片[若取样后材料不能马上测定,用液氮速冻后保存于-20 ℃,加2 mL样品提取液,提取液为50 mmol·L-1、pH 7.8的磷酸缓冲(PBS)溶液,内含1%的聚乙烯吡咯烷酮(PVP)],在冰浴下研磨成匀浆,转入10 mL试管,再用2 mL提取液分次将研钵冲洗干净,一并转入试管中,摇匀后放置在4 ℃冰箱提取4 h,在3 000 r·min-1离心15 min, 取上清液。沉淀中加1 mL提取液,搅匀,置4 ℃下再提取1 h,离心,合并上清液并记录体积,残渣弃去;上清液过C-18固相萃取柱。具体步骤是:80%甲醇(1 mL)平衡柱→上样→收集样品→移开样品后用100%甲醇(5 mL)洗柱→100%乙醚(5 mL)洗柱→100%甲醇(5 mL)洗柱→循环;将过柱后的样品转入5 mL塑料离心管中,真空浓缩干燥或用氮气吹干,除去提取液中的甲醇,用样品稀释液定容[样品稀释液为500 mL PBS中加0.5 mL Tween-20,0.5 g明胶(稍加热溶解)]。
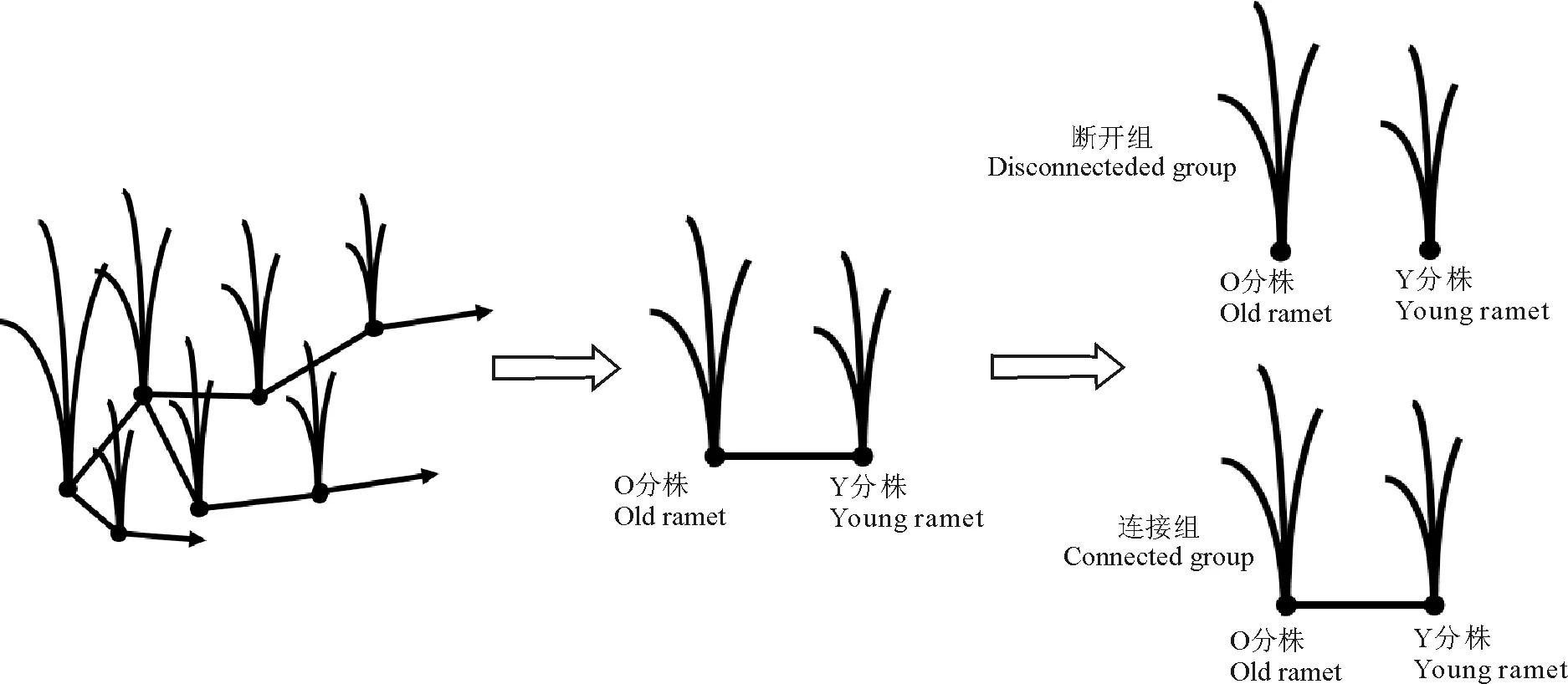
图1 野牛草不同光暗周期处理示意图Fig. 1 Schematic diagram of Buchloe dactyloides under different photoperiods
1.4指标测定及方法
运用酶联免疫吸附测定法(ELISA)测定IAA、GA、ABA及ZR共4种植物内源激素的含量,试剂盒由中国农业大学提供,具体测试方法参照试剂盒说明书进行。每个样品重复测定3次。内源激素的测定结果采用Logit 曲线方法进行计算。采用Excel 2007与SigmaPlot 10.0程序对数据进行处理并绘制数据图。应用SPSS软件对数据进行单因素方差分析(ANOVA),利用Duncan多重比较对差异显著性进行分析,P<0.05表示差异显著。
2 结果
2.1野牛草内源IAA含量的变化
差异光周期处理下,野牛草克隆分株中IAA含量的变化如图2所示,断开组中(图2A),经过1周的正置光周期(光照/黑暗=12 h/12 h)处理后,O分株中IAA含量在第1个24 h周期内呈现近余弦的波形,在第2个24 h周期内呈现近正弦的波形,并分别在测定第1天的24:00和测定第2天的16:00时达到波峰,含量分别为61.50和61.86 ng·g-1,而经过4周的倒置光周期(黑暗/光照=12 h/12 h)处理后,Y分株中IAA含量整体的变化趋势与O分株是相反的,在第1个24 h周期内呈现近正弦的波形,在第2个24 h周期内呈现近余弦的波形,并分别在测定第1天的24:00和测定第2天的12:00时降到波谷,含量分别为42.87和43.73 ng·g-1;在连接组中(图2B),相连克隆分株分别经过相反的光周期处理后(即O分株处于正置光周期,Y分株处于反置光周期),O分株IAA含量变化呈现近余弦的波形,并在测定第1天的08:00、测定第1天的20:00和测定第2天的12:00时达到波峰,含量为79.31、78.49和74.65 ng·g-1,Y分株IAA含量在24 h内的整体变化与O分株趋于基本一致,IAA含量变化也是呈现近余弦的波形,并在测定第1天的08:00、测定第1天的24:00和测定第2天的12:00时达到波峰,分别为77.11、76.43和75.79 ng·g-1。差异光周期处理对断开组与连接组中的O分株与Y分株的叶片IAA含量均有显著影响(P<0.05)。
2.2野牛草内源ABA含量变化
差异光周期处理下,野牛草克隆分株中ABA含量的变化如图3所示,断开组中(图3A),经过4周的正置光周期(光照/黑暗=12 h/12 h)处理后,O分株中ABA含量在24 h周期内基本呈现近余弦的波形,并分别在测定第1天的08:00和测定第2天的04:00、20:00时达到波峰,含量分别为8.10、6.80和6.43 ng·g-1,而经过4周的倒置光周期(黑暗/光照=12 h/12 h)处理后,Y分株中ABA含量整体的变化趋势与O分株是相反的,在24 h周期内呈现近正弦的波形,并分别在测定第1天的12:00、第2天的04:00和20:00时降到波谷,含量分别为4.57、5.71和4.74 ng·g-1;在连接组中(图3B),相连克隆分株分别经过相反的光周期处理后(即O分株处于正置光周期,Y分株处于反置光周期),O分株ABA含量变化呈现近正弦的波形,并在测定第1天的16:00、测定第2天的04:00和16:00时达到波峰,含量分别为11.16、11.56和12.70 ng·g-1,Y分株ABA含量在24 h内的整体变化与O分株趋于基本一致,ABA含量变化也是呈现近正弦的波形,并在测定第1天的16:00、测定第2天的04:00 和20:00时达到波峰,分别为11.09、11.25和13.05 ng·g-1。差异光周期处理对断开组与连接组中的O分株与Y分株的叶片ABA含量均有显著影响(P<0.05)。
2.3野牛草内源GA含量变化
差异光周期处理下,野牛草克隆分株中GA含量的变化如图4所示,断开组中(图4A),经过4周的正置光周期(光照/黑暗=12 h/12 h)处理后,O分株中GA含量在24 h内呈现近正弦的波形,并在测定第1天的16:00 和测定第2天的20:00时达到波峰,含量分别为11.04和11.07 ng·g-1,而经过4周的倒置光周期(黑暗/光照=12 h/12 h)处理后,Y分株中GA含量整体的变化趋势与O分株是相反的,24 h内基本上呈现近余弦的波形,并在测定第1天的16:00和测定第2天的12:00时降到波谷,含量为8.64和9.47 ng·g-1;而在连接组中(图4B),相连克隆分株分别经过相反的光周期处理后(即O分株处于正置光周期,Y分株处于反置光周期),O分株GA含量变化呈现近正弦的波形,并在测定第1天的16:00 和测定第2天的16:00时达到波峰,含量分别为9.16和9.89 ng·g-1,Y分株GA含量在24 h内的整体变化与O分株趋于基本一致,GA含量变化也是呈现近正弦的波形,并在测定第1天的20:00 和测定第2天的20:00时达到波峰,分别为9.58和11.80 ng·g-1。差异光周期处理对断开组与连接组中的O分株与Y分株的叶片GA含量均有显著影响(P<0.05)。

图2 差异光周期下野牛草克隆分株生长素IAA含量的日变化Fig. 2 Diurnal changes on IAA content of Buchloe dactyloides under different photoperiod treatments
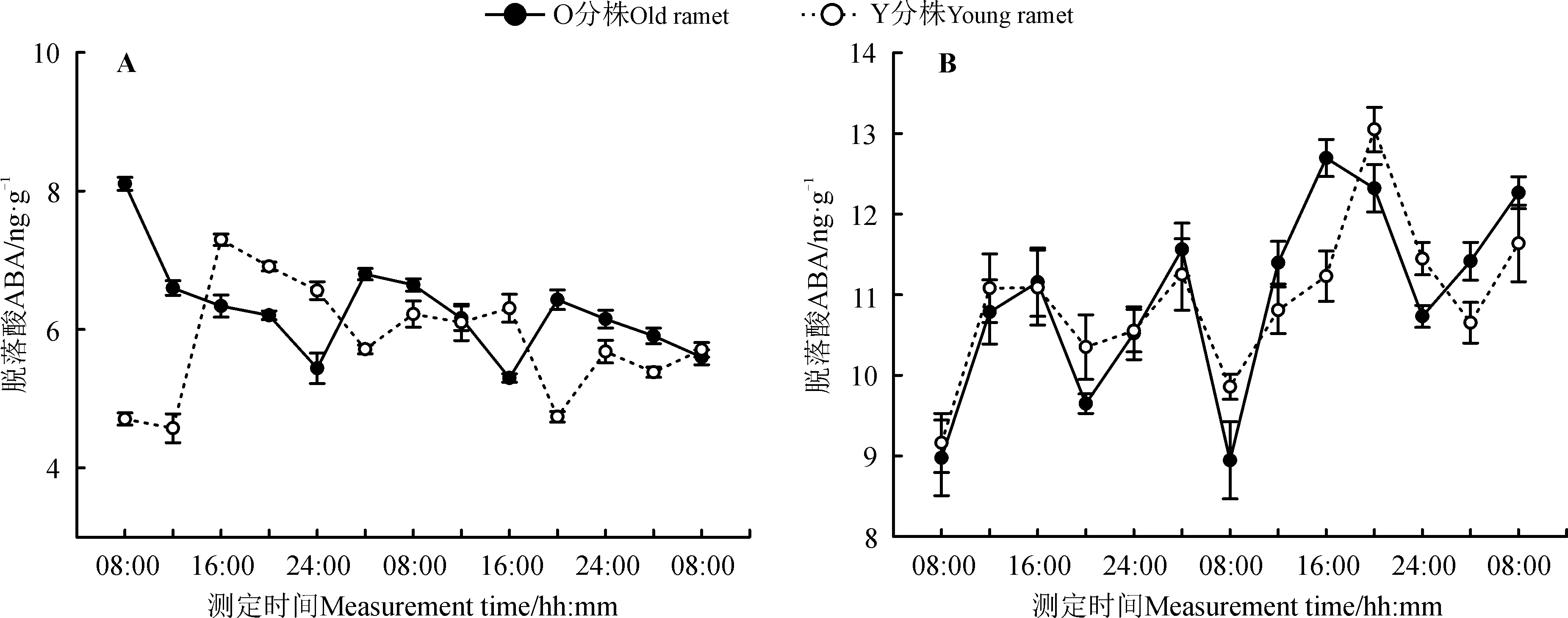
图3 差异光周期下野牛草克隆分株脱落酸ABA含量的日变化Fig. 3 Diurnal changes on ABA content of Buchloe dactyloides under different photoperiod treatments
2.4野牛草内源ZR含量变化
差异光周期处理下,野牛草克隆分株中ZR含量的变化如图5所示,断开组中(图5A),经过4周的正置光周期(光照/黑暗=12 h/12 h)处理后,O分株中ZR含量在第1个24 h周期内呈现近正弦的波形,在第2个24 h周期内呈现近余弦的波形,并分别在测定第1天的12:00和第2天的04:00、20:00时达到波峰,含量分别为10.56、10.86和9.49 ng·g-1,而经过4周的倒置光周期(黑暗/光照=12 h/12 h)处理后,Y分株中ZR含量整体的变化趋势与O分株是相反的,在第1个24 h周期内呈现近余弦的波形,在第2个24 h周期内呈现近正弦的波形,并分别在测定第1天的12:00、测定第2天的16:00和测定第3天的08:00降到波谷,含量分别为7.11、7.62和7.75 ng·g-1;在连接组中(图5B),相连克隆分株分别经过相反的光周期处理后(即O分株处于正置光周期,Y分株处于反置光周期),O分株ZR含量变化呈现近正弦的波形,并在测定第1天的20:00和测定第2天的16:00时达到波峰,含量为14.45和14.90 ng·g-1,Y分株ZR含量在24 h内的整体变化与O分株趋于基本一致,ZR含量变化也是呈现近正弦的波形,并在测定第1天的16:00和测定第2天的20:00时达到波峰,分别为13.76和14.82 ng·g-1。差异光周期处理对断开组与连接组中O分株与Y分株叶片ZR含量均有显著影响(P<0.05)。

图4 差异光周期下野牛草克隆分株赤霉素GA含量的日变化Fig. 4 Diurnal changes on GA content of Buchloe dactyloides under different photoperiod treatments

图5 差异光周期下野牛草克隆分株玉米素核苷(ZR)含量的日变化Fig. 5 Diurnal changes on ZR content of Buchloe dactyloides under different photoperiod treatments
3 讨论与结论
各种不同的环境因子,如光照条件、温度、非生物逆境等,调节了一系列植物内源激素,反之,这些激素广泛参与了植物的生理过程,确保了植物对变化的环境条件的最大适应性[9]。本研究发现:1)野牛草内源激素在一天内呈现节律性变化规律;2)断开组的野牛草克隆分株分别在正置光周期(光照/黑暗=12 h/12 h)和反置光周期(黑暗/光照=12 h/12 h)下,内源激素的变化呈现相反的趋势;3)连接组的野牛草分株分别在正置光周期和反置光周期下,内源激素的变化呈现同步化趋势;4)野牛草相连克隆分株内源激素在同步化过程中,除ABA外,IAA、GA和ZR的变化趋势都倾向于O分株,可以推测,由于O分株的光周期与预培养阶段是完全一致的,因此在差异光周期处理阶段,O分株的内源生物节律被进一步强化,而Y分株处于和预培养阶段完全相反的光周期条件,Y分株内部的已经稳定的生物节律在一定程度上被弱化,因此,在相连分株存在生理整合的前提下,相连分株的节律最终会趋于节律更加强化的O分株。
此外,研究中还发现,ABA的峰值基本上位于光周期的黑暗阶段(图3),这与Tallman[3]的研究结果一致,他认为ABA在黑暗中合成是为了保证气孔处于关闭状态,从而确保植物在夜间能最大程度复水(rehydration);相反,在光照开始后,ABA浓度大幅度下降,这表明ABA分解代谢过程被激活[31];IAA在中午左右达到峰值(图2),这点与Pavlová和Knekule[32]在红叶藜(Chenopodiumrubrum)中发现的结果基本一致;同时,本研究显示,ZR的峰值出现在白天(图5),而细胞分裂素在白天浓度较高是由于根中细胞分裂素的合成作用[33],白天细胞分裂素促进叶片的细胞分裂以及调节气孔导度,也作为一个信号分子,传递到植物的其它部分(如开花诱导)[34],或者诱导细胞分裂素响应基因的表达[35],而这些基因的丰度在白天表达量最高,同时呈现节律性振荡[36]。然而,植物在黑暗条件下,呼吸作用加强,翟晓朦等[37]发现,CO2浓度越高,秋眠型苜蓿(Medicagosativa)叶片中内源IAA、GA3含量越高,而ABA含量越低。
本研究结果表明,野牛草中IAA、ABA、GA和ZR 的表达水平在一天内并非维持在一个恒定的水平,而是呈现节律性振荡;同时,在差异光周期条件下,野牛草相连克隆分株间IAA、ABA、GA和ZR 的表达水平趋于同步化,并且倾向于内源生物节律较强的分株。因此,植物内源激素与植物生长发育的日变化密切相关,并且对植物生物节律具有一定的调节作用。
References:
[1] Lumsden P J,Millar A J.Biological rhythms and photoperiodism in plants.Quarterly Review of Biology.Oxford,Washington DC:BIOS Scientific Publishers,1998.
[2] Young M W,Kay S A.Time zones:A comparative genetics of circadian clocks.Nature Reviews Genetics,2001,2(9):702-705.
[3] Webb A A R.The physiology of circadian rhythms in plants.New Phytologist,2003,160(2):281-303.
[4] Dodd A N,Salathia N,Hall A,Kévei E,Tth R,Nagy F,Hibberd J M,Millar A J,Webb A A.Plant circadian clocks increase photosynthesis,growth,survival and competitive advantage.Science,2005,309:630-633.
[5] Hotta C T,Gardner M J,Hubbard K E,Baek S J,Dalchau N,Suhita D,Dodd A N,Webb A A.Modulation of environmental responses of plants by circadian clocks.Plant,Cell & Environment,2007,30(3):333-349.
[6] Yanovsky M J,Kay S A.Signaling networks in the plant circadian system.Current Opinion in Plant Biology,2001,4(5):429-435.
[7] Todd P M,Patrice A S,Hannah J Y,Taylor R S,Emily L S,Mark A M,José M A,Joseph R E,McClung C R.Enhanced fitness conferred by naturally occurring variation in the circadian clock.Science,2003,302:1049-1053.
[8] Fedoroff N V.Cross-talk in abscisic acid signaling.Sciences Stke Signal Transduction Knowledge Environment,2002(140):10.
[9] Srivastava L M.Plant growth and development:Hormones and environment.Plant Growth & Development Hormones & Environment,2002,16(S1):68-74.
[10] 罗富成,郭轶敏,彭健,段新慧,许文花,何超,郭凤根.外源激素对纳罗克非洲狗尾草种子休眠的破除效果.草业科学,2015,32(3):406-412. Luo F C,Guo Y M,Peng J,Duan X H,Xu W H,He C,Guo F G.Effects of exogenous hormones treatments to release seeds dormancy ofSetariasphacelatacv. Narok.Pratacultural Science,2015,32(3):406-412.(in Chinese)
[11] 韩云华,王彦荣,陶奇波.种子激素引发.草业科学,2016,33(12):2494-2502. Han Y H,Wang Y R,Tao Q B.Advances of seed hormonal priming.Pratacultural Science,2016,33(12):2494-2502.(in Chinese)
[12] Mizuno T,Yamashino T.Comparative transcriptome of diurnally oscillating genes and hormone-responsive genes inArabidopsisthaliana:Insight into circadian clock-controlled daily responses to common ambient stresses in plants.Plant and Cell Physiology,2008,49(3):481-487.
[13] Robertson F C,Skeffington A W,Gardner M J,Webb A A.Interactions between circadian and hormonal signalling in plants.Plant Molecular Biology,2009,69(4),419-427.
[14] Jouve L,Gaspar T,Kevers C,Greppin H,Agosti R D.Involvement of indole-3-acetic acid in the circadian growth of the first internode of Arabidopsis.Planta,1999,209(1):136-142.
[15] Nováková M,Motyka V,Dobrev P I,Malbeck J,Gaudinová A,Vanková R.Diurnal variation of cytokinin,auxin and abscisic acid levels in tobacco leaves.Journal of Experimental Botany,2005,56:2877-2883.
[16] Kunihiro A,Yamashino T,Nakamichi N,Niwa Y,Nakanishi H,Mizuno T.Phytochrome-interacting factor 4 and 5 (PIF4 and PIF5) activate the homeoboxATHB2 and auxin-inducibleIAA29 genes in the coincidence mechanism underlying photoperiodic control of plant growth ofArabidopsisthaliana.Plant and Cell Physiology,2011,52(8):1315-1329.
[17] Alabadí D,Gil J,Blázquez M A,García-Martínez J L.Gibberellins repress photomorphogenesis in darkness.Plant Physiology,2004,134(3):1050-1057.
[18] Alabadí D,Gallego-Bartolomé J,Orlando L,García-Cárcel L,Rubio V,Martínez C,Frigerio M,Iglesias-Pedraz J M,Espinosa A,Deng X W,Blízquez M A.Gibberellins modulate light signaling pathways to preventArabidopsisseedling de-etiolation in darkness.Plant Journal for Cell & Molecular Biology,2008,53(2):324-335.
[19] Foster K R,Morgan P W.Genetic regulation of development inSorghumbicolor(Ⅸ. The ma3R Allele Disrupts Diurnal Control of Gibberellin Biosynthesis).Plant Physiology,1995,108(1):337-343.
[20] Cowling R J,Harberd N P.Gibberellins controlArabidopsishypocotylgrowth via regulation of cellular elongation.Journal of Experimental Botany,1999,50:1351-1357.
[21] Kraepiel Y,Rousselin P,Sotta B,Kerhoas L,Einhorn J,Caboche M, Miginiac E.Analysis of phytochrome- and ABA-deficient mutants suggests that ABA degradation is controlled by light inNicotianaplumbaginifolia.Plant Journal,1994,6(6):665-672.
[22] Kraepiel Y,Marree K,Sotta B,Caboche M,Miginiac E.In vitro morphogenic characteristics of phytochrome mutants inNicotianaplumbaginifoliaare modified and correlated to high indole-3-acetic acid levels.Planta,1995,197(1):142-146.
[23] Kurapov P B,Skorobogatova I V,Sal’Nikova E I,Sorkina G L,Siusheva A G.Diurnal cycles of endogenous phytohormones in barley.Izvestiia Akademii Nauk Seriia Biologicheskaia,2000,1-2(1):108-114.
[24] Grieb S F,Imani J,Nezamabadi M K,Arnoldt-Schmitt B,Neumann K H.Changes in soluble proteins and phytohormone concentrations of cultured carrot petiole explants during induction of somatic embryogenesis (DaucuscarotaL.).Journal of Applied Botany & Food Quality,1997,71:94-103.
[25] Edwards K D,Akman O E,Knox K,Lumsden P J,Thomson A W,Brown P E,Pokhilko A,Kozma-Bognar L,Nagy F,Rand D A,Millar A J.Quantitative analysis of regulatory flexibility under changing environmental conditions.Molecular Systems Biology,2010,6(1):424.
[26] Harmer S L.The circadian system in higher plants.Plant Biology,2009,60:357-377.
[27] Pruneda Paz J L,Kay S A.An expanding universe of circadian networks in higher plants.Trends in Plant Science,2010,15(5):259-265.
[28] Umezawa T.Systems biology approaches to abscisic acid signaling.Journal of Plant Research,2011,124(4):539-548.
[29] Qian Y Q, Li D Y,Han L,Ju G S,Liu J X,Wu J Y,Sun Z Y.Inter-ramet physiological integration detected in buffalograss (Buchloedactyloides(Nutt.) Engelm.) under water stress.Weed & Turfgrass Science,2009,23(2):331-343.
[30] Tallman G.Are diurnal patterns of stomatal movement the result of alternating metabolism of endogenous guard cell ABA and accumulation of ABA delivered to the apoplast around guard cells by transpiration?Journal of Experimental Botany,2004,55:1963-1976.
[31] Qian Y Q,Li D Y,Han L,Sun Z Y.Inter-ramet photosynthate translocation in buffalograss under differential water deficit stress.Journal of the American Society for Horticultural Science American Society for Horticultural Science,2010,135(4):310-316.
[32] Pavlová L,Krekule J.Fluctuation of free IAA under inductive and non-inductive photoperiods inChenopodiumrubrum.Plant Growth Regulation,1984,2(2):91-98.
[33] Beck E,Wagner B M.Quantification of the daily cytokinin transport from the root to the shoot ofUrticadioicaL.Plant Biology,1994,107(5):342-348.

[35] Hare P D,Staden J V.The molecular basis of cytokinin action.Plant Growth Regulation,1997,23(1):41-78.
[36] Thomas T H,Hare P D,Staden J V.Phytochrome and cytokinin responses.Plant Growth Regulation,1997,23(1):105-122.
[37] 翟晓朦,臧春鑫,王敏,任梦云,关潇.CO2浓度升高对不同秋眠型苜蓿内源激素含量的影响.草业科学,2016,33(3):442-449. Zhai X M,Zang C X,Wang M,Ren M Y,Guan X.Effect of CO2enrichment on hormone content of different types fall dormancy alfalfa.Pratcaultural Science,2016,33(3):442-449.(in Chinese)
(责任编辑 王芳)
2017年8月国际市场主要畜产品与饲料价格分析
8月国际饲料价格和畜产品价格普遍出现下跌。
一、除苜蓿粉价格与7月持平外,其它饲料价格普遍出现下跌。
8月份美国苜蓿粉市场价格为206.00 USD·t-1,与7月持平,其余饲料价格普遍出现下跌。玉米、大豆、高粱、豆粕、菜籽、豆粉和棉籽饼市场分别平均价格为139.97、345.51、129.00、328.85、386.01、287.58和226.03 USD·t-1,环比分别下跌6.33%、5.69%、15.18%、8.18%、7.98%、8.35%和3.91%,其中,下跌幅度最大为高粱,下跌15.17%;棉籽饼下跌幅度最小,为3.91%。
二、除育牛奶、羊肉和羊羔肉市场平均价格出现上涨外,其它畜产品价格出现下跌。
8月份美国牛奶和新西兰羊肉、羊羔肉市场平均价格分别为0.33、3.55和5.98 USD·kg-1,涨幅依次为0.46%、0.35%和6.35%。而瘦肉猪、育肥牛、牛肉、欧盟鸡肉和猪肉市场价格出现下跌,分别为1.63、3.17、4.67、2.41和1.36 USD·kg-1,其中欧盟猪肉价格跌幅最大,为24.36%,其它依次环比下跌18.15%、4.11%、3.20%和0.56%。

图1 2017年8月国际市场主要饲料与畜产品价格
(兰州大学草地农业科技学院 杨春涛 整理)
CircadianrhythmvariationofendogenoushormonesinBuchloedactyloidesconnectedrametsunderdifferentialphotoperiod
Li Wei1,2, Qian Yong-qiang1, Han Lei1, Sun Zhen-yuan1
(1.Key Laboratory of Tree Breeding and Cultivation of State Forestry Administration, Research Institute of Forestry, CAF, Beijing 100091, China; 2.College of Landscape Architecture and Forestry, Qingdao Agricultural University, Qingdao 266109, China)
In order to understand the endogenous hormonal differences inBuchloedactyloidesconnected ramets under different photoperiods, the levels of four endogenous hormones [indole-3-acetic acid (IAA), gibberellin (GA), abscisic acid (ABA) and zeatin (ZR)] in buffalo grass leaves were determined using ELISA. The results indicated that IAA, GA, ABA and ZR levels of buffalo grass reveal rhythmic variations on a daily basis, while the endogenous hormone levels of buffalo grass ramets tend to be synchronized even under different photoperiods. After one week of different photoperiod treatments, under continuous light conditions, IAA, GA, ABA and ZR content in disconnected ramets of buffalo grass leaves basically showed the opposite trend within 24 h, however, IAA, GA, ABA and ZR content in connected ramets of buffalo grass leaves were synchronization trend within 24 h.
buffalo grass; connected ramets; phytohormone; photoperiod; circadian rhythm synchronization
Sun Zhen-yuan E-mail:sunzy@263.net
Q946.885
:A
:1001-0629(2017)09-1847-08
10.11829/j.issn.1001-0629.2016-0638
李伟,钱永强,韩蕾,孙振元.差异光周期下野牛草相连分株内源激素的日节律.草业科学,2017,34(9):1847-1854.
Li W,Qian Y Q,Han L,Sun Z Y.Circadian rhythm variation of endogenous hormones inBuchloedactyloidesconnected ramets under differential photoperiod.Pratacultural Science,2017,34(9):1847-1854.
2016-12-27接受日期:2017-03-22
国家自然科学基金——差异光周期作用下野牛草相连克隆分株间生物节律同步化调控机理(31100505)
李伟(1985-),男,新疆呼图壁人,讲师,博士,主要从事园林植物分子育种。E-mail:lwcsu_caf@163.com
孙振元(1964-),男,北京人,教授,博士,主要从事园林植物生理生态。E-mail:sunzy@263.net
