温度和氯离子浓度对30CrMnSiNiA腐蚀速率的影响研究
2017-09-29游明锐金平谭晓明王德苏玉玲
游明锐,金平,谭晓明,王德,苏玉玲
温度和氯离子浓度对30CrMnSiNiA腐蚀速率的影响研究
游明锐1,金平1,谭晓明1,王德1,苏玉玲2
(1.海军航空工程学院 青岛校区,山东 青岛 266000;2.海军91663部队,山东 青岛 266071)
目的研究温度和氯离子浓度对金属腐蚀速率的影响。方法通过失重法研究对比30CrMnSiNiA结构钢在不同氯离子浓度和温度下的腐蚀速率。结果30CrMnSiNiA钢的腐蚀速率都经历了一个增大-减小-趋于稳定的过程,说明腐蚀机理并未发生改变。在温度较低和氯离子浓度较低的条件下,升高温度和氯离子浓度将会提高腐蚀速率;当温度和氯离子浓度很高时,继续升高温度和氯离子浓度将会降低溶液中溶解氧的含量,使腐蚀速率降低,溶解氧的极限扩展速率将会成为限制腐蚀速率的关键因素。结论不同温度和氯离子浓度下金属腐蚀规律相同,温度和氯离子浓度在一定范围内促进了金属的腐蚀速率。当超过转化点后,提高温度和氯离子浓度会降低腐蚀速率。
失重法;腐蚀速率;氯离子浓度;腐蚀机理
影响钢铁腐蚀的因素很多,不仅仅取决于钢铁本身的组分,环境的温度、含氧度、酸碱度都会影响钢铁在环境中的腐蚀速率。一般认为温度越高,含氧越多,过酸的环境都会大大加快腐蚀速率。对于某些使用环境为浸泡在溶液内的钢铁,其腐蚀速率还会受溶剂种类和浓度的影响。在海洋环境中,氯离子是一种常见的含量较高的腐蚀离子,它也是引起金属材料腐蚀的主要因素[1]。张福泽[2]在推导金属腐蚀日历寿命的计算公式和确定方法时,对金属腐蚀损伤和腐蚀时间的线性关系进行了验证,这一结论在长时间跨度(>1000 h)内是符合实际实验结果的,但是在腐蚀初期并不符合线性规律。蔡启舟等[3]在研究不同金属接触腐蚀时发现,当NaCl的质量浓度在1~35 g/L范围内时,镁合金在自腐蚀速度随NaCl浓度增加而加快,但是没有探究继续提高NaCl浓度后的腐蚀速率问题。
文中以30CrMnSiNiA钢为例,通过试验对比,系统地研究了不同的温度和氯离子浓度对钢的腐蚀速率的影响,并对结果进行分析研究。为实验室加速腐蚀试验提供了依据。
1 试验
1.1 制备试件
通过线切割方法制作50 mm×50 mm×3 mm的30CrMnSiNiA高强度调质结构钢试件,材料的化学组成见表1。
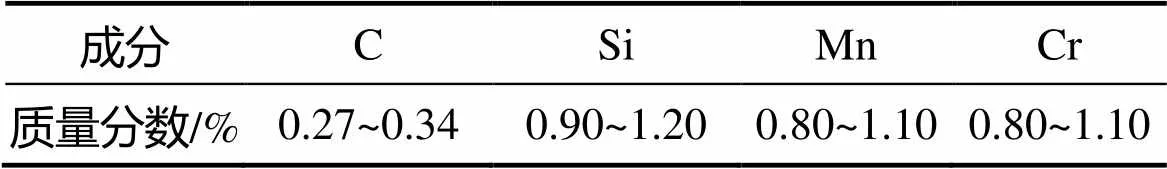
表1 30CrMnSiNiA的成分
试件标号后经320#—1000#砂纸逐级打磨表面至光滑,丙酮清洗后置于无水乙醇内备用。以海南陵水海水中NaCl的含量[4]为标准浓度(2.27 g/L),分别配置10,20,30,40,60,80,90,100倍氯离子浓度梯度的NaCl水溶液作为腐蚀浸泡液。
贾志军[5]通过研究合金钢在饱和CO2的NaCl溶液中pH值与腐蚀速率的关系发现,随着pH值的升高,腐蚀速率迅速下降。
因为pH值的升高有利于腐蚀产物在试件表面沉降,阻碍了电极反应的进行,对基体起保护作用。为缩短腐蚀时间,将溶液pH值调至4.0。
1.2 浸泡腐蚀试验
试验前将试件吹干、称量、记录数据。按照标号将试件分别放入盛有上述浓度梯度溶液的烧杯内,将烧杯放入恒温水浴锅内。水浴锅温度分别为30,40,60,80,90 ℃。记录试验开始时间,并定期测量试件质量。
1.3 清理腐蚀产物和测量试件质量
依据《GBT 16545—2015 金属和合金的腐蚀腐蚀试样上腐蚀产物的清除》中的要求配制去钢铁腐蚀产物清洗液:500 mL盐酸,3.5 g六次甲基四胺,加蒸馏水配制成1000 mL溶液。在20~25 ℃下浸泡10 min后超声清洗10 min,放入无水乙醇中除水后称量,记录质量。
2 结果与讨论
2.1 腐蚀速率的计算方法
通常金属的腐蚀程度用平均腐蚀速度(average corrosion rate)表示,对于均匀腐蚀的材料,通常采用腐蚀失(增)重、腐蚀深度和腐蚀电流表示法。文中采用腐蚀失重法表示钢材的腐蚀情况[6]。失重法计算公式为:
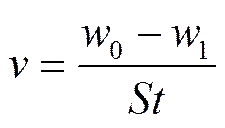
式中:为腐蚀速率,g/(m²·h);0为试样腐蚀前质量,g;1为试样腐蚀后的质量,g;为试件的表面积,m²;为腐蚀时间,h。
2.2 腐蚀质量损失结果
分别设置5个温度:30,40,60,80,90 ℃,每个温度设置7~8个氯离子浓度:10,(20),30,40,60,80,90,100倍氯离子浓度溶液1000 mL于烧杯中,每个烧杯中放置3个试验件。试件在腐蚀溶液中浸泡一段时间后取出称量,记录平均质量损失。根据式(1)计算试验件在各个温度和氯离子浓度下的腐蚀速率,结果见表2。
根据以上数据便可绘制不同温度、不同氯离子浓度下金属腐蚀速率随时间的变化趋势图。分析对比试件在30,60,90 ℃下的腐蚀速率,如图2所示。
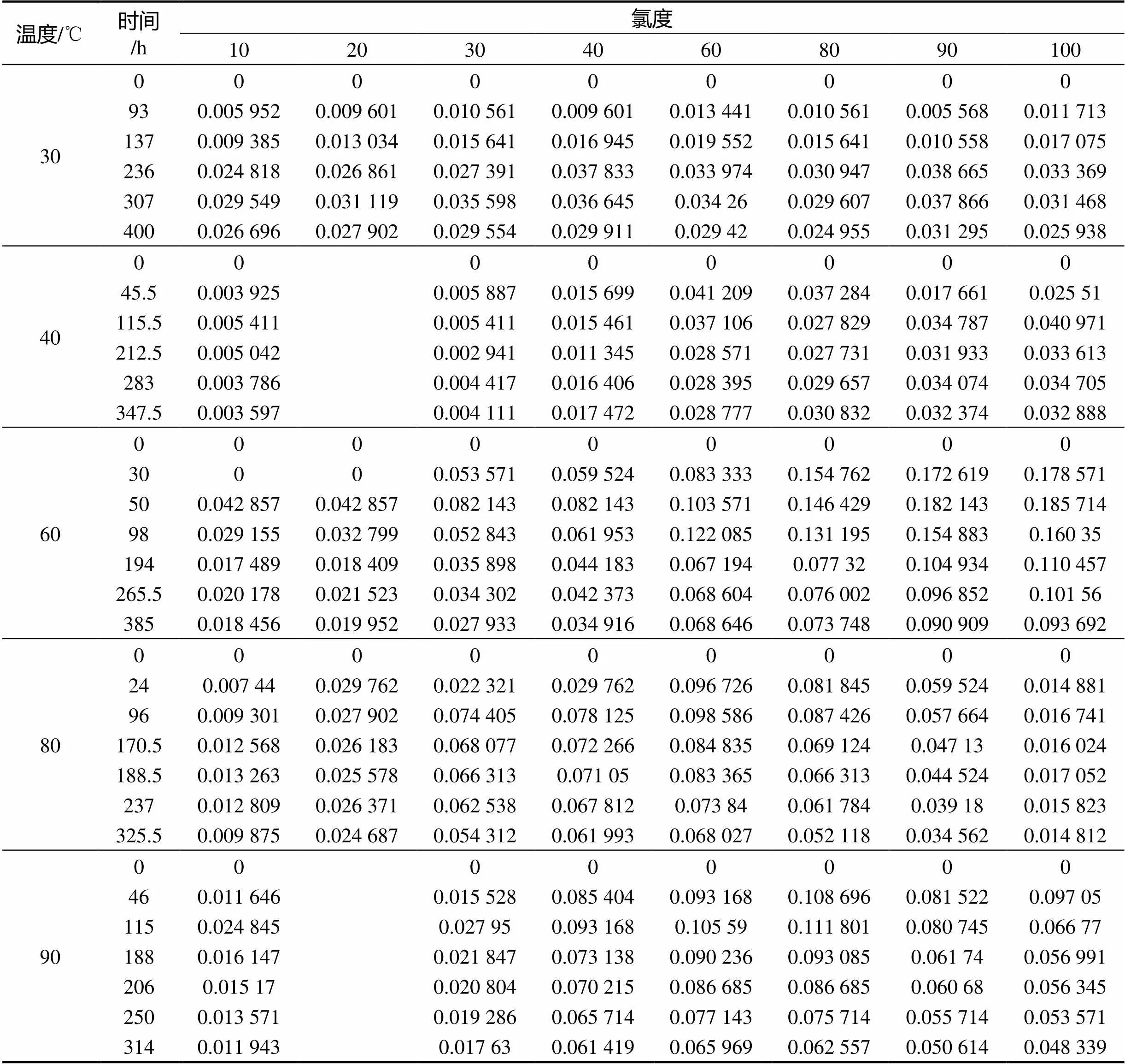
表2 30CrMnSiNiA在不同温度和不同氯化钠浓度溶液中腐蚀速率/(g·(m²·h)-1)
观察对比发现,各个温度下腐蚀速率随时间的变化趋势相同:初始阶段腐蚀速率很大,经过短时间的增大后降低,最后趋于平稳,这符合碳钢在海洋环境中的腐蚀规律[7-8],说明碳钢在各个温度的腐蚀规律基本一致[9]。同一温度下,当氯离子浓度为10倍到80倍时,腐蚀过程在氯离子浓度较高的溶液中首先达到最大腐蚀速率和稳定腐蚀速率,并且最大腐蚀速率和稳定腐蚀速率也与氯离子浓度正相关,说明氯离子能促进腐蚀过程的进行。当氯离子浓度大于80倍时,提高溶液氯离子浓度反而会降低最大腐蚀速率和稳定腐蚀速率。
可以将该腐蚀过程分为三个阶段。
1)自由腐蚀阶段。初始阶段金属表面处于活化状态,腐蚀速率很大,并且呈上升趋势。产生的锈层将会参与腐蚀过程,所以这一阶段不会持续太久。
2)腐蚀控制阶段。这一阶段主要是由于锈层在腐蚀过程中由加速腐蚀向抑制腐蚀的功能转化,从而引起的腐蚀速率降低的非线性过程。这一过程相当复杂,有许多相关的理论来解释锈层在腐蚀过程中的作用。
3)稳定腐蚀阶段。腐蚀速率最终趋于稳定的过程。锈层在腐蚀过程中的功能已经确定,溶液中溶解氧的极限扩散速率成为影响腐蚀速率的决定性因素。在其他因素保持不变的情况下,腐蚀将会以这个速率一直进行,直到金属表面积发生巨大的变化。
对比同一氯离子浓度下,不同温度对腐蚀速率的影响时发现:温度为30~60 ℃时,最大腐蚀速率和稳定腐蚀速率与温度正相关,升高温度也会缩短达到最大腐蚀速率和稳定腐蚀速率的时间。当温度大于60 ℃时,升高温度反而会降低最大腐蚀速率和稳定腐蚀速率,达到相应速率的时间也会延长。温度升高提高了氧的扩散速度[10],进而加速了电极反应,但是过高的温度会使溶液中氧气含量降低,进而削减了温度效应,如图3所示。
对试件的稳定腐蚀速率进行分析对比发现:30~60 ℃试件的稳定腐蚀速率随氯离子浓度升高而增大,如图4所示。当温度在60~80 ℃之间,氯离子浓度在60倍至80倍之间,有一个腐蚀速率转化点。当高于转化点时,继续升高温度和氯离子浓度将会使稳定腐蚀速率降低。在90 ℃时尤为明显,试件在90,100倍氯离子浓度溶液中的稳定腐蚀速率已明显低于60倍和80倍氯离子浓度溶液,甚至低于40倍氯离子浓度溶液。不难推断,当溶液温度和氯离子浓度处于腐蚀速率转化点时,试件的稳定腐蚀速率将达到最大。
3 腐蚀机理
钢铁在NaCl溶液内浸泡会发生电化学反应,在阳极发生铁的溶解,在阴极发生氧的去极化反应,反应方程式为:
阴极:(2)
阳极:(3)
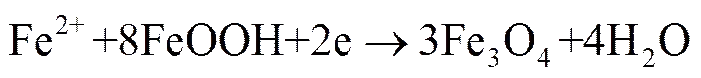
3.1 氯离子的影响
氯离子的存在对金属的腐蚀速率有至关重要的影响。一般认为,氯离子可以与金属形成络合物,破坏金属表面氧化膜。由于氯离子半径小、穿透性强,可从钝化膜致密孔隙中到达金属表面,并与金属相互作用形成可溶性化合物,使氧化膜的结构发生变化[11-12]。另一种理论认为,金属的氧化膜是由某种含氧钝化剂吸附在金属表面,降低了金属的表面活性,抑制了化学反应,而氯离子更容易吸附在金属表面,夺取了含氧钝化剂的位置,并与金属发生反应形成易溶于水的氯化物。氯离子富集在金属表面,形成强电场,Evans[13]认为,Fe2+和电子能穿透金属表面的锈层,使腐蚀反应发生在锈层表面。该电场加速这个过程,促进了金属的腐蚀。
试件在自由腐蚀阶段,表面的氧化膜被破坏,处于活化状态[7,10],腐蚀速率很快,腐蚀产物在金属表面形成锈层。金属表面被锈层覆盖后,金属表面的电化学反应变得复杂,锈层也将参与反应和物质的传输。
溶液中的氯离子能够在金属基体上形成活性点[14],反应生成可溶性物质,促进了金属的腐蚀[15-16]。

还有部分Fe2+参与以下反应:
(6)
生成的FeOH-和Fe(OH)2迅速被氧化,生成γ-FeOH。γ-FeOH是初期铁锈的主要成分,其多孔性为溶液中的溶解氧提供了通道,使溶解氧更容易达到金属表面,增大了反应速率。γ-FeOH具有阴离子选择性,更容易吸附氯离子,进而能促进金属的溶解。铁锈在腐蚀初期会提高腐蚀速率,这也是自由腐蚀阶段腐蚀速率上升的原因。
在酸性环境中,γ-FeOH还可以发生以下还原反应
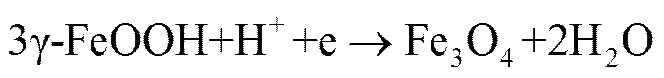
Fe3O4生成在锈层内层,逐渐增厚的锈层变得致密,将会阻碍溶解氧的传送,也会阻碍Fe2+向外扩散,腐蚀速率逐渐降低。Fe2+穿透Fe3O4意味着氧的还原过程将在Fe3O4表层进行,这时最终的稳定腐蚀速率将由溶液中氧的极限扩散速度控制。这与实验结果相吻合。
3.2 溶解氧的影响
影响氧气在溶液中的溶解度的因素很多,不但包括温度与气相氧分压,而且与水中的溶剂种类和浓度有极大的关联,如图5所示。
由图5可知,氧气在NaCl溶液中的溶解度与温度和NaCl的浓度负相关,即升高温度和增大NaCl浓度都会使溶液中氧气溶解度降低。这可以解释温度为80,90 ℃时,90,100倍氯离子浓度的稳定腐蚀速率低于60,80倍氯离子浓度,甚至低于40倍氯离子浓度稳定腐蚀速率的试验结果。
4 结论
1)试件在不同温度和氯离子浓度溶液中腐蚀速率均是先增加,达到最大腐蚀速率后减小,最后趋于稳定,说明腐蚀机理并未发生改变。腐蚀过程分为三个阶段:自由腐蚀阶段、腐蚀控制阶段和稳定腐蚀阶段。
2)30CrMnSiNiA钢在温度较高的溶液内和氯离子浓度较高的溶液内腐蚀速率率先达到峰值和稳定值,过高的温度和氯离子浓度将会降低溶液的溶氧量,进而降低腐蚀速率。存在一个腐蚀速率转化点,即当溶液温度和氯离子浓度在此点时,腐蚀性最大。
3)总结出稳定腐蚀速率与溶液温度和氯离子浓度之间的关系,为实验室加速试验提供了依据。
4)分别研究了氯离子、锈层和溶解氧含量在腐蚀过程中发挥的作用,对腐蚀机理进行解释,与实验结果相符合。
[1] 高泽海, 林旭彬, 陈秋岸, 等. 热带大气环境下钢铁材料腐蚀数据的分析[J]. 环境技术, 2015, 33(5): 22-24.
[2] 张福泽. 金属腐蚀“3等线”和试验日历寿命确定方法[J]. 航空学报, 2016, 37(2): 371-380.
[3] 蔡启舟, 王立世, 魏伯康, 等. NaCl水溶液中AZ91与A3钢的接触腐蚀[J]. 特种铸造及有色合金, 2004(1): 31-33.
[4] 张福泽, 叶序彬, 宋军. 飞机日历寿命试验的介质成分确定和加速方法[J]. 航空学报, 2008, 29(4): 873-879.
[5] 贾志军, 杜翠微, 刘志勇, 等. 3Cr低合金钢在饱和CO2的NaCL溶液中的腐蚀电化学行为[J]. 材料研究学报, 2011, 25(1): 39-44.
[6] 黎完模, 宋玉苏, 邓淑珍. 涂装金属的腐蚀[M]. 长沙: 国防科技大学出版社, 2003.
[7] MELCHER R E. Effect on Marine Corrosion of Carbon Co$ntent of Low Alloy Steel[J]. Corros Sci, 2003, 45(11): 2609.
[8] MA Y T, LI Y, WANG F H. The Effect of β-FeOH on the Corrosion Behavior of Low Carbon Steel Exposed in Tropic Marine Environment[J]. Mater Chem Phys, 2008, 112(3): 844.
[9] 黄桂桥. 碳钢在我国不同海域的腐蚀行为[J]. 腐蚀科学与防护技术, 2001,13(2): 81.
[10] 郑莹莹, 邹妍, 王佳. 海洋环境中锈层下金属腐蚀行为的研究进展[J]. 腐蚀科学与防护技术, 2011, 23(1): 93-98.
[11] 潘旭东, 王向明. 循环水中氯离子控制及对不锈钢腐蚀机理探讨[J]. 工业水处理, 2013, 33(4): 14-16.
[12] 陆柱, 蔡兰坤. 水处理药剂[M]. 北京: 化学工业出版社, 2002: 8-14.
[13] EVANS U R. Electrochemical Mechanism of Atmospheric Rusting[J]. Nature, 1965, 206: 980-982.
[14] 谢建丽, 金凯峰, 蒋晓斌, 等. 带锈碳钢在稀NaCl溶液中的腐蚀行为[J]. 表面技术, 2014,43(2): 55-59.
[15] 徐秀清, 魏丹, 俞莹滢, 等. Cl-浓度对含盐污水中10#碳钢腐蚀行为的影响[J]. 表面技术, 2013, 42(4): 59-61.
[16] 孙敏, 肖葵, 董超芳, 等. 带腐蚀产物超高强度钢的电化学行为 [J]. 金属学报, 2011, 47(4): 442-448.
Effects of Temperature and Chloride Ion Concentration on Corrosion Rate of 30CrMnSiNiA
YOU Ming-rui1, JIN Ping1, TAN Xiao-ming1, WANG De1, SU Yu-ling2
(1.Naval Aeronautical Engineering Institute Qingdao Branch, Qingdao 266000, China;2. Navy Unit 91663, Qingdao 266071, China)
Objective To study effects of temperature and chloride ion concentration on the corrosion rate of metal. Methods The corrosion rate of 30CrMnSiNiA steel structure at different chloride ion concentration and temperature was researched and compared with the weight loss method. Results The corrosion rate of steel 30CrMnSiNiA experienced an increase--decrease-- stabilizing process, which mean that the corrosion mechanism was not changed. At low temperature and low chlorine, elevated temperature and chlorine concentration would increase the corrosion rate; at high temperature and chlorine ion concentration, continuous raising the temperature and chlorine ion concentration would reduce the content of dissolved oxygen in solution, and thus decrease the corrosion rate. The limit extension rate of dissolved oxygen would become the key factor limiting the corrosion rate. Conclusion Rules for corrosion behaviors of the metal at different temperature and chlorine are the same. The temperature and chloride ion concentration promote the corrosion rate of metal within a certain scope. If the inversion point is exceeded, improving the temperature and chloride ion concentration can reduce the corrosion rate.
weight loss method; corrosion rate; chlorine ion concentration; corrosion mechanism
10.7643/ issn.1672-9242.2017.09.019
TJ07;TG147
A
1672-9242(2017)09-0093-06
2017-05-25;
2017-06-11
游明锐(1991—),男,河南安阳人,硕士,主要研究方向为航空宇航。
