替莫唑胺联合放疗治疗非小细胞肺癌脑转移的效果观察
2017-09-28王宝红郭守娟张丹丹李国文
王宝红 郭守娟 张丹丹 李国文
1.郑州大学第一附属医院 放疗科 河南 郑州 450052; 2.郑州大学附属郑州中心医院 放疗科 河南 郑州 450007)
·临床研究·
替莫唑胺联合放疗治疗非小细胞肺癌脑转移的效果观察
王宝红1郭守娟2张丹丹1李国文1
1.郑州大学第一附属医院 放疗科 河南 郑州 450052; 2.郑州大学附属郑州中心医院 放疗科 河南 郑州 450007)
目的探讨替莫唑胺(TMZ)联合放疗治疗非小细胞肺癌(NSCLC)脑转移的临床效果。方法选取郑州大学第一附属医院2014年9月至2015年12月收治的78例患者,均经病理学诊断为NSCLC,脑磁共振(MRI)提示脑转移灶≤3个,最大转移灶直径为4.3 cm。将这78名患者随机分为放疗组和联合组:放疗组仅给予放射治疗,先行全脑照射(whole brain radiotherapy,WBRT),处方剂量为36 Gy,每次为2 Gy,每周5次,共18次,5次/周,治疗结束后对转移灶进行缩野适形调强局部加量,处方剂量为24 Gy,每次2 Gy,每周5次,共12次;联合组给予同步放化疗,放疗的处理同放疗组,同步化疗给予TMZ 75 mg/(m2·d),早晨空腹温水送服,至放疗结束。放疗结束后1个月复查头部增强MRI,比较两组的近期疗效;以后每3个月复查1次,直至失访或死亡。结果放疗组、联合组的近期有效率分别为58.5%、81.0%(P=0.018),中位生存时间分别为7个月和12个月(P=0.021),两组患者在治疗期间不良反应差异无统计学意义(P<0.05)。结论放疗联合TMZ治疗NSCLC脑转移的近期疗效优于单纯放射治疗,且将中位生存时间延长5个月,患者从中获益更大。
放射治疗;非小细胞肺癌;脑转移;替莫唑胺
脑是非小细胞肺癌(non-small cell lung cancer,NSCLC)的常见转移部位之一,临床上有10%~30%的NSCLC患者发生脑转移[1]。其中恶性肿瘤脑转移所致的颅高压引起的头痛、恶心、呕吐等症状,严重影响患者的生活质量。仅给予甘露醇、地塞米松等支持治疗的患者的中位生存期为1~2个月[2]。另外,有研究发现,颅外转移是肺癌脑转移生存时间的独立预测因素[3]。目前脑转移的标准治疗有全脑放疗(WBRT)、立体定向放射以及外科手术[4]。但是,脑转移患者的最佳治疗方案尚无统一结论。因具有穿过血脑屏障、放疗增敏的特点,替莫唑胺(tomozolomide,TMZ)被广泛应用于脑部转移瘤的治疗。现将郑州大学第一附属医院2014年9月至2015年12月收治的78例患者分为放疗组和联合组,比较两组治疗效果。
1 资料与方法
1.1临床资料选取郑州大学第一附属医院2014年9月至2015年12月收治的78例患者,均经病理学证实为NSCLC,脑增强MRI提示颅内占位性病变≤3个,最大转移灶直径为4.3 cm。所有患者KPS≥70分,预期生存期>3个月。既往均无脑部转移瘤放疗史、手术史。血液及生化指标基本正常,无严重的实质脏器功能损害。其中男45例,女33例,年龄为19~78岁,中位年龄56岁;鳞癌52例,腺癌26例。男女之间比较,差异无统计学意义(P>0.05); 病理类型上比较,差异无统计学意义(P>0.05)。见表1。

表1 两组临床资料比较(n)
1.2治疗方法所有患者均经CT扫描定位,定位层厚3 mm,扫描范围自颅顶至环状软骨,由同一放疗医师勾画CTV及危及器官,包括眼球、晶体、视神经、视交叉、垂体、脑干、脊髓,经同一物理师制定计划,6 MeV X线头颅双侧对穿照射,处方剂量为36 Gy,每次为2 Gy,每周5次,共18次;结束后重新定位,同时行脑增强MRI,在CT-MRI融合图像上勾画大体肿瘤体积(Gross tumor volume,GTV),处方剂量为24 Gy,每次2 Gy,每周5次,共12次。联合组在放疗第1天给予TMZ胶囊(蒂清,江苏天士力帝益药业有限公司)75 mg/(m2·d),早晨空腹整粒温水送服,至放疗结束。放疗期间据病情给予甘露醇或甘油果糖、地塞米松等降颅压,奥美拉唑、托烷司琼等护胃、止吐治疗。后续可给予原发灶的治疗。
1.3评价标准评估方法按WHO标准,分为完全缓解(CR)、部分缓解(PR)、稳定(SD)及进展(PD);CR:指所有病灶完全消失;PR:与基线最大直径之和比较,靶病灶最大径之和至少缩小30%;SD:介于缓解及进展之间;PD:靶病灶最大径之和较基线最大直径之和增大≥20%或出现新病灶。其中,CR+PR评定为有效;SD+PD为无效。
1.4随访所有患者第1次随访时间是放疗结束后1个月,以后每3个月复查1次,直至失访或死亡,复查项目包括脑MRI、血常规、肝肾功能等。
1.5统计学处理采用SPSS 21.0统计学软件对数据进行分析:两组的近期治疗效果采用χ2检验,用Kaplan-Meier法进行生存分析,Log-rank法假设检验,P<0.05为差异有统计学意义。
2 结果
2.1近期疗效随访时间1~24个月(截止2016年6月31日),中位随访时间为13个月。随访率为100%,其中1例死于脑血管意外。放疗组和联合组的近期有效率分别为58.5%、81.1%。联合组的有效率较全脑组高,差异有统计学意义(P=0.018<0.05)。见表2。

表2 两组近期治疗效果比较(n,%)
2.2生存时间放疗组和联合组的中位生存时间分别为7个月和12个月,差异有统计学意义(P=0.021<0.05)。见图1。
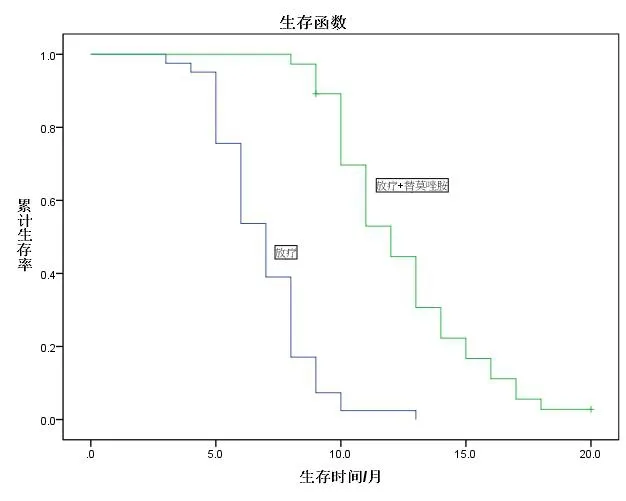
图1 两组生存曲线比较
2.3不良反应放疗期间常见的急性毒性反应消化道反应(厌食、恶心、呕吐等)及骨髓抑制(Ⅰ~Ⅱ度),经止吐、升白细胞等对症治疗后均能耐受放化疗。放疗期间未见严重的中枢神经系统毒性反应。
3 讨论
肺癌的发病率占恶性肿瘤的首位,也是肿瘤性死亡的首要病因[5]。每年全球约有1 600万人死于此病,占全球死亡人数的19%[6]。NSCLC脑转移的治疗为姑息性治疗,主要是减轻患者的临床症状,提高生存质量,延长生存期。全脑放疗对脑转移瘤的局部控制率的效果是肯定的[7]。作为脑转移的治疗方法之一,TMZ减轻了脑转移瘤的临床症状,并且延长了患者的中位生存时间[8]。正常情况下化疗药很难通过血脑屏障,从而使化疗效果大打折扣。TMZ是2代口服烷化剂,易于透过血脑屏障,是广谱的抗癌药,被广泛应用于胶质瘤以及脑转移瘤的治疗[9]。另外,TMZ有一定的放疗增敏作用[10]。放疗能打开血脑屏障,使化疗药进入脑脊液发挥作用[11]。Verger等[12]研究显示,两组患者在治疗期间,并没有发生急性严重的中枢神经系统损伤,严重的血液学毒性及消化道反应在联合组也很少见。Antonadou等[13]的随机试验研究显示,全脑放疗组、全脑放疗联合TMZ组的中位OS分别是7.0个月和8.6个月。韦燕等[14]关于放疗联合TMZ治疗脑转移瘤的实验显示,放疗组和联合组的中位生存期分别为10个月和14个月,两组患者均未出现严重的不良反应。以上结果与本研究结果的不同之处可能在于:①其他研究对病理分型并未限制,选取的乳腺癌患者占多数,本研究选取的均为NSCLC;②本研究选取的患者颅内占位性病变≤3个,最大转移灶直径为4.3 cm,预期生存期>3个月,且无颅外转移灶;③其他研究在全脑放疗后未再对转移灶调强局部加量,或者是对转移灶的局部加量方式为三维适形;④TMZ的应用不同,国外研究应用的TMZ是泰道,而国内研究大多使用蒂清;⑤放疗期间,不同实验采用的口服剂量也有所不同;⑤放疗结束后,本实验未再周期性口服TMZ,而其他实验则口服3~6个周期不等。
本研究结果显示:放射治疗联合TMZ,可以提高非小细胞肺癌脑转移患者的近期局部控制率,延长中位生存时间,减轻患者的颅脑高压症状、提高患者的生存质量。对于患者,放疗联合TMZ的治疗方法是安全的,不良反应也可以耐受,严重的急性毒性反应很少见。但是由于本研究样本量较少,没有参考分子生物学数据,所以本实验结果还需要大样本、前瞻性的实验来证实。
[1] Arrieta O,Villarreal-Garza C,Zamora J,et al.Long-term survival in patients with non-small cell lung cancer and synchronous brain metastasis treated with whole-brain radiotherapy and thoracic chemoradiation[J].Radiat Oncol,2011,6:166-171.
[2] Chua D,Krzakowski M,Chouaid C,et al.Whole-Brain Radiation Therapy Plus Concomitant Temozolomide for the Treatment of Brain Metastases From Non-Small-Cell Lung Cancer:A Randomized, Open-Label Phase Ⅱ Study[J].Clin Lung Cancer,2010,11(3):176-181.[3] 崔少华,白皓,董莉莉,等.肺癌脑转移生存预测因素分析[J].中国肺癌杂志,2015,18(7):436-442.
[4] Ellis T L,Neal M T,Chan M D.The role of surgery, radiosurgery and whole brain radiation therapy in the management of patients with metastatic brain tumors[J].Surg Oncol,2012,9(6):23-45.
[5] Koinis F,Kotsakis A,Georgoulias V,et al.Small cell lung cancer(SCLC):no treatment advances in recent years[J].Transl Lung Cancer Res,2016,5(1):39-50.[6] Moro-Sibilot D,Smit E,de Castro C J,et al.Non-small cell lung cancer patients with brain metastases treated with first-line platinum-doublet chemotherapy:Analysis from the European FRAME study[J].Lung Cancer,2015,90:427-432.[7] Rades D,Gerdan L,Segedin B,et al.Brain metastasis[J].Radiotherapy and Oncology,2013,189:123-127.
[8] Gamboa-Vignolle C,Ferrari-Carballo T,Arrieta O,et al.Whole-brain irradiation with concomitant daily fixed-dose Temozolomide for brain metastases treatment: A randomised phase Ⅱ trial [J].Radiotherapy and Oncology,2012,102:187-191.
[9] Fang C,Wang K,Stephen Z R,et al.Temozolomide Nanoparticles for Targeted Glioblastoma Therapy[J].ACS Appl Mater Interfaces,2015,7(12):6674-6682.
[10] 康勋,李珊,谢铮铮,等.恶性脑胶质瘤同步放化疗中替莫唑胺化疗的不良反应及对策[J].首都医科大学学报,2012,10(33):589-593.
[11] Middlenton M R,Grob J J,Aaronson N,et al.Randomized phase Ⅲ study of Temozolomide versus dacarbazine in the treatment of patients with advanced metastacic malignant melanoma[J].Clin Oncol,2008,18(1):158-167.
[12] Verger E,Gil M,Yaya R,et al.Temozolomide and concomitant whole brain radiotherapy in patients with brain metastases: a phase Ⅱ randomized trial[J].Radiat Oncol Biol Phys,2005,6(1):185-191.
[13] Antonadou D,Paraskevaidis M,Sarris G,et al.Phase Ⅱ randomized trial of temozolomide and concurrentradiotherapy in patients with brain metastases[J].Clin Oncol,2002,20(36):44-50.
[14] 韦燕,赵善琳,易海振,等.放射治疗联合替莫唑胺治疗脑转移瘤的疗效分析[J].现代肿瘤医学,2015,23(15):2114-2116.
李国文,E-mail:Lgw0371@163.com。
R 734.2doi: 10.3969/j.issn.1004-437X.2017.18.012
2016-11-02)
