负压屏障设施动物饲养笼具的选择及其感染风险的识别
2017-09-28向志光谷有刚李欣悦
向志光,佟 巍,谷有刚,李欣悦,秦 川
(中国医学科学院医学实验动物研究所,北京协和医学院比较医学中心,北京 100021)
经验交流
负压屏障设施动物饲养笼具的选择及其感染风险的识别
向志光,佟 巍,谷有刚,李欣悦,秦 川*
(中国医学科学院医学实验动物研究所,北京协和医学院比较医学中心,北京 100021)
目的生物安全实验室的感染性动物实验大部分经空气传播的致病因子可利用安全隔离装置有效控制,啮齿类动物饲养笼具作为一种常用设备对其要求仍不明确。本研究将测试本实验室(负压屏障设施)模拟感染动物实验在使用开放和密闭2种啮齿类动物笼具的病原暴露风险,并评价本设施的硬件条件和管理措施对于风险控制的水平。方法使用具有卡那霉素抗性的大肠杆菌(Kan+,E.coli,DH5α)作为指示微生物,测试开放笼盒饲养、密闭笼盒(与外界无压力梯度)饲养、生物安全柜动物换笼等操作的暴露风险,并对负压设施内外的指示微生物进行监测。结果动物在负压屏障设施中使用开放笼具饲养存在病原暴露风险,负压屏障设施一定程度上可以控制病原的播散;动物在无压力梯度的密闭笼盒的饲养环节未能检测到指示菌;密闭笼盒使用生物安全柜设备进行换笼操作可有效控制病原暴露风险。结论在负压屏障设施内使用密闭笼盒,在笼盒与外界无压力梯度的情况下亦可保障生物安全风险的有效控制。
负压屏障设施;动物实验;感染风险;密闭笼盒
动物病原感染性实验为了防止生物安全风险,需要在特定的实验环境中进行,其中对设施最基本的要求包括实验室与外周环境的压力梯度等[1]。我国《实验室生物安全通用要求》根据所操作生物因子所采取的防护措施进行分级,并根据实验室活动差异、个体防护装备和基础设施水平等对实验室进行区分,其中符合4.4.2的实验室,可有效利用安全隔离装置操作常规量经空气传播的致病性生物因子[2]。在实验动物饲养笼具的选择上,可以利用负压动物笼具等作为安全隔离装置。目前啮齿类动物的感染性研究多使用IVC(独立送风笼架具)进行饲养,而业界对于此类设备的技术指标的要求以及安全性仍存在质疑。因此本文拟使用开放笼盒和密闭笼盒对指示微生物的扩散情况进行此类测试。在感染性动物实验过程中啮齿类动物的饲养主要涉及动物笼具更换,此过程需要在生物安全柜或类似设备内进行。因此本文对此操作存在的可能风险进行了模拟检测。
本研究选用大肠杆菌抗性菌做指示微生物。大肠杆菌为环境中常见微生物,自然环境中生存能力较强,可以作为指示微生物[3]。为了排除自然环境中大肠杆菌等微生物对于实验的影响,本研究采用具有卡那霉素抗性基因的基因工程菌作为指示微生物。
1 材料和方法
1.1指示微生物的制备和模拟感染材料的制备
选择转化质粒pET-28a的大肠杆菌E.coli的基因工程菌株DH5α为指示菌。该菌使用含有50 μg/mL卡那霉素(Kan+)的LB培养基进行过夜培养,培养物浓度达到109/mL(稀释法测定),该指示菌使用固体LB平板进行计数检测。对指示菌的Kan标记进行核酸检测方法检测,指示微生物使用核酸检测方法的检测灵敏度与固体平板培养计数法接近(数据未展示),本研究选用培养法。
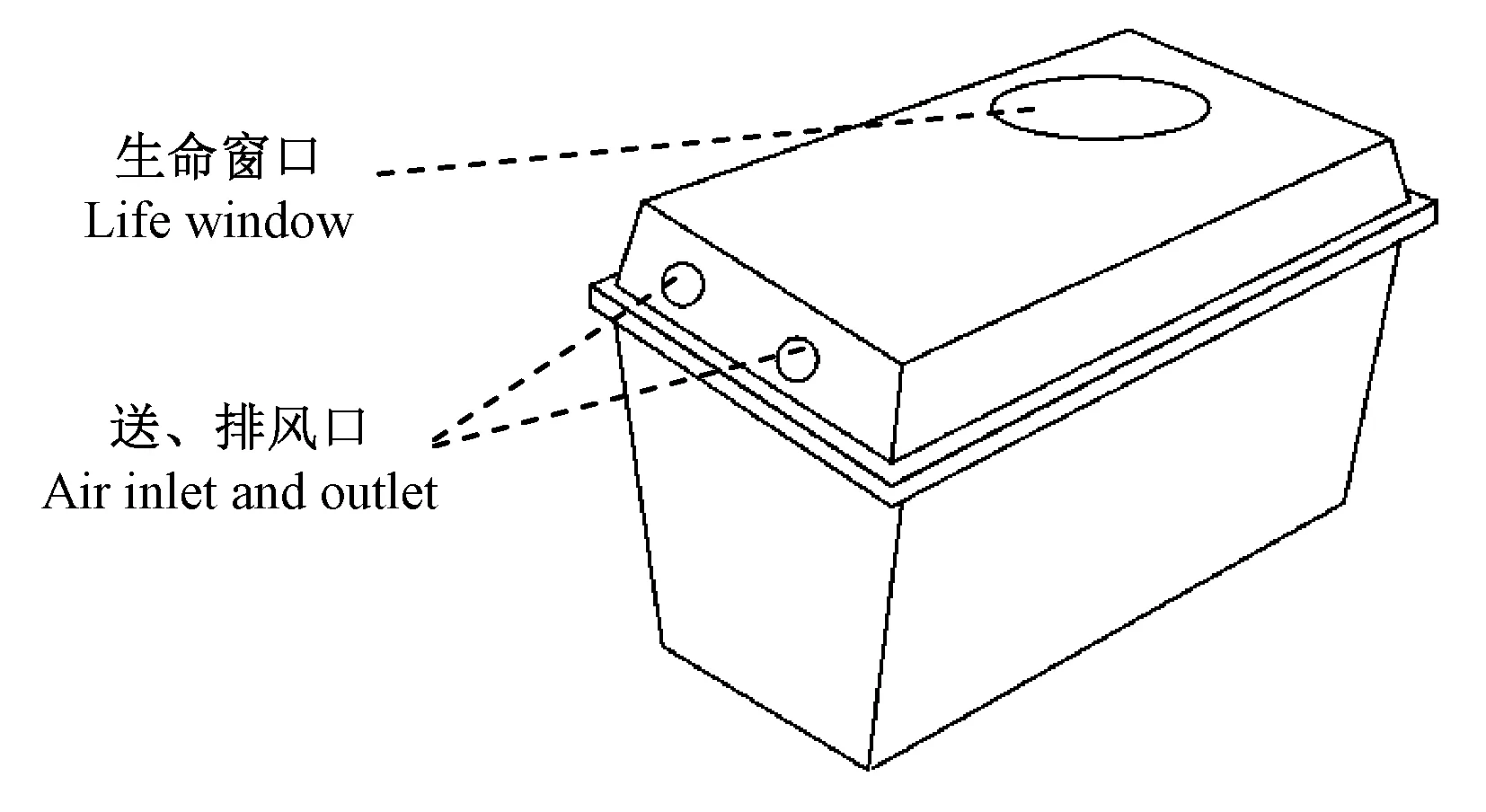
图1 密闭笼盒示意图Fig.1 Schematic diagram of the sealed cage
具有密闭功能的笼盒如图1所示。该笼盒用于IVC笼架具,在脱离笼架具时送风口和排风口自然封闭。在本试验中,使用此类IVC笼盒作为具有密闭功能的笼盒,脱离IVC系统使用时,打开生命窗口,该窗口打开后仍有高效过滤装置,可以在保证笼内动物通气的情况下,隔离笼内外微生物等的交换。笼内装入小鼠垫料,使用湿热灭菌法进行灭菌处理。将该笼盒放入生物安全柜。将过夜培养的50 mL指示菌培养物在生物安全柜内与笼盒内垫料混合,模拟感染材料,笼盒内放入2只2月龄C57BL/6J雌性小鼠。混合后密封笼盒,并作表面消毒。1.2表面消毒
使用84消毒液进行表面消毒,消毒剂的有效氯含量为0.55%,新鲜配制,在本测试中72 h内有效。使用工作浓度84消毒液沾湿纱布,对笼盒表面和工作台面进行消毒,擦拭3次,每次间隔2 min。
1.3负压设施参数的测定
记录负压设施的环境温度与湿度;监测负压设施与外界准备间的压力梯度;测定送风口风速,并根据室内容积计算换气次数。使用发烟法测定负压设施室内的气流走向。测定实验室内平均气流速度。
1.4浮游菌及沉降菌的采集
参照GB/T 16293-2010浮游菌测试方法[4]采集室内环境中的浮游菌,使用气体撞击采样器(Microflow,意大利Aquaria公司)进行浮游菌的采集,采集的气流流速为90 L/min,每次采集500 L,内置含有50 μg/mL卡那霉素的LB固体培养基的培养皿(90 mm直径)。参照GB/T 14925-2010采集动物实验室室内落下菌[5],使用含有50 μg/mL卡那霉素的LB固体培养基的培养皿(90 mm直径)采集设施和设备内的沉降菌,采集时间为30 min。采样点的位置见附图。
2 结果
2.1负压实验室基本参数
本研究使用的设施是负压屏障设施,实验室与外侧准备间的压力梯度维持在-25.0~-30.0 Pa之间。实验室温度维持在23.2℃~23.3℃之间,湿度为53.3%。实验室顶部有4个送风口,送风口面积为(4 × 0.372) m2(4个送风口合计),送风口分布于实验室中央位置。测试送风口的平均风速为0.43 m/s,室内容积为2.3 m(层高)× 43.7 m2(设施面积),经计算,该实验室的换气次数为23次/h;在实验室顶部有3个排风口,排风口分布于实验室外周位置。
使用发烟法对实验室气流走向进行测定,接近送风口位置(30 cm内)的气流方向指向远离送风口的方向;接近排风口的位置(30 cm内)的气流方向指向排风口方向;其他空间位置发烟烟尘无特定走向。该实验室属于乱流负压实验室。测定平均气流速度为0.05 m/s。
2.2密闭笼盒饲养动物——指示菌无发现
按照如图2所示布点位置测定实验室浮游菌和落下菌。在进行实验之前,所有位置均未检测到指示菌。将装有小鼠及污染垫料的小鼠笼以密闭状态放置在实验室内,放置位置为图2中E点所示。离地面高度为80 cm。该位置处于送风和排风之间。在此饲养状态下对各位置进行浮游菌和沉降菌的采样,各位置点检测到指示菌计数均为0。
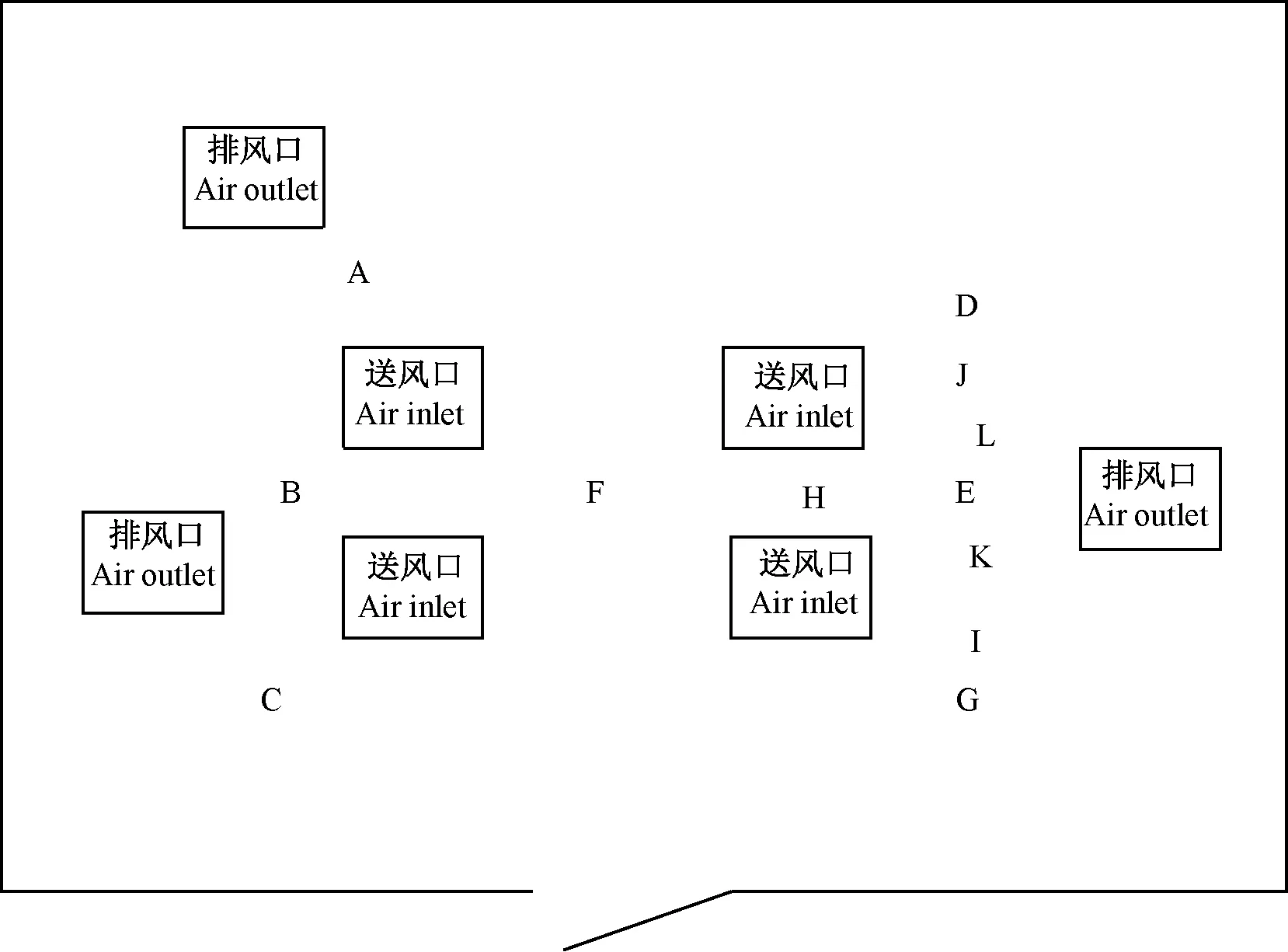
图2 负压屏障实验室风口位置及采样点分布图Fig.2 Distribution map of air-outlets and sampling points in the negative-pressure barrier facility
2.3生物安全柜内换笼操作的病原暴露风险及控制
将密闭笼盒做表面消毒后移入生物安全柜,生物安全柜内事先放置采样培养皿,采样点分布如图3所示。准备好镊子用于动物的夹取。换笼操作人员坐于操作台前,带双层手套,外层手套在安全柜内做表面消毒。由助手移入新净密闭笼盒。在安全柜内打开新净笼盒;打开带有动物及污染物的笼盒,用镊子夹取动物,并转移到新净笼盒内;转移带有饲料的内置笼网至新笼盒(手直接操作);取一培养皿,将接触笼盒的手在平板表面进行印制接种;使用含消毒液的纱布做手部消毒,封闭新净笼盒,对笼盒表面用沾有生理盐水的灭菌拭子擦拭新净笼盒表面,并涂布平板。对新净笼盒做表面消毒,由助手转出生物安全柜。收集事先放置的培养皿,对生物安全柜台面消毒,消毒后的手再次印制培养平板。消毒后再次对生物安全柜内放置平板,采集落下菌。
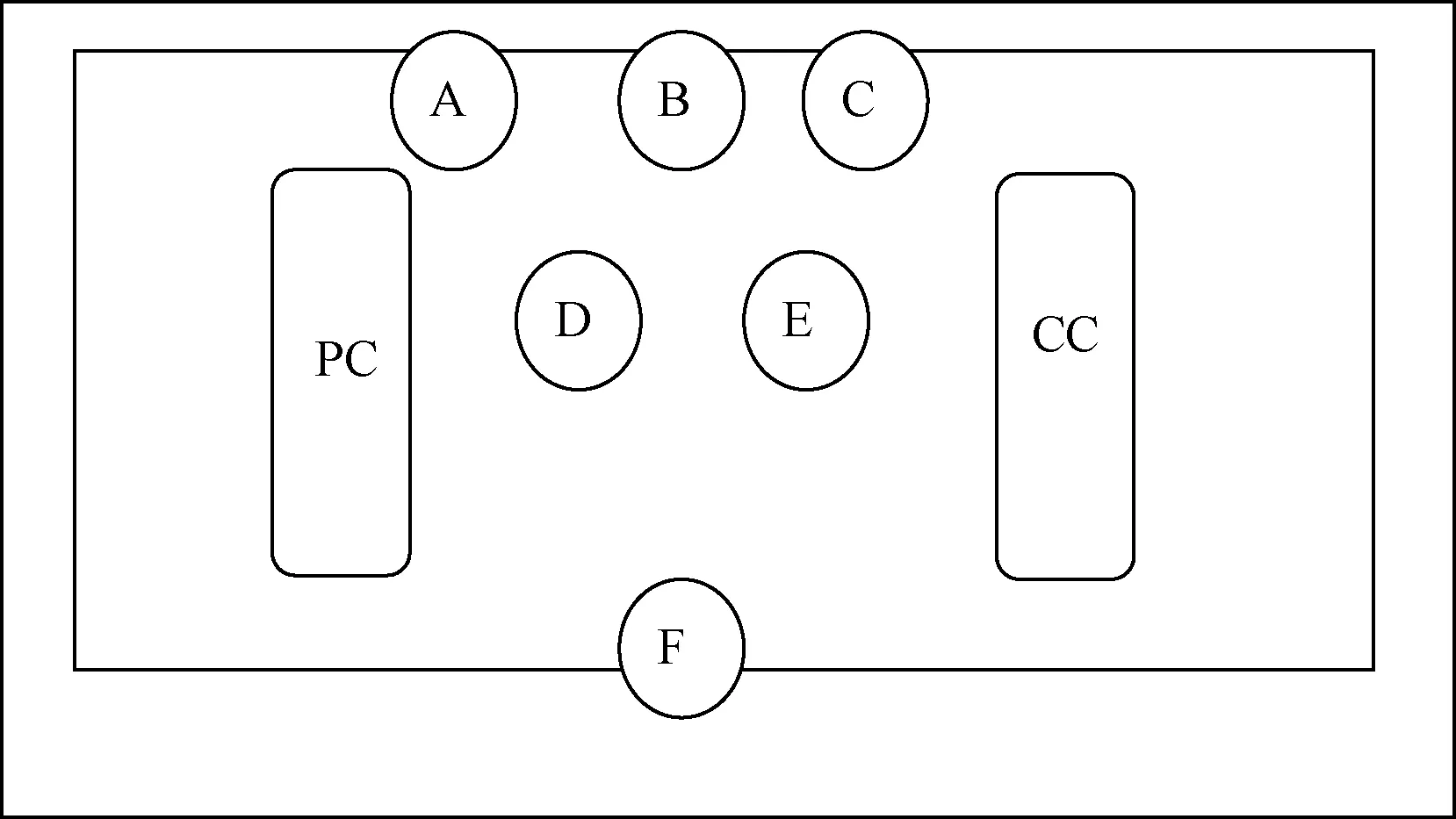
注:PC表示污染的笼盒;CC表示清洁的笼盒。图3 生物安全柜落下菌采样位置图Note. PC means polluted cage; CC means clean cage.Fig.3 Sampling points of microorganisms in the biosafety cabinet
结果发现,放置在内侧通风处的采样点有指示菌富集,其中B点因在转移动物过程中有垫料混入指示菌数量较多;距离污染笼盒较近的A点落下菌的数量为24,距离较远的C点落下菌数为1。安全柜中央位置离污染笼盒较近的D点落下菌数为25,而较远的E点无落下菌。外侧风口处F点检测到1个落下菌。转移笼盒内笼网后手印制平板培养24 h后出现类手型菌落分布,48 h长满。新净笼盒表面采样未发现指示菌。手部消毒后再次印制平板,无指示菌生长。台面消毒后再次采集落下菌,无指示菌生长。
上述实验表明,生物安全柜内由于气体流向的控制,在排风口以及距离污染物较近的位置存在污染风险,操作人员的手部由于与笼具内部接触存在病原暴露风险,而有效氯浓度为0.55%的84消毒液对手部及台面消毒可以有效控制指示菌的暴露风险。
2.4在乱流负压屏障设施动物开放饲养存在病原暴露风险
将动物以及污染笼盒放置在同一饲养位置(图2中E点),打开笼盖,开放饲养。开放30 min后采集各位置落下菌和H、I、J三个采样位置的浮游菌。采集位点见图2。结果在距离笼盒位置较近的K位置,采集到落下菌数为9,其他位置的落下菌未有指示菌生长;采集的浮游菌在H、I、J三个位点分别为35、2、0。
开放饲养24 h后采集各位置落下菌和浮游菌,各位点落下菌均未有指示菌生长;采集的浮游菌在H、I、J三个位点分别为11、1、1。对开放笼具附近台面进行擦拭采样,400 cm2的范围内采集到的样品接种平板指示菌数量高于200。在负压实验室对动物进行开架饲养时,检测实验室外准备间的浮游菌,结果在多个位置进行检测,未发现指示菌。
2.5负压设施的自净
将开放笼具再次密闭,并对笼具做外部表面消毒,并移出实验室。并对笼具放置台面做表面消毒。实验室静置30 min。采集室内落下菌和浮游菌,均无指示菌生长。
3 讨论
3.1生物安全柜内动物换笼的风险因素
生物安全柜内气体流向是较为稳定的,由于窗口处下降气流流速高,形成了气帘,对于在安全柜内操作起到了双向保护的作用。在生物安全柜内的操作主要问题在于安全柜内外物品的进出。在本实验中可以看出,污染笼盒会对周围局部环境造成污染,但扩散范围不大,操作面的垂直气流可以有效隔离污染物,但是在下风向位置的污染风险存在。因此在生物安全柜的使用过程中应注意防止排风口封堵,防止对气流走向的干扰;同时应注意设定洁净区和非洁净区,动物笼具更换过程中生物安全柜的使用也应遵守这一原则。
操作人员的手的污染难以避免。动物的移动可以借助镊子等工具,但是笼网等的移动还是需要手的直接接触。因此在操作过程中要识别这一感染风险。一旦手套与感染物发生接触,就要进行必要的处理,包括手套消毒或是更换。
3.2浮游菌可以更好地识别感染风险
在负压屏障设施内空气的洁净度较好,空气中的浮游颗粒物较少,细菌等微生物缺少灰尘等颗粒物附着,因此也难以沉降。在本实验中仅在笼盒开放饲养的状态下,笼盒开放30 min后在近笼盒位置检测到沉降菌。这不排除在打开笼盒时的操作带来的气溶胶污染;而24 h后再次采集沉降菌,沉降菌采集时间为30 min,结果各位置均为阴性。但是对动物笼盒台面的20 cm×20 cm拭子培养物却获得较多的指示微生物样品。而在笼盒开放饲养24 h后依然可以采集到浮游菌样品。因此,浮游菌对于感染物的识别灵敏度在本实验中高于沉降菌指标。
3.3负压屏障设施对于感染风险的控制
在动物笼盒开放饲养24 h后采集负压实验室外准备间的浮游菌,多个位置均为阴性。此结果说明实验设施的负压状态可以保证将污染物有效控制在屏障设施内。在排除开放笼盒污染物的30 min后再次测试浮游菌,多个位置的测试结果均为阴性,这表明该设施在正常工况下具有良好的自净能力,该设施的换气次数达到23次/小时,满足中国国家标准对于生物安全实验室换气次数的要求[6],30 min内基本完成了实验室空气的自净。
3.4密闭笼盒可以有效保障动物感染实验安全
本实验使用的笼盒为某国产IVC笼具,其密闭状态是在打开笼具生命窗口过滤帽外盖的状态下进行的。在此状态下保证了动物的基本通气。因此该笼盒并不存在与外界的压力梯度。在无压力梯度的状态下,此笼具的密闭状态可以较好地控制模拟感染性生物因子的空气传播。而IVC笼具是在此基础上通过送排风系统连接笼具,理论上除了保障动物的正常换气外,如果动物笼具不是处于正压状态,在负压屏障设施内使用微负压IVC笼具即可对啮齿动物饲养环节的感染性生物因子进行有效控制。当考虑生物安全的加量防护原则时,可适当提高对IVC笼具此类技术指标的要求。
[1] Bohannon JK, Janosko K, Holbrook MR, et al. Safety precautions and operating procedures in an (A)BSL-4 laboratory: 3.Aerobiology [J]. J Vis Exp, 2016, (116): e53602.
[2] GB 19489-2008, 实验室生物安全通用要求 [S]. 2008.
[3] 段会勇, 柴同杰, 蔡玉梅, 等. ERIC-PCR对鸡舍大肠杆菌气溶胶向舍外环境传播的鉴定[J]. 中国科学(C辑: 生命科学), 2008, 38(1): 74-83.
[4] GB/T 16293-2010, 医药工业洁净室(区)浮游菌的测试方法 [S]. 2010.
[5] GB 14925-2010, 实验动物环境及设施 [S]. 2010.
[6] GB 50346-2011, 生物安全实验室建筑技术规范 [S]. 2011.
Selectionoflaboratoryanimalcagesandrecognitionofinfectionriskinthenegative-pressurebarrierfacility
XIANG Zhi-guang, TONG Wei, GU You-gang, LI Xin-yue, QIN Chuan*
(Institute of Laboratory Animal Sciences, Chinese Academy of Medical Sciences (CAMS) & Comparative Medicine Center, Peking Union Medical College (PUMC), Beijing 100021, China)
ObjectiveMost of the airborne pathogens of infectious animal experiments in biosafety laboratories can be effectively controlled by barrier apparatus. However,the requirements for biosafety parameters of the rodent cages, which are commonly-used devices, are not clear yet. The purpose of this study is to estimate the risk of pathogen exposure by mimicking infectious animal experiments using open cage or sealed cage for rodents in barrier facility under negative pressure in our laboratory, and to evaluate the risk-controlling level of the hardware conditions and management measures of our facility.MethodsE.coli(DH5α, with the kanamycin-resistance gene, Kan+) was used as the indicator microorganism. The risk of pathogen exposure of the following operations were tested: mice raised in open cage or sealed cage (without pressure gradient inside and outside), and sealed-cage changing of mice in biosafety cabinet. The quantities of indicator microorganisms inside and outside the facility with negative pressure were monitored to estimate the efficiency of biosafety-control over the facility.ResultsThere was a risk of pathogen exposure when open cage was used in the barrier facility under negative pressure, and the spread of pathogens could be controlled in barrier facility under negative pressure to some extent. There was no indicator microorganism detected when animals were raised in sealed cage without pressure gradient inside and outside, and the risk of pathogen exposure during the procedure of sealed-cage changing in the biosafety cabinet could be effectively controlled.ConclusionsThe biosafety of animal experiments can be ensured using sealed cage in barrier facility under negative pressure, even without pressure gradient inside and outside of the cage.
Negative-pressure barrier facility; Animal experiments; Infection risk; Sealed cage
R-33
A
1671-7856(2017) 09-0076-04
10.3969.j.issn.1671-7856.2017.09.014
2017-01-03
卫计委公益性行业科研专项(编号:201302006);国家重点研发计划(编号:2016YFD0501000)。
向志光(1980-),男,副研究员,免疫学博士,研究方向:实验动物质量控制。E-mail: xiangzhg@yahoo.com
秦川,女,教授,博士生导师,医学博士,研究方向:实验病理。E-mail: qinchuan@pumc.edu.cn
