高危型人乳头状瘤病毒感染在宫颈病变进展中的风险研究
2017-09-28许惠惠朱海燕章彤彤尚贤文俞加正颜卫华
许惠惠 朱海燕 章彤彤 尚贤文 俞加正 颜卫华
317000 临海,温州医科大学附属浙江省台州医院中心实验室(许惠惠、颜卫华),检验科(朱海燕),健康管理中心(章彤彤),妇科(尚贤文、俞加正)
·论著·
高危型人乳头状瘤病毒感染在宫颈病变进展中的风险研究
许惠惠 朱海燕 章彤彤 尚贤文 俞加正 颜卫华
317000 临海,温州医科大学附属浙江省台州医院中心实验室(许惠惠、颜卫华),检验科(朱海燕),健康管理中心(章彤彤),妇科(尚贤文、俞加正)
目的探讨高危人乳头状瘤病毒(Human papillomavirus,HPV)基因分型检测在宫颈癌前病变诊断中的临床应用价值。方法选取2012年12月至2015年3月在浙江省台州医院妇科初诊的4 095例宫颈癌筛查结果为HPV阳性者作为研究对象,分析HPV型别流行病学特征及HPV阳性者的宫颈组织病理学诊断结果;Logistic回归分析高危型HPV在宫颈癌前病变进展中的风险值。结果浙江省台州地区女性宫颈HPV感染率从高到低依次为HPV52、16、58、39和56;宫颈上皮内瘤变(Cervical intraepithlial neoplasm,CIN)女性中HPV感染率从高到低依次为HPV16、52、58、33和31。Logistic回归分析显示HPV16、33感染者致CIN2+风险性较大,回归系数OR分别为3.670(95%CI: 2.399~5.612,P<0.05)、2.045(95%CI: 1.087~3.848,P<0.05)。CIN2+女性中,细胞学结果为NILM:Logistic回归分析结果显示HPV16感染者致CIN2+的风险较大,回归系数OR=2.539(95%CI: 1.622~3.976,P=0.000);细胞学结果为意义未明的非典型鳞状细胞(Atipical squamous cells of unknown significance,ASCUS):Logistic回归分析结果显示HPV16、58感染者发生CIN2+的风险较大,回归系数OR分别为1.911(95%CI: 0.530~6.893)、1.757(95%CI: 0.557~5.548)。结论高危HPV基因分型检测在宫颈癌前病变诊断中具有重要的临床应用价值,尤其是对宫颈细胞学阴性、ASCUS患者临床处理时的重要参考指标,更精确宫颈癌筛查风险分层。
宫颈癌是最常见的女性生殖道恶性肿瘤。据统计,全球每年约有53万的宫颈癌新发病例,死亡人数超过28万,其中80%发生在医疗资源欠缺的发展中国家。由于发展中国家没有建立经济有效的宫颈癌筛查方案,大多数宫颈癌患者直到晚期才被发现,结果导致83%的女性患者死于本可预防的疾病。人乳头瘤病毒(Human papillomavirus, HPV)持续感染是宫颈癌前病变(宫颈上皮内瘤变,Cenvical intraepithelial neoplasm,CIN)及宫颈癌发生的主要病因[1]。HPV在宫颈癌组织中的检出率高达99%,可通过对HPV 检测,预测宫颈相关疾病恶性进展的风险值,提前干预可降低宫颈癌的发生率。但是,在现阶段采用的宫颈癌筛查方案中,评估高危型HPV在宫颈癌前病变进展中的风险,可降低细胞学假阴性及CIN2+患者漏诊。在前期研究基础上[2],我们将宫颈癌筛查女性中HPV阳性并且有宫颈活检病理诊断结果者作为研究对象,探讨高危HPV基因分型检测在宫颈癌前病变诊断中的临床应用价值。
1 材料与方法
1.1一般资料收集2012年12月至2015年3月温州医科大学附属浙江省台州医院妇科初诊患者的宫颈脱落细胞标本共19 207例,患者年龄18~87岁(41.25±10.04岁),均签订知情同意书。选取HPV阳性者共4 095例(41.69±10.48岁),经宫颈组织病理学诊断者共1 696例(42.17±10.36岁),其中包括参加宫颈细胞学检查者共1 343例和未参加细胞学检查者共353例。本研究排除标准:全子宫切除术、LEEP术后及妇科恶性肿瘤史患者。本研究经浙江省台州医院伦理委员会审查,符合国家及浙江省台州医院研究伦理有关章程。
1.2研究方法
1.2.1 HPV基因分型:基于GP5+/6+PCR-Luminex xMAP技术对HPV病毒进行DNA分型,包括14种高危型(HPV16、18、31、33、35、39、45、51、52、56、58、59、66、68)和12种低危型(HPV06、11、26、40、42、44、53、55、61、73、82、83)[3]。Luminex200多功能液相芯片分析仪(Luminex公司,美国)读取HPV 基因分型结果;严格按照试剂操作说明书进行。
1.2.2 细胞学检查:采用2001年TBS分级报告系统:①NILM:未见上皮内细胞病变;②ASCUS:意义不明确的不典型鳞状细胞;③ASC-H:不除外高度鳞状上皮内瘤变的不典型鳞状细胞;④LSIL:低度鳞状上皮内病变;⑤HSIL:高度鳞状上皮内病变;⑥AGC:不典型腺细胞和腺癌;⑦SCC:鳞状细胞癌。
1.2.3 宫颈病理学诊断:宫颈CIN病理分级:①宫颈炎;②湿疣/CIN1级;③CIN2级;④CIN3级;⑤宫颈癌。
1.3统计学方法采用SPSS16.0软件,应用卡方检验及Logistic回归分析对数据进行统计分析,以P<0.05为差异有统计学意义。
2 结果
2.1台州地区宫颈HPV分布特征台州地区女性HPV感染率21.3%(4095/19207),其中高危型感染占15.6%、低危型感染占5.7%、单一感染占16.0%、混合感染占5.3%。HPV感染率最高的5种高危型分别为52(17.2%)、16(10.4%)、58(9.5%)、39(5.4%)和56(5.2%),HPV感染率最高的3种低危型分别为61(5.5%)、06(3.2%)和44(3.1%)(图1)。

图1 浙江省台州地区女性宫颈高危和低危HPV型别分布Fig.1 Prevalence of high- and low- risk HPV types in Taizhou area of Zhejiang province
在宫颈上皮内瘤变(CIN1-3级)女性中,HPV感染率最高的5种型别分别为16(28.9%,173/599)、52(20.5%,123/599)、58(16.0%,96/599)、33(9.7%,58/599)、31(6.5%,39/599)。在高度宫颈上皮内瘤变(CIN2+)女性中,HPV感染率最高的5种型别分别为16(37.8%,137/362)、52/58(18.2%,66/362)、33(12.2%,44/362)、31(7.2%,26/362)。在不同宫颈CIN病理分级女性中,HPV感染率略有不同(表1)。
2.2HPV感染者宫颈组织病理学诊断结果HPV感染者行宫颈活检病理学诊断共1 696例,包括正常1 097例(高危HPV感染928例,占84.6 %)、宫颈湿疣/CIN1级237例(高危HPV感染202例,占85.2%)、CIN2级130例(高危HPV感染122例,占93.8%)、CIN3级193例(高危HPV感染175例,占90.7%)、宫颈癌39例(鳞癌35例、腺癌4例;高危HPV感染39例,占100.0%)。
按是否检出CIN2+进行分类,将HPV型别进行Logistic回归分析、校准年龄因素后,发现HPV16感染者发生CIN2+的风险较大,回归系数OR值为3.670(95%CI: 2.399~5.612,P<0.05);HPV33感染者发生CIN2+的风险较大,回归系数OR值为2.045(95%CI: 1.087~3.848,P<0.05)。而其他HPV型别感染与宫颈CIN2+发生风险无显著性差异(P>0.05)。
2.3高危HPV基因分型在宫颈细胞学筛查中的作用高危型HPV感染者共1 149例参加了宫颈细胞学检查,表2为高危型HPV感染者细胞学检查及组织病理学诊断结果分组。单独采用宫颈HPV筛查与单独采用细胞学筛查结果比较,组织病理学异常者CIN2+检出率显著上升(χ2=42.26,P<0.05)。在CIN2+患者中,细胞学检测结果为NILM占12.1%(104/856),经Logistic回归分析,HPV16感染者发生CIN2+的风险较大,回归系数OR=2.539(95%CI: 1.622~3.976,P=0.000)。

表1 高危HPV型别在HPV阳性且宫颈组织病理学异常者中的分布Tab.1 Prevalence rates of high-risk HPV types for cervical pathology status among HPV-positive women
注:a经Logistic回归分析,HPV16感染者发生CIN2+的分险较大,回归系数OR值为3.670(95%CI: 2.399-5.612,P<0.05);b经Logistic回归分析,HPV33感染者发生CIN2+的分险较大,回归系数OR值为2.045(95%CI: 1.087-3.848,P<0.05)。
Note:aORs for CIN2+ in HPV16 infected women was 3.670 (95%CI2.399-5.612,P<0.05) by Logistic regression;bORs for CIN2+ in HPV33 infected women was2.045 (95%CI1.087-3.848,P<0.05) by Logistic regression
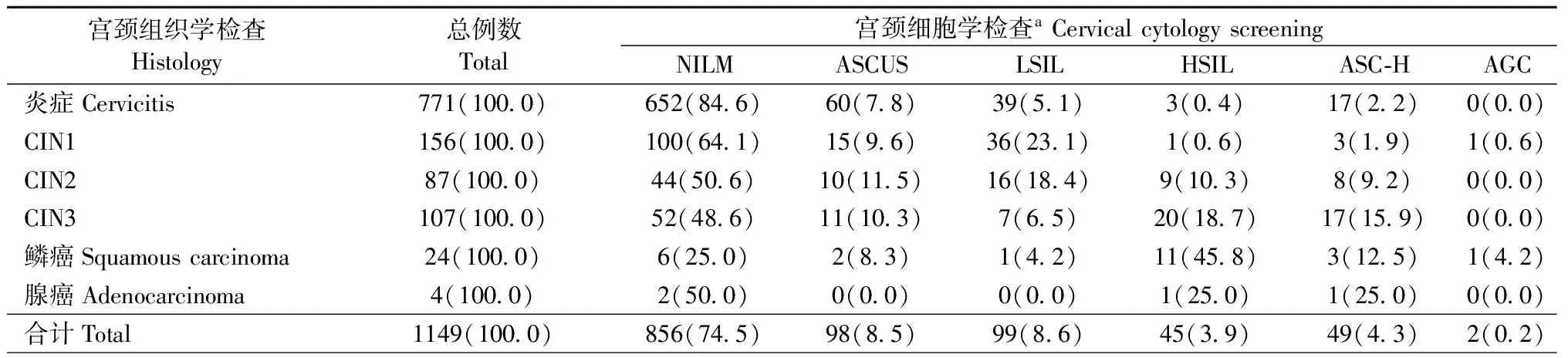
表2 高危型HPV感染者的宫颈细胞学和组织病理学结果Tab.2 Results of cervical cytology and pathological diagnosis among HR-HPV positive women
注:a经卡方检验分析,采用宫颈HPV筛查与细胞学检查相比,对CIN2+的检出率显著上升(χ2=42.26,P<0.05)。
Note:aCompared to cytology test, HPV screening was significantly increased in detecting CIN2+ (χ2=42.26,P<0.05) by Chi-square test
细胞学诊断结果为ASCUS的患者中CIN2+占23.5%(23/98),经Logistic回归分析,HPV16、58感染者发生CIN2+的风险较大,回归系数OR分别为1.911(95%CI: 0.530~6.893)、1.757(95%CI: 0.557~5.548)。细胞学诊断结果为LSIL的患者中CIN2+占24.2%(24/99),经Logistic回归分析,HPV16、31、33、58感染者发生CIN2+的风险较大,回归系数OR分别为1.317(95%CI: 0.372~4.659)、2.027(95%CI: 0.425~9.655)、4.074(95%CI: 1.021~16.260,P=0.047)、1.857(95%CI: 0.696~4.960)。
3 讨论
宫颈癌筛查已成功降低全球女性宫颈癌的发病率和病死率。2002年美国癌症协会(ACS)首次将HPV DNA检测纳入宫颈癌筛查方案[4]。基于欧美国家研究数据,宫颈癌病例99%以上的HPV呈阳性;其中,HPV16在宫颈癌中占55%~60%、HPV18占10%~15%、其他高危型HPV占剩余的25%~35%[5]。随着流行病学调查研究发现,大多数种群的HPV感染高峰发生在初次性行为年龄中位数后几年,在美国是17岁[6]。但是,大多数女性(约90%)HPV感染是一个短暂且无症状的过程,通常在1~2年内自行消退;只有少数持续感染者发展为宫颈癌前病变的几率明显增加。回顾性研究指出,持续感染HPV16者(12~24个月)在5年内20%~30%会发展为CIN3,在30年内约30%(未经临床治疗)、1%(经临床治疗)发展为宫颈癌[7]。
2012美国ASCCP新版宫颈癌筛查指南推荐:30~65岁女性,优先推荐每5年进行细胞学和高危型HPV联合筛查,细胞学结果为HSIL、ASC-H及AGC以上或细胞学结果阴性HPV16/18阳性者,直接阴道镜下行多点活检;细胞学结果阴性其他高危型HPV阳性者,12个月后复查细胞学和高危型HPV检测等[8]。目前,浙江省台州地区仍采用两者联合筛查方案,尽管对CIN2+具有更高的敏感性和特异性,却忽略了除HPV16、18以外的其他12种高危HPV型别在宫颈癌前病变进展中的作用。基于本研究结果,我们推荐将高危HPV基因分型作为宫颈癌初筛方案取代传统的宫颈细胞学和HPV联合筛查。
近期,美国ASCCP发布了过渡期临床指导:将高危型HPV检测作为初筛方法用于宫颈癌筛查[9],与本研究结论基本一致。如:HPV16/18阳性者可直接行阴道镜下活检诊断,HR-HPV阴性者进入第二轮常规筛查。值得注意的是,除HPV16/18外,其他12种高危型HPV阳性者的临床处理,过渡期临床指导延续了2012新版指南。但是,基于本研究结论,我们推荐如果HPV58阳性合并细胞学≥ASCUS、HPV31、33阳性合并细胞学≥LSIL,推荐阴道镜下行多点活检。
单独HPV检测结果有关CIN3+的诊断灵敏度与联合筛查方案数值相近,但具有极佳的阴性预测价值[10-13]。随访结果显示3年内CIN3+发生率0.069%(HPV筛查阴性者)显著低于5年内CIN3+发生率0.11%(联合筛查均为阴性者);值得注意的是,3年内CIN3+检出率(0.069%)比单独细胞学结果阴性者要降低一半(0.19%)[10]。ATHENA研究发现,HPV16/18阳性者3年内CIN3+发生风险约为21.1%(95%CI: 18.4~24.0),其他高危HPV型别5.4%(95%CI: 4.5~6.4)[14]。
综上,HPV基因分型检测在宫颈癌前病变诊断中具有重要的临床应用价值,尤其是在宫颈细胞学阴性、ASCUS和LSIL患者临床处理时的重要参考指标。
[1] Chelimo C, Wouldes TA, Cameron LD, et al. Risk factors for and prevention of human papillomaviruses (HPV), genital warts and cervical cancer [J]. J Infect, 2013, 66(3): 207-217. doi: 10.1016/j.jinf.2012.10.024.
[2] 许惠惠, 石卫武, 徐玖飞, 等. HPV基因分型在宫颈癌筛查风险分层管理中的价值[J]. 中华实验和临床病毒学杂志, 2016, 30(1): 14-18. doi: 10.3760/cma.j.issn.1003-9279. 2016.01.004.
[3] Xu HH, Shi WW, Lin A, et al. HLA-G 3' untranslated region polymorphisms influence the susceptibility for human papillomavirus infection[J]. Tissue Antigens, 2014, 84(2):216-222. doi: 10.1111/tan.12359.
[4] Saslow D, Runowicz CD, Solomon D, et al. American Cancer Society guideline for the early detection of cervical neoplasia and cancer[J]. CA Cancer J Clin, 2002, 52(6):342-362. doi: 10.3322/canjclin.52.6.342.
[5] de Sanjose S, Quint WG, Alemany L, et al. Human papillomavirus genotype attribution in invasive cervical cancer: a retrospective cross-sectional worldwide study[J]. Lancet Oncol, 2010, 11(11): 1048-1056. doi: 10.1016/S1470-2045(10)70230-8.
[6] Mosher WD, Chandra A, Jones J. Sexual behavior and selected health measures: men and women 15-44 years of age, United States, 2002[J]. Adv Data, 2005, 15(362):1-55.
[7] McCredie MR, Sharples KJ, Paul C, et al. Natural history of cervical neoplasia and risk of invasive cancer in women with cervical intraepithelial neoplasia 3: a retrospective cohort study[J]. Lancet Oncol, 2008, 9(5):425-434. doi: 10.1016/S1470-2045(08)70103-7.
[8] Saslow D, Solomon D, Lawson HW, et al. American Cancer Society, American Society for Colposcopy and Cervical Pathology, and American Society for Clinical Pathology screening guidelines for the prevention and early detection of cervical cancer[J]. Am J Clin Pathol, 2012, 137(4):516-542. doi: 10.1309/AJCPTGD94EVRSJCG.
[9] Huh WK, Ault KA, Chelmow D, et al. Use of primary high-risk human papillomavirus testing for cervical cancer screening: interim clinical guidance[J]. Gynecol Oncol, 2015, 136(2):178-182. doi: 10.1016/j.ygyno.2014.12.022.
[10] Gage JC, Schiffman M, Katki HA, et al. Reassurance against future risk of precancer and cancer conferred by a negative human papillomavirus test[J]. J Natl Cancer Inst, 2014, 106(8): dju153. doi: 10.1093/jnci/dju153.
[11] Katki HA, Kinney WK, Fetterman B, et al. Cervical cancer risk for women undergoing concurrent testing for human papillomavirus and cervical cytology: a population-based study in routine clinical practice[J]. Lancet Oncol, 2011, 12(7):663-672. doi: 10.1016/S1470-2045(11)70145-0.
[12] Dillner J, Rebolj M, Birembaut P, et al. Long term predictive values of cytology and human papillomavirus testing in cervical cancer screening: joint European cohort study[J]. BMJ, 2008, 337:a1754. doi: 10.1136/bmj.a1754.
[13] Rijkaart DC, Berkhof J, Rozendaal L, et al. Human papillomavirus testing for the detection of high-grade cervical intraepithelial neoplasia and cancer: final results of the POBASCAM randomised controlled trial[J]. Lancet Oncol, 2012, 13(1):78-88. doi: 10.1016/S1470-2045(11)70296-0.
[14] Castle PE, Stoler MH, Wright TC, et al. Performance of carcinogenic human papillomavirus (HPV) testing and HPV16 or HPV18 genotyping for cervical cancer screening of women aged 25 years and older: a subanalysis of the ATHENA study[J]. Lancet Oncol, 2011, 12(9):880-890. doi: 10.1016/S1470-2045(11)70188-7.
Riskevaluationofhigh-riskhumanpapillomavirusgenotypingincervicallesionsprogress
XuHuihui,ZhuHaiyan,ZhangTongtong,ShangXianwen,YuJiazheng,YanWeihua
MedicalResearchCenter(XuHH,YanWH),ClinicalLaboratory(ZhuHY),HealthManagementCenter(ZhangTT),DepartmentofGynecology(ShangXW,YuJZ),WenzhouMedicalUniversityAffiliatedtoTaizhouHospitalofZhejiangProvince,Linhai317000,China
YanWeihua,Email:yanwhcom@yahoo.com
ObjectiveTo evaluate the clinical value of high-risk humam papillomavirus(HR-HPV) genotyping in diagnosis of cervical lesions.MethodsBetween December 2012 and March 2015, a total of 4 095 women who were diagnosed as cervical inflammation-related disease were chosen to be evaluated in gynecological clinic at Taizhou Hospital of Zhejiang Province. All the women experienced HPV genotyping, analysis of the epidemiological characteristics of HPV types in Taizhou area and theresult of histopathologic diagnosis of HPV positive women. Logistic regression analysis was used to estimate the risk of HR-HPV genotyping in cervical lesion progression.ResultsOverall, HPV52 was the most prevalent genotype, followed by HPV16,58,39 and 56. Among the women with cervical intraepithelial neoplasm (CIN), HPV16 was the most frequent type, followed by HPV52,58,33 and 31. Logistic regression analysis showed that a higher risk of CIN2+ for women infected with HPV16 or HPV33, the regression coefficients OR were 3.670(95%CI: 2.399-5.612,P<0.05) and 2.045(95%CI: 1.087-3.848,P<0.05), respectively. Logistic regression analysis showed that a higher risk of CIN2+ for NILM with positive HPV16, and the regression coefficients OR were 2.539(95%CI: 1.622-3.976,P=0.000); the ASCUS with positive HPV16 and 58 had higher risk of CIN2+, the regression coefficients OR were 1.911(95%CI:0.530-6.893) and 1.757(95%CI:0.557-5.548), respectively.ConclusionsHPV genotyping has important clinical value to detect precancerous cervical lesions, especially when cervical cytology is negative, in management of patiemts with atypical squamous cells of an undertermined significance(ASCUS) or low grade squamous intraepithelial lesion(LSIL).
Human Papillomavirus; Genotype; Screening; Precancerous Conditions
乳头状瘤病毒,人;基因型;筛查;癌前状态
2016-04-08)
(本文编辑:唐浏英)
颜卫华,Email: yanwhcom@yahoo.com
10.3760/cma.j.issn.1003-9279.2017.04.006
浙江省公益技术应用研究计划项目(2016C33231);浙江省医药卫生科技计划项目(2015KYB438);台州市医学会科学研究基金(TZSYXH15-11)
Fundprograms: Science and Technology Bureau of Zhejiang Province (2016C33231); Health Bureau of Zhejiang Province (2015KYB438); Taizhou Medical Research Fund (TZSYXH15-11)
