白藜芦醇对血红素氧化酶-1诱导的离体星形胶质细胞损伤的保护作用
2017-09-27王海涛张永东郭红云刘元强苏海翔
王 涛 郭 欢 王海涛 张永东 郭红云 刘元强 苏海翔
(甘肃省医学科学研究院转化医学研究中心,甘肃 兰州 730050)
白藜芦醇对血红素氧化酶-1诱导的离体星形胶质细胞损伤的保护作用
王 涛 郭 欢 王海涛 张永东 郭红云 刘元强 苏海翔
(甘肃省医学科学研究院转化医学研究中心,甘肃 兰州 730050)
目的探讨白藜芦醇对血红素氧化酶(HO)-1诱导的离体星形胶质细胞损伤的保护作用。方法体外培养、纯化获得星形胶质细胞,并构建 HO-1 基因转染入星形胶质细胞,在施加白藜芦醇干预后,运用CCK-8 法检测细胞损伤情况,Western印迹检测HO-1 蛋白的表达及普鲁士蓝染色法检测铁离子的沉积情况。结果GFAP 鉴定显示95%以上的细胞为星形胶质细胞;转染HO-1基因入星形胶质细胞后 HO-1 蛋白显著升高2.3倍;在施加白藜芦醇干预后,100 μmol/L白藜芦醇均能降低HO-1 蛋白的表达;同时,10、50 μmol/L白藜芦醇也能够降低55%铁离子的沉积。结论白藜芦醇对HO-1诱导的离体星形胶质细胞损伤具有较好的保护作用。
白藜芦醇;血红素氧化酶-1;星形胶质细胞;铁沉积
研究表明,白藜芦醇在帕金森病(PD)、阿尔茨海默病(AD)等多种中枢神经系统退行性疾病中发挥着重要保护作用〔1,2〕。血红素氧化酶(HO)能够催化血红素降解的酶,其中诱导型的 HO-1 所催化的酶解反应被认为是一种由氧应激引起的细胞保护性反应机制〔3〕。有研究发现AD患者脑组织的病理改变有β淀粉样蛋白(Aβ)沉积,线粒体过量铁沉积、氧化性损伤、功能障碍等,这些病理变化与患者脑组织 HO-1 高表达密切相关〔4〕。目前研究已经发现,HO-1 的高表达对离体星形胶质细胞具有损伤作用〔5〕,同时会增加细胞内的铁离子沉积〔6〕,促进线粒体的氧化性损伤〔4〕。本实验构建 HO-1 过表达的星形胶质细胞模型,观察白藜芦醇对 HO-1 诱导的离体星形胶质细胞 HO-1 表达和铁离子沉积的影响。
1 材料与方法
1.1材料与试剂 DMEM/F12 培养基和胎牛血清购于 Hyclone公司;HO-1兔抗大鼠多克隆抗体购于Abcam公司;β-actin小鼠抗大鼠单克隆抗体、GFAP兔抗大鼠单克隆抗体、辣根过氧化物酶标记的山羊抗兔 IgG、辣根过氧化物酶标记的山羊抗小鼠 IgG 购于中杉金桥公司;白藜芦醇(CAS No.:501-36-0)购于 Aladdin 公司;CCK-8 购于日本同仁公司;GenEscortTMⅡ转染试剂体购于慧基生物有限公司;普鲁士蓝染色试剂盒购于索莱宝公司。
1.2星形胶质细胞培养及鉴定 参照Gupta等〔4〕的方法,取新生2 d内的乳鼠,超净台内无菌条件下断头取脑分离出大脑皮层剪碎,胰酶消化,离心、吹打及过滤后,接种于培养瓶内,放入37℃、5%CO2饱和湿度培养箱内培养45~60 min后,轻轻翻转培养瓶,采用差速贴壁处理〔7〕,去除成纤维细胞成分。5~7 d 传代 1 次,传至第3代时,使用GFAP抗体的免疫组化鉴定星形胶质细胞。
1.3建立 HO-1 过表达的星形胶质细胞模型 参照Song等〔8〕的方法,扩增的 HO-1 基因片段与 pcDNA3.1/Zeo 载体连接,转化 E.Coli Top10 感受态细胞,提取、纯化的质粒用紫外分光计测定 A260/A280 值和浓度,内切酶HindⅢ和BamHⅠ双酶切后进行琼脂糖凝胶电泳初步鉴定,并送上海生工生物技术有限公司测序进一步验证,按照相同的方法,制备 1 个不带有 HO-1 基因片段的表达载体作为阴性对照。细胞培养用含有10% 胎牛血清的DMEM/F12培养基,在37℃条件下、5%CO2饱和湿度培养箱中培养。转染前24 h接种星形胶质细胞至24孔板,每孔细胞约2×105个,转染时细胞融合度达到80%~90%。按照 GenEscortTMⅡ 说明书配制质粒和脂质体复合物,转染体系为 200 μl,每孔终体积为2 ml,放入37℃、5% CO2饱和湿度培养箱中继续培养4 h后换液,同时设立阴性对照组。
1.4实验分组 将实验分为HO-1组和HO-1+白藜芦醇组,其中白藜芦醇浓度分为25、50、100、200、400和800 μmol/L 6个亚组,测定细胞增殖情况,计算IC50值。将细胞分为Sham组(转染阴性对照)、HO-1 组和 HO-1+白藜芦醇组,其中白藜芦醇浓度分为 10、50和100 μmol/L 3个亚组,鉴定 HO-1 蛋白表达水平和铁离子的沉积情况。
1.5CCK-8 测定细胞抑制率 将转染后的模型细胞接种于96孔板,同时设空白对照组(未施加白藜芦醇处理),阴性对照组(不加 CCK-8),每孔加200 μl含不同浓度白藜芦醇的 DMEM/F12培养基,培养48 h后加入 10 μl CCK-8 溶液,细胞培养箱内孵育4 h,酶标仪450 nm下测各孔吸光度。每个检测浓度下设4个复孔,重复3次检测,并计算白藜芦醇对过表达HO-1细胞模型的抑制率。根据Bliss法运用SPSS16.0计算IC50值。抑制率计算公式:细胞抑制率=〔(对照孔-实验孔)/(对照孔-空白孔)〕×100%。
1.6Western印迹检测白藜芦醇对模型细胞HO-1表达的影响 取等量蛋白样品加入10%SDS-PAGE分离后,以半干转法转至 NC 膜上,加入脱脂牛奶室温摇床封闭2 h;分别加入稀释的一抗,4℃过夜;次日洗脱缓冲液洗膜,分别加入相应二抗室温孵育1 h,洗膜;电化学发光(ECL)显色后,置于Chemi Doc XRS+凝胶成像系统中曝光并拍照。采用 Image Lab 5.2 软件对显影条带进行分析,计算HO-1条带与内参条带的灰度比值,作为 HO-1 蛋白的相对表达水平。
1.7白藜芦醇对HO-1过表达细胞模型中铁沉积的影响 细胞爬片用4%的多聚甲醛固定10~20 min,蒸馏水冲洗2次,每次2 min。配置Perls stain普鲁士蓝染液(亚铁氰化钾溶液和浓盐酸以1∶1的比例混合),滴在爬片上,室温孵育60 min后,弃染液,蒸馏水冲洗2次,每次2 min。置于显微镜下观察普鲁士蓝染色的分布,400倍下每组各取10个视野照相存档。使用Image-Pro Plus 6.0图像分析软件对普鲁士蓝染色结果进行免疫组化定量分析,观察值用平均光密度(IOD)值表示。
1.8统计学方法 采用SPSS16.0 统计软件包进行单因素方差分析。
2 结 果
2.1星形胶质细胞鉴定结果 星形胶质细胞传代至第3代时采用GFAP抗体免疫组化鉴定,阳性率达95%以上,结果说明绝大多数细胞为星形胶质细胞,见图1。
2.2HO-1 过表达细胞模型的建立 Western印迹技术检测转染阴性对照载体的星形胶质细胞的HO-1蛋白(32 kD) 条带较浅,而转染目的基因载体的星形胶质细胞HO-1蛋白表达显著增强,与Sham组相比升高2.3倍,其 Mean IOD比值有显著差异,见图2。每种细胞β-Tubulin 蛋白条带表达水平相同,提示上样量无差异。

图1 星形胶质细胞的免疫组化鉴定(×400)
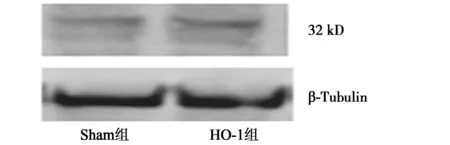
图2 Western印迹分析质细胞和转染HO-1过表达细胞模型
2.3CCK-8测定细胞抑制率 25、50、100、200、400、800 μmol/L白藜芦醇对HO-1基因转染后的星形胶质细胞生长抑制率分别为(12.65±1.02)%、(35.75±1.92)%、(50.51±3.33)%、(55.48±4.11)%、(78.72±7.21)%及(85.26±5.10)%,细胞抑制率与药物浓度呈正相关,并具有良好的线性关系,相关系数R2为0.959。根据 Bliss 法运用SPSS16.0软件拟合线性回归方程,计算出白藜芦醇的 IC50值为(118.03±2.49)μmol/L。
2.4Western印迹检测白藜芦醇对模型细胞 HO-1表达的影响 白藜芦醇对细胞模型的HO-1表达的影响见图3,与Sham组相比,HO-1组 HO-1蛋白表达增加7.14倍。与 HO-1组相比,10、50、100 μmol/L白藜芦醇能不同程度地降低过表达HO-1的星形胶质细胞中HO-1蛋白的表达,分别降低到37.70%,32.85%及39.81%。
2.5白藜芦醇对HO-1过表达细胞模型中铁沉积的影响 普鲁士蓝染色显示,Sham 组大鼠细胞几乎没有蓝色铁沉积。与 Sham 组相比较,HO-1组细胞内可见明显蓝色铁沉积。与HO-1组比较,白藜芦醇组蓝色染色均明显减少。见图4。定量分析显示,与 Sham 组(2.16)比较,HO-1组的Mean IOD值(5.55)提高了2.58倍(P<0.01);与HO-1组比较,白藜芦醇能不同程度地减少由于过表达HO-1而导致的铁离子,10 μmol/L白藜芦醇降低到55.17%(3.06,P<0.01),50 μmol/L白藜芦醇降低到55.63%(3.09,P<0.01)。

1~5:Sham组、HO-1组、HO-1+10、50、100 μmol/L白黎芦醇组图3 白藜芦醇作用细胞模型后HO-1表达的 Western印迹检测结果
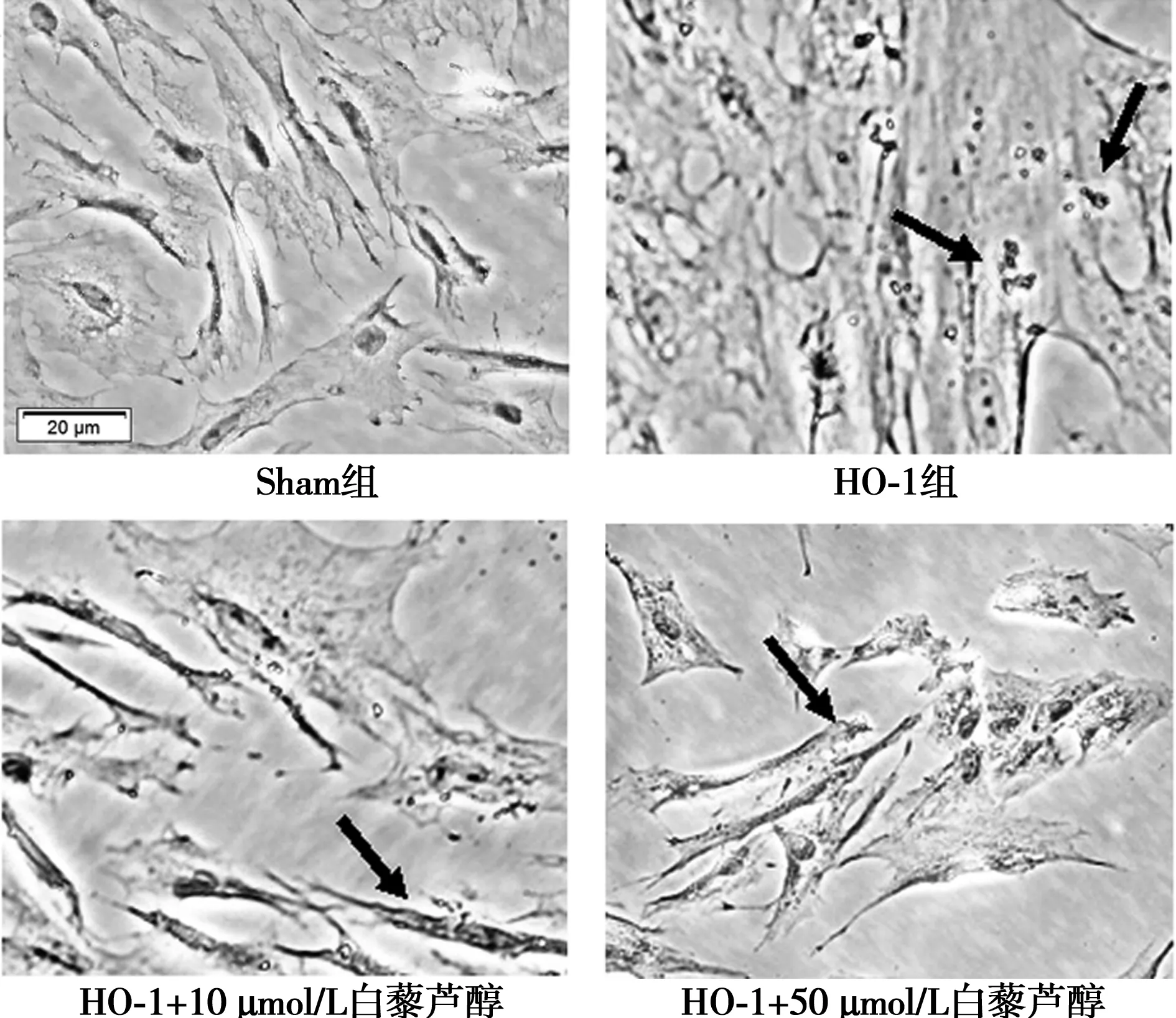
箭头所示为铁沉积部位图4 白藜芦醇对HO-1引起的铁沉积的影响 (普鲁士蓝染色,×400)
3 讨 论
HO是参与血红素降解的重要酶类之一,可把血红素氧化为胆绿素、游离的Fe2+和一氧化碳〔9〕,其中诱导型的HO-1所催化的酶解反应被认为是一种由氧应激引起的细胞保护性反应机制〔10〕。研究表明,AD患者脑组织中线粒体过量铁沉积、氧化性损伤、β淀粉样蛋白沉积等病理变化与患者脑组织HO-1高表达密切相关〔4〕。轻微认知障碍(MCI)患者的颞叶皮层和海马神经胶质细胞中HO-1表达水平显著高于非痴呆组,而与AD患者相近〔11〕。这说明皮层和海马的氧化胁迫造成的神经胶质细胞中HO-1的高表达现象是 AD 发病机制的早期事件。由于AD的病因不明,目前临床上主要针对AD胆碱能神经元受损假说使用神经递质替代治疗药物及非特异性神经保护类药物以延缓神经元退行性病变的进展,如雌激素、非甾体类抗炎药、神经营养因子、促神经细胞代谢药等。但是,目前国内外在临床上尚缺乏针对调节HO-1通路的 AD治疗药物。因此,寻找毒性低、能降低HO-1损伤、提高治疗效果的药物显得尤为重要。白藜芦醇是具有多种有益的生物学效应的多酚类化合物,具有抗氧化、抗肿瘤、抗炎、增强免疫调节、保护心血管等多种有益于人类健康的药理活性,Jin等〔12〕发现白藜芦醇对 6-羟基多巴胺诱导的PD模型大鼠具有明显的保护效应,能够降低模型大鼠脑黑质中炎症相关因子环氧化酶(COX)-2及肿瘤坏死因子(TNF)-α的表达。王刚等〔1〕也发现白藜芦醇能够改善小鼠海马神经元的神经可塑性,从而逆转Aβ引起的小鼠的学习记忆损伤。由于星形胶质细胞增生与激活在AD的发病机制中起着重要的作用。AD病理性神经血管单元的重塑与星形胶质细胞损伤有关,且在疾病早期出现,能导致认知异常〔13〕。本实验表明白藜芦醇可能对HO-1高表达导致的细胞模型损伤具有保护作用。这与Juan等〔14〕的研究关于白藜芦醇在≥20 μmol/L时,降低HO-1的表达和启动子的活性的研究结论一致。本研究表明白藜芦醇对HO-1诱导的离体星形胶质细胞的损伤具有保护作用,而这种保护能力可能与其能够清除由于HO-1催化血红素分解而产生的自由基有关。此结果与HO-1抑制剂锡中卟啉(SnMP)或DEX可消除人HO-1基因过表达的影响,减少铁离子的沉积的研究结果非常相似〔15〕。
铁可催化H2O2还原成活性极强的羟自由基,可能是造成氧胁迫的主因,同时,HO-1表达水平升高是星形神经胶质细胞线粒体铁沉积的关键,而多酚类的化合物由于具有天然螯合铁的能力,因此可减轻铁超载导致的神经细胞损伤。本实验结果证实白藜芦醇能够降低HO-1表达的同时,也具有清除HO-1高表达所引起的铁沉积的能力,10 μmol/L白藜芦醇是保护血红素氧化酶-1诱导的离体星形胶质细胞损伤的最佳浓度。
1王 刚,陈 玲,吴 凡,等.反式白藜芦醇对Aβ25-35诱导的阿尔兹海默病小鼠模型学习记忆的改善作用〔J〕.中国现代应用药学,2015;32(7):785-90.
2徐 芳.白藜芦醇对帕金森病小鼠行为表现及对多巴胺能神经元NF-κB蛋白表达的影响〔J〕.山东医药,2015;55(28):32-3.
3He M,Nitti M,Piras S,etal.Heme oxygenase-1-derived bilirubin protects endothelial cells against high glucose-induced damage〔J〕.Free Radic Biol Med,2015;89(1):91-8.
4Gupta A,Lacoste B,Pistell PJ,etal.Neurotherapeutic effects of novel HO-1 inhibitors in vitro and in a transgenic mouse model of Alzheimer's disease〔J〕.J Neurochem,2014;131(6):778-90.
5Song W,Zukor H,Liberman A,etal.Astroglial heme oxygenase-1 and the origin of corpora amylacea in aging and degenerating neural tissues〔J〕.Exp Neurol,2014;254(1):78-89.
6谢淑玲,伍文彬,彭丽燕,等.脑铁超载相关蛋白与阿尔茨海默病相关性〔J〕.中国老年学杂志,2015;35(12):3456-9.
7周 欣,明晓云,康颂建,等.差速贴壁技术对大鼠脑皮质星形胶质细胞纯化率的影响〔J〕.中国组织工程研究与临床康复,2007;11(15):2829-31.
8Song W,Zukor H,Lin SH,etal.Unregulated brain iron deposition in transgenic mice over-expressing HMOX1 in the astrocytic compartment〔J〕.J Neurochem,2012;123(2):325-36.
9Wegiel B,Nemeth Z,Correa-Costa M,etal.Heme oxygenase-1:a metabolic nike〔J〕.Antioxid Redox Signal,2014;20(11):1709-22.
10Kumar A,Ganini D,Deterding LJ,etal.Immuno-spin trapping of heme-induced protein radicals:implications for heme oxygenase-1 induction and heme degradation〔J〕.Free Radic Biol Med,2013;61:265-72.
11Sherwin BB,Chertkow H,Schipper H,etal.A randomized controlled trial of estrogen treatment in men with mild cognitive impairment〔J〕.Neurobiol Aging,2011;32(10):1808-17.
12Jin F,Wu Q,Lu YF,etal.Neuroprotective effect of resveratrol on 6-OHDA-induced Parkinson's disease in rats〔J〕.Eur J Pharmacol,2008;600(1-3):78-82.
13Verkhratsky A,Olabarria M,Noristani HN,etal.Astrocytes in Alzheimer's disease〔J〕.Neurotherapeutics,2010;7(4):399-412.
14Juan SH,Cheng TH,Lin HC,etal.Mechanism of concentration-dependent induction of heme oxygenase-1 by resveratrol in human aortic smooth muscle cells〔J〕.Biochem Pharmacol,2005;69(1):41-8.
15Ham D,Schipper HM.Heme oxygenase-1 induction and mitochondrial iron sequestration in astroglia exposed to amyloid peptides〔J〕.Cell Mol Biol (Noisy-le-grand),2000;46(3):587-96.
〔2016-07-16修回〕
(编辑 苑云杰/曹梦园)
R741
A
1005-9202(2017)18-4452-04;doi:10.3969/j.issn.1005-9202.2017.18.009
甘肃省中医药管理局科研计划项目(No.GZK-2010-Z7)
苏海翔(1963-),女,博士,研究员,主要从事衰老、神经退行性疾病、肿瘤相关的机制研究。
王 涛(1981-),男,助理研究员,硕士,主要从事抗神经退行性疾病、抗肿瘤药物筛选及其机制研究。
