基于氧化型谷胱甘肽保护的荧光金纳米团簇的制备及其对Fe3+的检测
2017-09-26谢立娟李碧野席海山
董 哲,谢立娟,李 阳,2,李碧野,李 丹,席海山
(1.内蒙古民族大学 天然产物化学及功能分子合成自治区重点实验室,内蒙古 通辽 028043; 2.通辽市医院骨一科,内蒙古 通辽 028000)
基于氧化型谷胱甘肽保护的荧光金纳米团簇的制备及其对Fe3+的检测
董 哲1*,谢立娟1,李 阳1,2,李碧野1,李 丹1,席海山1
(1.内蒙古民族大学 天然产物化学及功能分子合成自治区重点实验室,内蒙古 通辽 028043; 2.通辽市医院骨一科,内蒙古 通辽 028000)
利用氧化型谷胱甘肽作为还原剂和稳定剂,通过绿色合成法制备了具有良好生物相容性的金纳米团簇(GSSG-Au NCs),其平均粒径大小为2.9 nm。以其为荧光探针实现了对Fe3+的高灵敏检测,且对干扰离子具有高度选择性,线性范围宽 (0.1~30 μmol/L),检出限为0.03 μmol/L。该方法用于实际水样(自来水、湖水和河水)中Fe3+的测定,结果满意。
金纳米团簇;氧化型谷胱甘肽;荧光探针;铁离子
铁是生物体所必需的微量元素之一,也是人体中含量最丰富的过渡金属,为细胞代谢和基因表达调控提供了必要条件[1]。许多酶均是通过Fe3+来维持其生物活性,生物机体内Fe3+缺乏或摄入过多,可能会引起多种生理疾病甚至死亡[2]。因此,高选择性和高灵敏地检测Fe3+具有十分重要的意义[3]。目前,痕量检测Fe3+的方法主要有离子色谱法、原子发射光谱法、原子吸收光谱法、伏安法和电感耦合等离子体质谱法等,但这些方法存在仪器运行成本较高、维护繁琐等缺点,限制了其广泛应用[3-4]。
贵金属纳米团簇具有生物毒副作用低、化学及光稳定性强、斯托克斯位移大、量子产率高等优点,近年来在生化分析领域引起广泛关注[5-6]。金纳米团簇作为分析灵敏度高及线性检测范围宽的荧光探针,近年来广泛应用于重金属和生物蛋白等的检测[7-10]。基于金纳米团簇材料的荧光分析方法具有操作简便和灵敏度高等优点,在生物医学传感器、纳米电子、新型催化剂、光电纳米器件等领域拥有广阔的应用前景。谷胱甘肽是一种含有γ-谷酞基和巯基(—SH)的三肽化合物,机体内一般以还原型(GSH)形式存在,具有一定生物活性,氧化应激后形成氧化型谷胱甘肽(GSSG)[11-12]。本实验设计合成了基于GSSG保护的水溶性荧光金纳米团簇,并对水样中的Fe3+进行检测,该探针响应灵敏,可用于实际水样中铁离子的测定,对Fe3+快速检测具有潜在的应用价值。
1 实验部分
1.1 仪器与试剂
透射电子显微镜(JEM-2100F,日本电子),动态光散射仪(Dynapro,美国怀雅特),荧光分光光度计(970CRT,上海精科),紫外可见分光光度计(UV-Vis 8453,美国安捷伦),荧光寿命测试系统(FL-TCSPC,法国堀场),集热式恒温加热磁力搅拌器(DF-101,金坛区岸头林丰实验仪器厂)。
氯金酸(HAuCl4)、氧化型谷胱甘肽(GSSG)和2-(N-吗啡啉)乙烷磺酸钠(MES)购于阿拉丁(Aladdin)试剂中国有限公司;其它所用试剂均为国产分析级,购于长春鼎国生物技术有限责任公司,未经进一步纯化。实验用水由Milli-Q(18.2 MΩ·cm)超纯水系统(Millipore,Biocel)制备。
1.2 实验方法
1.2.1 GSSG-Au NCs的合成参考Guo等[13-14]的制备方法并加以适当修改:在圆底烧瓶中分别加入5 mL的HAuCl4溶液(5.0 mmol/L),在冰浴中磁力搅拌下,将5 mL的GSSG溶液(2.0 mmol/L)逐滴加入到烧瓶中。将溶液不断搅拌20 min后,再逐滴加入10 mL的0.1% NaBH4溶液,然后快速加入1 mL 0.50 mol/L的NaOH溶液。撤掉冰浴的保护后,再不断搅拌8 h。对所得混合溶液施加总功率为90 W的超声波10 min,避光静置3 h后得到黄棕色溶液。所得GSSG-Au NCs用锡箔纸包好,置于4 ℃冰箱内避光储存备用[15-16]。
1.2.2 Fe3+的荧光检测将100 μL的Fe3+溶液(浓度为0.5~800 μmol/L)加入到调配好的GSSG-Au NCs溶液中(30 μL的GSSG-Au NCs溶液,200 μL的MES缓冲溶液和1 670 μL的水溶液),每次混合摇匀后均静置30 min。在室温下,荧光强度测定时的激发波长为361 nm,激发和发射狭缝宽度均为5 nm。考察不同金属离子对GSSG-Au NCs的荧光猝灭情况,验证荧光探针检测Fe3+的选择性。
2 结果与讨论
2.1 GSSG-Au NCs制备条件的优化
2.1.1反应时间的选择依照“1.2.1”合成方法,撤掉冰浴后继续搅拌,每隔一段时间测定产品的荧光值,在反应过程中所合成的GSSG-Au NCs荧光强度在第16 h后达到最大,但与搅拌8 h的产品所发出的荧光相差不大。考虑到能源消耗效率,确定最佳反应时间为8 h。
2.1.2反应物浓度最佳比例依照“1.2.1”合成方法,考察了不同浓度比的反应物对金纳米团簇合成的影响。分别加入5 mL不同浓度的HAuCl4溶液(0.5、2.5、5.0、10、20 mmol/L),GSSG溶液用量为5 mL,浓度为2.0 mmol/L。实验发现5 mL HAuCl4溶液浓度为5.0 mmol/L时,所合成的金纳米团簇样品荧光值达到最大。
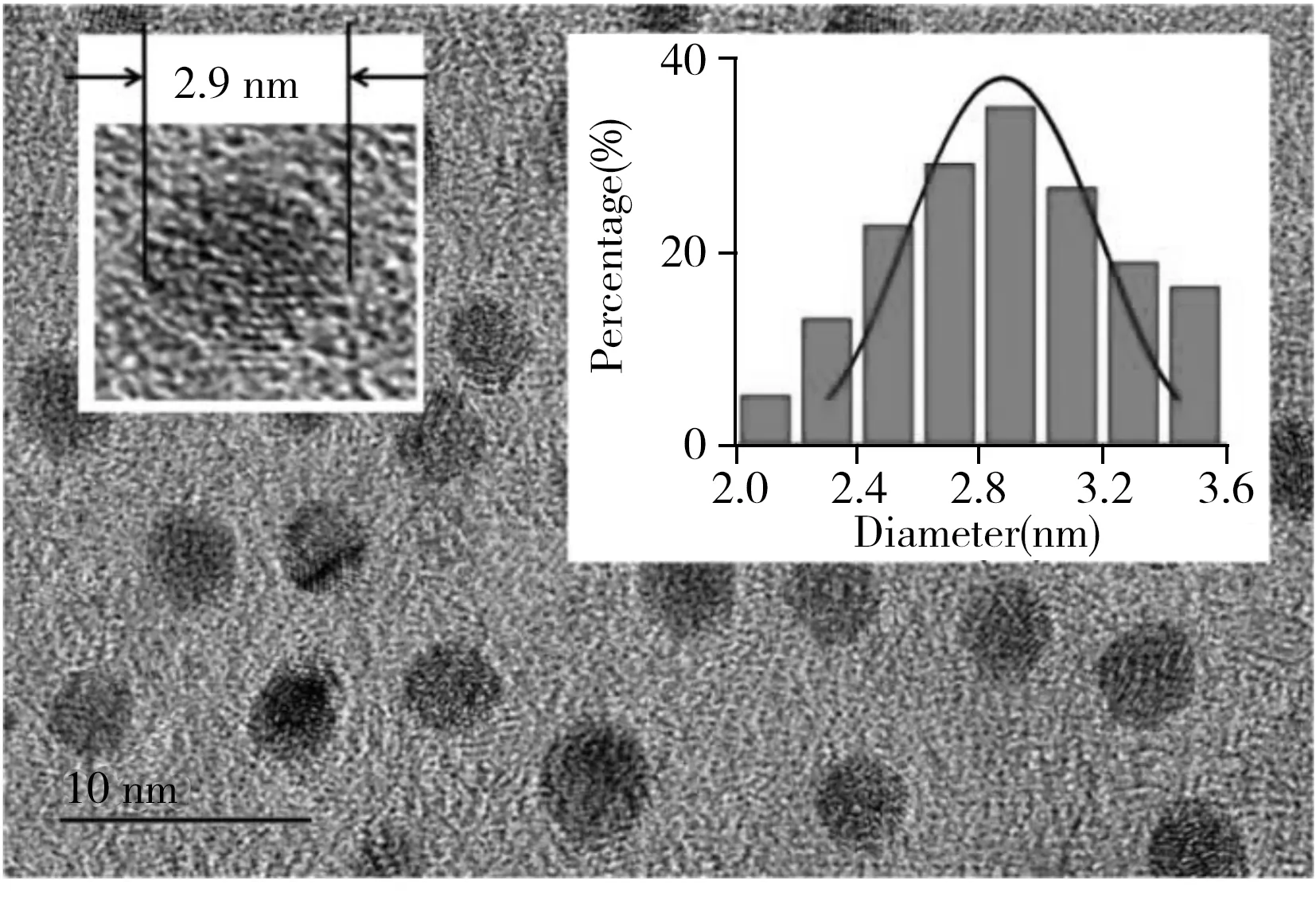
图1 GSSG-Au NCs的TEM光谱图 Fig.1 Typical TEM images of GSSG-Au NCsinsert: the size distributions
2.2 GSSG-Au NCs的荧光特性
2.2.1 GSSG-Au NCs的形貌特征考察了所制备荧光GSSG-Au NCs的形态和尺寸分布,分别用透射电子显微镜(TEM)和动态光散射仪(DSL)进行了表征。如图1所示,粒子呈球状,分散性良好,平均粒径为2.9 nm。所制备的金纳米团簇在400 nm处出现制备样品特有的等离子体共振吸收峰(图2插图)。采用罗丹明作为基准物质(在水中的量子产率为0.31%),测得GSSG-Au NCs荧光量子产率为2.71%。以上结果表明,已成功合成了稳定性好和量子产率高的荧光GSSG-Au NCs。
2.2.2 GSSG-Au NCs的激发与发射光谱所合成的金纳米团簇的荧光激发-发射光谱如图2所示,其激发光谱峰的λem在672 nm处,最大荧光发射光谱峰λex在361 nm处。该金纳米团簇的激发光谱连续,同时具有很宽的荧光激发波长范围(260~430 nm),荧光发射峰峰形对称,半峰宽较窄,荧光强度高,合成出的金纳米团簇光学性质稳定,有良好的发光性能。
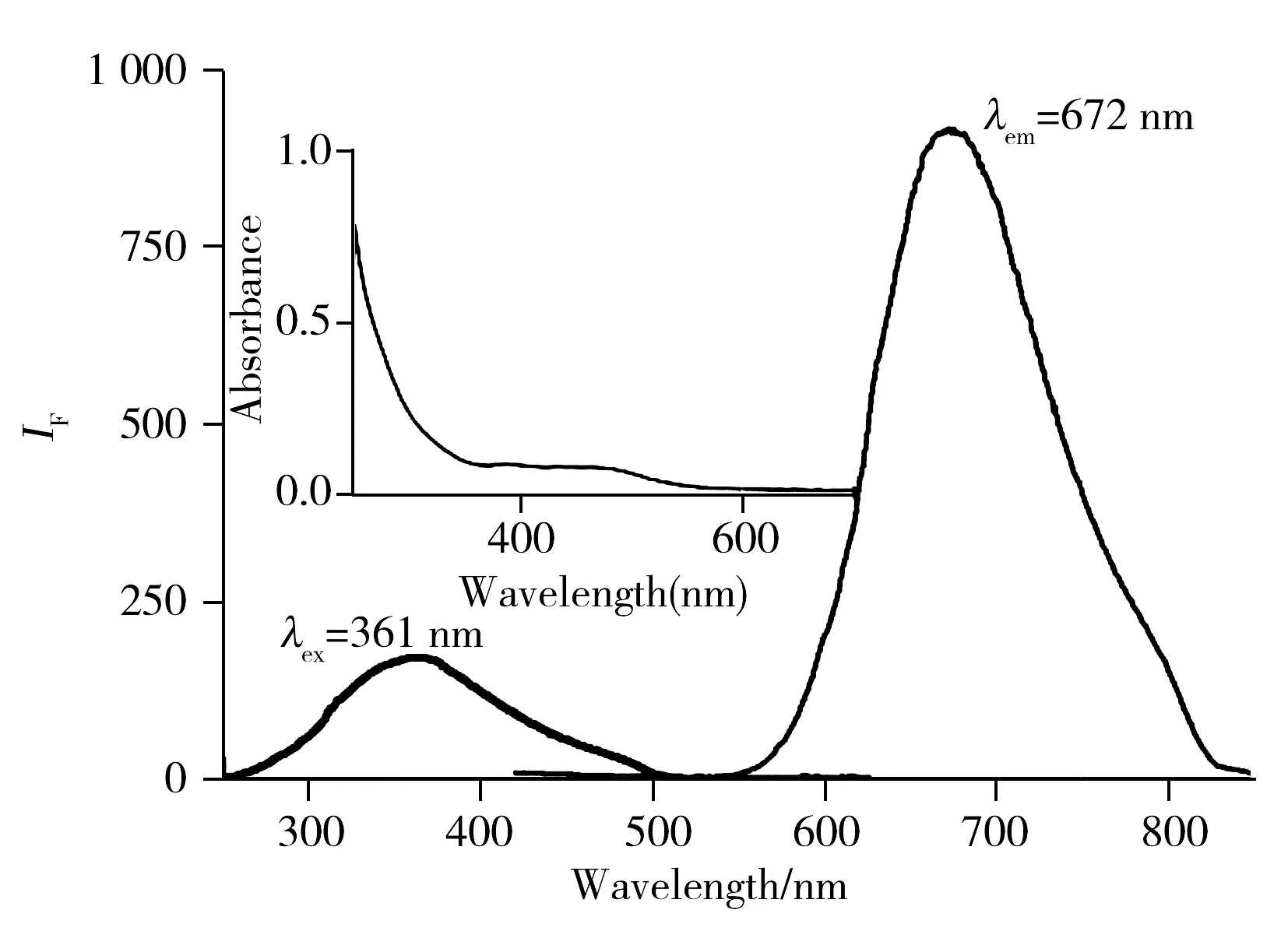
图2 GSSG-Au NCs的激发光谱及发射光谱 Fig.2 The excitation and emission spectra of GSSG-Au NCsinsert:UV-Vis absorption spectrum
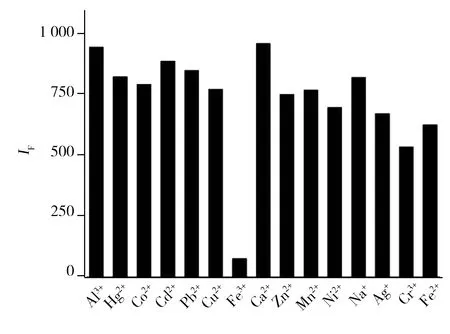
图3 GSSG-Au NCs对不同金属离子的荧光响应情况Fig.3 Sensitivity of the GSSG-Au NCs based assay towards different metal ions
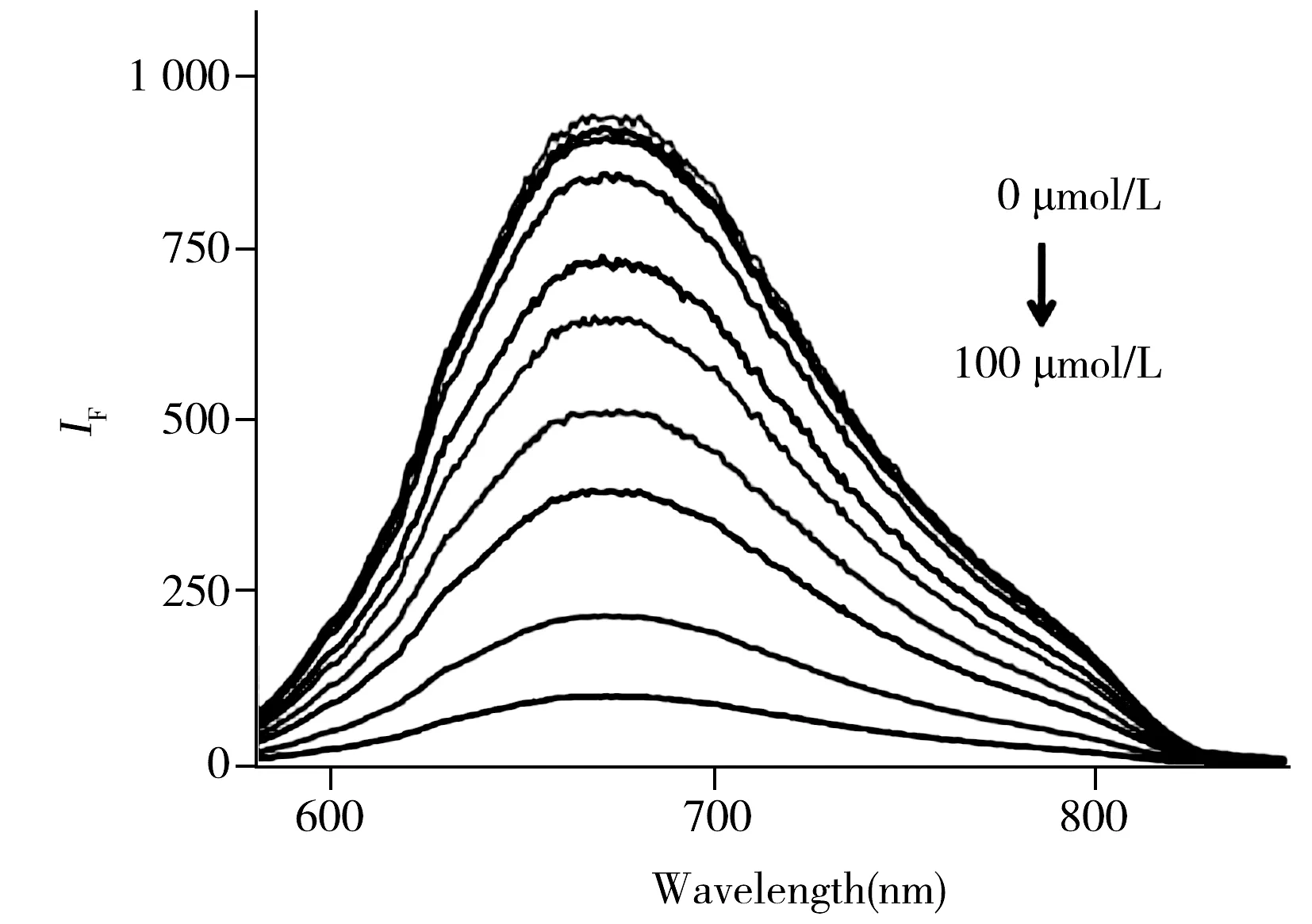
图4 加入不同浓度Fe3+时GSSG-Au NCs的荧光光谱图Fig.4 The fluorescence spectra of GSSG-Au NCs with different concentrations of Fe3+
2.2.3 GSSG-Au NCs的稳定性为考察GSSG-Au NCs作为荧光探针的稳定性,研究了其在不同盐浓度条件下的荧光光谱,发现GSSG-Au NCs的荧光强度在高盐浓度条件下(100 mmol/L NaCl)几乎不受影响。实验还对GSSG-Au NCs样品的热稳定性能进行了研究,结果表明GSSG-Au NCs的荧光值在4~95 ℃范围内变化不大,表明所制备的探针具有较好的结构稳定性。另外,考察了所合成的探针对Fe3+的荧光强度随时间的变化,结果表明该探针具有较好的时间稳定性。同时考察了GSSG-Au NCs的荧光衰减曲线,计算得到其平均荧光寿命为1.572 ns[18]。
2.3 GSSG-Au NCs对Fe3+的选择性
2.3.1 GSSG-Au NCs对不同金属离子的响应情况本文考察了可能存在的金属离子对GSG-Au NCs荧光强度的影响。如图3所示,其他实验条件相同,当体系中分别加入等浓度(10 μmol/L)的不同金属离子时,Fe3+对该GSSG-Au NCs荧光表现出很强的猝灭效应,而其他金属离子只会引起较微弱的猝灭效应。
2.3.2 GSSG-Au NCs测定Fe3+的干扰试验固定Fe3+浓度为10 μmol/L,在检测体系中分别加入100 μmol/L的干扰金属离子。结果显示,Al3+、Cr3+、Hg2+、Co2+、Cd2+、Cu2+、Ca2+、Mn2+、Zn2+、Ni2+、Pb2+、Na+、Ag+、Fe2+等金属离子对检测无干扰,表明该方法检测铁离子具有较高的选择性,可用于实际环境水样中Fe3+的检测。
2.3.3 GSSG-Au NCs对Fe3+检测的工作曲线与检出限在优化实验条件下,采用GSSG-Au NCs在水体系中对不同浓度的Fe3+进行测定,以此验证本方法的灵敏度和线性范围。从图4中可知,随着Fe3+浓度的增加,GSSG-Au NCs在水体系中的荧光强度不断下降。在优化条件下,Fe3+浓度在0.1~30 μmol/L范围内与荧光强度变化值呈良好的线性关系,其回归方程为(IF0-IF)/IF=0.057 4C+0.138(r2=0.996)。以3σ/k[17]计算荧光探针的检出限为0.03 μmol/L。
2.4 实际水样中Fe3+的检测
为验证本方法的实用性,采用合成的GSSG-Au NCs荧光探针测定实际水样(包括自来水、湖水和河水)中Fe3+浓度,并同时用ICP-AES 法平行测定。实际水样经简单的过滤除沉操作后直接用于铁离子的检测。每种水样中分别加入4.0、8.0、12.0 μmol/L的Fe3+,然后将含有不同浓度Fe3+的实际水样加入到GSSG-Au NCs溶液中,搅拌后静置30 min测定体系的荧光强度,每组分别测定3 次取其平均值,计算相对标准偏差(RSD),同时进行样品加标回收率的测定,结果见表1。两种方法测得Fe3+浓度的结果一致,加标回收率为82.5%~102.5%,RSD为1.7%~3.7%。说明本方法测定Fe3+浓度的准确性和可靠性符合要求。
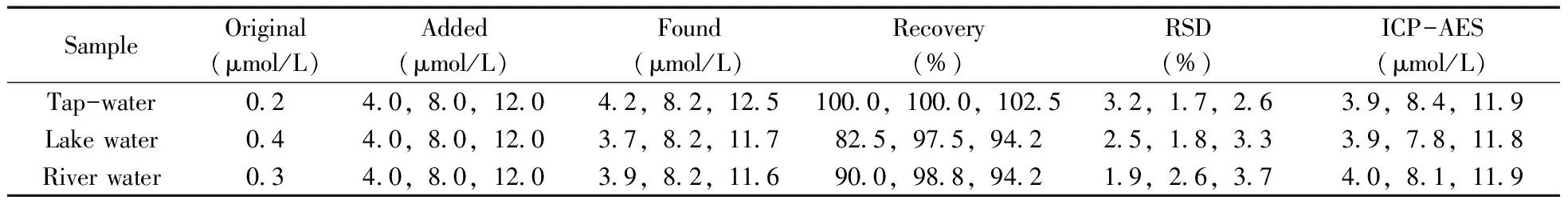
表1 水样中Fe3+浓度的含量测定Table 1 Determination of Fe3+ in water samples
3 结 论
本文在水溶液中利用环境友好的生物小分子作为还原剂和稳定剂,一步法制备了荧光金纳米团簇,可以简便和迅速地测定溶液中Fe3+的浓度。通过优化实验条件,确定了最佳合成条件,并考察了本方法的特异性、检测范围和灵敏度,其检出限达0.03 μmol/L。所构建的方法具有灵敏度高、选择性好、操作简单等特点,同时具有较强的准确度和精密度,可应用于实际水样的测定。
[1] Hamishehkar H,Ghasemzadeh B,Naseri A,Salehi R,Rasoulzadeh F.Sens.ActuatorsB,2015,150: 934-939.
[2] Kakhlon O,Cabantchik Z I.FreeRadicalBiol.Med.,2002,33(8): 1037-1046.
[3] Wei S,Jia K,Shou H,Zhou X,Wang P,Liu X.Chem.Phys.Lett.,2017,678: 72-78.
[4] Qin Y A,Zhang X,Liu S Y,Sun M M.J.Instrum.Anal.(秦元安,张献,刘叔尧,孙明明.分析测试学报),2015,34(10): 1158-1162.
[5] Zhang Y,Li M,Niu Q,Gao P,Zhang G M,Dong C,Shuang S M.Talanta,2017,171: 143-151.
[6] Selvaprakash K,Chen Y.Biosens.Bioelectron.,2017,92: 410-416.
[7] Qing T,He X,He D,Qing Z,Wang K,Lei Y,Liu T,Tang P,Li Y.Talanta,2016,161: 170-176.
[8] Lan J,Zou H Y,Wang Q,Zeng P,Li Y F,Huang C Z.Talanta,2016,161: 482-488.
[9] Mao B,Qu F,Zhu S,You J.Sens.ActuatorsB,2016,234:338-344.
[10] Hu S,Ye B,Yi X,Cao Z,Wu D,Shen C,Wang J.Talanta,2016,155: 272-277.
[11] Jones D P.MethodsEnzymol,2002,348(1): 93-112.
[12] Giustarini D,Tsikas D,Colombo G,Milzanic A,Dalle-Donnec I,Fantid P,Rossi R.J.Chromatogr.B,2016,1019(3):210-214.
[13] Guo C,Irudayaraj J.Anal.Chem.,2011,83(8): 2883-2889.
[14] Xie J,Zheng Y,Ying J Y.J.Am.Chem.Soc.,2009,131(3): 888-889.
[15] Zhang Z,Deng C Q,Guo T,Meng L S.J.Instrum.Anal.(张祯,邓成权,郭添,孟列素.分析测试学报),2014,33(7): 810-814.
[16] Ayesh A I,Karam Z,Awwad F,Meetani A M.Sens.ActuatorsB,2015,221: 201-206.
[17] Liu J,Wang B,Xu M,Wang L,Zhou Z.J.Lumin.,2017,185:258-262.
[18] Vosch T,Antoku Y,Hsiang J,Richards C I,Gonzalez J I,Dickson R M.Proc.Natl.Acad.Sci.USA,2007,104(31): 12616-12621.
Synthesis of a Fluorescent Gold Nanoclusters Probe Based on GSSG and Its Application in Determination of Fe3+
DONG Zhe1*,XIE Li-juan1,LI Yang1,2,LI Bi-ye1,LI Dan1,XI Hai-shan1
(1.Key Laboratory for the Natural Products Chemistry and Functional Molecular Synthesis,Inner Mongolia University for Nationalities,Tongliao 028043,China; 2.Orthopedics One,Tongliao City Hospital,Tongliao 028000,China)
Gold nanoclusters were synthesized based on oxidized glutathione(GSSG) with a mean diameter of 2.9 nm.The fluorescence of GSSG-Au NCs was strongly quenched when Fe3+ions were present.The sensor was used to detelt Fe3+ions has a wide linear range of 0.1-30 μmol/L,a high sensitivity of 0.03 μmol/L and a good selectivity.The method described was successfully applied in real sample(tap water,lake water and river water samples) determination.
gold nanoclusters(Au NCs); oxidized glutathione(GSSG); fluorescent probe; Fe3+
O433.4
:A
:1004-4957(2017)09-1155-04
2017-04-28;
:2017-05-31
国家自然科学基金(21661026);内蒙古民族大学大型仪器功能开发创新基地资助项目
*
:董 哲,博士,实验师,研究方向:无机生物,Tel: 0475-8314847,E-mail:dongzhe@imun.edu.cn
10.3969/j.issn.1004-4957.2017.09.018
