纳米铜/石墨烯-壳聚糖复合膜修饰电极及其对葡萄糖的直接测定
2017-09-26潘芊秀程远征王江云张凤莲邓树娥
潘芊秀,程远征,王江云,张凤莲,邓树娥
(潍坊医学院 化学教研室,山东 潍坊 261053)
纳米铜/石墨烯-壳聚糖复合膜修饰电极及其对葡萄糖的直接测定
潘芊秀*,程远征,王江云,张凤莲,邓树娥
(潍坊医学院 化学教研室,山东 潍坊 261053)
以石墨烯-壳聚糖复合膜修饰玻碳电极,并在此复合膜上电沉积纳米铜,用于葡萄糖的无酶检测。以扫描电镜、傅立叶红外光谱及电化学交流阻抗谱对该复合膜微观形态进行表征,以循环伏安法、计时电流法对该电极的电化学行为进行研究。实验结果表明,在0.1 mol/L NaOH溶液中修饰电极对葡萄糖具有良好的催化氧化作用,该电极对葡萄糖的检测线性范围为5.6×10-5~1.2×10-3mol/L,检出限(S/N=3)为2.3×10-5mol/L。该修饰电极对样品的检测具有良好的稳定性、重现性。
纳米铜;石墨烯-壳聚糖复合膜;修饰电极;葡萄糖
葡萄糖的检测在临床诊断及工业生产等方面具有重要意义,酶基葡萄糖传感器的制备在数十年间获得了长足发展[1-3]。酶传感器一般需在固体电极表面固定葡萄糖氧化酶,由于固定化酶易失活,因此需要较苛刻的制备条件,且传感器的有效使用寿命往往很短。纳米材料因具有较高表面活性,独特的催化性质和光电化学性质而被广泛用于修饰电极的制备,尤其是近年来各种贵金属纳米材料如银[4]、金[5]、铂[6]等被广泛使用,无酶传感器的研制已引起人们越来越广泛的兴趣,现已实现了无酶葡萄糖传感器的制备及检测[7-10]。
石墨烯是一种具有二维结构的新型碳纳米材料,具有较大的比表面积、良好的导电性、无毒以及优良的生物相容性,被广泛用于电极的修饰及生物传感器的制备[11-16]。相比于其它贵金属材料,纳米铜具备低电阻、高催化性、价格低及制备简单等优异特性而被尝试用于电极修饰[17]。本文将石墨烯分散于壳聚糖中,在玻碳电极表面形成导电性良好的复合膜,再以壳聚糖-石墨烯复合膜为载体电沉积纳米铜,充分发挥纳米铜的纳米尺寸和电催化效应增强对葡萄糖的催化氧化,从而实现对葡萄糖的直接测定。
1 实验部分
1.1 试剂与仪器
高纯石墨烯(GH,纯度>98%)和壳聚糖(CS,脱乙酰度>95%)购自上海阿拉丁试剂有限公司;铁氰化钾(K3[Fe(CN)6])和亚铁氰化钾(K4[Fe(CN)6])购自西陇化工有限公司;氯化钠(NaCl)、氯化铜(CuCl2·2H2O)、磷酸二氢钾(KH2PO4)、磷酸氢二钾(K2HPO4·3H2O)、氯化钾(KCl)、葡萄糖(C6H12O6·H2O)和氢氧化钠(NaOH)等均为分析纯,购于国药集团;实验用水为去离子水。
傅立叶变换红外光谱仪(Nicolet iS10,美国),电化学分析仪(VersaSTAT3,美国),扫描电子显微镜(Hitachi S-4800,日本),超声波清洗机(SB25-120,宁波新芝),CHI660E电化学工作站(上海辰华),三电极体系:玻碳电极(GCE,5.0 mm)及其修饰电极作为工作电极,铂丝电极为对电极,饱和甘汞电极(SCE)为参比电极。
1.2 实验过程
将直径5 mm的玻碳电极在0.05 μm Al2O3粉上打磨光滑,用水冲洗干净,高纯N2吹干备用。将壳聚糖溶于稀醋酸(0.8%,体积分数),搅拌2 h得10 mg/L的壳聚糖溶液。再将石墨烯超声分散于壳聚糖溶液中,得到石墨烯-壳聚糖溶液(CS-GH,1 mg/mL)。
取5 μL制备好的CS-GH溶液滴涂到玻碳电极表面,室温过夜晾干,得GCE/CS-GH电极。将GCE/CS-GH电极置于由0.01 mol/L NaCl和0.01 mol/L CuCl2组成的沉积液中,以饱和甘汞电极(SCE)为参比电极,沉积电位-1.0 V,沉积700 s后以水冲洗电极,得GCE/CS-GH/Cu电极。所有电化学实验均通N2除氧,且实验过程中保持N2气氛围。
2 结果与讨论
2.1 壳聚糖膜(CS)与壳聚糖-石墨烯膜(CS-GH)的红外光谱
实验以傅立叶红外光谱法考察了壳聚糖膜与壳聚糖-石墨烯复合膜的区别(图1)。相比于纯壳聚糖膜(图1a),壳聚糖-石墨烯复合膜的红外光谱图(图1b)中,壳聚糖的羟基(—OH)、氨基(—NH2)特征峰分别向长波长方向发生偏移且强度减小,说明石墨烯颗粒已分散结合于壳聚糖溶液中,形成均匀的壳聚糖-石墨烯复合膜。
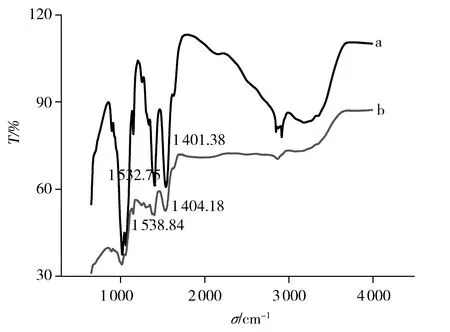
图1 壳聚糖膜(a)与壳聚糖-石墨烯复合膜(b)的红外光谱图Fig.1 Infrared spectra of chitosan film(a) and chitosan-graphene film(b)
2.2 电极表面形态的表征
实验中通过扫描电镜图(SEM)对电沉积纳米Cu的形貌进行了直观表征(图2)。其中图2A为壳聚糖-石墨烯复合膜在玻碳电极表面的SEM图,由图可知壳聚糖-石墨烯复合膜提供了一个巨大、较粗糙的表面,更有利于Cu颗粒的沉积。图2B为在壳聚糖-石墨烯复合膜表面电沉积纳米Cu颗粒后的SEM图。由图可清晰看到Cu颗粒已成功在电极表面沉积,且在电极表面呈树枝状结构,使得修饰电极具有更大的表面积,沉积的纳米Cu颗粒也将极大改善复合膜的导电能力。
2.3 电极表面的交流阻抗
在0.1 mol/L 磷酸盐缓冲溶液(PBS)中,以5 mmol/L K3[Fe(CN)6]和5 mmol/L K4[Fe(CN)6]组成的氧化还原电对为探针分子,以电化学交流阻抗法考察了修饰电极的表面性质(图3)。其中曲线a是裸玻碳电极的阻抗图,曲线b和c分别代表GCE/CS-GH和GCE/CS-GH/Cu修饰电极的阻抗行为。如图所示,GCE/CS-GH电极在高频区的半圆直径比裸玻碳电极大幅增加,由此可见修饰壳聚糖-石墨烯膜后电极的导电性变差,这可能是因为虽然石墨烯具有良好的导电性,但壳聚糖的存在使导电性变差。而在GCE/CS-GH电极表面沉积纳米Cu之后,所得电极的阻抗谱图中半圆直径大幅减小,说明纳米Cu极大改善了复合膜的导电性。

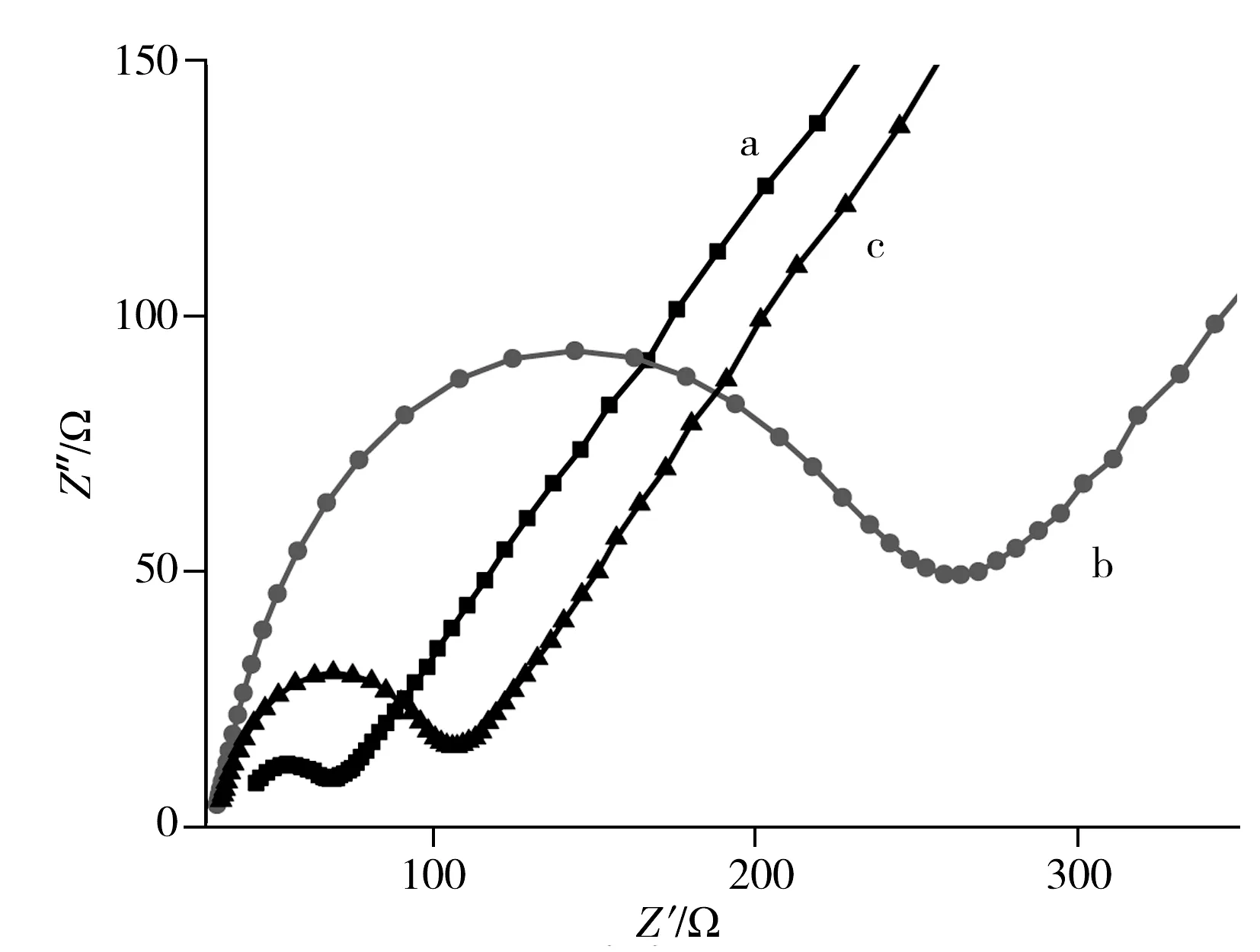
图3 裸GCE(a)、GCE/CS-GH(b)与GCE/CS-GH/Cu(c)的交流阻抗图 Fig.3 Electrochemical impedance spectroscopy of bare GCE(a),CS-GH(b) and CS-GH/Cu(c) modified electrodes 0.1 mol/L PBS(pH 7.0) with 5 mmol/L K3 [Fe(CN)6]+ 5 mmol/L K4 [Fe(CN)6]
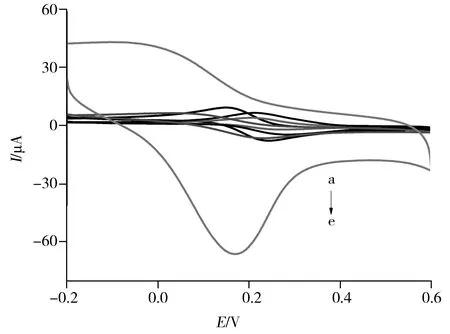
图4 不同修饰电极的循环伏安图Fig.4 Cyclic voltammograms of different electrodes by sweeping potential from -0.2 V to 0.6 Va.GCE/CS, b.GCE/CS-GH, c.GCE/CS/Cu, d.GCE, e.GCE/CS-GH/Cu;scan rate:100 mV/s,solution:0.1 mol/L KCl with 1 mmol/L K3 [Fe(CN)6]
2.4 电沉积时间的影响
在5 mL 0.01 mol/L NaCl和0.01 mol/L CuCl2的沉积液中,沉积电位-1.0 V,考察了沉积时间分别为500、600、660、700、760、800 s时所制备的GCE/CS-GH/Cu对葡萄糖催化电流的影响。结果表明当沉积时间由500 s延长至700 s时,响应电流逐渐增大。沉积时间大于700 s时,所制备电极对葡萄糖的催化能力反而降低,这可能是因为过长的沉积时间导致沉积Cu颗粒过大,使修饰电极的电活性面积减小,因而实验中沉积时间选择700 s。
2.5 修饰电极的电化学活性
采用循环伏安法对不同材料修饰电极的电化学活性进行考察(图4),检验了不同修饰电极在含有1 mmol/L K3[Fe(CN)6]的0.1 mol/L KCl溶液中的循环伏安行为。由图可知Fe3+在GCE/CS(图4a)和GCE/CS/Cu(图4c)电极上几乎没有氧化还原响应,说明纯壳聚糖膜的导电性较差。GCE/CS-GH(图4b)电极的电流信号相比于前两者有所改善,这得益于石墨烯的高导电性,但电流信号仍比裸GCE电极(图4d)弱。而在壳聚糖-石墨烯膜上沉积纳米Cu后,氧化电流急剧增大,形成明显的氧化峰。说明在石墨烯与纳米Cu协同作用下,CS-GH/Cu(图4e)复合膜修饰电极显示出较强的电化学活性。
2.6 GCE/CS-GH/Cu电极的电化学性质
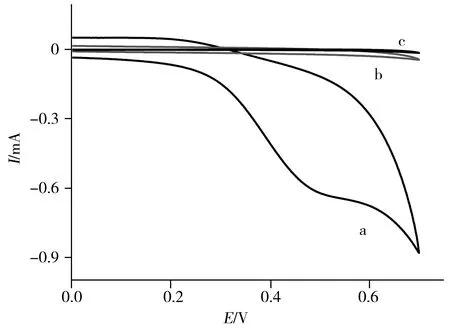
图5 CS-GH/Cu(a)、CS-GH(b)、CS/Cu(c)修饰电极对葡萄糖响应的循环伏安图Fig.5 Cyclic voltammograms of CS-GH/Cu(a), CS-GH(b) and CS/Cu(c) modified electrodes sweeping potential:from 0.0 V to 0.8 V(vs.SCE);scan rate:100 mV/s;solution:0.1 mol/L NaOH with 6.0×10-4 mol/L glucose
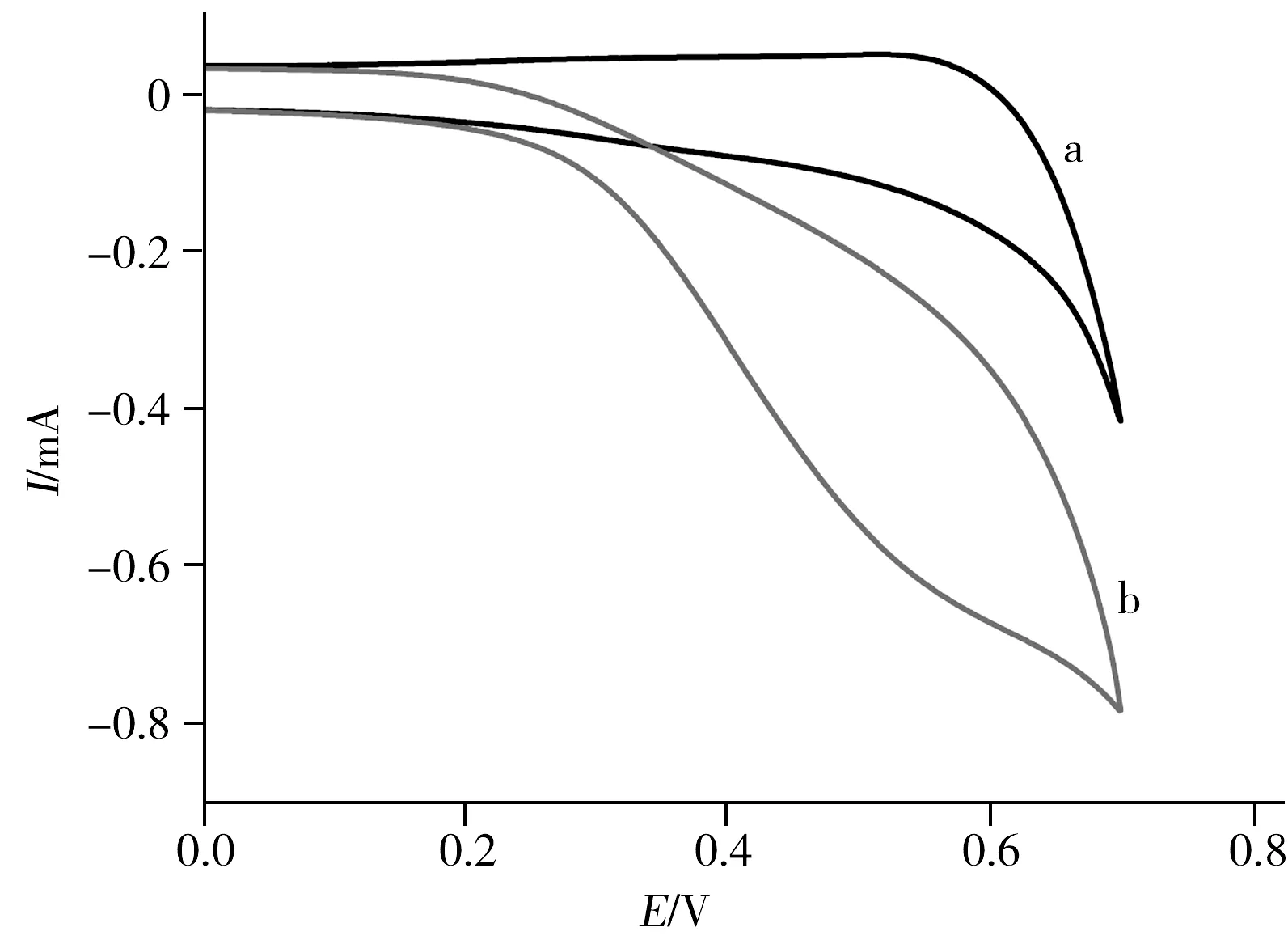
图6 GCE/CS-GH/Cu对葡萄糖的循环伏安响应Fig.6 Cyclic voltammograms of GCE/CS-GH/Cusweeping potential:0.0 V to 0.8 V(vs.SCE);scan rate:100 mV/s;solution:0.1 mol/L NaOH with 4.2×10-4 mol/L glucose (b) and without glucose(a)
在含有6.0×10-4mol/L葡萄糖的0.1 mol/L NaOH溶液中,采用循环伏安法分别对不同修饰电极的电化学行为进行了考察(图5)。由图可知,GCE/CS-GH(图5b)和GCE/CS/Cu(图5c)对葡萄糖无电化学响应,而GCE/CS-GH/Cu电极在0.45 V左右对葡萄糖有明显的催化作用(图5a),氧化电流急剧增大。说明沉积Cu对葡萄糖分子在电极表面的催化氧化具有关键作用,替代了传统酶电极中的生物酶。由此可推测,沉积Cu在碱性条件下对葡萄糖的催化氧化机理如下[7]:
Cu+2OH-→Cu(OH)2+2e
Cu(OH)2+OH-→CuOOH+H2O+e
CuOOH+Glucose→Gluconolactone+Cu(OH)2
Gluconolactone→Gluconic acid
图6为GCE/CS-GH/Cu电极在空白0.1 mol/L NaOH溶液中及葡萄糖浓度为 4.2×10-4mol/L时的循环伏安图。当NaOH溶液中不含葡萄糖时,修饰电极没有发生明显的氧化还原反应(图6a)。而在溶液中加入葡萄糖后,产生明显可测的氧化电流(图6b),由此可知GCE/CS-GH/Cu电极对葡萄糖具有较灵敏的催化氧化作用。
2.7 葡萄糖检测
在0.1 mol/L NaOH溶液中,工作电位为0.45 V,不断加入一定量的2.8×10-2mol/L葡萄糖溶液,采用计时电流法研究了GCE/CS-GH/Cu电极对葡萄糖的检测。实验可得,该电极对葡萄糖的响应在5 s内可达到稳定值。葡萄糖浓度在5.6×10-5~1.2×10-3mol/L范围内与氧化电流呈线性关系,回归方程为I(μA)=1.94+42.93c(mmol/L),r=0.994,检出限(S/N=3)为2.3×10-5mol/L。
2.8 电极的重现性、稳定性及选择性检测
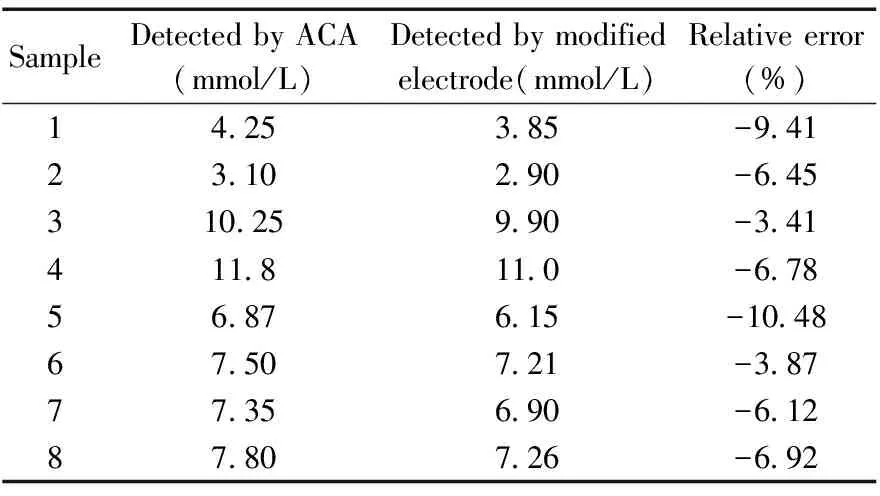
表1 修饰电极与ACA对于血样中葡萄糖的检测结果对比Table 1 Comparative analysis of glucose concentration detected by modified electrode and ACA
将制备好的GCE/CS-GH/Cu电极在含有1.6×10-4mol/L葡萄糖的0.1 mol/L NaOH溶液中,连续循环伏安扫描6次,得到基本重合的曲线。将制备好的电极在室温放置1个月,同样条件对葡萄糖进行检测,峰电流仍能达到最初的90%。
在含有1.6×10-4mol/L葡萄糖的0.1 mol/L NaOH溶液中,以循环伏安法考察了实际样品中可能存在的干扰物质(硝酸钾、氟化铵、尿酸、半胱氨酸及抗坏血酸)对修饰电极响应信号的影响,且干扰物质的浓度为葡萄糖浓度的10倍。实验结果表明,这5种物质对修饰电极的影响可以忽略不计。
2.9 样品测定
实验血样及血糖值由潍坊医学院附属医院检验科提供,随机抽取8份血样进行一定比例的稀释,使其浓度位于修饰电极的线性范围内,将检测结果与全自动生化仪(ACA)所测数据进行比对,每次测定的相对误差均低于10.5%(表1),说明该修饰电极的检测是可信的。
3 结 论
本实验采用简单的滴涂、电沉积等方式在玻碳电极表面修饰了壳聚糖-石墨烯/纳米铜复合膜,该修饰电极在NaOH溶液中对葡萄糖有较灵敏的电化学响应,可用于葡萄糖的定量检测。该修饰电极制备过程简单,且因未使用生物酶而使其重现性、稳定性较好,可为葡萄糖电化学传感器的制备提供一定的参考。
致谢:本论文的完成得益于山东大学化学化工学院邹桂征教授课题组的大力支持,在此表示诚挚的感谢。
[1] Ciftci H,Oztekin Y,Tamer U,Ramanaviciene A,Ramanavicius A.ColloidsSurf.B,2014,123:685-691.
[2] Huang X M,Deng X,Wu D,Tang J.J.Instrum.Anal.(黄小梅,邓祥,吴狄,唐婧.分析测试学报),2014,33(3):313-317.
[3] Gao X J,Wang H S,Cai Q Y.J.Instrum.Anal.(高先娟,王怀生,蔡青云.分析测试学报),2013,32(7):872-876.
[4] Wang G Y,Shi G F,Chen X F,Yao R X,Chen F W.Microchim.Acta,2015,182:315-322.
[5] Wu L,Cao Z,Song T M,Song C,Xie J L,He J L,Xiao Z L.Chin.Anal.Chem.(吴玲,曹忠,宋天铭,宋铖,谢晶磊,何婧琳,肖忠良.分析化学),2014,42(11):1656-1660.
[6] Ma D Q,Tang X N,Guo M Q,Lu H R,Xu X H.Ionics,2015,21:1417-1426.
[7] Fan Z J,Liu B,Liu X H,Li Z P,Wang H G,Yang S R,Wang J Q.Electrochim.Acta,2013,109:602-608.
[8] Li X L,Yao J Y,Liu F L,He H C,Zhou M,Mao N,Xiao P,Zhang Y H.Sens.ActuatorsB,2013,181:501-508.
[9] Zhang S,Han L,Hou C T,Li C C,Lang Q L,Han L H,Liu A H.J.Electroanal.Chem.,2015,742:84-89.
[10] Wu L,Xiong E H,Yao Y,Zhang X,Zhang X H,Chen J H.Talanta,2015,134:699-704.
[11] Govindhan M,Amiri M,Chen A.Biosens.Bioelectron.,2015,66:474-480.
[12] Zhang Z H,Cai R,Long F,Wang J.Talanta,2015,134:435-442.
[13] Zhang W X,Zheng J Z,Shi J G,Lin Z Q,Huang Q T,Zhang H Q,Wei C,Chen J H.Anal.Chim.Acta,2015,853:285-290.
[14] Zhang X,Zhang Y C,Ma L X.Sens.ActuatorsB,2016,227:488-496.
[15] Zhang L,Yuan W J,Hou B Q.J.Electroanal.Chem.,2013,689:135-141.
[16] Zheng Y Y,Liu Z M,Li J,Zhan H J.J.Instrum.Anal.(郑莹莹,刘志敏,李婕,展海军.分析测试学报),2015,34(10):1152-1157.
[17] Zhang Y,Yu L L,Yang Y Y,Jia N Q.J.ShanghaiNormalUniv.:Nat.Sci.(张洋,于利利,杨亚云,贾能勤.上海师范大学学报:自然科学版),2013,42(1):37-43.
Preparation of Nano-copper/Graphene-Chitosan Composite Membrane Modified Electrode and Its Direct Determination of Glucose
PAN Qian-xiu*,CHENG Yuan-zheng,WANG Jiang-yun,ZHANG Feng-lian,DENG Shu-e
(Department of Chemistry,Weifang Medical University,Weifang 261053,China)
The enzyme-free detection of glucose was achieved by using the nano-copper/graphene-chitosan composite matrix modified glass carbon electrode.The microstructure of the composite matrix was characterized by scanning electron microscopy(SEM),FT-IR spectrum and electrochemical impedance spectroscopy(EIS).The electrochemistry behavior of the modified electrode was investigated by cyclic voltammetry and chronoamperometry.The results showed that the modified electrode exhibited a good catalytic oxidation of glucose in 0.1 mol/L NaOH and with a wide linear range of 5.6×10-5-1.2×10-3mol/L and a low detection limit of 2.3×10-5mol/L(at signal/noise ratioS/N= 3).The modified electrode could be used to detect the real samples with a good stability and repeatability.
nano-copper;graphene-chitosan composite membrane;modified electrode;glucose
O657.1;TS245.4
:A
:1004-4957(2017)09-1145-05
2017-04-25;
:2017-06-22
山东省自然科学基金项目(ZR2015BL003);山东省高等学校科技计划项目(J14LC19)
*
:潘芊秀,硕士,讲师,研究方向:电分析化学,Tel: 0536-8462065,E-mail: pqx2005@wfmc.edu.cn
10.3969/j.issn.1004-4957.2017.09.016
