高效液相色谱-电化学检测法研究大蒜素对百草枯中毒小鼠脑组织中单胺类神经递质含量的影响
2017-09-26檀笑昕张淑娟张铧尹连靠奇徐向东康维钧
檀笑昕,张淑娟,刘 坤,张铧尹,连靠奇,徐向东,康维钧
(河北医科大学 公共卫生学院,河北 石家庄 050011)
高效液相色谱-电化学检测法研究大蒜素对百草枯中毒小鼠脑组织中单胺类神经递质含量的影响
檀笑昕,张淑娟,刘 坤,张铧尹,连靠奇,徐向东,康维钧*
(河北医科大学 公共卫生学院,河北 石家庄 050011)
建立了单胺类神经递质的高效液相色谱-电化学检测方法,探讨了大蒜素对百草枯中毒小鼠脑组织内的单胺类神经递质及其代谢产物的影响。健康ICR小鼠随机分为4组:正常对照(Con)组、大蒜素(DAS)组、百草枯染毒(PQ)组和大蒜素治疗(PQ+DAS)组,每组6只。PQ组灌胃PQ 35 mg/kg建立中毒模型,Con组和DAS组灌服同体积生理盐水。DAS组和PQ+DAS组小鼠于造模2 、26、50 h后腹腔内各注射1次DAS(25 mg/kg),PQ组和正常组小鼠腹腔内注射等量无菌生理盐水。造模12 h后处死小鼠。收集小鼠脑组织样品并称重,处理后进样。色谱分析采用 Acclaim 120 C18(150 mm×2.1 mm,3 μm)色谱柱,以离子对缓冲盐溶液-甲醇(93∶7,体积比)为流动相,流速为0.27 mL/min;电化学检测器检测,工作电压为450 mV。结果表明,与正常组和DAS组比较,PQ组部分神经递质水平降低;DAS治疗后能够改变上述生化指标的变化;与PQ组相比,PQ+DAS组神经递质含量增高,差异均具有统计学意义(P<0.05)。脑组织样品中5-HT、DA、5-HIAA、DOPAC和HVA低、中、高3水平的加标回收率均为79.8%~112.1%,相对标准偏差(RSD)小于10%。实验表明,大蒜素对百草枯中毒后小鼠体内含量降低的神经递质有明显的上调作用。
高效液相色谱-电化学检测;百草枯;大蒜素;单胺类神经递质
百草枯(Paraquat,PQ)是一种有机杂环类接触性脱叶剂,具有触杀作用和一定内吸作用,目前在世界范围内广泛使用。PQ可经皮肤、呼吸道和消化道进入体内,其在体内几乎不经降解,主要随尿排出体外,可分布在肺、肝、肾、甲状腺、胎盘、各种体液和脑脊液中,从而体现其明显的脏器损伤效应[1]。且PQ目前尚无特效解毒药物[2-3],中毒后很快出现多器官功能衰竭导致死亡[4-5],中毒死亡率达80%以上[6-7]。研究表明,百草枯中毒可导致小鼠脑组织脂质过氧化增强,脑内单胺类神经递质含量降低,对小鼠神经系统具有毒性[8]。
大蒜素(Alltride)又名大蒜新素,化学名为二烯丙基硫化物(DAS),是大蒜的主要有效成分。大蒜素是硫代亚磺酸类有机物,所含的巯基能与含硫蛋白质和谷胱甘肽发生氧化还原反应,并能通过多种途径抑制氧化应激,具有较强的抗氧化活性[9]。研究表明,大蒜素进入人体后通过增加谷胱甘肽S-转移酶、谷胱甘肽还原酶和过氧化氢酶的活性等途径达到抑制氧化损伤的作用[10]。已有研究[11]显示,百草枯中毒后摄入大蒜素可减轻肺损伤,但其能否对抗PQ中毒所致的神经损伤鲜见报道。本文研究了大蒜素对PQ中毒所致小鼠脑组织中神经递质含量的影响,旨在为大蒜素对百草枯的临床治疗作用进行初步探索。
多巴胺(Dopamine,DA)、5-羟色胺(5-Hydroxytryptamine,5-HT)及其代谢产物等物质作为单胺类神经递质(Monoamine neurotransmitters,MNTs),是哺乳动物和人体内中枢神经重要的信息传递物质,已报道的检测方法主要有荧光法、放射免疫法、气相色谱法、气相色谱-质谱联用法、毛细管电泳法、液相色谱和液相色谱-质谱联用等[12-16],其中液相色谱检测方法又包括紫外检测法[17-18]和柱前衍生化检测法[19-21]。本研究建立了同时测定小鼠脑组织中DA、5-HT及其代谢产物3,4-二羟基苯乙酸(DOPAC)、高香草酸(HVA)、 羟基吲哚乙酸(5-HIAA)的HPLC-ECD法,并用于观察检测百草枯中毒小鼠模型在大蒜素干预治疗后脑组织中单胺类神经递质水平的变化。
1 实验部分
1.1 仪器与试剂
U3000型HPLC仪,配有电化学检测器(ECD,美国赛默飞世尔公司); Heal Force SMART-N高纯水机(上海力康仪器有限公司)。百草枯水剂(200 g/L,先正达南通作物保护有限公司),大蒜素(Alltride,C6H10S3,纯度≥94.2%,中国食品药品检定研究院)。3,4-二羟基苯乙酸(Sigma-Aldrich公司)、多巴胺盐酸盐(纯度98%,北京百灵威科技有限公司)、5-羟色胺盐酸盐(中国药品生物制品检定所)、高香草酸(纯度>98%,TCI公司)、羟基吲哚乙酸(纯度≥98%,Sigma-Aldrich公司);甲醇(色谱纯),1-庚烷磺酸钠(98%离子色谱级)、盐酸二乙胺(纯度99%)均购自成都艾科达化学试剂有限公司;柠檬酸钠(优级纯,纯度≥99%,阿拉丁);其他试剂均为分析纯,实验用水为高纯水。
1.2 实验动物
实验动物雄性ICR小鼠(25~35 g)购于河北医科大学实验动物中心。所有小鼠在标准条件下饲养,饲养场所通风良好,动物分组分笼饲养。室温(24±1) ℃;湿度为50%±10%;光照6∶00~18∶00,给予普通饲料和自由饮水。实验前24 h 禁食,自由饮水。动物实验符合中华人民共和国卫生部实验动物管理条例(第55号文件,2001)的规定,并经河北医科大学实验动物伦理委员会批准。
1.3 实验条件
1.3.1实验模型制备25~35 g健康ICR小鼠随机分为4组:正常对照(Con)组、大蒜素(DAS)组、百草枯染毒(PQ)组和大蒜素治疗(PQ+DAS)组。第1天8∶00,PQ组和PQ+DAS组小鼠给予PQ 35 mg/kg灌胃,建立中毒模型,Con组和DAS组灌服同体积生理盐水。DAS组和PQ+DAS组小鼠于造模2、26、50 h后腹腔内各注射1次DAS(25 mg/kg),PQ组和正常组小鼠腹腔内注射等体积无菌生理盐水。第3天10∶00,处死小鼠。
1.3.2标准储备液与混合标准工作液的制备精密称取DA、5-HT、5-HIAA、HVA、DOPAC标准品适量,以0.1 mol/L高氯酸溶解,配制成浓度分别为57.16、67.68、52.3、65.96、72.55 μmol/L的储备液;DOPAC、HVA、5-HT各取2.0 mL,DA、5-HIAA各取2.5 mL,用Ringer’s液(含氯化钠0.82%~0.9%、氯化钾0.025%~0.035%、氯化钙0.03%~0.036%)定容至100 mL,制成DA、5-HT、5-HIAA、HVA、DOPAC浓度分别为1 429.0、1 353.6、1 307.5、1 319.2、1 451.0 nmol/L的混合标准工作液。
1.3.3单胺类神经递质的测定小鼠断头处死,于冰面上取小鼠全脑,称重后,分两次加入共1.2 mL 0.1 mol/L高氯酸,冰浴中超声匀浆,4 ℃下12 000 r/min离心20 min后取上清液,过0.22 μm滤膜后进样检测。色谱柱为Acclaim 120 C18Column(150 mm×2.1 mm,3 μm);流动相:缓冲盐溶液(28 mmol/L柠檬酸钠、14.5 mmol/L 磷酸二氢钾、2.2 mmol/L 1-庚烷磺酸钠、0.5 mmol/L乙二胺四乙酸二钠(EDTA-2Na)、10.0 mmol/L 盐酸二乙胺,0.28% 乙酸调pH 4.55) -甲醇(93∶7,体积比),流速:0.27 mL/min;工作电压:450 mV;柱温:35 ℃;进样量:20 μL。
1.4 统计学分析
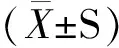
2 结果与讨论
2.1 匀浆液的选择
在样品匀浆液的选择上,选取3种匀浆/蛋白沉淀液进行样品处理(① 0.3 mL生理盐水+0.6 mL冰乙腈;② 0.6 mL 0.1 mol/L高氯酸;③ 0.3 mL 0.1 mol/L高氯酸+0.3 mL 0.1 mol/L EDTA-2Na)。实验发现,采用①匀浆样品稳定性差且无法有效提取待测物;匀浆液②对各待测物的提取保留效果最好,且在检测条件下无干扰峰,但处理后的匀浆液显酸性,DA和HVA分离变差;匀浆液③对待测样品酸度的影响小,高氯酸浓度适宜,不会引起神经递质氧化分解,既能有效沉淀蛋白,又不干扰峰形。最终选择匀浆液“0.3 mL 0.1 mol/L高氯酸+0.3 mL 0.1 mol/L EDTA-2Na”进行后续实验。
2.2 色谱条件的优化
2.2.1色谱分离条件的优化本文使用Syncronis C18(250 mm×4.6 mm,5 μm;Thermo Scientific,USA )、Accucore C18(150 mm×4.6 mm,2.6 μm; Thermo Scientific,USA)、Acclaim 120 C18(150 mm×2.1 mm,3 μm; Thermo Scientific,USA)、Atlantis T3(150 mm×1 mm,1 μm; Waters,USA) 4种色谱柱进行试验。结果表明,选择直径<3 mm的柱子可增加检测灵敏度,检出限下降1个数量级以上;同时,粒径越小,柱效越高,但粒径≤1 μm后柱外谱带明显加宽,柱压明显升高。综合考虑,选用Acclaim 120 C18柱(150 mm×2.1 mm,3 μm; Thermo Scientific,USA)进行后续实验。
本文以两种不同流动相进行试验,并对各组分的比例进行了优化。经反复试验发现,以磷酸盐-柠檬酸钠缓冲体系作为流动相的噪声低于乙酸钠-柠檬酸钠缓冲体系,有效降低了检出限。进一步优化了酸度对待测物分离检测的影响,发现当pH值大于5.5时,DOPAC与5-HIAA不能有效分离且4 min内出峰;pH值小于4.2时,各物质的峰形均有明显拖尾,检出限增大。有机相比例主要影响各待测物的保留时间,实验发现,增大甲醇的比例不会改变各物质的出峰顺序,但可明显缩短各物质的保留时间,尤其是对5-HT影响较大,但甲醇比例过大会使得DOPAC出峰过早,与非待测峰重叠,影响分析结果。经过优化,选用“14.5 mmol/L 磷酸二氢钾-30 mmol/L柠檬酸钠+ 0.5 mmol/L EDTA-2Na+2.2 mmol/L 1-庚烷磺酸钠+10 mmol/L二乙胺盐酸盐+0.28%乙酸”为流动相。
2.2.2氧化电位的选择DOPAC、DA的出峰电位为200 mV;5-HT及5-HIAA为300 mV;HVA为400 mV。在400~650 mV范围内,峰高与施加电压大小成正比,但大于450 mV后,杂峰拖尾严重,对分析物造成干扰。选择450 mV作为施加电压测定样品后发现,脑组织样品中抗坏血酸含量较高,在已有条件下无法氧化完全,拖尾较严重,对DOPAC的定量检测造成干扰。因此,本实验在检测时,选择在前3 min以通道1(E1)施加650 mV氧化电位以尽可能消除AA的干扰后,通道2(E2)再以450 mV为氧化电位对待测物进行检测。
2.2.3其他条件的选择由于流动相中含离子对试剂时,采用梯度洗脱会导致柱压在短时间内明显改变,进而对色谱柱造成损伤,因此采用改变流速和柱温的方法,既可使各物质保持良好的分离度,又可缩短5-HT的保留时间。实验发现,柱温越高,流速越大,保留时间缩短,峰形更佳;流速越大,峰展宽越小,但因柱径小、有机相比例小、待测物极性大等因素,流速不宜超过0.3 mL/min。最终选择流速为0.27 mL/min,柱温为35 ℃。
2.3 方法学验证
取空白溶剂(匀浆液)、20 nmol/L混合标准品溶液、正常小鼠脑组织匀浆进样测定,记录色谱图(图1)。结果显示,标准品和脑透析液中的各峰形对称,内源性杂质无干扰,DOPAC、5-HIAA、HVA、DA、5-HT的保留时间分别约为3.75、7.26、9.19、10.99、29.56 min,5种待测物分离良好。
分别取0.02、0.05、0.10、0.20、0.50、1.00、2.00 mL混合标准工作液,加水稀释定容至10.00 mL配制系列标准品溶液,进样20 μL测定。以浓度(X,μmol/L)为横坐标、标准物质的峰面积(Y,μA×min)为纵坐标进行回归分析,得到5种待测物质的标准曲线。以最低浓度标准工作液进样后各待测物峰面积的3倍标准偏差为检出限(LOD)。各待测物的LOD、线性范围、回归方程及相关系数见表1。
因5种待测物均为内源性物质,故用加入法测定回收率,即向脑组织样品中加入高、中、低3种浓度的混合标准品溶液,进样测定。试样及加标试样的色谱图见图1,结果见表2。


图1 试样(A)及加标试样(B)的色谱图Fig.1 Chromatograms of test sample(A) and test sample with mixed standard substance(B)1. DOPAC,2. 5-HIAA,3. HVA,4. DA,5. 5-HT

表1 待测物的线性范围、回归方程、相关系数与检出限Table 1 Linear range,regression equation,correlation coefficients(r) and limit of detection(LOD) of five compounds
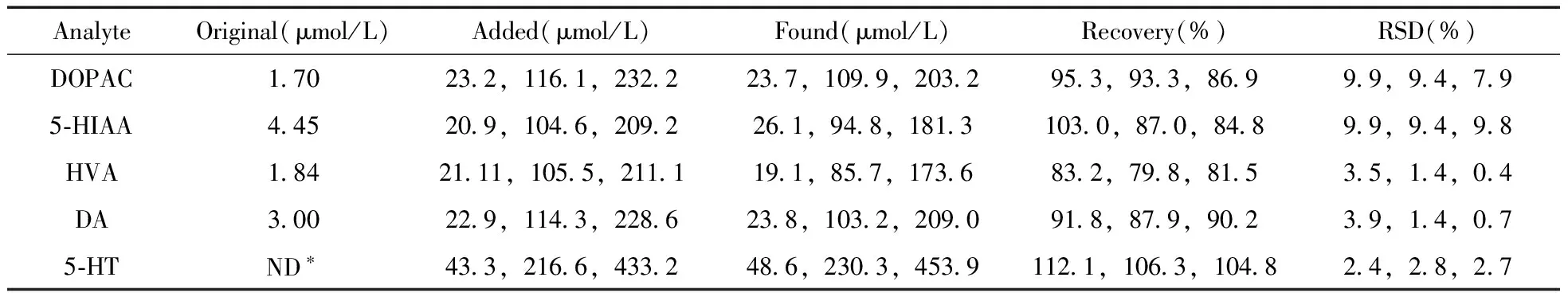
表2 加标回收率的实验结果(n=3)Table 2 Results of recovery tests of spiked sample(n=3)
*no detected
2.4 稳定性试验
将已知浓度的样品溶液3份,置于常温下存放,分别于同日内0、3、6、12 h重复测定4次,考察样品的稳定性。结果HVA、DA、5-HT在常温下可稳定12 h以上,DOPAC在6 h后含量略有下降,5-HIAA在3 h后含量大幅下降,表明脑透析液中5-HIAA在常温下仅能稳定1~2 h。而在4 ℃下,样品中各待测物含量均可稳定2 d以上。
2.5 脑组织中单胺类神经递质含量
各组小鼠脑组织中5种待测物含量见表3。结果表明,PQ组大鼠脑组织中DA、5-HT的含量显著低于Con组(P<0.05),而PQ+DAS组脑组织中DA、5-HT的含量与PQ组相比显著上升(P<0.05)。DAS组和Con组小鼠的含量无显著差异(P>0.05)。此外,PQ组的DOPAC和5-HIAA含量明显高于Con组(P<0.05),提示PQ的毒性作用可能促进了DA和5-HT的氧化代谢。
DA和5-HT是中枢神经系统内重要的神经递质,两者与其主要代谢产物DOPAC、HVA、5-HIAA在神经信号的传递中均发挥着重要作用。有研究表明,氧化应激可加速单胺类神经递质的氧化过程,导致其含量下降[22]。百草枯中毒会引起活性氧激增并导致NADPH及其它还原物质的消耗[23],降低还原型谷胱甘肽(GSH)水平[24]。脑组织内抗拒脂质过氧化的酶消耗过多,使得清除体内自由基的能力降低,一方面可导致小鼠脑组织脂质过氧化增强,造成脑黑质、纹状体氧化损伤,对其功能有特异性毒性[25-29];另一方面,可使脑内单胺类神经递质含量降低,对小鼠神经系统具有一定的毒性作用[8,30],长期接触可能改变多巴胺的代谢[31-32]。脑内的多巴胺主要由单胺氧化酶(MAO)转化为DOPAC,在儿茶酚氧位甲基转移酶(Corn)的作用下,DOPAC转化为高香草酸(HVA)。但与灵长类动物不同,鼠脑中多巴胺代谢的终产物主要是DOPAC[33];5-HT的主要代谢产物是5-HIAA。在本实验中,PQ组小鼠脑组织中的DA和5-HT较Con组均有下降趋势,而DOPAC、5-HIAA的含量明显升高,这与PQ的发病机理相一致。
本实验中大蒜素治疗(PQ+DAS)组的DA、5-HT含量均高于PQ染毒组,与周晓明等[34]得出的MAO的表达有抑制作用的实验结果一致。此次实验中DAS组的5-HT含量高于Con组,与吕亚囡等[35]得出的大蒜素对5-HT存在上调作用的结论一致。
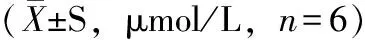

GroupDOPAC5⁃HIAAHVADA5⁃HTCon128 01±0 81113 44±1 8352 27±2 6139 89±1 277 75±2 02DAS156 74±12 47153 60±2 4681 24±2 5534 38±5 3310 72±4 01PQ141 28±2 58138 35±4 0339 16±1 3617 59±4 953 99±0 28PQ+DAS166 78±3 29181 01±2 6746 14±7 3421 67±6 935 03±0 50
3 结 论
本文建立了HPLC-ECD法,灵敏、简便、快速地测定了小鼠脑组织中5-HT、DA、5-HIAA、DOPAC、HVA等单胺类神经递质的含量,从而考察了大蒜素对百草枯染毒小鼠脑组织神经递质含量变化的影响。实验结果提示,大蒜素可能通过减轻氧化损伤和提高小鼠单胺类神经递质DA、5-HT 的含量来有效改善百草枯中毒小鼠的脑损伤,对百草枯神经毒性有一定的解毒作用。然而,大蒜素可否作为百草枯解毒剂或解毒辅助药物应用于临床,尚有待于进一步探讨。
[1] Mohamed F,Buckley N A,Jayamanne S,Pickering J W,Peake P,Palangasinghe C,Wijerathna T,Ratnayake I,Shihana F,Endre Z H.Toxicol.Lett.,2015,237(2):140-150.
[2] Zheng D,Li C B,Wang S,Cang Y Q,Song Y X,Liu X Y,Li X H,Mohan C,Wu T F,Hu D Y,Peng A.LifeSci.,2015,123(123):9-17.
[4] Yu G C,Kan B T,Jian X D,Wang J R,Sun J,Song C Z.Exp.Ther.Med.,2014,8(1): 233-236.
[5] Wang W Z,Li J,Ma G Y,Li N,Wang P,Xiao Q M,Li B Y,Liu Y J,Gao X,Li W.Chin.Crit.CareMed.(王维展,李敬,马国营,李娜,王璞,肖青勉,李柏艳,刘永建,高珣,李伟.中华危重病急救医学),2015,27(4): 254-258.
[6] Zhang B L,Yao L,Ou Y.Chin.Crit.CareMed.(张宝兰,姚朗,欧艺.中国急救医学),2010,30(2): 139-141.
[7] Gil H W,Kang M S,Yang J O,Lee E Y,Hong S Y.Clin.Toxicol.,2008,46(6): 515-518.
[8] Chen Q,Kang W J,Zhang R,Ma L,Xue P,Zhao L J,Lian K Q.Chin.J.Ind.Hyg.Occup.Dis.(陈庆,康维钧,张荣,马莉,薛鹏,赵丽娟,连靠奇.中华劳动卫生职业病杂志),2009,27(4):238-239.
[9] Yang R H,Wu H,Zhang N.J.SoutheastUniv.:Med.Sci.Ed.(杨融辉,吴晗,张宁.东南大学学报:医学版),2015,34(6):1037-1040.
[10] Ho C Y,Cheng Y T,Chau C F,Yen G C.J.Agric.FoodChem.,2012,60(1): 100-107.
[11] Cao Y F,Wang H W,Su X,Hou Y,Guan J,Xie B,Yu Y M,Wang L O,Chen Y B,Han Y L,Qiu P,Song W.Chin.J.Pharmcol.Toxicol.(曹玉芳,王洪武,苏醒,侯宇,管军,谢斌,余燕梅,王莲藕,陈颖斌,韩艳丽,邱平,宋维.中国药理学与毒理学杂志),2015,30(5): 526-531.
[12] Zhang H,Zhao G Z,Wang D S,Zhao B X,Ji B,Song Y,Zhang P,Liu Y L,Li Y H.Chin.Acup.Moxib.(张鹤,赵国桢,汪德生,赵百孝,嵇波,宋艳,张平,刘亚利,李莹辉.中国针灸),2015,35(12): 1275-1279.
[13] Yang J M,Ren J,Liu H Q,Wang Y L,Xu Z Q.Chem.J.Chin.Univ.(杨娇美,任杰,刘慧青,王永乐,徐中其.高等学校化学学报),2013,34(12): 2699-2703.
[14] Xu J L,Yan X J,Ye F T,Liu C C.J.Instrum.Anal.(徐继林,严小军,叶芳挺,刘才才.分析测试学报),2004,23(z1): 26-29.
[15] Dam D V,Vermeiren Y,Aertsa T,Deyn D,Paul P.J.Chromatogr.A,2014,1353: 28-39.
[16] Su F L,Wang F,Zhu R H,Huang A L,Li H D.Chin.J.Pharm.Anal.(苏芬丽,王峰,朱荣华,黄爱玲,李焕德.药物分析杂志),2008,28(8): 1238-1243.
[18] Zhao H Y,Duan C L,Fan C X,Liu Q,Zhang T,Yang H.Chin.J.Anal.Chem.(赵焕英,段春礼,范春香,刘琦,张韬,杨慧.分析化学),2009,37(3):330-334.
[19] Huang X,Chen J W,He L P,Kang X J.Chin.J.Prev.Med.(黄晓,陈佳文,贺莉萍,康学军.中华预防医学杂志),2012,42(12):1117-1120.
[20] Qi W H,Zhao X E,Qi Y,Sun Z W,Chen G,You J M,Suo Y R.J.Instrum.Anal.(亓伟梅,赵先恩,亓永,孙志伟,陈光,尤进茂,索有瑞.分析测试学报),2015,34(9): 1014-1020.
[21] Zhou X L,Wang Y,Chen L Q,Kang X J.Chin.J.Chromatogr.(周小玲,王羽,陈利琴,康学军.色谱),2011,29(11):1107-1111.
[22] Wushuer P,Upur H,Kuerban A,Aizezi R,Dang M,Aimaiti N.Sci.Technol.Rev.(帕丽丹·吾术尔,哈木拉提·吾甫尔,阿不都卡德尔·库尔班,热娜古丽·艾则孜,党明,努尔买买提·艾买提.科技导报),2013,31(18): 63-67.
[23] Chen N,Bowles M R,Pand S M.Hum.Exp.Toxicol.,1994,13(8): 551-570.
[24] Malchiorri D,Reiter R J,Attia A M,Hara M,Burgos A,Nistico G.LifeSci.,1995,56(2): 83-89.
[25] Rudyk C,Litteljohn D,Syed S,Dwyer Z,Hayley S.Neurobiol.Stress,2015,2: 85-93.
[26] Narasimhan M,Riar A K,Rathinam M L,Vedpathak D,Henderson G,Mahimainathan L.Toxicol.Lett.,2014,228(3): 179-191.
[27] Shimizu K,Ohtaki K,Matsubara K,Aoyama K,Uezono T,Saito O,Suno M,Ogawa K,Hayase N,Kimura K,Shiono H.BrainRes.,2001,906(1/2):135-142.
[28] Wu B L,Song B,Tian S Z,Huo S H,Cui C X,Guo Y S,Liu H J.NeuroToxicol.,2012,33(5): 1330-1337.
[29] Wu B L,Song B,Yang H Q,Huang B Y,Chi B,Guo Y S,Liu H J.NeuroToxicol.,2013,35: 62-70.
[30] Kutera K,Smialowskab M,Wierofiskab L,Zięba B,Wardas J,Pietraszek M,Nowak P,Biedka I,Roczniak W, Konieczny J,Wolfarth S,Ossowska K.BrainRes.,2007,1155:196-207.
[31] Bismnth C,Garnier R,Baud F J,Muszynski J,Keyes C.DrugSaf.,1990,5(4): 243-251.
[32] Mandel J S,Adami H O,Cole P.Regul.Toxicol.Pharmacol.,2012,62(2): 385-392.
[33] Liu Y H,Wang S X,Cheng D Y,Shang A J,Zhang J.Pract.J.Med.Pharm.(刘玉河,王树新,程东源,尚爱加,张纪.实用医药杂志),2003,20(6): 473-474.
[34] Zhou X M,Yang Z Y,Wang L L,Zheng Y,Zhang Y J, Liu Q H.J.Trop.Med.(周晓明,杨志勇,王璐璐,郑勇,张雅洁,刘清华.热带医学杂志),2014,14(11): 1428-1430.
[35] Lü Y N,Dong Q.Chin.J.Clin.Pharmacol.Ther.(吕亚囡,董群.中国临床药理学与治疗学),2012,17(8): 884-887.
Study on Effects of Alltride on Monoamine Neurotransmitters in Brain of Paraquat Poisoning Rats by HPLC-ECD
TAN Xiao-xin,ZHANG Shu-juan,LIU Kun,ZHANG Hua-yin,LIAN Kao-qi, XU Xiang-dong,KANG Wei-jun*
(School of Public Health,Hebei Medical University,Shijiazhuang 050011,China)
An HPLC-ECD method was established for the determination of five neurotransmitters in cerebral tissues of rats to discuss the protective effects of alltride(DAS) on the monoamine neurotransmitters(MNTs) in paraquat(PQ) poisoning rats brain tissues.Male ICR rats were divided into four groups(n=6) according to their different treatments.The paraquat(PQ) group and the treatment(PQ+DAS) group exposed to 35 mg/kg PQ i.g..The control group and the alltride(DAS) group were given the same volume of sterile saline.The alltride(DAS) group and treatment group were administrated with 25 mg/kg DAS i.p.after PQ was given intragastrically for 2,26,50 h.PQ group and normal group rats were injected with the same amount of sterile saline.The determination was performed on an Acclaim 120 C18column with a mobile phase consisted of buffer salt(sodium citrate,monopotassium phosphate,sodium heptanesulfonate,EDTA-2Na,diethylamine hydrochloride )-methanol(93∶7,by volume) at a flow rate of 0.27 mL/min,and the voltage of electrode was set at 450 mV.Compared with the normal or DAS group,the PQ group showed significant decreases in the quantities of DA and 5-HT.The combination of PQ and DAS resulted in higher amounts of neurotransmitters than that of the administration with PQ alone(P<0.05).The spiked recoveries were in the range of 79.8%-112.1%with RSDs lower than 10%.DAS could prevent rats from the PQ-induced decrease of the neurotransmitters,which may be associated with its abilities to relieve oxidative damages.
HPLC-ECD;paraquat;alltride;monoamine neurotransmitters
O657.72;O623.732
:A
:1004-4957(2017)09-1069-06
2017-04-10;
:2017-04-17
国家自然科学基金资助项目(81573202)
*
:康维钧,博士,教授,研究方向:卫生检验新方法,Tel: 0311-86265754,E-mail: kangwj158@163.com
10.3969/j.issn.1004-4957.2017.09.002
