牛mettl3基因的原核表达与蛋白纯化
2017-09-26高学军刘丽杰李冬李姗姗陈东莹于萌萌
高学军,刘丽杰,李冬,李姗姗,陈东莹,于萌萌
牛mettl3基因的原核表达与蛋白纯化
高学军,刘丽杰,李冬,李姗姗,陈东莹,于萌萌
(东北农业大学,黑龙江省高校农业生物功能基因重点实验室,哈尔滨150030)
m6A甲基转移酶(methyltransferase-like protein 3,METTL3)可调控mRNA的m6A甲基化水平,调节细胞蛋白质合成,实验室前期发现METTL3为乳腺上皮细胞乳合成重要调节分子,发挥泌乳调节作用。目前尚不清楚METTL3分子结构基础及其参与的调节机制。为揭示METTL3结构与功能关系,对METTL3蛋白作原核表达及纯化。研究采用PCR方法扩增牛mettl3基因完整CDS区,将CDS区插入原核表达载体pGEX-4T-1,异丙基硫代-β-D-半乳糖苷(IPTG)诱导METTL3蛋白大量表达,用8 mol·L-1尿素裂解包涵体,利用GST蛋白纯化试剂盒纯化诱导获得METTL3蛋白。SDS-PAGE证实GST-METTL3融合蛋白存在于包涵体内,试验获得高纯度GST-METTL3融合蛋白,为进一步研究METTL3蛋白在奶牛泌乳中作用提供重要依据。
牛;METTL3;原核表达;纯化
自然界中RNA最主要修饰形式为甲基化[1]。由于初期细胞中RNA含量较低、提取后易降解、保存过程中稳定性差等因素限制,m6A功能未被发现,但m6A甲基转移酶可为了解m6A功能提供依据。1992年,Martin首次将Hela细胞核提取物和mRNA孵育,短时间孵育后发现Hela细胞核提取物在体外可将一定量mRNA催化形成m6A,即刻提取Hela细胞核,初步分离细胞核成分,获得两种形式酶,后续试验发现这两种形式酶主要存在细胞核中,可催化mRNA中A碱基形成m6A,将其体外进一步分离得到3个独立组分,分别为MT-A1(30 ku)、MT-A2(200 ku)和MT-B(876 ku)[2],Bokar等发现MT-A1是组成酶最小组分,不具有生物活性,MT-A2在70 ku处亚基被命名为METTL3[3]。Krug等报道,m6A甲基转移酶在mRNA m6A修饰过程中起主要调控作用,主要作用酶有METTL3和METTL14(Methyltransferase like 14)[4-6],且METTL3可催化RNA生成m6A[7-8]。
郝亚娟研究表明,将HeLa细胞中mettl3基因敲除可致m6A表达量降低30%[9]。Zheng等研究表明,METTL3集中存在富含剪切因子细胞核内亚细胞器-核小斑(Nuclear speckle)上,说明RNA剪切和加工与m6A修饰密切相关[10]。敲除mettl3基因引起一些物种发生减数分裂,出现发育异常[11-13]。在癌细胞中发现METTL3蛋白可促进癌基因翻译及增殖[14],调控mRNA中与癌症密切相关m6A甲基化水平[15-16]。朱琳娜等研究表明,超表达甲基转移酶METTL3可提高mRNA m6A甲基化水平,抑制脂肪沉积,RNA甲基化调控属于转录后水平调控[17-19]。在mRNA转录、剪切、出核、翻译等系列反应过程中m6A起调控作用,mRNAm6A甲基化水平在一定程度上受METTL3调控。本课题组前期研究发现METTL3参与细胞信号调节过程,METTL3正向调控奶牛乳腺上皮细胞(Bovine mammary epithelial cells,BMECs)中乳脂、乳蛋白合成[20]。
目前METTL3蛋白结构与功能关系尚不清楚,其信号转导通路尚待揭示。本试验旨在通过原核表达和纯化获得METTL3蛋白,阐明METTL3蛋白结构与功能关系及相关信号转导通路。构建mettl3基因原核表达载体,将阳性克隆质粒转入大肠埃希菌BL21中大量诱导表达,获得蛋白通过GST融合蛋白纯化试剂盒纯化,得到纯化后METTL3蛋白。为研究METTL3结构及其信号转导通路奠定基础。
1 材料与方法
1.1 载体和细胞
载体pGEX-4T-1由东北农业大学黑龙江省高校农业生物功能基因重点实验室提供。大肠埃希氏菌BL21购于哈尔滨博仕生物公司。原代培养奶牛乳腺组织,取自泌乳期健康中国荷斯坦奶牛。消化法获得乳腺上皮细胞,扩增培养,冻存前五代细胞于液氮中。消化法优点为短时间内可获得乳腺上皮细胞。
1.2 试剂与仪器
TRIzol®Reagent购于Invitroge公司;Reverse Transcriptase M-MLV(RNase H-)、DNA Marker(DL 5 000、DL 10 000)购于TaKaRa公司;GST MiniSpin Purification kit购于北京中科晨宇公司;Quick BlockTMWestern封闭液、GST抗体均购于北京碧云天公司;METTL3抗体购于Cell Signaling Technology CST公司;蛋白印记膜再生液Stripping buffer购于北京天根公司;牛血清、DMEM/F12干粉均购于PAN Bio-tech公司;HRP标记二抗购于北京中杉公司;激光扫描显微镜购于Leica TCS SP2公司;DYY-5电泳仪购于北京六一公司;由哈尔滨博仕生物提供引物合成、核酸测序服务。
1.3 方法
1.3.1 BMEC原代培养与纯化
消化法培养奶牛乳腺上皮细胞,将健康中国荷斯坦奶牛宰杀后,立即以常规手术方法取乳腺组织,将离体组织快速放入75%酒精中浸泡2 min,初步对乳腺组织杀菌消毒。将组织放入含有10倍双抗D-Hanks中浸泡2 min,此期间重复换掉DHanks,将组织块清洗干净后放入烧杯中,用含10倍双抗D-Hanks清洗至液体澄清,氟康唑洗2遍。准备2个小烧杯组织剪块,将脂肪、结缔组织、乳腺导管等去除掉,用剪子将实质组织尽量剪碎,为后续消化液充分消化,剪切后用含10倍双抗的D-Hanks清洗,将D-Hanks吸取倒掉,将剪好组织块放入锥形瓶中,向锥形瓶中加入提前溶解消化液,37℃摇床中反应4 h。400目铜网过滤组织液低速离心。用无血清培养液将离心后的沉淀吹起悬匀清洗,重复此步骤两次。最后放入含有10%血清培养液中常规培养,3 d后可获得纯化奶牛乳腺上皮细胞。
1.3.2 RNA提取以及鉴定
本试验中BMECs用含12%血清DMEM/F12培养液培养,选取活力旺盛且细胞生长至培养瓶80%细胞。Trizol法提取细胞总RNA,按照Reverse Transcriptase M-MLV反转录酶合成步骤进行反转录得到cDNA。
1.3.3 METTL3蛋白全长编码区基因扩增
设计一对mettl3特异性引物。上游引物:5' CGGAATTCGCCACGAGACTGAAATGT 3',下游引物:5'GCGTCGACATAGATTCTTAGGTTTAGAGAT GAT 3',引物由哈尔滨博仕生物公司设计合成。
1.3.4 原核表达载体pGEX-4T-1-METTL3构建
用EcoRⅠ和SalⅠ两种限制酶,将空载体pGEX-4T-1和上述通过PCR扩增获得目的片段双酶切,酶切产物用凝胶电泳检测,胶回收目的片段。得到pGEX-4T-1载体和mettl3基因用T4DNA连接酶,16℃金属浴连接过夜。次日将连接后产物转入BL21感受态细胞,37℃过夜,在超净工作台中挑取单菌落,次日提取质粒,将双酶切后正确质粒外送测序。菌液与80%甘油混合,-80℃保存。
1.3.5 重组蛋白在原核细胞中的诱导表达及鉴定
将pGEX-4T-1空载体及阳性重组质粒pGEX-4T-1-METTL3接种到含有100 μg·mL-1氨苄青霉素LB培养基中,37℃摇床过夜,次日取出1 mL菌液,加入500 mL锥形瓶中扩大培养。活化后菌液37℃摇床培养2 h至吸光度达0.6~0.9。试验分四组:第一组为无IPTG诱导pGEX-4T-1空载体、第二组为IPTG诱导pGEX-4T-1空载体、第三组无IPTG诱导阳性菌液、第四组为IPTG诱导阳性菌液。将第二组和第四组加入IPTG终浓度至1 mmol·L-1,同时将第四组IPTG诱导的阳性菌液分4种方法诱导:28℃培养6 h、30℃培养4 h、30℃培养6 h、16℃过夜培养[21]。其余分组采取28℃培养6 h。4℃离心10 min,收集菌体弃上清,加入10 mL预冷的PBS重悬沉淀中菌体,重复2次。冰上超声破碎[22],4℃离心10 min,收集上清及粗包涵体沉淀。向粗包涵体沉淀中加入4 mL 8 mol·L-1尿素,4℃过夜,4℃离心10 min之后取上清。收集两次分离得到上清液,冻存于-80℃冰箱中。分别取20 μL菌液上清及裂解沉淀后上清与上样缓冲液1:1混合,90℃沸水煮10 min。混合后样品超声3次,每次15 s。配置8%SDS-PAGE电泳。电泳结束后配置胶放入90℃水中煮10 min。重复3次,目的将背景洗脱干净,取出配置胶清晰可见诱导蛋白条带。
1.3.6 融合蛋白GST-METTL3纯化
取200 μL诱导后蛋白样品与100 μL重悬后液体充分混合,4℃摇床过夜。次日将孵育后液体全部加入离心层析柱内,4℃低速离心收集结合样品。向离心层析柱内加入500 μL预冷PBS,4℃低速离心,重复两次。除去未结合蛋白质,向离心柱内加入100~200 μL还原型GSH溶液,室温作用10 min。4℃低速离心收集样品。重复此步骤可增加回收量。取出少量纯化后样品作Western blotting初步检测。
1.3.7 目的蛋白鉴定
将诱导后GST-METTL3作8%SDS-PAGE电泳检测。将2次过柱得到的融合蛋白作8%SDSPAGE电泳,分别利用特异性GST抗体和METTL3抗体做Western blotting分析,鉴定纯化后的蛋白是否为目的蛋白。
2 结果
2.1 重组表达载体pGEX-4T-1-METTL3构建
PCR产物电泳结果见图1A。比对10 000的DNA Marker与产物,图中2 300 bp处出现清晰条带,与试验预期mettl3片段大小一致,说明mettl3基因成功扩增。
pGEX-4T-1-METTL3经过EcoRⅠ和SalⅠ双酶切,在2 300 bp和5 300 bp处得到两条清晰条带,分别为目的片段mettl3和pGEX-4T-1载体(见图1B),条带出现位置与试验预期相符。同时与NCBI中公布的mettl3基因mRNA序列CDS区完全匹配。证明重组质粒pGEX-4T-1-METTL3构建成功。
2.2 GST-METTL3蛋白诱导表达及鉴定
由图2可知,IPTG分别对pGEX-4T-1-METTL3重组载体和pGEX-4T-1空载体诱导表达,考马斯亮蓝染色结果表明,第二条泳道IPTG诱导空载体表达GST蛋白明显多于第一条泳道未经IPTG诱导空载体表达GST蛋白。第三条泳道为IPTG诱导GST-METTL3上清中蛋白,在90 ku处无明显条带,第四条泳道为IPTG诱导的GST-METTL3包涵体上清中蛋白,90 ku处看到明显条带,表明METTL3蛋白成功诱导并主要以包涵体形式存在。电泳结果显示,第二和第四泳道出现特异性条带位置分别与GST蛋白和GST-METTL3融合蛋白分子质量相符,结果表明GST蛋白和GST-METTL3融合蛋白成功大量诱导表达。
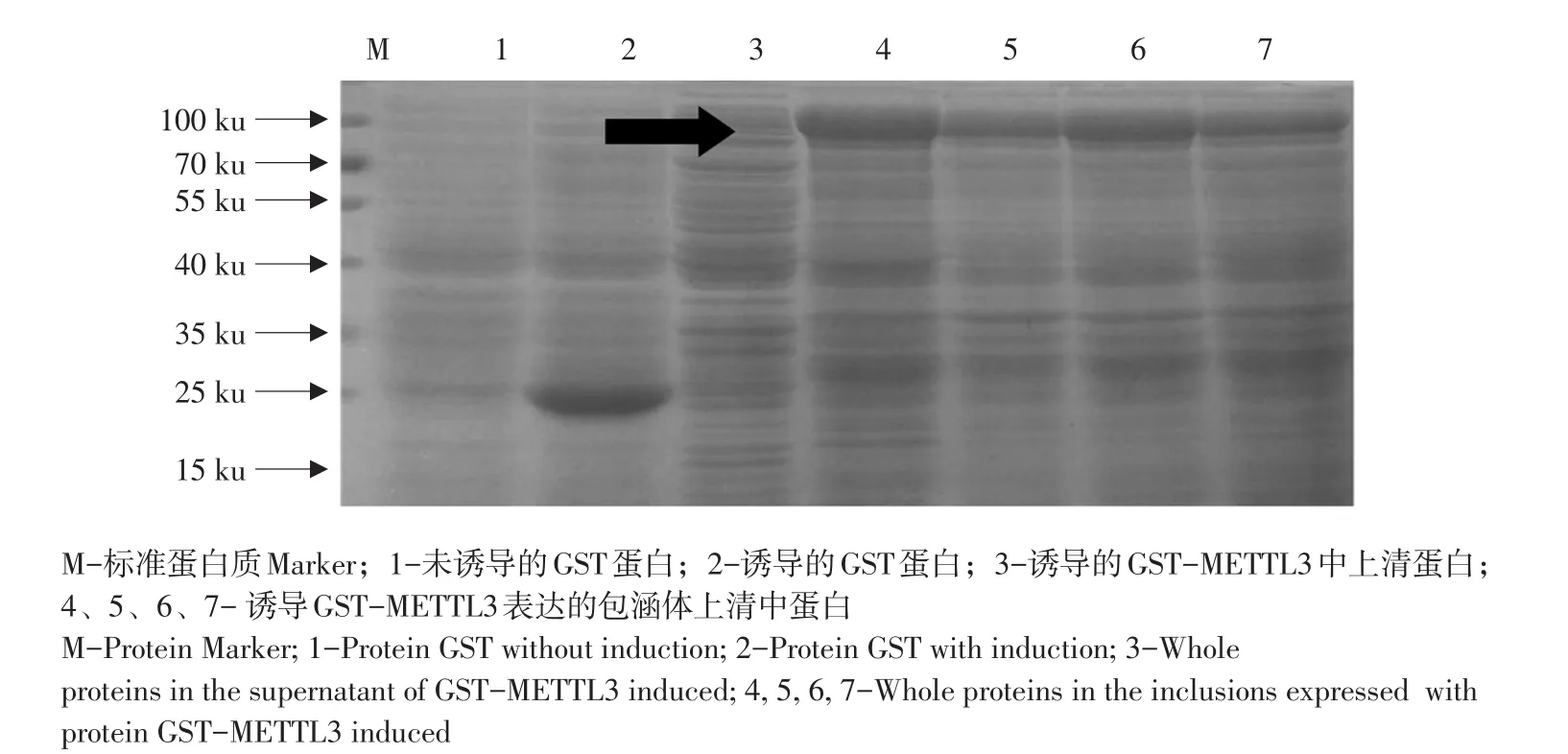
图2 重组菌诱导表达产物的SDS-PAGE分析结果Fig.2 SDS-PAGE analysis of recombinant bacteria E.coli BL21
2.3 融合蛋白GST-METTL3纯化
由图3可知,纯化样品作Western blotting分析,第一条泳道为纯化未经IPTG诱导GST蛋白,经过GST标签单克隆抗体检测在27 ku处出现特异性条带,但条带较浅,第二条泳道为纯化IPTG诱导GST蛋白含量,显著高于第一泳道GST蛋白。第三、四、五泳道为纯化IPTG诱导GST-METTL3包涵体上清中蛋白,经诱导包涵体上清中蛋白再经过柱纯化后洗脱液中蛋白在90 ku处可以被兔抗GST单抗特异性识别,表明纯化后蛋白极可能为GST-METTL3融合蛋白。
2.4 目的蛋白鉴定
由图4可知,纯化后GST-METTL3融合蛋白由于杂带较多,采用多次少量添加还原型GSH洗脱缓冲液,除去特异性结合蛋白,最终获得高纯度METTL3蛋白。利用METTL3特异性抗体作Westernblotting分析。从两图中可看出在90 ku处,纯化后融合蛋白GST-METTL3与METTL3抗体产生特异性免疫反应,图A杂带较多,B图只有目的条带,表明诱导、纯化得到融合蛋白为GST-METTL3蛋白。
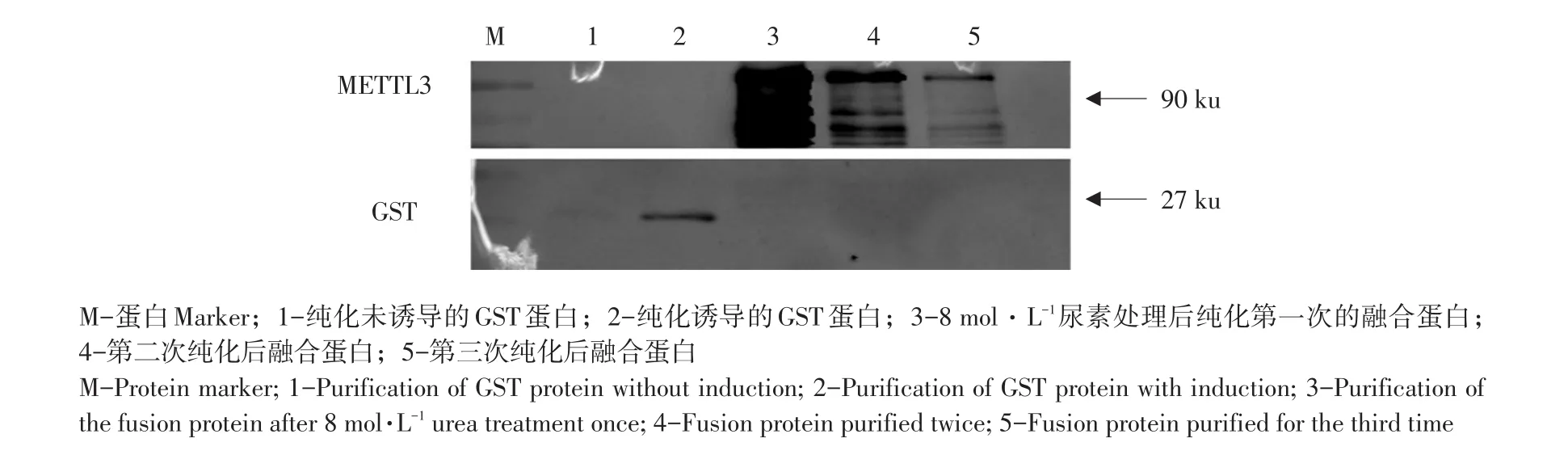
图3 Western blotting分析纯化的融合蛋白GST-METTL3Fig.3 Western blotting analysis of the recombinant protein GST-METTL3 after purification
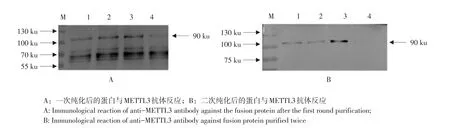
图4 目的蛋白Western blotting鉴定结果Fig.4 Western blotting analysis of the fusion protein with anti-METTL3 antibody
3 讨论
本试验成功构建含有GST标签pGEX-4T-1-METTL3载体,将阳性克隆质粒转入大肠埃希菌BL21感受态细胞,用IPTG(1 mmol·L-1,28℃,6 h)大量诱导表达,对包涵体蛋白用8 mol·L-1尿素作用24 h,得到蛋白通过GST融合蛋白纯化试剂盒纯化,经Western blot验证,获得纯化METTL3蛋白。
带有GST标签原核表达载体广泛用于蛋白原核表达。GST标签分子质量约27 ku,具有可溶性高、可在不同宿主中表达、适合范围广、可很好保留蛋白抗原性和生物活性,提高外源蛋白稳定性,可利用GST层析柱快速纯化等优点[23-24]。但GST标签分子较大,影响蛋白质功能和下游试验,因此纯化后需去除标签。由于GST标签蛋白含有特殊剪切序列,纯化后使用不同蛋白酶可简单去除GST标签[25-26]。本试验中将诱导后融合蛋白产物通过GST层析柱快速、简单纯化,经Western blot检测确定为METTL3蛋白。结果表明,GST标签载体构建成功,表达蛋白可用GST融合蛋白纯化试剂盒快速、简单纯化。本试验未去除GST标签,主要考虑将GST标签用于METTL3蛋白分子标记试验。
原核表达重组蛋白关键在于蛋白诱导表达,但每个蛋白诱导表达条件不同。本试验利用IPTG对pGEX-4T-1-METTL3载体在大肠埃希菌BL21感受态细胞中表达诱导。本课题组前期试验确定IPTG浓度为1 mmol·L-1[25]。本试验采用500 mL大容量锥形瓶培养菌液,为菌液提供足够氧气。在提高菌液量,优化诱导温度和时间。按以下四个条件诱导:28℃培养6 h;30℃培养4 h;30℃培养6 h;16℃过夜培养。SDS-PAGE电泳结果显示,28℃6 h诱导后效果最好,诱导获得蛋白约占总蛋白30%,诱导温度和时间达到理想效果。
本研究结果表明,在BL21中表达METTL3蛋白主要以包涵体形式存在,难以分离纯化。包涵体是目的蛋白在原核表达过程中形成不具有生物学活性、非折叠状态聚集体,有极强折光性[27]。在宿主体内表达时因诱导过程中蛋白过高、过快、温度较低,使表达蛋白未完成折叠等过程,形成包涵体。包涵体可去除细胞内可溶性蛋白,避免蛋白水解酶降解表达产物并提高产量,但包涵体复性过程需加入变性剂,可引起蛋白质不可逆修饰及性质改变。Yang等指出在一步法变性和复性过程中,6 mol·L-1盐酸胍或8 mol·L-1尿素变性剂用于溶解包涵体中蛋白[28]。盐酸胍溶解能力高于尿素,但易造成SDS-PAGE电泳条带变形,而尿素优点为变性蛋白在碱性条件下可长期保存,尿素溶解具有蛋白不电离、成本低、蛋白复性后除去尿素不会造成大量蛋白质沉淀等。为确认GSTMETTL3经诱导后产生蛋白是在上清还是沉淀中形成包涵体,设计四个分组:分别为无IPTG诱导GST蛋白、IPTG诱导GST蛋白、IPTG诱导GSTMETTL3上清中蛋白、IPTG诱导GST-METTL3包涵体上清中蛋白。上述蛋白经考马斯亮蓝染色表明GST-METTL3经过IPTG诱导形成包涵体。本试验采用尿素作为变性剂溶解包涵体,用8 mol·L-1尿素作用24 h后可获得溶解蛋白,但此过程易造成目的蛋白降解甚至重组[29],目的蛋白产生大小不同肽段,导致第一次通过GSH-Sepharose 4B柱纯化蛋白杂带较多。为获得较高纯度蛋白,需将上述诱导后蛋白再一次纯化过柱。本试验采用二次纯化方法解决纯化后蛋白杂带较多问题。纯化过程中仍存在主要问题为诱导蛋白不易与GSHSepharose 4B磁珠互相结合,造成目的蛋白在纯化过程过早被PBS缓冲液洗脱,显著降低蛋白回收率,呈现假阴性结果。为提高蛋白收率,本试验将目的蛋白与GSH-Sepharose磁珠4℃孵育过夜,通过延长作用时间,目的蛋白和GSH-Sepharose磁珠充分结合,多次过柱纯化,显著提高蛋白回收率,200 μL菌液可获得300 μL纯度较高蛋白用于后续试验。
4 结论
本试验成功构建原核表达载体pGEX-4T-1-METTL3,阳性质粒诱导时,通过多次改变IPTG浓度、诱导温度、液体培养基体积等条件实现重组蛋白高水平表达。试验结果表明诱导后融合蛋白,在低温诱导过程中形成包涵体并以包涵体形式存在,为获得融合蛋白,用8 mol·L-1尿素溶解包涵体,获得大量GST-METTL3蛋白,GST蛋白纯化试剂盒对其多次过柱纯化,最终获得纯度较高METTL3蛋白。METTL3蛋白可为研究RNA甲基化及METTL3蛋白功能及其机制提供试验材料。
[1]Cantara W A,Crain P F,Rozenski J,et al.The RNA modification database,RNAMDB:2011 update[J].Nucleic Acids Research, 2011,39:195-201.
[2]Narayan P,Ludwiczak R L,Goodwin E C,et al.Context effects on N6-adenosine methylation sites in prolactin mRNA[J].Nucleic Acids Research,1994,22(3):419-426.
[3]Bokar J A,Shambaugh M E,Polayes D,et al.Purification and cDNA cloning of the AdoMet-binding subunit of the human mRNA(N6-adenosine)-methyltransferase[J].Rna-a Publication of the Rna Society,1997,3(11):1233-1247.
[4]Krug R M,Morgan M A,Shatkin A J.Influenza viral mRNA contains internal N6-methyladenosine and 5'-terminal 7-methylguanosine in cap structures[J].Journal of Virology,1976,20(1): 45-53.
[5]Rottman F M,Desrosiers R C,Friderici K.Nucleotide methylation patterns in eukaryotic mRNA[J].Progress in Nucleic Acid Research&Molecular Biology,1977,19:21-38.
[6]Wei C M,Moss B.Nucleotide sequences at the N6-methyladenosine sites of HeLa cell messenger ribonucleic acid[J].Biochemistry,1977,16(8):1672-1676.
[7]Acosta J J,Muñoz R M,González L,et al.Src mediates prolactin-dependent proliferation of T47D and MCF7 cells via the activation of focal adhesion kinase/Erk1/2 and phosphatidylinositol 3-kinase pathways[J].Molecular Endocrinology,2003,17 (11):2268-2282.
[8]Bird A.Methylation talk between histones and DNA[J].Science, 2002,294(5549):2113-2115.
[9]郝亚娟.RNA N6-甲基腺嘌呤(m~6A)位点形成机制及功能研究[D].北京:中国科学院北京基因组研究所,2016.
[10]Zheng G,Dahl J A,Niu Y,et al.ALKBH5 Is a Mammalian RNA demethylase that impacts RNA metabolism and mouse fertility[J].Molecular Cell,2013,49(1):18-29.
[11]Hongay C F,Orrweaver T L.Drosophila inducer of MEiosis 4 (IME4)is required for notch signaling during oogenesis[J]. Proceedings of the National Academy of Sciences of the United States of America,2011,108(36):14855-14860.
[12]Zhong S,Li H,Bodi Z,et al.MTA is an Arabidopsis messenger RNA adenosine methylase and interacts with a homolog of a sexspecificsplicingfactor[J].PlantCell,2008,20(5):1278-1288.
[13]Niu Y,Zhao X,Wu Y S,et al.N6-methyl-adenosine(m6A)in RNA:An old modification with a novel epigenetic function[J]. Genomics Proteomics Bioinformatics,2013,11(1):8-17.
[14]Lin S,Choe J,Peng D,et al.The m6A methyltransferase METTL3 promotes translation in human cancer cells[J].Molecular Cell, 2016,62(3):335-345.
[15]Shah J C,Clancy M J.IME4,a gene that mediates MAT and nutritional control of meiosis in Saccharomyces cerevisiae[J]. Molecular Cellular Biology,1992,12(3):1078-1086.
[16]Camper S A,Albers R J,Coward J K,et al.Effect of undermethylation on mRNA cytoplasmic appearance and half-life[J]. Molecular Cellular Biology,1984,4(3):538-543.
[17]朱琳娜.FTO、METTL3基因表达对猪脂肪细胞mRNA N6-甲基腺苷水平及脂肪沉积的影响研究[D].杭州:浙江大学,2014.
[18]Bird A.Methylation talk between histones and DNA[J].Science, 2001,294(5549):2113-2115.
[19]Alarcón C R,Lee H,Goodarzi H,et al.N6-methyladenosine marks primary microRNAs for processing[J].Nature,2015,519 (7544):482-485.
[20]李冬,黄鑫,李姗姗,等.METTL3对乳腺上皮细胞中乳蛋白和乳脂肪合成的影响[J].中国畜牧兽医,2017,44(5):1267-1274.
[21]翟红,柏锡,朱延明,等.SCMRP基因原核表达及多克隆抗体制备[J].东北农业大学学报,2009,40(7):60-65.
[22]王庭柱,郭永丽,高明春,等.牛IFN-ε基因克隆、表达与抗病毒活性分析[J].东北农业大学学报,2015,46(12):39-44.
[23]麦杰晖,于波,张其中.近江牡蛎金属硫蛋白(MT)的原核表达、纯化及多克隆抗体制备[J].农业生物技术学报,2015,23 (8):1104-1111.
[24]余静,罗韬,罗美中.利用酵母双杂交筛选豌豆叶绿体镁离子螯合酶D亚基相互作用蛋白[J].中国生物化学与分子生物学报,2011,27(9):864-872.
[25]高学军,臧艳丽,魏诚杰,等.牛eIF5基因原核表达与蛋白纯化[J].东北农业大学学报,2016,47(6):68-73.
[26]杨清.分子生物学与基因工程实验技术[M].北京:中国农业大学出版社,2014.
[27]刘玉英,钱和年,黄华梁,等.以包涵体形式表达的6B11卵巢癌抗独特型单链抗体的复性、纯化和活性研究[J].北京大学学报医学版,1998,30(5):400-403.
[28]Yang Z,Zhang L,Zhang Y,et al.Highly efficient production of soluble proteins from insoluble inclusion bodies by a two-stepdenaturing and refolding method[J].Plos One,2011,6(7):1-8.
Prokaryotic expression and protein purification of dairy cowmettl3 gene/
GAO Xuejun,LIU Lijie,LI Dong,Li Shanshan,Chen Dongying,Yu Mengmeng
(Key Laboratory of Agricultural Biological Functional Gene Labotatory of Heilongjiang Province,Northeast Agricultural University,Harbin 150030,China)
m6A methyltransferase(methyltransferase-like protein 3,METTL3)can regulate m6A methylation levels in mRNA,thus plays an important role in regulating protein synthesis in cells.The previous laboratory study found that METTL3 was one of the important regulatory molecules for milk synthesis in bovine mammary epithelial cells,regulating the lactation.It was still unknown the molecular basis and regulation mechanism of METTL3.To reveal the relationship between the protein structure and function of METTL3,METTL3 were expressed inE.coli,and purified this protein for further study.In this study,dairy cowmettl3 coding sequence was amplified by PCR and was cloned into pGEX-4T-1 vector.Protein expression was induced by IPTG and the inclusion bodies was cracked with 8 mol·L-1urea,then GST-METTL3 was purified by protein purified kit,identified by SDS-PAGE and Western blotting analysis.SDS-PAGE confirmed that fusion protein Gst-METTL3 existed in inclusion bodies. Western blotting and SDS-PAGE confirmed the recombinant protein GST-METTL3 was successfully expressed and purified.In summary,this study provided the experimental materials for the furtherresearches on the effect of METTL3 in dairy cow lactation.
dairy cow;METTL3;prokaryotic expression;purification
Q786
A
1005-9369(2017)08-0001-07
时间2017-9-12 11:34:37[URL]http://kns.cnki.net/kcms/detail/23.1391.S.20170912.1134.002.html
高学军,刘丽杰,李冬,等.牛mettl3基因的原核表达与蛋白纯化[J].东北农业大学学报,2017,48(8):1-7.
Gao Xuejun,Liu Lijie,Li Dong,et al.Prokaryotic expression and protein purification of dairy cowmettl3 gene[J].Journal of Northeast Agricultural University,2017,48(8):1-7.(in Chinese with English abstract)
2017-06-22
国家高技术研究发展计划(863计划)项目(2013AA102504-03)
高学军(1969-),男,教授,博士生导师,研究方向为乳业生物技术。E-mail:gaoxj53901@163.com
