大豆PM1蛋白抗氧化作用及提高酵母对铜耐受力
2017-09-23李承娜刘子明刘国宝郑易之
李承娜,高 阳,刘子明,刘国宝,郑易之
深圳大学生命与海洋科学学院,深圳市微生物基因工程重点实验室,广东深圳518060

【生物工程/Bioengineering】
大豆PM1蛋白抗氧化作用及提高酵母对铜耐受力
李承娜,高 阳,刘子明,刘国宝,郑易之
深圳大学生命与海洋科学学院,深圳市微生物基因工程重点实验室,广东深圳518060
Cu2+是植物生长必需的微量元素之一,但土壤中过量的Cu2+会对植物细胞产生毒害作用.大豆GmPM1蛋白属于第4组的胚胎晚期富集(late embroygenesis abundant, LEA)蛋白,该组蛋白序列中富含组氨酸残基. 研究大豆GmPM1蛋白在提高植物耐Cu2+胁迫方面的保护作用及其机理. 对大豆幼苗进行150 μmol/L CuSO4胁迫实验. 结果表明,Cu2+胁迫会造成大豆幼苗叶片失水萎蔫;在胁迫3 h和24 h时,幼叶内GmPM1基因表达上调. 构建了酵母表达载体pYES2-GmPM1,转化Cu2+敏感型酵母(ΔYAP1)得到重组菌ΔYAP1-GmPM1. 检测结果表明,表达GmPM1蛋白的酵母重组子对Cu2+胁迫耐受力得到提高. 采用Cu抗坏血酸体系,在体外检测出GmPM1及富含组氨酸残基的GmPM1-C端蛋白具有清除羟基自由基能力. 研究表明,大豆GmPM1蛋白可通过其C端的组氨酸残基结合过多的Cu2+,清除由Cu2+胁迫造成的细胞内产生的过量羟基自由基,提高植物及其细胞对Cu2+胁迫的耐受性.
大豆;GmPM1蛋白;组氨酸;Cu2+胁迫;清除羟基自由基;酵母重组子
胚胎晚期富集蛋白(late embryogenesis abundant,LEA)是参与生物体抵抗非生物胁迫的一类重要蛋白质[1]. 根据 LEA 蛋白保守序列的特点,可将LEA蛋白分为7组. 大多数的LEA蛋白具有高度亲水性和热稳定性[2]. LEA蛋白不仅在种子发育后期大量表达,也可被低温、缺水、高盐、渗透和重金属等胁迫条件诱导表达[3]. 目前对第1~第3组LEA蛋白的保护功能已经进行了较多研究,但是对同样在植物体内高表达的第4组的LEA蛋白(LEA4蛋白)研究较少,如棉花GossypiumhirsutumD-113蛋白在成熟的种子中的浓度可达286μmol/L[4].
有研究表明,经质量浓度为250g/L聚乙二醇(polyethylene glycol)处理12h的拟南芥幼苗体内的3个LEA4基因(AtLEA4-1、AtLEA4-2和AtLEA4-5)mRNA表达量大量增加[5];与对照植株相比,AtLEA4-5基因的过表达植株在缺水处理时具有较高的相对含水量;当AtLEA4-5基因插入突变后,突变体幼苗及成苗对渗透胁迫及干旱的耐受力都有所减弱,可见,在抵抗非生物胁迫过程中LEA4蛋白可能有着重要功能[5]. 一些体外实验也证明,拟南芥的AtLEA4-2和AtLEA4-5蛋白在冻融条件下可保护乳酸脱氢酶活性[6].
大豆GmPM1蛋白属LEA4蛋白. 体外实验证明,在干燥情况下GmPM1蛋白可结合海藻糖或蜜三糖;也能阻止干燥诱导的多聚赖氨酸聚集;且能起稳定细胞膜的作用. 可见,在干燥胁迫下,GmPM1蛋白通过参与细胞内玻璃化结构的形成来保护蛋白质和细胞膜结构[7]. LEA4蛋白缺乏重复的基序,其N-端高度保守,C-端保守性略低. 计算软件预测,N-端具有形成高比例兼性α-螺旋的潜能,而C-端则呈无规则卷曲结构[6]. 本实验前期工作证明,GmPM1蛋白可结合Fe3+、Ni2+、Cu2+和Zn2+等离子,参与GmPM1同源寡聚体形成[8]. 然而,GmPM1蛋白能否提高植物对重金属(如Cu2+)胁迫的耐受性,其作用机制还不清楚.
本研究首先检测了Cu2+胁迫下大豆幼叶形态变化及GmPM1的相对表达量. 又检验了转GmPM1基因的酵母突变体对Cu2+胁迫耐受力. 比较了GmPM1蛋白及其N端和C端蛋白清除羟基自由基的能力,并检测结合Cu2+对GmPM1蛋白结构的影响. 证明了GmPM1蛋白在抵抗Cu2+胁迫中可能发挥重要保护功能.
1 材料方法
1.1植物材料、菌株和质粒
“白农六号”大豆(GlycinemaxL.)种子. 重组菌BL-Pet28a-GmPM1由本实验室保存. 突变体菌株ΔYAP1是源于BY4742野生型酵母,购自Euroscarf(http://www.uni-frankfurt.de/fb15/mikro/euroscarf/), 菌株信息见表1. 酵母表达载体pYES2购自美国Invitrogen公司.
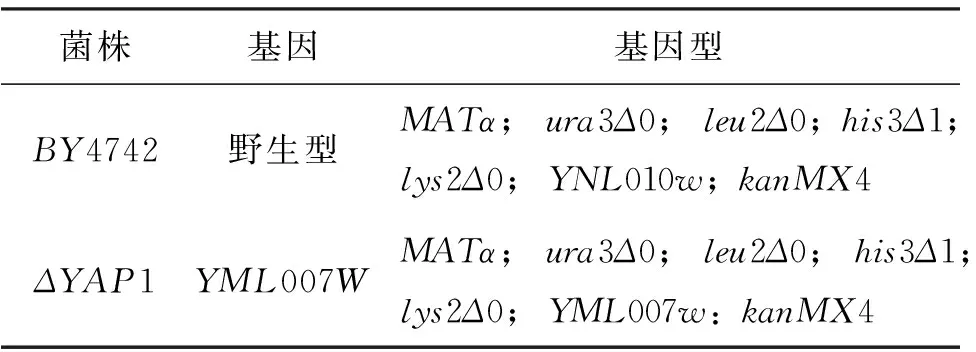
表1 酵母突变株及基因型
1.2方法
1.2.1大豆幼苗的培养及Cu2+胁迫处理
大豆种子萌发后移栽到霍格兰氏营养液中培养. 待生长至两片真叶期时,用150μmol/LCuSO4进行胁迫处理,在不同时间点取幼叶进行液氮速冻.
1.2.2荧光实时定量PCR
大豆叶片RNA的提取及荧光实时定量聚合酶链式反应(quantitativereal-timepolymerasechainreaction,RT-PCR)参照Wang等[9]的实验方法进行.GmPM1的正反向引物为GmPM1-F(GCTACAAACATTGGTGCTTCTG) 和GmPM1-R(GCTCCGCCTGGTTCATCT),并以大豆actin基因为内参,对应的引物为actinF(GTGCACAATTGATGGACCAG)和actinR(GTGCACAATTGATGGACCAG). 用2-△△Ct方法进行RT-PCR数据分析.
1.2.3酵母表达载体的构建与转化
根据GmPM1基因序列设计引物Y-PM1F(GATAGAGCTCATGCAGGGAGGAAAGAAAGCG)和Y-PM1R(CCGGAATTCTTAAGTACCCCCAGTCCCATA),以重组质粒pET28a-GmPM1为模板进行PCR扩增. 将扩增的PCR片段进行HindIII和SacI酶切,再连接至酵母表达载体pYES2-CT. 采用醋酸锂法,将空载体pYES2-CT和重组表达载体pYES2-GmPM1转化Cu2+敏感型酵母 (ΔYAP1), 获得重组酵母ΔYAP1-pYES2和ΔYAP1-GmPM1.
1.2.4Cu2+胁迫固体平板酵母生长的测定
挑取对照菌ΔYAP1-pYES2和重组菌ΔYAP1-GmPM1的单克隆,在SCR(syntheticcompletemediumcontainingraffinose)液体培养基中培养2~3d,按体积比为1∶50接种到诱导液体培养基(以20g/L半乳糖为碳源的SC-U(syntheticcompletemediumlackofura)培养基)中,置于200r/min30℃培养24h. 待菌液长至对数生长期,即光密度值D(600)为0.6~1.2,将其稀释至D(600)=0.6, 再以10倍为梯度进行稀释. 取稀释的菌液4μL滴至含不同浓度CuSO4的SC-U半乳糖固体培养基上. 于28℃培养2~3d,并拍照记录.
1.2.5羟基自由基的清除
参照Hara等[10]的实验方法,采用Cu2+抗坏血酸钠体系检测羟基自由基活性.
1.2.6圆二色谱(circulardichroism,CD)测定
配置500μL的样品溶液:1mmol/LHepes(pH=7.0),50mmol/LNa2SO4,10μmol/L的GmPM1、GmPM1-N或GmPM1-C蛋白,不同浓度(0、10、50和100μmol/L)的CuSO4溶液.25℃孵育10min,用J810圆二色谱仪(日本JASCO公司)测定. 用OriginPro8.0处理数据,并根据式(1)计算PII结构(polyprolineIItypehelicalstructure)含量[11].
[θ]=fH[θ]H+fⅡ[θ]II+fU[θ]U
(1)
其中, [θ]为特定温度下测定的222nm处的椭圆率;fH、fⅡ和fU分别为α-helix、PII和unordered的百分含量; [θ]H、[θ]II和[θ]U分别为α-helix、PII和unordered在222nm处的摩尔椭圆率常数,分别为-30000、+9580和-5560deg·cm2·dmol-1.
2 结果与分析
2.1CuSO4胁迫下大豆幼苗形态及GmPM1基因表达的变化
2.1.1 CuSO4胁迫下大豆幼苗表型变化
大豆种子发芽后,移到改良的霍格兰氏营养液中. 两片真叶期时,对大豆幼苗进行150 μmol/L CuSO4处理,观察大豆幼叶表型变化(图1). 当CuSO4胁迫0 h时,真叶坚挺伸展;胁迫3 h时,叶片有些下垂;胁迫6 h时叶片再次开始坚挺;胁迫24 h时幼苗叶片基本上已恢复坚挺,但叶边缘开始卷曲;胁迫48~72 h时叶片边缘已经萎蔫,且叶片脱水严重.

图1 CuSO4胁迫下大豆幼苗表型变化Fig.1 Phenotype of soybean seedlings under CuSO4 stress
2.1.2 CuSO4胁迫大豆幼苗叶中GmPM1基因的相对表达量
采用荧光实时定量RT-PCR检测Cu2+胁迫后大豆幼苗GmPM1基因的表达水平(图2). 结果表明,Cu2+胁迫3 h后的幼叶GmPM1基因表达量上升;在胁迫6~12 h后表达量下降;胁迫24 h后再次上升;胁迫48~72 h后该基因相对表达量再次下降. 可见,Cu2+胁迫后,GmPM1基因的相对表达量与叶表型变化有一定对应关系.
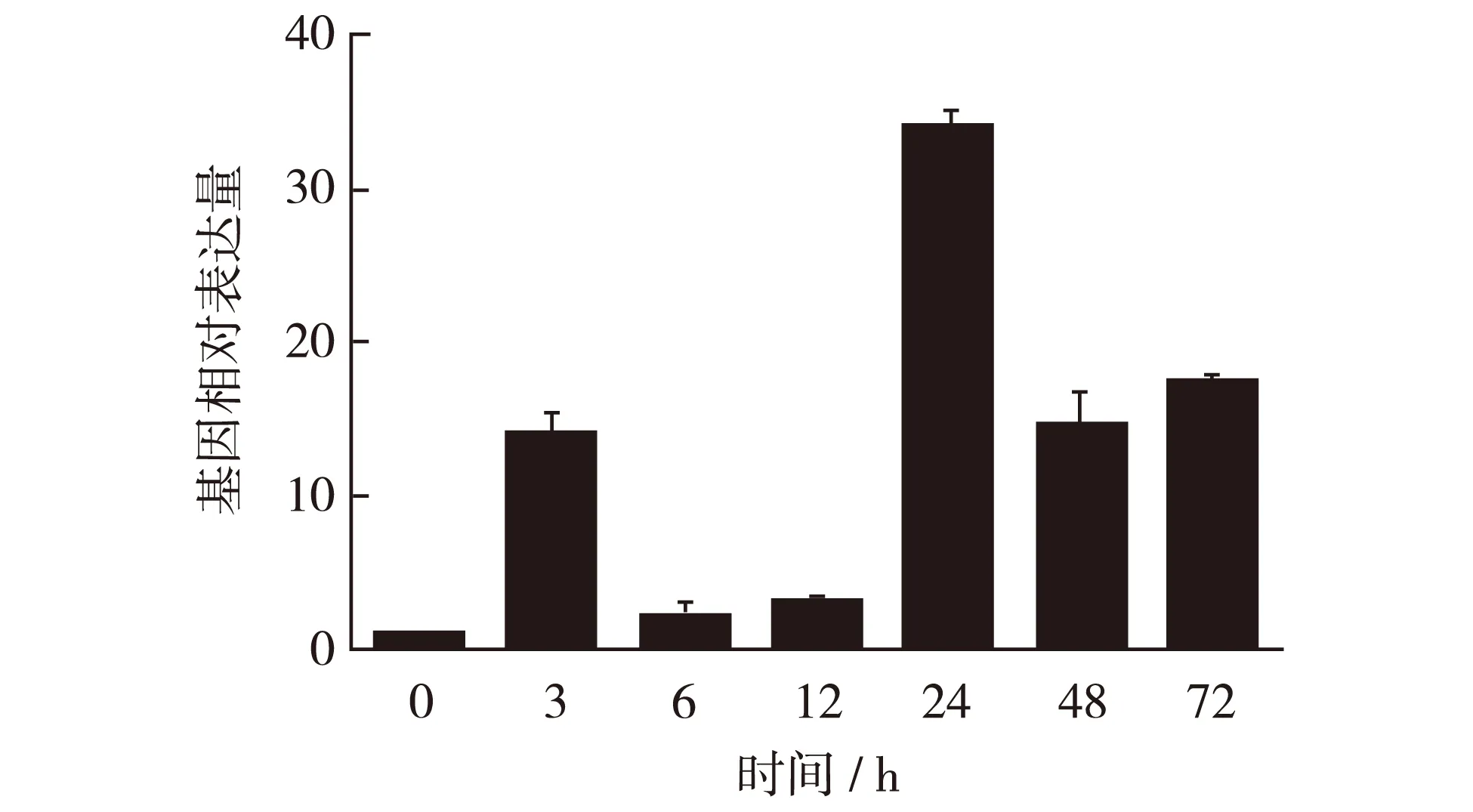
图2 大豆幼叶中GmPM1基因的相对表达量Fig.2 Relative transcript level of GmPM1 gene in soybean seedling leaves
2.2GmPM1蛋白表达提高Cu2+敏感型酵母(ΔYAP1)对Cu2+耐受力
将空载体pYES2-CT和重组表达载体 pYES2-GmPM1转化Cu2+敏感型酵母(ΔYAP1). 提取ΔYAP1-pYES2和ΔYAP1-GmPM1重组菌的可溶性蛋白进行十二烷基硫酸钠聚丙烯酰胺凝胶电泳(sodium dodecyl sulfate polyacrylamide gel electrophoresis,SDS-PAGE),结果如图3. 从中可见,与对照菌相比,ΔYAP1-GmPM1重组酵母可表达一特异条带(21 ku, 1 u =1 Da),如图3箭头所示. 该条带与文献[8]报告的大肠杆菌表达的GmPM1蛋白大小一致,表明GmPM1能在重组酵母中正常表达.
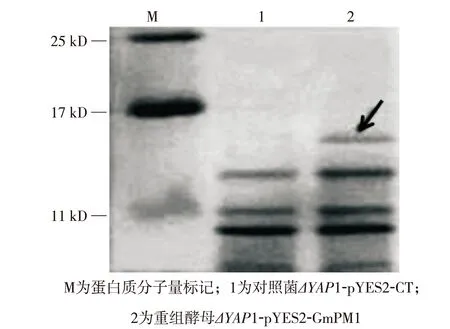
图3 GmPM1蛋白在重组酵母中表达Fig.3 Expression of GmPM1 protein in the recombinant yeast
将ΔYAP1-pYES2和ΔYAP1-GmPM1重组菌培养至对数生长期,再分别接种到正常固体培养基及含80和100 μmol/L CuSO4的胁迫培养基上,培养2~3 d. 结果表明,在正常培养基上,对照菌和重组菌生长状况接近. 但在80和100 μmol/L CuSO4培养基上,ΔYAP1-GmPM1重组菌长势明显优于转空载体对照菌,意味着GmPM1蛋白表达可提高ΔYAP1酵母对Cu2+胁迫耐受力(图4).

图4 对照菌ΔYAP1-pYES2和重组菌ΔYAP1-GmPM1的生长情况Fig.4 Growth situation of ΔYAP1-pYES2 and ΔYAP1-GmPM1
2.3GmPM1、GmPM1-N和GmPM1-C蛋白具有清除羟基自由基的能力
参照Hara等[10]的实验方法,检测GmPM1蛋白及其N端和C端蛋白清除Cu2+产生的羟基自由基的能力. 用荧光检测剂香豆素-3-羧酸来检测羟基自由基量的变化,在反应初始阶段荧光值会上升,但随时间延长荧光值将会保持不变. 以反应30 min时的荧光值为纵坐标,蛋白浓度为横坐标,做出拟合曲线,图5(a)至(d)分别是加入牛血清蛋白(albumin from bovine serum,BSA;对照)、GmPM1、GmPM1-N和GmPM1-C后荧光值变化的拟合曲线. 由图5(a)至(d)可知,样品的荧光值随蛋白浓度增加而降低,表明GmPM1、GmPM1-N和GmPM1-C蛋白清除羟基自由基能力有剂量依赖性.
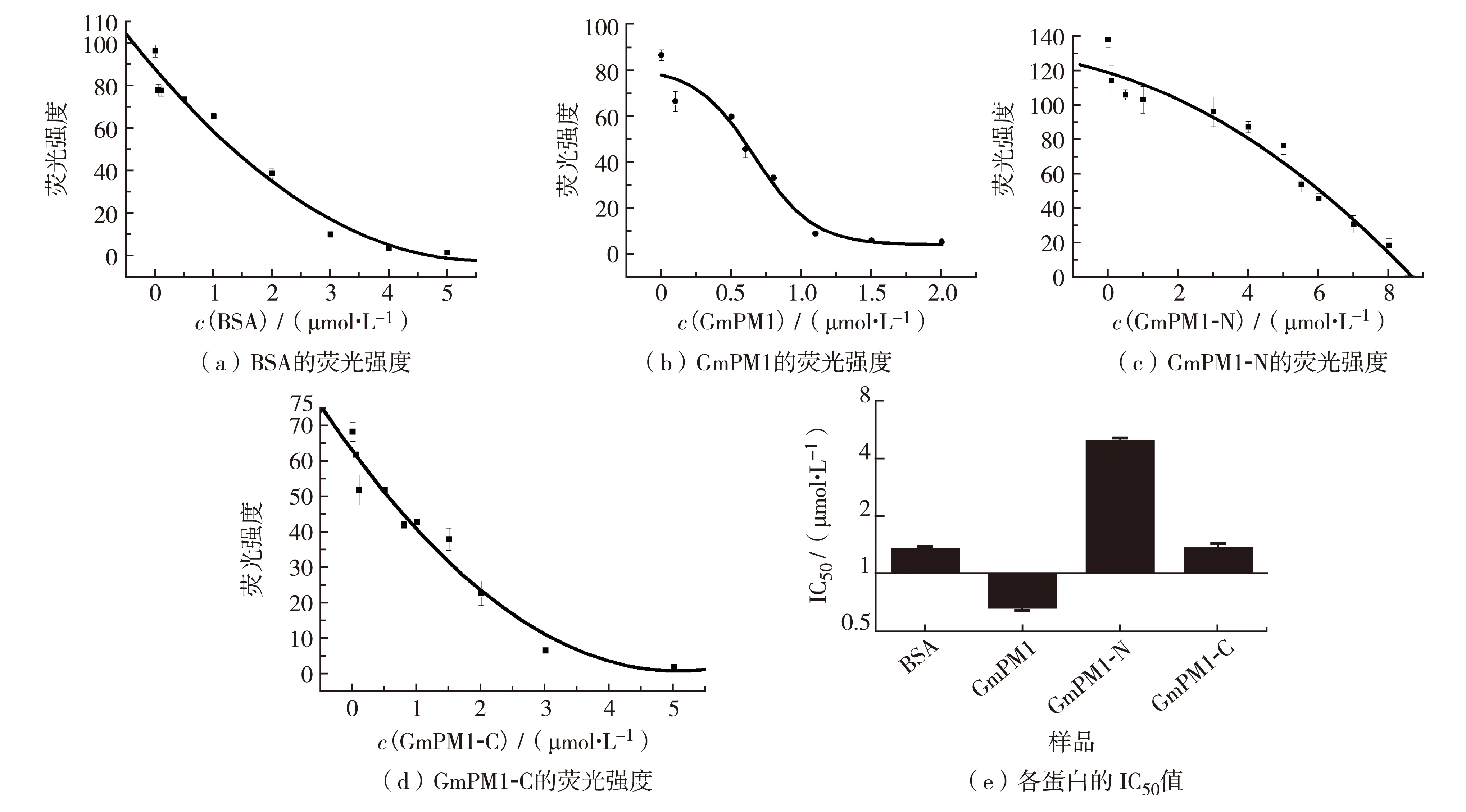
图5 BSA、GmPM1、GmPM1-N和GmPM1-C蛋白清除羟基自由基能力Fig.5 Activities of scavenging hydroxyl radicals of BSA, GmPM1, GmPM1-N and GmPM1-C
以荧光强度达到最大值的50%对应的蛋白浓度(inhibitory concentration 50%, IC50)表示羟基自由基清除能力,如图5(e),即IC50值越小,该蛋白清除羟自由基能力越强,以未加入蛋白样品时荧光值为最大荧光强度. 由图5(e)知,BSA、GmPM1、GmPM1-N 和GmPM1-C的IC50分别为1.34、0.66、4.93和1.37 μmol/L,表明GmPM1蛋白及其短肽蛋白的清除羟基自由基能力顺序为:GmPM1>GmPM1-C> GmPM1-N蛋白.
2.4Cu2+对GmPM1、GmPM1-N和GmPM1-C蛋白结构变化的影响
GmPM1蛋白属固有无序蛋白. 在正常生理状态下的GmPM1主要为无序结构状态. 本研究以CD光谱法检测在不同Cu2+浓度下,GmPM1、GmPM1-N和GmPM1-C蛋白的二级结构变化.c(Cu2+)=0 μmol/L时,GmPM1、GmPM1-N和GmPM1-C的CD谱在198 nm附近存在一负峰,这是典型的无规则卷曲结构,如图6(a)至(c). 加入高浓度Cu2+(10、50和100 μmol/L)后,GmPM1和GmPM1-N的CD图谱未发现明显改变. 与其不同,GmPM1-C的CD图谱在205 nm处出现一等漫射点,如图6(c)箭头处,这为典型的多聚脯氨酸II型螺旋结构特征[12].
绘制GmPM1-C蛋白CD差异谱,如图6(d),即在190~210 nm有1个负峰,210 ~230 nm有1个正峰,且在215 nm处差异达最大,进一步证实GmPM1-C蛋白存在PII结构[12]. 利用公式计算PII结构含量[11]. 加入100 μmol/L Cu2+后,GmPM1-C蛋白的PII结构为从27%降低到18%. 可见,高浓度的Cu2+,可直接影响GmPM1-C蛋白的二级结构及其构象.
3 讨 论
Cu2+是植物正常生长发育所必须的重要微量元素之一,但是,土壤中Cu2+过量存在会严重影响植物正常生长发育,甚至导致植物死亡. González-mendoza等[13]研究发现,铜胁迫会使亮叶白骨壤(Avicenniagerminans)叶的气孔导度及叶绿素含量降低,从而减弱净光合作用. Cu2+还可增加活性氧(Reactive Oxygen Species,ROS)的产生,或降低植物细胞内抗氧化酶活性,导致ROS过量积累,造成氧化伤害[14]. 在长期进化中,植物体中产生了多种抵抗铜离子毒害的机制,如形成共生菌根和诱导表达金属转运蛋白,抗逆蛋白及植物络合素合酶等[15]. 如香蕉MpDhn12蛋白(LEA2)在体外可结合Cu2+,过表达后可提高Cu2+敏感酵母Δsod1, 表明MpDhn12蛋白可能具有抗氧化功能[16].
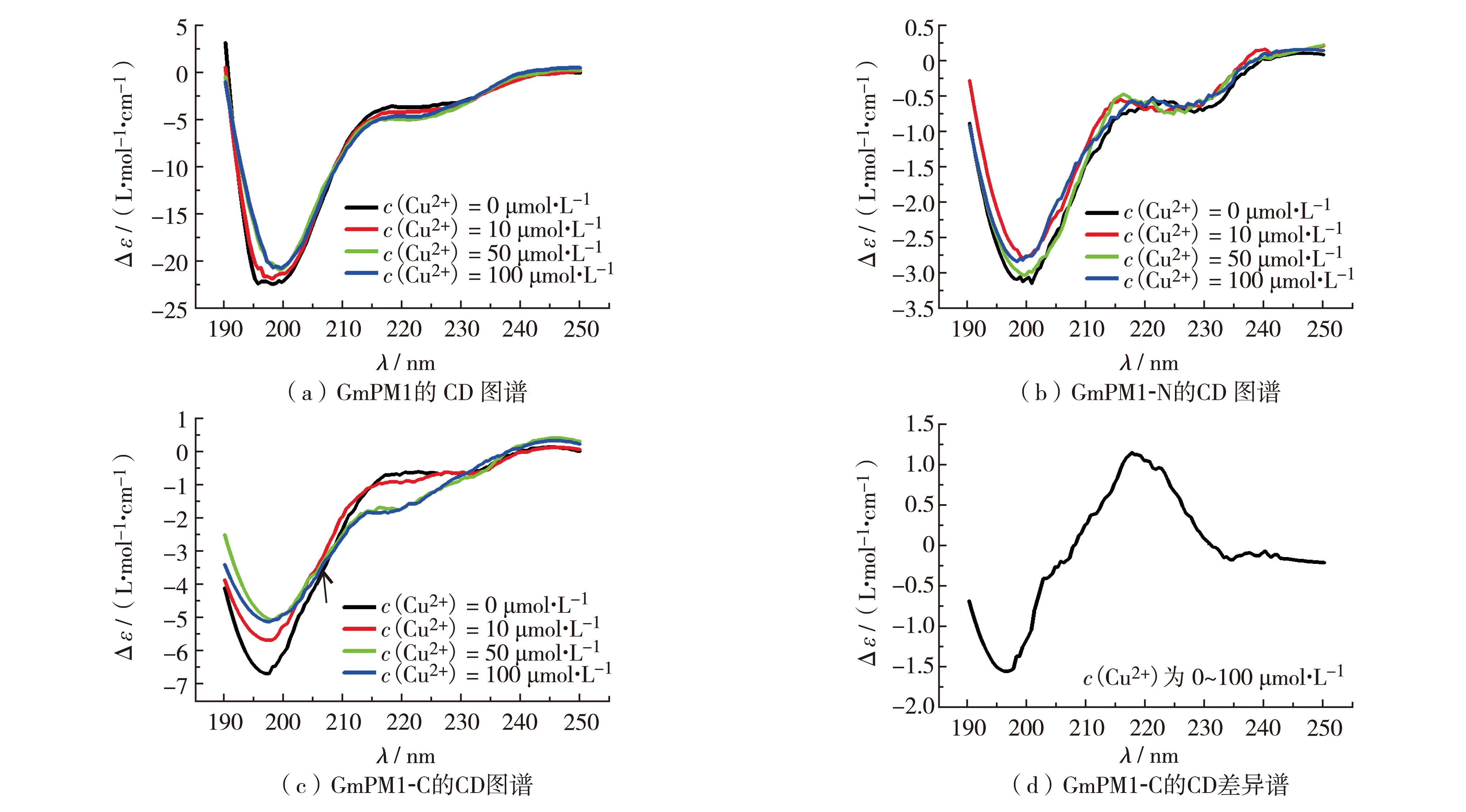
图6 GmPM1、GmPM1-N和GmPM1-C的CD图谱Fig.6 CD spectrum of GmPM1, GmPM1-N and GmPM1-C
本研究表明,在Cu2+胁迫3 h和24 h时,大豆幼苗叶中GmPM1基因表达量两次上升,意味着GmPM1基因的诱导表达可能存在快速应答和慢速应答,这与在高Cu2+胁迫下的植物叶片萎蔫反应有一定对应关系. 结合前人的有关报告[17],笔者认为Cu2+胁迫3 h时GmPM1基因表达量第1次上升应为“快速应答”,为植物对周围环境变化的应激性反应;而Cu2+胁迫24 h时GmPM1基因表达量第2次上升应为“慢速应答”,是对胁迫的耐受性,即在较长胁迫下植物体产生的适应性反应.
为准确地鉴定外源基因的功能,可利用酵母突变体及功能互补实验.ΔYAP1是酿酒酵母YAP1基因的缺失株.YAP1基因可编码碱性亮氨酸拉链类(basic leucine zipper, bZIP)转录因子,至少参与对32个氧化胁迫诱导基因的表达调控. 若YAP1基因突变,酵母突变株对氧化胁迫的敏感性将增强[18]. 本研究将GmPM1基因转化ΔYAP1酵母后, GmPM1重组酵母对Cu2+胁迫耐受性提高. 还进一步证明GmPM1蛋白清除羟基自由基能力明显高于GmPM1-C. GmPM1蛋白含10个组氨酸残基,主要分布在其C端. 可见,大豆GmPM1蛋白清除羟基自由基能力与蛋白序列中组氨酸数目及蛋白的长度相关. 笔者推测,高浓度Cu2+会造成酵母细胞的离子毒害及氧化伤害. 酵母重组子表达的GmPM1蛋白可结合细胞内过多的Cu2+,并可清除过多的羟基自由基,从而减少Cu2+胁迫造成的过氧化伤害,这可能是GmPM1蛋白保护酵母细胞的机制之一.
多聚脯氨酸II型螺旋结构,即PII结构[19]. 在水溶液中,PII结构与自由卷曲间处于动态平衡. 文献[20]研究指出,PII结构常位于蛋白质的表面,可作为固有无序蛋白分子间互作的位点. 部分LEA蛋白也存在PII结构. 如点突变使大豆Em蛋白中的PII结构含量降低时,在冻融条件下Em蛋白保护乳酸脱氢酶活性也降低[21]. 盐芥(Thellungiellasalsuginea)的TsDHN-1和TsDHN-2蛋白在磷酸化时PII结构增加;在温度升高时PII结构降低. 并推测PII结构的改变会影响蛋白与靶分子的结合[22]. 本研究结果显示,与Cu2+结合后的大豆GmPM1蛋白的C端发生二级结构改变,反映在PII结构的含量减少. 由此推测,GmPM1蛋白通过C-端与Cu2+结合后,可能会使其二级结构或三维构象发生改变,这种结构的改变也可能影响GmPM1蛋白的功能.
/
:
[1] 刘 昀,刘国宝,李冉辉,等.胚胎晚期富集蛋白与生物的干旱胁迫耐受性[J]. 生物工程学报,2010, 26(5): 569-575. Liu Yun, Liu Guobao, Li Ranhui, et al. Functions of late embryogenesis abundant proteins in desiccation-tolerance of organisms: a review[J]. Chinese Journal of Biotechnology, 2010, 26(5): 569-575.(in Chinese)
[2] Garay-Arroyo A, Colmenero-Flores J M, Garciarrubio A, et al. Highly hydrophilic proteins in prokaryotes and eukaryotes are common during conditions of water deficit[J]. The Journal of Biological Chemistry, 2000, 275(8): 5668-5674.
[3] Su Mengying, Huang Gan, Zhang Qing, et al. The LEA protein, ABR, is regulated by ABI5 and involved in dark-induced leaf senescence inArabidopsisthaliana[J]. Plant Science, 2016, 247: 93-103.
[4] Roberts J K, Desimone N a, Lingle W L, et al. Cellular concentrations and uniformity of cell-type accumulation of two lea proteins in cotton embryos[J]. The Plant Cell, 1993, 5(7): 769-780.
[5] Olvera-Carrillo Y,Campos F,Reyes J L,et al.Functional analysis of the group 4 late embryogenesis abundant proteins reveals their relevance in the adaptive response during water deficit inArabidopsis[J]. Plant Physiology, 2010, 154(1): 373-390.
[6] Cuevas-Velazquez C L, Saab-Rincón G, Reyes J L, et al. The unstructured n-terminal region of Arabidopsis group 4 late embryogenesis abundant (LEA) proteins is required for folding and for chaperone-like activity under water deficit[J]. The Journal of Biological Chemistry, 2016, 291(20): 10893-10903.
[7] Shih M D, Hsieh T Y, Lin T P, et al. Characterization of two soybean (GlycinemaxL.) LEA IV proteins by circular dichroism and Fourier transform infrared spectrometry[J]. Plant and Cell Physiology, 2010, 51(3): 395-407.
[8] Liu Guobao, Liu Ke, Gao Yang, et al. Involvement of C-Terminal histidines in soybean PM1 protein oligomerization and Cu2+binding[J]. Plant and Cell Physiology, 2017, 58(6): 1018-1029.
[9] Wang Hui, Hu Tangjin, Huang Jianzi, et al. The expression ofMillettiapinnatachalcone isomerase in Saccharomyces cerevisiae salt-sensitive mutants enhances salt-tolerance[J]. International Journal of Molecular Sciences, 2013, 14(5): 8775-8786.
[10] Hara M, Kondo M, Kato T. A KS-type dehydrin and its related domains reduce Cu-promoted radical Generation and the histidine residues contribute to the radical-reducing activities[J]. Journal of Experimental Botany, 2013, 64(6): 1615-1624.
[11] Park S H, Shalongo W, Stellwagen E. The role of PII conformations in the calculation of peptide fractional helix content[J]. Protein Science, 1997, 6(8): 1694-1700.
[12] Soulages J L, Kim K, Arrese E L, et al. Conformation of a group 2 late embryogenesis abundant protein from soybean. Evidence of poly(L-proline)-type II structure[J]. Plant Physiology, 2003, 131(3): 963-975.
[13] González-Mendoza D, Espadas Y Gil F, Escoboza-Garcia F, et al. Copper stress on photosynthesis of black mangle (Avicenniagerminans)[J]. Anais da Academia Brasileira de Ciencias, 2013, 85(2): 665-670.
[14] Chamseddine M, Wided B A, Guy H, et al. Cadmium and copper induction of oxidative stress and antioxidative response in tomato (Solanumlycopersicon) leaves[J]. Plant Growth Regulation, 2008, 57(1): 89-99.
[15] 金 枫,王 翠,林海建,等.植物重金属转运蛋白研究进展[J]. 应用生态学报, 2010, 21(7): 1875-1882. Jin Feng, Wang Cui, Lin Haijian, et al. Heavy metal-transport proteins in plants: a review[J]. Chinese Journal of Applied Ecology, 2010, 21(7): 1875-1882.(in Chinese)
[16] Mu Peiqiang, Feng Dongru, Su Jianbin, et al. Cu2+triggers reversible aggregation of a disordered His-rich dehydrin MpDhn12 fromMusaparadisiacal[J]. Journal of Biochemistry, 2011, 150(5): 491-499.
[17] Finkelstein R. Abscisic acid synthesis and response[J]. The Arabidopsis Book, 2013, 11(11): e0058.
[18] Mowla S B, Cuypers A, Driscoll S P, et al. Yeast complementation reveals a role for anArabidopsisthalianalate embryogenesis abundant(LEA)-like protein in oxidative stress tolerance[J]. Plant Journal, 2006, 48(5): 743-756.
[19] Tiffany M L, Krimm S. New chain conformations of poly(glutamic acid) and polylysine[J]. Biopolymers, 1968, 6(9): 1379-1382.
[20] Rath A, Davidson A R, Deber C M. The structure of “unstructured” regions in peptides and proteins: role of the polyproline II helix in protein folding and recognition[J]. Biopolymers, 2005, 80(2-3): 179-185.
[21] Zou Yongdong, Hong Ruisha, He Shuwen, et al. Polyproline II structure is critical for the enzyme protective function of soybean Em (LEA1) conserved domains[J]. Biotechnology Letters, 2011, 33(8): 1667-1673.
[22] Rahman L N, Smith G S, Bamm V V, et al. Phosphorylation ofThellungiellasalsugineadehydrins TsDHN-1 and TsDHN-2 facilitates cation-induced conformational changes and actin assembly[J]. Biochemistry, 2011, 50(44): 9587-9604.
【中文责编:晨兮;英文责编:艾琳】
CharacteristicsofantioxidantactivityofsoybeanPM1proteinandenhancementoftoleranceofrecombinantyeasttocopperstress
LiChengna,GaoYang,LiuZiming,LiuGuobao,andZhengYizhi
CollegeofLifeSciencesandOceanography,ShenzhenUniversity,ShenzhenKeyLaboratoryofMicrobiologyandGeneEngineering,Shenzhen518060,GuangdongProvince,P.R.China
Cu2+is an essential micronutrient for plant growth, but it is toxic when plant growth under excess copper stress. Soybean GmPM1protein belongs to late embryogenesis abundant (LEA) group4(LEA4) proteins, which has a high proportion of histidine residues in the protein sequence. Firstly, we investigate the protective function and mechanisms of GmPM1protein in plant under Cu2+stress. The leaves of soybean seedling are withered under150μmol/L CuSO4stress, and at the meantime the expression ofGmPM1gene in the young leaves was up-regulated in3h and24h of the stress. Secondly, the yeast expression plasmid of pYES2-GmPM1is constructed and then transformed into the copper-sensitive yeast mutantΔYAP1to create recombinants ofΔYAP1-GmPM1. The recombinant yeast expressing GmPM1protein could enhance the tolerance to Cu2+stress. Then, the activities of scavenging hydroxyl radicals of GmPM1and GmPM1-C protein in vitro are determined by using Cu-ascorbic acid system, which is rich in histidine residual in their sequence. The results show that GmPM1could chelate Cu2+through histidine residual in the C-terminal of GmPM1protein and exert the activity of scavenge hydroxyl radicals, thus could improve the tolerance of plants to Cu2+stress.
soybean; GmPM1protein; histidine; Cu2+stress; scavenging hydroxyl radicals; recombinant yeast
2017-05-24;Accepted:2017-06-05
Professor Zheng Yizhi. E-mail:yzzheng@szu.edu.cn
Q 943.2;Q 71
:Adoi:10.3724/SP.J.1249.2017.05457
Foundation:National Natural Science Foundation of China(31370289)
:Li Chengna, Gao Yang, Liu Ziming, et al. Characteristics of antioxidant activity of soybean PM1 protein and enhancement of tolerance of recombinant yeast to copper stress[J]. Journal of Shenzhen University Science and Engineering, 2017, 34(5): 457-463.(in Chinese)
国家自然科学基金资助项目(31370289)
李承娜(1991—),女,深圳大学硕士研究生. 研究方向:植物抗逆分子生物学.E-mail: 1324471270@qq.com
引文:李承娜,高 阳,刘子明,大豆PM1蛋白抗氧化作用及提高酵母对铜耐受力[J]. 深圳大学学报理工版,2017,34(5):457-463.
