循环单核细胞亚群联合左心室射血分数对急性ST段抬高型心肌梗死患者预后危险分层的评估
2017-09-22汪小君周颖马永强罗燕薇焉力方姬文婕刘新林刘军翔周欣李玉明
汪小君,周颖,马永强,罗燕薇,焉力方,姬文婕,刘新林,刘军翔,周欣,李玉明
冠心病研究
循环单核细胞亚群联合左心室射血分数对急性ST段抬高型心肌梗死患者预后危险分层的评估
汪小君,周颖*,马永强,罗燕薇,焉力方,姬文婕,刘新林,刘军翔,周欣,李玉明
目的:探讨循环单核细胞亚群联合左心室射血分数(LVEF)对急性ST段抬高型心肌梗死(STEMI)患者预后危险分层的评估价值。
方法:入选发病后24小时内就诊于武警后勤学院附属医院心脏中心并接受经皮冠状动脉介入(PCI)治疗的STEMI患者,采用流式细胞术检测外周血单核细胞3个亚群:经典型单核细胞(CD14++CD16-)、中间型单核细胞(CD14++CD16+)和非经典型单核细胞(CD14+CD16++)。随访患者3年内主要不良心血管事件(MACE)的发生情况;采用COX比例风险模型分析单核细胞亚群及LVEF与MACE的关系;采用受试者工作特征(ROC)曲线结合多元Logistic回归分析建立相关MACE预测模型。
结果:3年的随访中221例患者共50例发生MACE。与非MACE患者相比,MACE患者年龄更大[(63.82±11.88)岁 vs (58.84±11.40)岁,P=0.009]、糖尿病病史更多(28.0% vs18.7%,P<0.001)、LDL-C(2.77 mmol/L vs 2.41 mmol/L,P=0.003)、CD14++CD16+单核细胞值(47.17 cells/μl vs 21.47 cells/μl,P<0.001)更高;LVEF值(52% vs 46%,P<0.001)更低。多变量COX回归分析显示,CD14++CD16+(HR=2.211,95%CI:1.211~3.635,P=0.016)、LVEF(HR=2.014,95%CI:1.038~2.933,P=0.022)是STEMI患者发生MACE的独立危险因素。多元Logistic回归分析联合ROC曲线结果显示,CD14++CD16+单核细胞联合LVEF对MACE的预测价值(AUC=0.744,95%CI: 0.664~0.823,P<0.001)高于单指标CD14++CD16+单核细胞(AUC=0.683,95%CI: 0.598~0.768,P<0.001)及LVEF(AUC=0.640,95%CI :0.552~0.729,P=0.003)。
结论:循环CD14++CD16+单核细胞联合LVEF能够预测STEMI患者3年内MACE的发生,具有潜在临床应用价值。
心肌梗死;单细胞分析;每搏输出量;预后
(Chinese Circulation Journal, 2017,32:854.)
近10年来,我国急性ST段抬高型心肌梗死(STEMI)的住院人数增长了2倍,接受急诊经皮冠状动脉介入治疗(PCI)的STEMI患者比例从10.2%上升至27.6%,但STEMI患者院内及远期预后仍未得到明显改善[1],根据预后情况早期进行危险分层具有重要的意义。左心室射血分数(LVEF)是评价心脏收缩功能的主要指标,能够反应心肌梗死患者病情的严重程度,是影响心肌梗死预后的主要指标[2-4]。近年研究显示,CD14++CD16+单核细胞在心肌梗死的损伤修复以及动脉粥样硬化斑块进展中发挥了重要作用,是心肌梗死患者主要不良心血管事件(MACE)的独立危险因素[5-7]。本研究旨在评估循环单核细胞亚群联合LVEF检测对STEMI患者长期预后危险分层的评估。
1 资料与方法
研究对象:分别入选2012-11至2013-05,2015-01至2015-11发病后24h内就诊于武警后勤学院附属医院心脏中心并行单核细胞流式分析的STEMI患者221例。
诊断和排除标准:诊断标准参照欧洲心脏病学会(ESC)2012年STEMI诊断及治疗指南[8]。排除标准:①STEMI发病时间>24h;②入院前有感染或炎症性疾病史并接受相关治疗;③有恶性肿瘤病史;④近6个月有失代偿性心力衰竭病史;⑤入院前接受激素替代治疗;⑥不适合行急诊PCI;⑦既往冠状动脉多支血管病变及冠状动脉旁路移植术病史;⑧不同意参与研究的患者。
采集信息内容:一般情况:性别、年龄、体重指数(BMI)。病史采集:高血压、糖尿病、脑卒中、恶性肿瘤、陈旧性心肌梗死、吸烟史、饮酒史、特殊用药史等。入院时指标:入心脏导管室前抽取静脉血,测定血常规、心肌酶、血肌酐等,并依据单核细胞的标志性分子CD86、CD14、CD16对单核细胞亚群进行流式细胞术(FCM)分析。急诊室内行床旁彩色多普勒心脏超声(Philips,NED)检测左心房前后径、左心室舒张末内径、LVEF等指标。次日晨起空腹抽取静脉血,检测单核细胞流式、肝肾功能、血脂四项、血糖、糖化血红蛋白、甲状腺功能等指标。本实验室前期研究成果显示CD14++CD16+单核细胞第2天达峰值,因此本文所指的CD14++CD16+单核细胞均为第2天所测得的CD14++CD16+单核细胞,具体流式设门及分析方法参考本实验室前期成果[9,10]。所有患者PCI术前给予阿司匹林300 mg、氯吡格雷300 mg或替格瑞诺180 mg负荷剂量,术后予以维持剂量。患者对本研究均知情同意。
随访内容:通过门诊及再住院对出院后的患者随访3年,其余患者进行电话随访,以发生MACE为观察终点,记录发生MACE的时间。MACE包括:心原性死亡、非出血性卒中、再发心肌梗死、心力衰竭、随访期间需再次行PCI治疗。所有的死因均为心原性死亡,非心原性死亡予以排除。
统计方法:应用STATA14.1(StataCorp,College Station,TX,USA )软件进行统计学分析。计量资料符合正态分布的用均数±标准差表示,不符合正态分布用中位数和四分位数(P25,P75)表示,计数资料用百分比表示。对符合正态分布的计量资料用两独立样本的t检验,计数资料进行χ2检验,非正态分布的计量资料组间比较采用Mann-Whitney U检验。利用COX回归分析影响STEMI患者MACE发生的危险因素。利用受试者工作特征(ROC)曲线结合多元Logistic回归分析建立MACE预测模型,并计算各指标的最佳截断值(约登指数=敏感性+特异性-1),用曲线下面积(AUC)及Hosmer-Lemeshow检验来检测模型的判别及校准能力。以CD14++CD16+预测STEMI发生MACE的最佳截断值32.1cell/μl,LVEF预测MACE的最佳截断值47%对STEMI患者进行分层,用Kaplan-Meier生存分析各变量累计生存率并绘制生存曲线。P<0.05为差异有统计学意义。
2 结果
2012-11至2013-05入选STEMI患者100例,2015-01至2015-11入选STEMI患者121例,共计221例患者,其中男177例(80.09%),女44例(19.91%),平均年龄(60.04±11.66)岁。3年的随访中共50例患者发生MACE,其中心原性死亡12例、非出血性卒中4例、再发心肌梗死4例、心力衰竭15例、需再次行PCI治疗15例。
MACE患者与非MACE患者基线特征比较(表1):与非MACE患者相比,MACE患者年龄更大,既往糖尿病史更多,LDL-C及 CD14++CD16+值更高;LVEF更低。吸烟史、高血压、体重指数、总单核细胞计数、血肌酐、尿素氮、左心房前后径、左心室舒张末径及其他药物治疗差异无统计学意义。
单因素分析(表2):使用COX模型对影响STEMI预后的各项因素逐个进行单因素分析,结果显示对MACE发生有显著性影响的因素为:年龄、LVEF和CD14++CD16+单核细胞。
多因素分析(表2):将年龄、LVEF、CD14++CD16+引入COX回归方程进行多因素分析,并对上述参数进一步用性别、体重指数、吸烟史、高血压史、糖尿病史、CRP等传统心血管疾病危险因素进行校正,结果显示:CD14++CD16+(HR=2.211,95%CI:1.211~3.635,P=0.016)、LVEF(HR=2.014,95%CI:1.038~2.933,P=0.022)是发生MACE的独立危险因素。
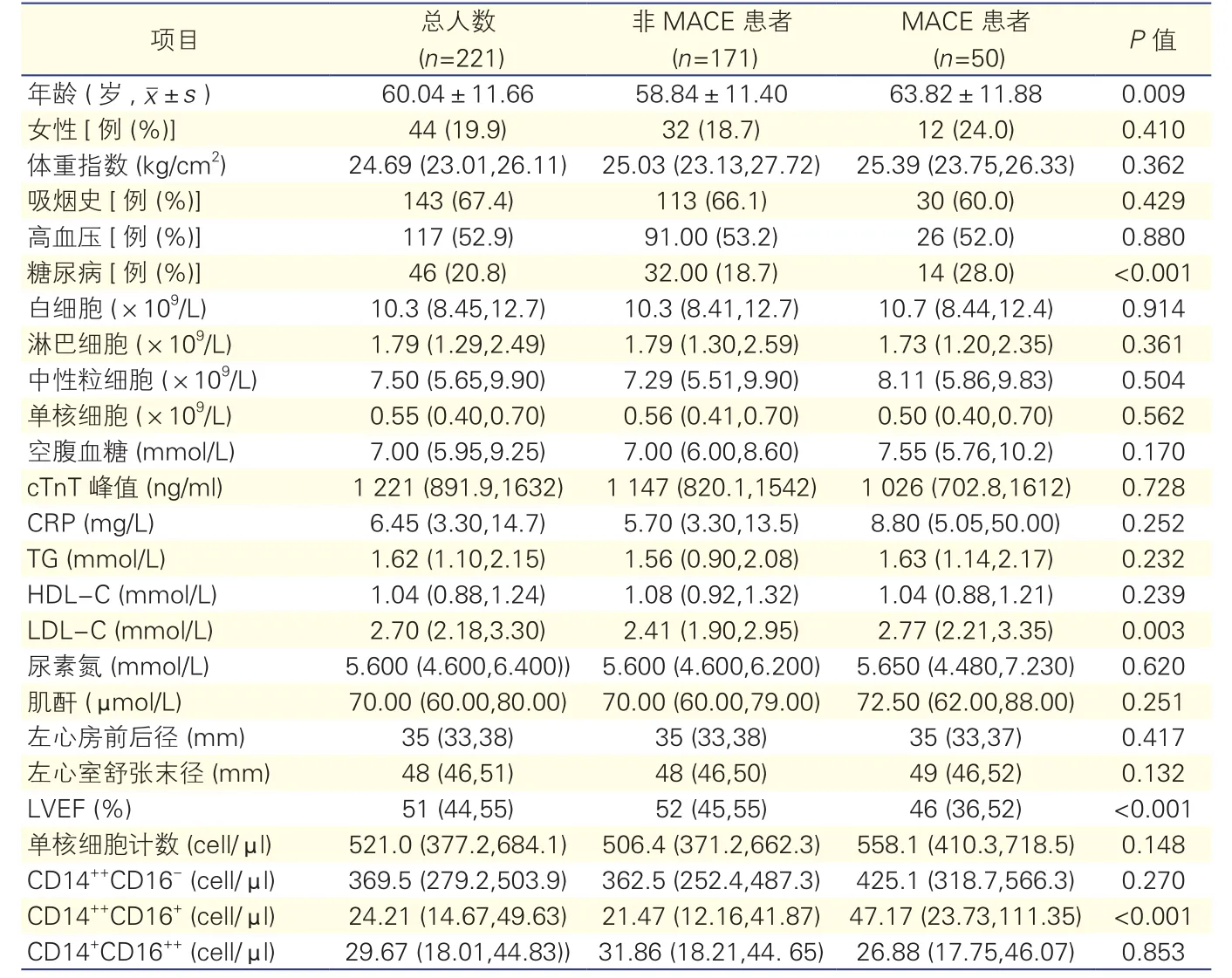
表1 MACE患者与非MACE患者基线特征比较[M(P25, P75)]
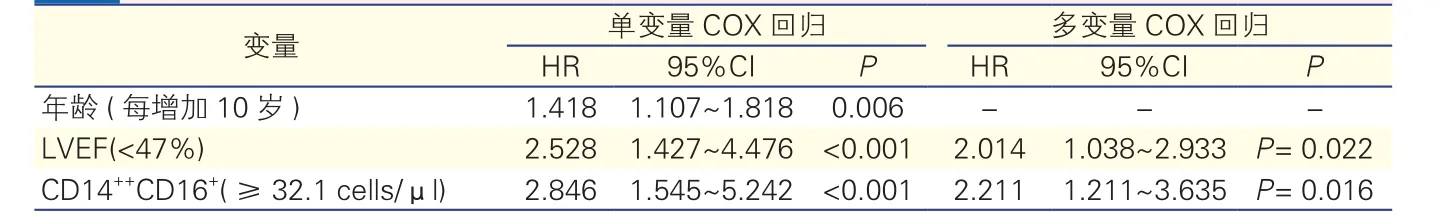
表2 单变量以及经危险因素校正的多变量COX回归分析
生存分析:Kaplan-Meier生存分析显示,CD14++CD16+<32.1cells/μl(n=90)患者发生MACE16例,发生率为17.18%;CD14++CD16+≥32.1 cells/μl(n=131)患者发生MACE34例,发生率为25.96%,两者差异具有统计学意义(P<0.001)。LVEF<47%(n=80)患者发生MACE19例,发生率为23.75%;LVEF≥47%(n=141)患者发生MACE 31例,发生率为21.99%,差异具有统计学意义(P< 0.001)。(图1)
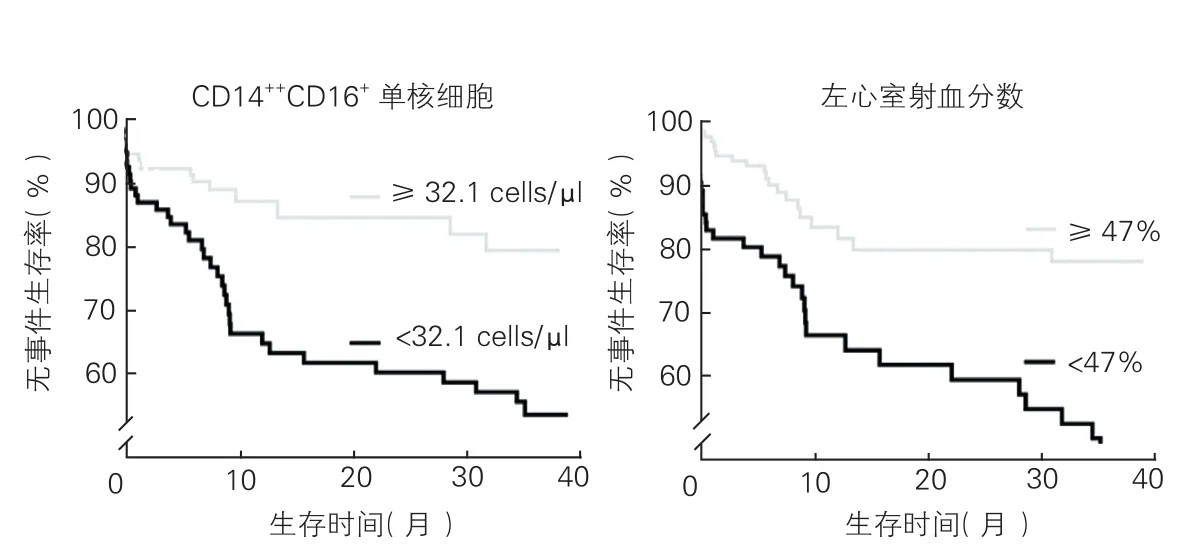
图1 CD14++CD16+单核细胞以及左心室射血分数Kaplan-Meier生存分析
多变量Logistic回归分析及ROC曲线:通过多变量Logistic回归分析建立基于CD14++CD16+单核细胞及LVEF联合预测模型:Logit(y)=-1.035-(1.559×Mon2)+(1.151×LVEF)(表3)。通过ROC曲线评估其预测价值,结果显示CD14++CD16+联合LVEF模型对MACE的预测价值(AUC=0.744,95%CI:0.664~0.823,P<0.001)高于单指标CD14++CD16+单核细胞(AUC=0.683,95%CI:0.598~0.768,P<0.001)及LVEF(AUC=0.640,95%CI: 0.552~0.729,P=0.003),差异具有统计学意义(图2)。
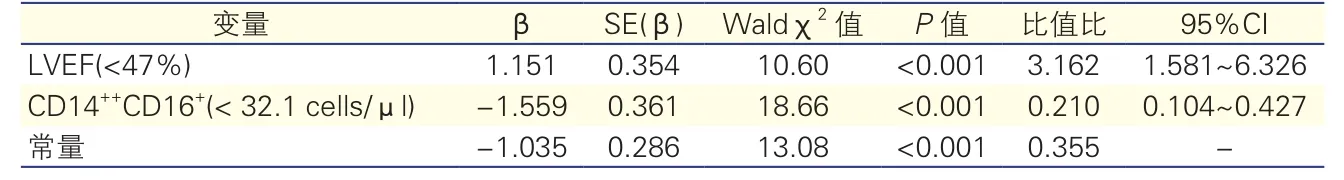
表3 Logistic回归模型及各变量参数估计值与比值比
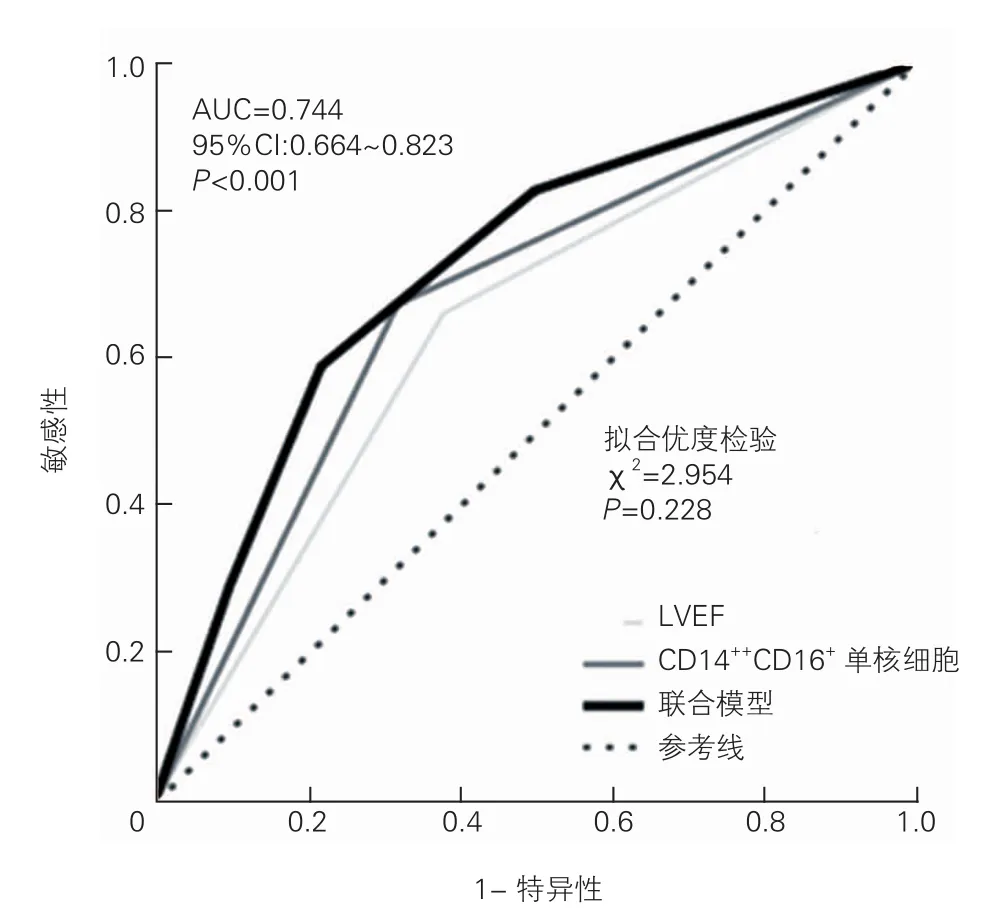
图2 基于CD14++CD16+单核细胞以及LVEF的联合预测模型ROC曲线分析
3 讨论
本研究通过分析STEMI患者循环单核细胞亚群、既往史、LVEF、LDL-C等临床指标与随访3年MACE的关系,结果显示CD14++CD16+单核细胞及LVEF是STEMI患者MACE的独立预测因子。
LVEF是反应血流动力学的一项重要指标,其与STEMI患者预后不良密切相关,LVEF越低,STEMI患者预后越差,经治疗后LVEF升高明显者较LVEF无明显改善者预后好。Antonelli等[11]对1 474例STEMI患者前瞻性研究发现,与LVEF≥50%患者相比,LVEF<50%的STEMI患者院内死亡风险增高2.91倍。HORIZONS-AMI 研究共纳入了3 602例接受急诊PCI治疗的STEMI患者,结果发现LVEF<40%是STEMI患者30天及1年MACE的独立预测因子[2]。本研究结果与以上研究一致,提示LVEF是STEMI预后的独立危险因素。LVEF主要反映有功能心肌细胞的数量和收缩能力,LEVF越低,表明有功能的心肌细胞越少,心室重构越严重,心脏收缩功能越差,因此预后不良。同时研究还发现LVEF低的STEMI患者出血并发症明显升高,可能是其不良预后增多的另一个原因。
单核细胞以及单核细胞源性巨噬细胞是机体固有免疫系统的中心环节,参与宿主防御、免疫调节、组织修复与再生等病理生理过程[12]。根据单核细胞表面脂多糖(LPS)受体(CD14)和IgG Fc片段受体γⅢ(F cγⅢ)(CD16)的表达水平,将单核细胞分为3个亚群:经典型单核细胞(CD14++CD16-)、中间型单核细胞(CD14++CD16+)和非经典型单核细胞(CD14+CD16++)[13]。不同的单核细胞亚群在不同的疾病中发挥不同的作用。目前越来越多的研究显示单核细胞与心血管疾病尤其是心肌梗死的发生、发展及预后密切相关[5,6,10,14-17]。聚集于动脉内膜上的单核细胞源性巨噬细胞能够摄取氧化型脂蛋白,并分泌多种炎症介质,最终形成泡沫细胞,而泡沫细胞是构成易损斑块的主要成分,易损斑块的破裂可导心肌梗死[18]。此外,近年来研究发现心肌梗死后单核细胞活化、心肌炎症反应增强,这种由单核细胞介导的炎症反应与心肌梗死后心室重构及心力衰竭密切相关。Tapp等[17]研究结果显示CD14++CD16+单核细胞亚群及单核细胞血小板聚合体可以作为STEMI患者一项预后指标。Rogacev等[6]研究发现在接受透析治疗的终末期慢性肾脏病患者中,CD14++CD16+单核细胞计数而非总单核细胞计数能够预测不良心血管结局。本研究结果与以上研究相一致,发现CD14++CD16+单核细胞与STEMI患者3年MACE密切相关,即使在校正年龄、吸烟、高血压史、糖尿病史、C-反应蛋白(CRP)等混杂因素后,CD14++CD16+单核细胞仍然能够独立预测STEMI患者远期主要不良心血管事件。尽管有研究报道慢性炎症指标CRP能够预测心肌梗死患者MACE发生[19],但本研究并未得出这一结果,可能与入选人群、样本量、MACE定义、随访时间不同等因素有关。目前关于单核细胞亚群影响患者预后的具体机制尚不明确。STEMI后心室重塑过程始于急性缺血期触发的炎症反应,心肌梗死后大量的AngⅡ释放入血,后者通过与AT1受体结合动员脾脏中储存的单核细胞向梗死灶转移,梗死灶及其周围的单核细胞能够促进肿瘤坏死因子(TNF)、白细胞介素-6(IL-6)等炎症细胞因子释放,从而参与心室重塑、心肌细胞凋亡、心功能减退、内皮细胞功能受损等病理生理过程[20]。因此,推测MACE组患者CD14++CD16+单核细胞的过度动员对心肌修复造成了较大影响,可能为其MACE增多的主要原因。
本研究采用单变量分析时还发现年龄是STEMI患者的MACE的危险因素,但进一步通过Cox多元回归分析未发现其是STEMI患者预后的独立危险因素,原因可能为传统的心血管危险因素如高血压史、糖尿病史等受年龄影响较大。由于本研究为单中心、小样本研究,尚需要更大样本量、多中心试验进一步证实,此外CD14++CD16+单核细胞及LVEF与院内MACE关联性的亚组分析还需进一步探索。
本研究显示,CD14++CD16+联合LVEF预测STEMI患者发生MACE的ROC曲线下面积(0.744)高于单指标CD14++CD16+单核细胞(0.683)及LVEF(0.640),因此将循环炎症指标CD14++CD16+单核细胞和血流动力学指标LVEF这两个影响STEMI患者预后的独立预测因子结合起来将有可能更好的评估患者的危险程度,对于高危患者早期给予充分的药物治疗、积极的血运重建,以改善患者远期预后。
[1] Li J, Li X, Wang Q, et al. ST-segment elevation myocardial infarction in China from 2001 to 2011 (the China PEACE-Retrospective Acute Myocardial Infarction Study): aretrospective analysis of hospital data. Lancet, 2015, 385: 441-451.
[2] Ng VG, Lansky AJ, Meller S, et al. The prognostic importance of left ventricular function in patients with ST-segment elevation myocardial infarction: the HORIZONS-AMI trial. Eur Heart J Acute Cardiovasc Care, 2014, 3: 67-77.
[3] Chen ZW, Yu ZQ, Yang HB, et al. Rapid predictors for the occurrence of reduced left ventricular ejection fraction between LAD and non-LAD related ST-elevation myocardial infarction. BMC Cardiovasc Disord, 2016, 16: 3.
[4] 邵春来, 洪小苏, 陈建昌, 等. 血浆脑钠肽联合左心室射血分数对心力衰竭患者预后的评估价值. 中国循环杂志, 2006, 21: 356-360.
[5] Berg KE, Ljungcrantz I, Andersson L, et al. Elevated CD14++CD16-monocytes predictcardiovascular events. Circ Cardiovasc Genet, 2012, 5: 122-131.
[6] Rogacev KS, Cremers B, Zawada AM, et al. CD14++CD16+monocytes independently predict cardiovascular events: a cohort study of 951 patients referred for elective coronary angiography. J Am Coll Cardiol, 2012, 60: 1512-1520.
[7] Swirski FK, Nahrendorf M, Etzrodt M, et al. Identification of splenic reservoir monocytes and their deployment to inflammatory sites. Science, 2009, 325: 612-616.
[8] Steg PG, James SK, Atar D, et al. ESC Guidelines for the management of acute myocardial infarction in patients presenting with ST-segment elevation. Eur Heart J, 2012, 33: 2569-2619.
[9] 杨国红, 卢芮伊, 孙海英, 等. 四色流式分析冠心病患者外周血单核细胞亚群及单核细胞-血小板聚集体的变化. 临床心血管病杂志, 2013, 29, 29-33.
[10] Zhou X, Liu XL, Ji WJ, et al. The kinetics of circulating monocyte subsets and monocyte-platelet aggregates in the acute phase of st-elevation myocardial infarction: associations with 2-year cardiovascular events. Medicine (baltimore), 2016, 95: e3466.
[11] Antonelli L, Katz M, Bacal F, et al. Heart failure with preserved left ventricular ejection fraction in patients with acute myocardial infarction. Arq Bras Cardiol, 2015, 105: 145-150.
[12] Rogacev KS, Zawada AM, Hundsdorfer J, et al. Immunosuppression and monocyte subsets. Nephrol Dial Tansplant, 2015, 30: 143-153.
[13] Ziegler-Heitbrock L, Ancuta P, Crowe S, et al. Nomenclature of monocytes and dendritic cells in blood. Blood, 2010, 116: e74-80.
[14] Arslan U, Kocaoglu I, Balci MM, et al. Monocyte heterogeneity in myocardial infarction with and without ST elevation and its association with angiographic findings. Coron Artery Dis, 2013, 24: 404-411.
[15] Heine GH, Ortiz A, Massy ZA, et al. Cardiovascular Medicine working group of the European Renal Association-European D and Transplant A. Monocyte subpopulations and cardiovascular risk in chronic kidney disease. Nat Rev Nephrol, 2012, 8: 362-329.
[16] Hristov M and Heine GH. Monocyte subsets in atherosclerosis. Hamostaseologie, 2015, 35: 105-112.
[17] Tapp LD, Shantsila E, Wrigley BJ, et al. The CD14++CD16+monocyte subset and monocyte-platelet interactions in patients with ST-elevation myocardial infarction. J Thromb Haemost, 2012, 10: 1231-1241.
[18] Ziegler-Heitbrock L. The CD14+CD16+blood monocytes: their role in infection and inflammation. J Leukoc Biol, 2007, 81: 584-592.
[19] 刘蓉, 杨跃进, 乔树宾, 等. 高敏C反应蛋白对急性ST段抬高型心肌梗死患者近期预后的预测价值. 中国循环杂志, 2011, 26: 19-22.
[20] Tsujioka H, Imanishi T, Ikejima H, et al. Impact of heterogeneity of human peripheral blood monocyte subsets on myocardial salvage in patients with primary acute myocardial infarction. J Am Coll Cardiol, 2009, 54: 130-138.
Prognostic Value for the Risk Stratification of Circulating Monocyte Subsets Combining Left Ventricular Ejection Fraction in Patients With Acute ST-segment Elevation Myocardial Infarction
WANG Xiao-jun, ZHOU Ying, MA Yong-qiang, LUO Yan-wei, YAN Li-fang, JI Wen-jie, LIU Xin-lin, LIU Jun-xiang, ZHOU Xin, LI Yu-ming.
Graduate School of Tianjin Medical University, Tianjin (300070), China
Objective: To explore the prognostic value for circulating monocyte subsets combining left ventricular ejection fraction (LVEF) in patients with acute ST-segment elevation myocardial infarction (STEMI).
Methods: STEMI patients admitted within 24 h of onset received PCI in Pingjin hospital heart center were enrolled. Flow cytometry (FCM) was used to examine 3 subsets of monocyte in peripheral blood as classical CD14++CD16–monocyte, intermediate CD14++CD16+monocyte and non-classical CD14+CD16++monocyte. The patients were followedup in 3 years for major adverse cardiac events (MACE) occurrence. The relationship between monocyte subsets, LVEF and MACE occurrence was studied by COX model analysis and MACE prediction model was established by ROC combining multivariate Logistic regression analysis.
Results: There were 50/221 patients suffered from MACE during 3-year follow-up period. Compared with Non-MACE patients, MACE patients had the elder age (63.82±11.88) years vs (58.84±11.40) years, P=0.009; more diabetes mellitus (28.0% vs 18.7%), P<0.001; higher blood levels of LDL-C (2.77 mmol/L) vs (2.41 mmol/L), P=0.003 and CD14++CD16+monocyte (47.17 cells/μl) vs (21.47 cells/μl), P<0.001; lower LVEF (52% vs 46%), P<0.001. Multivariate Cox analysis indicated that CD14++CD16+(HR=2.211, 95% CI 1.211-3.635, P=0.016) and LVEF (HR=2.014, 95% CI 1.038-2.933, P=0.022) were the independent risk factors for MACE occurrence in STEMI patients. ROC combining multivariate Logistic regression analysis presented that MACE predictive value of CD14++CD16+monocyte combining LVEF (AUC=0.744, 95% CI 0.664-0.823, P<0.001) was higher than the single value of CD14++CD16+monocyte (AUC=0.683, 95% CI 0.598-0.768, P<0.001) and LVEF(AUC=0.640, 95% CI 0.552-0.7291, P=0.003) respectively.
Conclusion: Circulating level of CD14++CD16+monocyte combining LVEF may predict MACE occurrence within 3 years in STEMI patients; it had potential value in clinical practice.
Myocardial infarction; Single-cell analysis;Stroke volume prognosis; Prognosis
LI Yu-ming, Email: cardiolab@live.com
2016-12-19)
(编辑:汪碧蓉)
国家自然科学基金(81570335);天津市心血管重塑与靶器官损伤重点实验室开放基金(TJC1404, TJC1408)
300701 天津市,天津医科大学研究生院(汪小君、周颖);天津市心血管重塑与靶器官损伤重点实验室 武警后勤学院附属医院心脏中心 心血管病研究所(马永强、罗燕薇、焉力方、刘新林、刘军翔、周欣、李玉明),呼吸与重症医学科(姬文婕)
汪小君 硕士研究生 主要从事冠心病的基础与临床研究 Email: 13516249339@163.com 通讯作者:李玉明 Email:cardiolab@live.com周欣 Email:xzhou@live.com*为共同第一作者
R541
A
1000-3614(2017)09-0854-05
10.3969/j.issn.1000-3614.2017.09.006
