干旱对2种沙棘生长和生理特性的影响
2017-09-21李裕冬
李裕冬,陈 娟,罗 艳
(1.四川省自然资源科学研究院,四川 成都 610015; 2.绵阳师范学院,四川 绵阳 621000; 3.四川省生物资源保护与可持续利用实验室,四川 成都 610015)
干旱对2种沙棘生长和生理特性的影响
李裕冬1,3,陈 娟2,罗 艳1
(1.四川省自然资源科学研究院,四川 成都 610015; 2.绵阳师范学院,四川 绵阳 621000; 3.四川省生物资源保护与可持续利用实验室,四川 成都 610015)
以采自四川省红原县的中国沙棘、西藏沙棘幼苗为试材,采用盆栽试验法,对不同土壤水分(对照,即100%田间持水量;中度干旱,即50%田间持水量;极度干旱,即30%田间持水量)条件下中国沙棘和西藏沙棘幼苗生长速率、根超微结构以及不同器官中的碳水化合物含量进行测定。结果表明:在不同水分处理下,中国沙棘生长速率明显高于西藏沙棘;但与对照相比,水分胁迫对中国沙棘的抑制效应更显著。与对照相比,水分胁迫均显著影响了2种沙棘幼苗不同器官中的碳水化合物的积累和分配。极度干旱胁迫下,中国沙棘有更多的根部淀粉、根可溶性总糖、根蔗糖和根果糖含量,表现出较强的根渗透调节能力;而水分胁迫对西藏沙棘地上茎和叶碳水化合物的影响比地下部分更显著。中度水分胁迫时,2种沙棘的根系超微结构未有明显变化;而极度水分胁迫时,2种沙棘均显示根细胞超微结构的损伤。表明中度水分胁迫下,中国沙棘和西藏沙棘表现出较好的适应能力,而极度水分胁迫不同程度地影响了2种沙棘幼苗的生长和碳代谢能力。
沙棘;碳水化合物;超微结构;干旱胁迫
沙棘(HippophaerhamnoidesLinn.)为胡颓子科(Elaeagnaceae)沙棘属(Hippophae)灌木或小乔木,用途广泛。沙棘果实和种子含有丰富的维生素、胡萝卜素、植物甾醇和不饱和脂肪酸,具有很高的药用和食用价值[1]。沙棘根部的根瘤菌可固氮[2],常用于土壤修复和造景。沙棘的抗旱、抗寒、抗盐碱等特性使其成为防风固沙、改良土壤的先锋树种,在调节土壤微气候和保持生态系统稳定方面具有较好的作用[3-5]。目前,中国是世界上沙棘资源最为丰富的国家。中国沙棘(H.rhamnoides)是我国特有的、分布最广的一个亚种,主要分布于山坡、草甸、谷地、河岸或干涸河床,在青藏高原东缘至黄土高原极为普遍。西藏沙棘(H.thibetana)是青藏高原上分布最广的种类,也是整个沙棘属最基部类群,是分化最早的一个种。作为特生种,其生长和形态特征与其他种有明显差异[6]。
干旱是影响植物生产力的最重要因子之一,全球气候变化使干旱更严重地限制植物的生长[7-8]。前人研究指出干旱影响了中国沙棘的光合速率和水分利用效率[4,9-10],但现有的研究多关注于植物地上部分,对地下根的超微结构和不同器官中碳水化合物变化特征研究不多。并且,现阶段西藏沙棘的干旱适应性研究也较少。为此,本文研究不同土壤水分条件下中国沙棘和西藏沙棘的生长速率、根超微结构和碳水化合物变化特征及适应机制,旨在为干旱和半干旱地区利用中国沙棘和西藏沙棘进行土壤修复和人工林营造提供参考。
1 研究方法
1.1植物材料和试验设计
采用完全随机处理设计。水分处理包括3个梯度:良好的水分条件(对照处理,CK),即100%田间持水量;中度干旱(处理1),即50% 田间持水量;极度干旱(处理2),即30%田间持水量。2个亚种:中国沙棘、西藏沙棘。每种处理20次重复。
植物材料均采自四川省红原县。2014年5月18日,选取120株基径(约为6 mm)、高度(约为20 cm) 基本一致的2年生幼苗栽入已装有均匀土壤的10 L花盆中。将所有植物放入钢架防雨大棚中正常培养42 d后,进行不同水分处理84 d。
1.2生长速率测定
在试验结束时,随机抽取5株幼苗测定高度和基径。株高生长速率=株高增长量(cm)/水分处理时间(d);基径生长速率=基径增长量(mm)/水分处理时间(d)。
1.3碳水化合物测定
取烘干过筛后的0.2 g叶、茎和根细粉,用80%(w/v)的乙醇提取30 min,然后5000 r·min-1离心10 min,残余物继续用9.2 mol·L-1的HClO4水解30 min,在5000 r·min-1离心15 min,提取液用于淀粉和可溶性总糖的测定。淀粉含量测定用0.2%硫酸-蒽酮试剂作为反应液,加好试液后的试管置沸水浴15 min后,放冷,然后在625 nm处测定[11],以葡萄糖作为标准品。乙醇提取液同时用于蔗糖测定和果糖的测定[12]。
1.4超微结构观察(Transmission electron microscopy,TEM)
每个处理随机挑选3株植株,取每个植株根尖部位,将其用磷酸缓冲液冲洗干净,在2.5%戊二醛(用pH 7.2的磷酸缓冲液配制)中于22 ℃下至少固定2 h以上,再在相同温度下用锇酸(OsO4)固定2 h,之后分别在30%、50%、70%、90%丙酮中脱水处理,然后浸泡于环氧树脂812型中2 h,并使其聚合8 h,最后制备超薄切片并利用透射电镜H-600IV TEM (Hitachi,Tokyo,Japan)观察拍片。
1.5统计分析
使用SPSS 16.0 for Windows统计软件(SPSS Inc.,Chicago,IL,USA)对所测数据进行统计分析。将不同水分处理组的植株生长、生理和生化指标进行一元方差分析(ANOVA),平均数间的多重比较采用Tukey检验(P<0.05),两因子方差分析(Two-way ANOVAs)用于评价亚种间、干旱和二者交互效应。
2 结果与分析
2.1干旱对沙棘生长速率的影响
由图1可知,中国沙棘与西藏沙棘亚种间基径和株高生长差异明显,且不同水分处理显著影响了两者的生长速率(表1)。西藏沙棘生长较慢,在中度水分胁迫下,其生长速率并无明显变化,极度水分胁迫下,其基径生长速率下降显著,但株高的生长速率变化不明显。相同水分处理下,中国沙棘的株高和基径生长速率均显著高于西藏沙棘。但与未进行水分胁迫的对照植株相比,2种干旱处理均显著抑制了中国沙棘的基径和株高生长速率。
2.2干旱对沙棘碳水化合物的影响

表1 水分胁迫、亚种间和两者交互对中国沙棘和西藏沙棘生长和碳水化合物的效应
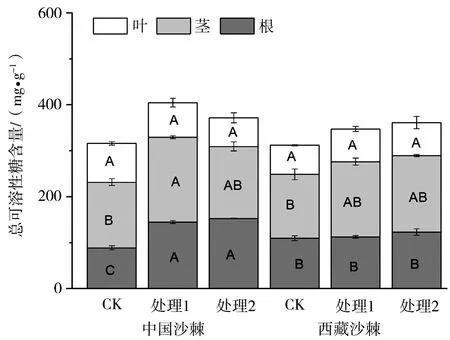
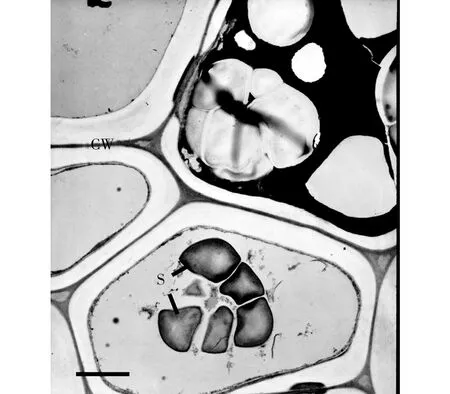
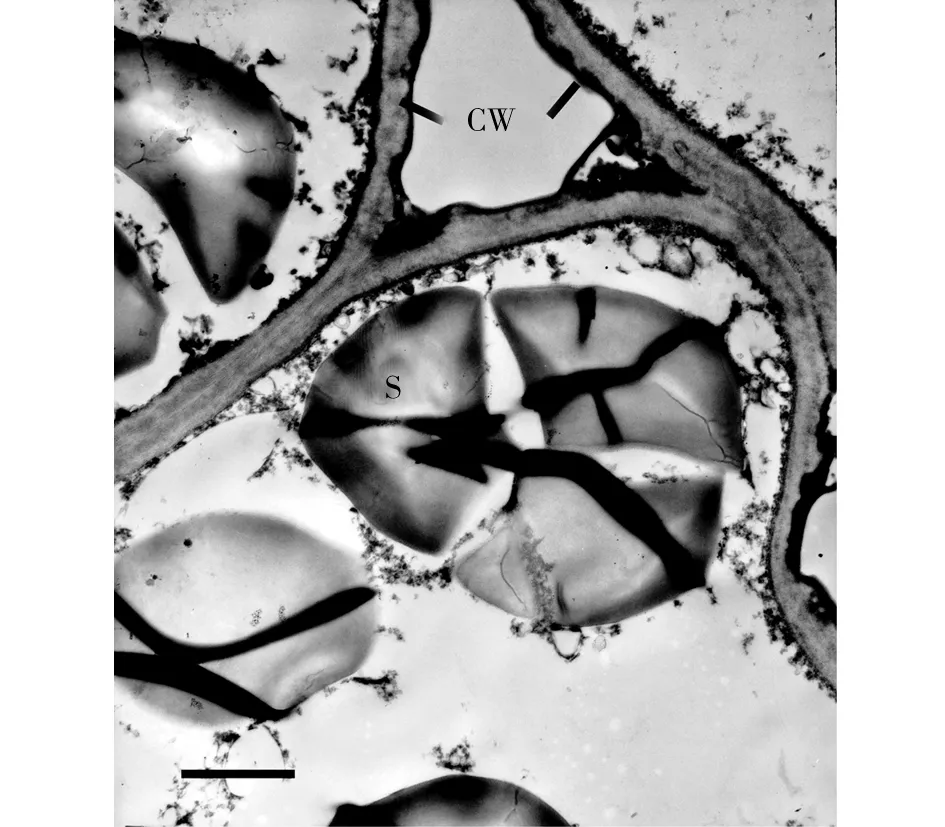
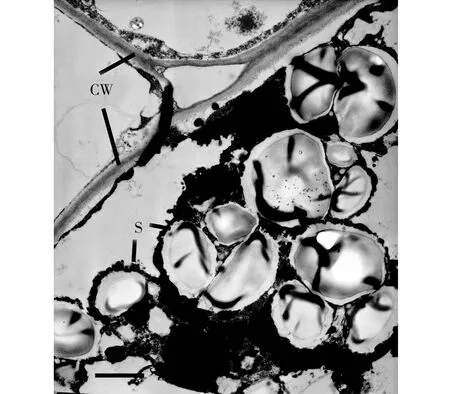
*:*为0.01 图1 不同水分处理下中国沙棘、西藏沙棘的生长速率 水分良好、中度水分胁迫条件下,2种沙棘茎、根的淀粉含量无明显差异,但西藏沙棘有更高的叶淀粉含量。极度干旱下,中国沙棘茎、根中淀粉含量显著高于西藏沙棘,且西藏沙棘叶淀粉含量也明显下降,说明两者间存在淀粉积累和分配上的响应差异(图2)。2种干旱处理显著降低了中国沙棘的叶蔗糖含量,而仅极度水分胁迫降低了西藏沙棘的叶蔗糖含量。极度水分胁迫下西藏沙棘茎中蔗糖含量显著增加,而中国沙棘表现出根蔗糖含量增加(图3)。水分处理并未影响西藏沙棘根、茎、叶中的可溶性总糖水平。中国沙棘在水分胁迫下表现为根的可溶性总糖含量上升,且中度水分胁迫下其茎的可溶性糖含量也显著上升,但不同水分处理未影响其叶的可溶性总糖含量(图4)。水分处理未显著影响2种沙棘的叶果糖含量。但2种水分胁迫显著增加了盅国沙棘的根果糖含量和西藏沙棘的茎果糖含量,而对西藏沙棘根果糖含量无明显影响(图5)。统计分析显示,根蔗糖和总糖,茎果糖、根、茎、叶的淀粉含量表现出明显的种间差异;水分处理显著影响除叶总糖和根果糖外的碳水化合物含量;种间×水分交互作用显著影响根总糖,根、茎、叶淀粉,茎、根蔗糖和果糖的含量(表1)。 2.3干旱对沙棘根超微结构的影响 水分良好的条件下,西藏沙棘和中国沙棘的根细胞壁和细胞膜结构清晰、平滑,细胞内淀粉积累相对较少(图6)。中度水分胁迫下,与对照相比,2种沙棘根超微结构并无明显差异(图7)。但在极度水分胁迫下,2种沙棘的根细胞壁扭曲、变薄、木质化更少,淀粉粒明显增多,且中国沙棘根超微结构中比西藏沙棘有更多的淀粉粒积累(图8、图9)。 图2 不同水分处理下中国沙棘、西藏沙棘不同器官中的淀粉含量 图3 不同水分处理下中国沙棘、西藏沙棘不同器官中的蔗糖含量 图4 不同水分处理下中国沙棘、西藏沙棘不同器官中的果糖含量 图5 不同水分处理下中国沙棘、西藏沙棘不同器官中总可溶性糖含量 CW为细胞壁;S为淀粉粒;下同。图6 正常水分下的中国沙棘、西藏沙棘根超微结构 图7 中度干旱下的中国沙棘、西藏沙棘根超微结构 图8 极度干旱下的西藏沙棘根超微结构 图9 极度干旱下的中国沙棘根超微结构 试验结果表明,水分胁迫尤其是极度干旱显著影响中国沙棘和西藏沙棘的生长速率和碳水化合物积累与分配,这将影响到它们对土壤的固氮效应、碳代谢和储存能力。碳水化合物的积累和分配反映了植物对环境条件的适应过程。淀粉和低分子量糖如果糖和蔗糖是植物储存碳的重要成分,且蔗糖是光合产物转运的主要形式[13]。前人的研究表明,水分胁迫显著影响中国沙棘的光合速率[9,14]和水分利用效率[15],这将影响到光合产物的生成、转运和积累过程。本试验结果表明不同的水分处理影响2种沙棘的淀粉、蔗糖、果糖和可溶性总糖含量,2种沙棘在碳水化合物积累与分配上存在显著差异。前人对中国沙棘的研究发现,长期轻度及中度干旱下中国沙棘可溶性糖和游离脯氨酸显著增加而渗透势降低,表现出低水势耐旱特性[16]。本研究显示,极度干旱条件下,中国沙棘分配了更多的淀粉、可溶性总糖、蔗糖与果糖在根中,从而使根具有更好的渗透调节能力,有利于根系吸收水分和营养物质,这可能是中国沙棘适应极度干旱的渗透调节机制。但与未经水分胁迫的对照相比,水分协迫处理后的西藏沙棘并未显示出根中碳水化合物的明显差异,这表明在水分胁迫下,西藏沙棘与中国沙棘碳水化合物生成过程中可能存在响应时间上的差异;也表明2种沙棘在碳水化合物地上茎、叶和地下根积累与分配上存在差异,说明两者在水分胁迫下有不同的适应策略。水分胁迫下植物根损伤会影响其对水分和养分的吸收能力。本研究显示,中度胁迫下,2种沙棘的根超微结构均未有明显的改变,表明中度胁迫并未对根造成损伤。但在极度胁迫下,可以明显看到2种沙棘均产生明显变化:细胞间隙大,细胞壁和细胞膜有扭曲和松散,不如对照下细胞壁光滑和紧密,细胞木质化少;此外,淀粉粒也明显增大,这可能与根中高的淀粉含量有关。 Grime等[17]把植物生活史对策分为竞争型(Competition,C)和胁迫忍耐型(Stress,S)。C-对策者在资源丰富的生境,生长快速,生物量积累大;在资源贫瘠的生境中,植物易受胁迫和伤害;S-对策者在资源丰富的生境生长速率较慢,但在资源有限的生境中具有较强的抗胁迫能力。中国沙棘在水分良好的条件下的适应趋向于C-对策,而中度和极度干旱抑制了其生长速率。中国沙棘表现出生理响应上的塑性,如分配更多的碳水化合物到根部,从而提高其渗透调节能力,以适应极端水分胁迫环境。西藏沙棘趋向于S-对策,在水分良好条件下,其生长速率缓慢;在中度水分胁迫下,并未表现出明显的抑制效应。这一方面可能与试验的胁迫时间长短有关,同时也说明西藏沙棘可能通过调节内在生理生化过程,如碳水化合物和营养物质的分配,维持内环境的稳定和适应水分胁迫环境。 总之,本研究结果表明:中度水分胁迫下,中国沙棘和西藏沙棘均表现出较好的适应能力。极度水分胁迫不同程度地抑制了2种沙棘的生长速率、改变了碳水化合物积累与分配特征及根超微结构。作为改良土壤的先锋树种和药食两用的经济树种,我国干旱与半干旱地区常利用沙棘人工林进行防风固沙、土壤修复和发展经济。在全球气候变化导致干旱日益加剧的背景下,为提高营林效果,在人工林的营建中要注意对沙棘幼苗的水分管理。此外,中国沙棘和西藏沙棘广泛分布于青藏高原,其幼苗对水分胁迫的响应与适应差异可能影响到这一敏感生态系统的植物群落结构、土壤固氮效应与碳氮循环过程。 [1]Beveridge T,Li TSC,Oomah BD,Smith A.Sea buckthorn products:Manufacture and Composition[J].J Agr Food Chem,1999(47):3480-3488. [2]Benson DR,Silvester WB.Biology of Frankia strains.Actinomycete symbionts of actinorhizal plant[J].Microbiol.Rev,1993(57):293-319. [3]Guo W,Li B,Zhang X,Wang R.Architectural plasticity and growth responses of Hippophae rhamnoides and Caragana intermedia seedlings to simulated water stress[J].J Arid Environ,2007,69(3):385-399. [4]Li CY,Xu G,Zang R,et al.Sex-related differences in leaf morphological and physiological responses in Hippophae rhamnoides along an altitudinal gradient[J].Tree Physiol,2007(27):399-406. [5]李玉新,赵忠,陈金泉.不同林龄人工沙棘林结构与林下物种多样性研究[J].西北植物学报,2010,30(4):645-651. [6]钟正昌,方江平,普琼.西藏沙棘资源及其综合开发利用[J].西藏科技,2003(8):23-25. [7]Chaves MM,Maroco JP,Pereira JS.Understanding plant responses to drought-from genes to the whole plant[J].Funct Plant Biol,2003,30(3):239-264. [8]刘彬,吴福忠,张健,等.岷江干旱河谷——山地森林交错带震后生态恢复的关键科学技术问题[J].生态学报,2008,28(12):5892-5898. [9]刘瑞香.不同土壤水分条件对中国沙棘和俄罗斯沙棘的光合和蒸腾作用的影响[J].水土保持通报,2006,26 (1):1-5,15. [10] 蔡海霞,吴福忠,杨万勤.干旱胁迫对高山柳和沙棘幼苗光合生理特征的影响[J].生态学报,2011,31(9):2430-2436. [11]Yemm EW,Willis AJ.The estimation of carbohydrates in plant extracts by anthrone[J].Biochem J,1954(57):508-514. [12]Green TH,Mitchell RJ,Gjerstad DH.Effects of nitrogen on the response of loblolly pine to drought.2.Biomass allocation and C-N balance[J].New Phytol,1994(128):145-152. [13]Huber SC.Relation between photosynthetic starch formation and dry-weight partitioning between the shoot and root[J].Can J Bot,1983(61):2709-2710. [14]裴斌,张光灿,张淑勇,等.土壤干旱胁迫对沙棘叶片光合作用和抗氧化酶活性的影响[J].生态学报,2013,33(5):1386-1396. [15]高丽,杨劼,刘瑞香.不同土壤水分条件下中国沙棘雌雄株光合作用、蒸腾作用及水分利用效率特征[J].生态学报,2009(29):6025-6034. [16]韩蕊莲,李丽霞,梁宗锁.干旱胁迫下沙棘叶片细胞膜透性与渗透调节物质研究[J].西北植物学报,2003,23(1):23-27. [17]Grime JP.Plant Strategies and Vegetation Processes[M].Chichester:John Wiley,1979. EffectofDroughtonGrowthandPhysiologicalTraitsofTwoSpeciesofSeaBuckthorn LIYudong1,3,CHENJuan2,LUOYan1 (1.SichuanProvincialAcademyofNaturalResourceSciences,Chengdu610015,Sichuan,China;2.MianyangNormalUniversity,Mianyang621000,Sichuan,China; 3.SichuanProvinceLaboratoryforNaturalResourcesProtectionandSustainableUtilization,Chengdu610015,Sichuan,China) In the paper,takingHippopharhamnoidesandHippophaethibetanaseedlings came from Hongyuan County as experimental materials,the effect of different drought treatments (control,100% field capacity,moderate drought,50% field capacity and extreme drought,30% field capacity) on traits of growth rate,carbohydrates and root ultrastructure of two subspecies of sea buckthorn were investigated by a pot experiment.The result indicated thatH.rhamnoidesshowed higher growth rate thanH.thibetanaunder well-watered and drought stress.Two levers of drought inhibited more growth rate ofH.rhamnoidesthan that ofH.thibetana.Two levels of drought significantly affected the carbohydrates of two subspecies of sea buckthorn.In extreme drought stress,H.rhamnoidesshowed higher starch,soluble sugar,sucrose and fructose in roots than that ofH.thibetana,indicating better root osmotic adjustment,while drought had more obvious effect on carbohydrates of aboveground than that of roots ofH.thibetana.In addition,H.rhamnoidesandH.thibetanashowed no obvious damage in root ultrastructure compared with the control plants under moderate drought.However,two subspecies of sea buckthorn were damaged by extreme drought treatment.The study indicated that drought differently affected the growth rates and carbohydrates,which may affect the structure and ecological function of sea buckthorn in Tibet Plateau.In addition,to improve the afforestation,the water regimes of seedlings of sea buckthorn should be paid more attention. sea buckthorn;carbohydrates;ultrastructure;drought stress 10.13428/j.cnki.fjlk.2017.03.002 2017-02-01; : 2017-05-03 四川省科技厅应用基础研究项目(2015JY0014);四川省生态安全与保护重点实验室开放基金 (SP0014);四川省植物资源共享平台项目(2016TJPT0001);四川省公益性科研院所基本科研业务费项目(2014年166) 李裕冬(1980—),男,四川内江人,四川省自然资源科学研究院助研,硕士,从事生态学研究。E-mail:pikapaul@163.com。 陈娟(1975—),女,湖南衡阳人,绵阳师范学院副教授,从事植物生态学研究。E-mail:cj-041698@163.com。 S793.6;Q945.78 : A : 1002-7351(2017)03-0010-06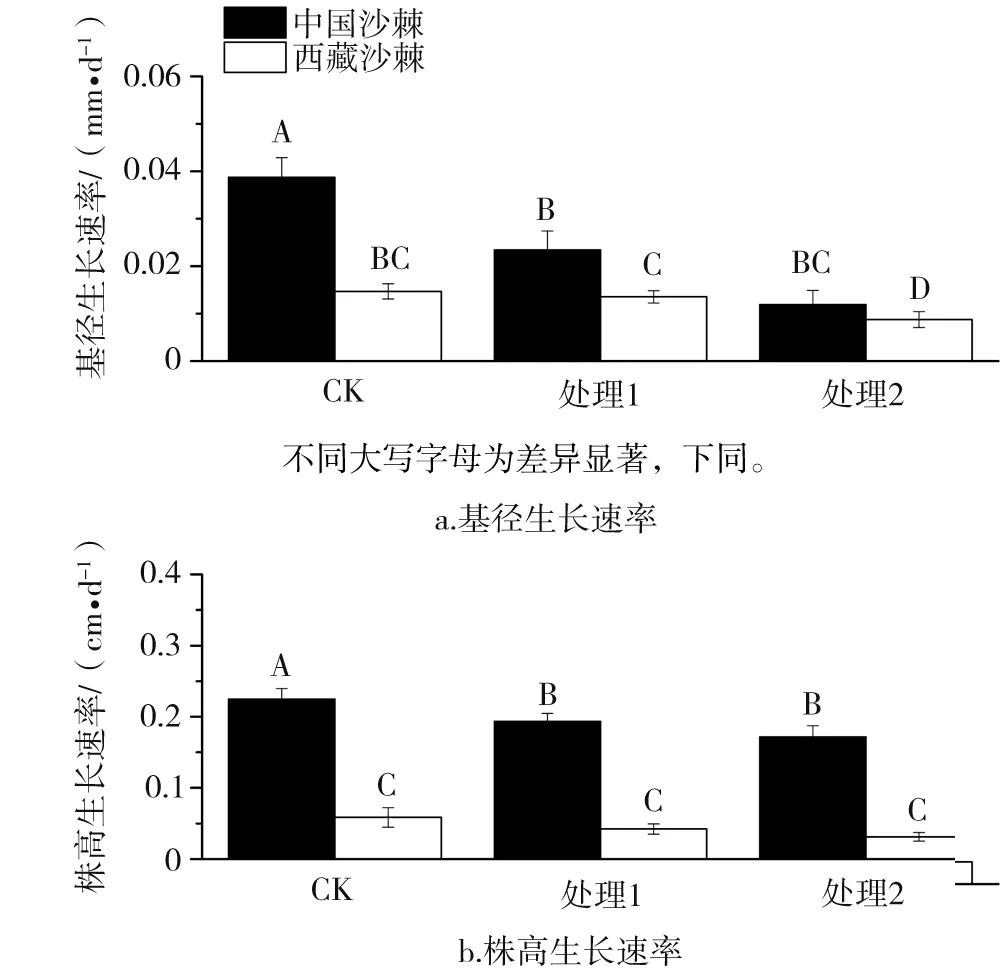




3 结论与讨论
