乳腺癌相关长链非编码RNA的研究进展
2017-09-21磊吴
刘 磊吴 炅
1.复旦大学附属肿瘤医院乳腺外科,复旦大学上海医学院肿瘤学系,上海 200032;2.南昌大学第二附属医院乳腺外科,江西 南昌 330006
乳腺癌相关长链非编码RNA的研究进展
刘 磊1,2综述吴 炅1审校
1.复旦大学附属肿瘤医院乳腺外科,复旦大学上海医学院肿瘤学系,上海 200032;2.南昌大学第二附属医院乳腺外科,江西 南昌 330006
长链非编码RNA(long non-coding RNA,lncRNA)是一类长度大于200 nt、不能编码蛋白质的RNA,参与基因调控的各个层面。近年来研究发现,多种lncRNA在乳腺癌的发生、发展过程中起着重要的调控作用。该研究就lncRNA在乳腺癌中的异常表达,与乳腺癌的增殖、凋亡、侵袭、转移的关系,以及在乳腺癌早期诊断、药物耐药、判断预后中的作用等相关进展做一综述,希望为乳腺癌的预测、诊断和个体化治疗提供新的靶点和思路。
长链非编码RNA;乳腺癌;肿瘤发生;肿瘤进展;分子标志物
乳腺癌是女性最常见的恶性肿瘤,具有高度的异质性。乳腺癌患者在治疗方案一致的情况下,其药物反应、复发及生存期都往往不同。目前临床上主要根据不同的分子亚型来规范乳腺癌的综合治疗。而分子亚型的区分仅仅基于不到人类基因序列2%的蛋白编码基因[1]。其余绝大多数非编码转录产物,即非编码RNA(non-coding RNA,ncRNA),因为之前其数量、种类及功能状况都不明确,缺乏有效的研究手段,而被研究者们认为不具有生物学功能,是基因组转录的“噪音”。随着研究手段的飞速发展,研究者们逐渐认识到,ncRNA在细胞分化与代谢的生命过程中发挥着非常重要的作用。其中转录长度超过200 nt的长链ncRNA(long ncRNA,lncRNA)不仅在表观遗传、转录及转录后水平上调控基因表达,参与X染色体沉默、基因组印记、染色质修饰、转录激活、转录干扰及核内运输等多种重要的调控过程[2],而且其功能失调也与多种疾病病理过程密切相关[3],在乳腺癌的发生、发展和诊疗过程中发挥着重要作用[4]。本研究就lncRNA与乳腺癌的最新研究进展综述如下。
1 lncRNA概述
LncRNA通常位于细胞核和细胞质中,在真核细胞中普遍被转录。LncRNA具有polyA尾巴和启动子结构,但序列中缺少开放阅读框,因此不具有或很少具有蛋白质编码功能。目前,对于lncRNA的来源尚不十分清楚,普遍认为可能来自以下途径[5]:① 在早期进化过程中,蛋白质编码基因的开放阅读框发生突变、基因结构破坏而产生;② 染色质重排,两个非转录片段串联到一起而形成;③ 非编码基因通过反移位产生;④ 由局部的串联复制子产生邻近的ncRNA;⑤ 基因中插入一个转座成分而形成。
LncRNA通常依据临近的具有蛋白编码功能的基因片段来进行编码和分类[5],主要分为:
① 反义lncRNA(antisensc-lncRNA):lncRNA转录起始于临近的具有编码功能基因内部或其3’端,且转录方向与之相反,并有至少一个外显子的重叠;② 正义lncRNA (sense-lncRNA):与反义刚好相反;③ 内含子lncRNA(intronic transript lncRNA):指lncRNA转录起始于具有编码功能基因的内含子,且无任何外显子的重叠;④ 双向lncRNA(bidirectional lncRNA):起始于临近的具有编码功能基因的启动子,具有双向转录潜能的lncRNA;⑤ 基因间lncRNA(large intergenic ncRNA,LincRNA):指转录于两个具有编码功能基因间的lncRNA。
LncRNA可在多个层面调控基因的表达,在恶性肿瘤中,它可以通过修饰染色体参与表观遗传学调节、与转录因子的相互作用参与转录调节、影响mRNA处理过程参与转录后调节等来发挥促癌和抑癌作用。例如:lncRNA HOTAIR可以通过招募多梳抑制性复合物2(polycomb repressive complex 2,PRC2),使H3组蛋白的第27位赖氨酸甲基化,促进肿瘤的侵袭和转移[6]。而lncRNA Gas5通过与糖皮质激素受体(glucocorticoid receptor,GR)的DNA结合区域结合发挥诱饵作用,阻止GR与糖皮质激素应答元件结合,下调靶基因(参与抑制细胞凋亡)的转录活性,诱导肿瘤细胞凋亡[7]。
2 lncRNA在乳腺癌发生、发展中的作用
2.1 lncRNA在乳腺癌组织中的特异度表达
近年来,研究发现在乳腺组织恶变过程中出现大量基因和转录水平的显著改变,而这些变化往往与lncRNA的异常表达密切相关[8]。lncRNA的异常表达在乳腺癌组织中有上调也有下调,其中以lncRNA上调者多见[9-27]。具体异常表达情况见表1。Gibb等[10]利用基因芯片高通量分析乳腺癌与正常乳腺组织中lncRNA的差异性表达,发现乳腺癌组织中有220个lncRNA异常表达,其中129个lncRNA为乳腺癌特异度表达,可以作为乳腺癌的生物标志物。Hung等[11]通过对与细胞周期相关基因的启动子进行lncRNA筛选,发现有35个lncRNA在乳腺浸润性导管癌中异常表达,进一步提示lncRNA在乳腺癌不同病理类型中的特异度。此外,人们在不同的分子分型中也发现特异lncRNA表达。Sun等[12]对乳腺癌细胞系和乳腺癌组织标本进行检测,发现lncRNA H19在雌激素受体阳性乳腺癌中过表达,并能促进乳腺癌的生长和增殖。Milevskiy等[13]通过不同分子亚型乳腺癌标本进行基因芯片分析,结果发现,lncRNA HOTAIR在HER-2阳性亚群中高表达。而Kang等[14]则发现反义lncRNA IRAIN在HER-2阳性和三阴性乳腺癌中表达下调。这些lncRNA的特异度表达充分说明了其与乳腺癌的发生有着密不可分的联系,这也为下一步研究乳腺癌相关lncRNA的功能奠定了基础。
2.2 lncRNA对乳腺癌增殖和凋亡的影响
肿瘤的发生与细胞凋亡失常往往密切相关。当细胞凋亡机制遭到破坏,细胞数目将会增多,从而导致肿瘤的发生。一些lncRNA能够通过干扰细胞凋亡,导致细胞过度生长, 从而引发乳腺恶性肿瘤。Shi等[15]实验证实lncRNA SPRY4-IT1在乳腺癌组织中表达显著增高,它可以通过作用于致癌基因ZNF703,促进雌激素受体阴性的乳腺癌细胞增殖。Huang等[16]研究发现,lncRNA UCA1能够通过竞争P27 mRNA,与核内不均一性核糖核蛋白1(heterogeneous nuclear ribonucleoprotein 1,hnRNP1)结合,抑制P27蛋白(周期素依赖性蛋白激酶抑制因子)表达,促进乳腺癌细胞增殖。而最近的体内外实验亦证实[17],lncRNA CCAT2能通过影响Wnt信号通路,促进乳腺癌细胞增殖。当然,也有一些lncRNA通过减弱细胞增殖而抑制肿瘤生长。如lncRNA PinX1能够使乳腺癌细胞生长阻滞在G0/G1期,从而抑制乳腺癌的增殖,达到抗肿瘤的效果[18]。
2.3 lncRNA对乳腺癌浸润、转移的调控作用
乳腺癌的转移是一个由多基因调控、多步骤发展的复杂过程,涉及肿瘤细胞生长、迁移和侵袭等一系列过程。与正常组织以及原发肿瘤相比,乳腺癌转移灶的lncRNA含量发生显著变化,其表达水平与侵袭力及预后往往具有相关性。有学者研究发现[19],缺氧诱导因子能够通过上调lncRNA EFNA3的表达,引起Ephrin-A3在细胞表面聚集,增加肿瘤细胞从血管外渗到周围组织的能力,从而促进乳腺癌细胞的侵袭转移。当然,lncRNA同样可以作为肿瘤抑制因子来调节乳腺癌的浸润转移过程。Liu等[28]证实lncRNA NKILA与NF-kB通路密切相关,它可以被NF-kB通路释放的炎性因子上调,并可以作为负调节因子,通过阻断IkB磷酸化,抑制NF-kB介导的乳腺癌转移。
针对lncRNA促进肿瘤侵袭、转移的作用机制,人们开始利用药物来下调lncRNA的表达,以达到抑制肿瘤转移的效果。Zhao等[29]研究发现,高浓度17b-雌二醇能通过下调lncRNA MALAT-1表达,来抑制lncRNA MALAT-1对乳腺癌细胞系的生长、浸润和转移的影响,二者具有剂量依赖性。
LncRNA在乳腺癌的浸润、转移过程中的作用是目前研究的热点。lncRNA对浸润、转移的调控作用与乳腺癌上皮-间质转化(epithelial-tomesenchymal transition,EMT)及表观遗传调控密切相关。
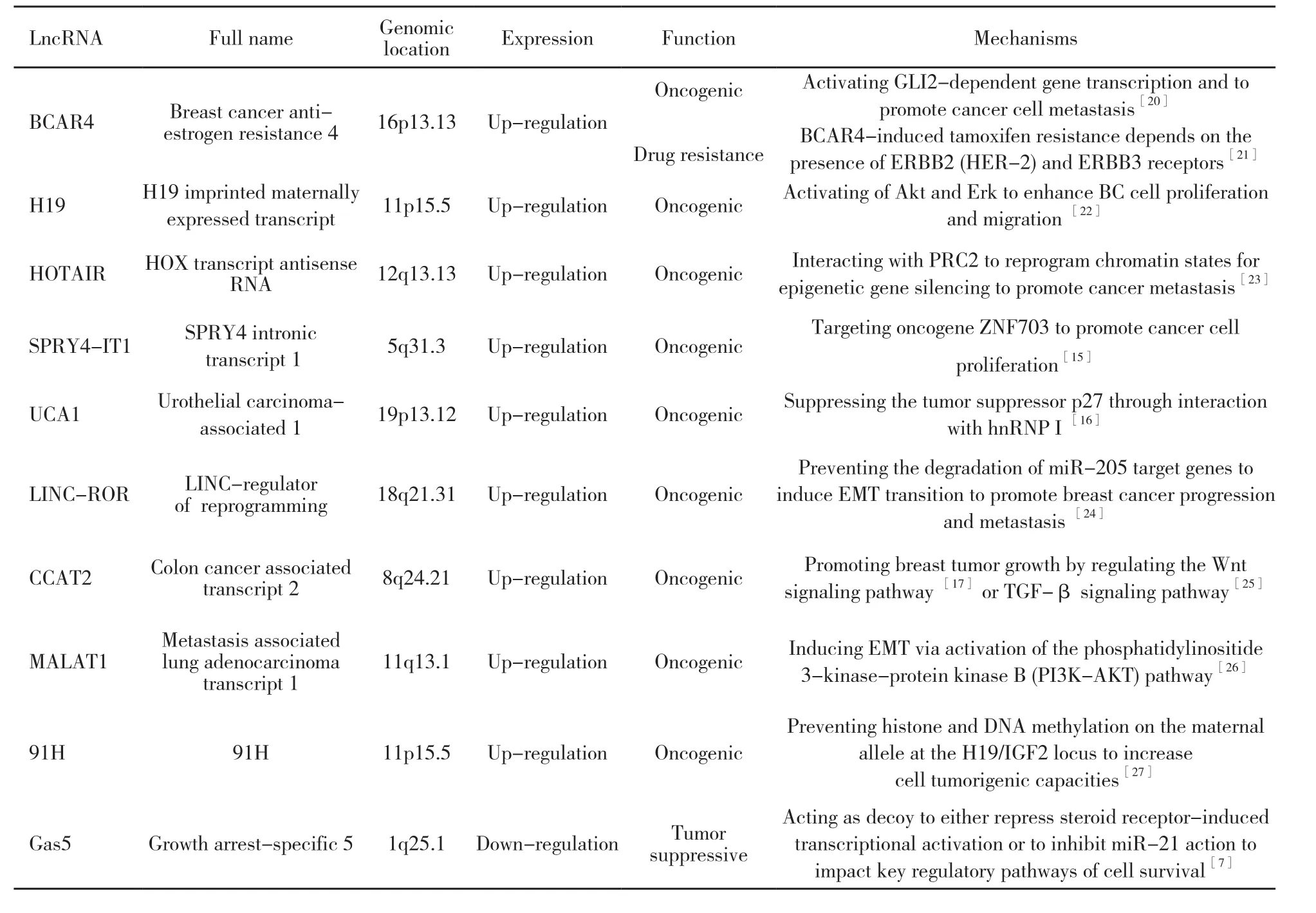
表 1 乳腺癌中常见异常表达的lncRNAsTab. 1 The abnormal expression of lncRNAs in breast cancer
2.3.1 lncRNA调控乳腺癌的EMT
EMT是指上皮细胞通过特定程序转化为具有间质表型细胞的生物学过程,在癌症转移过程中发挥重要作用。Hu等[30]利用lncRNA芯片,对调控因子Twist诱导乳腺癌细胞EMT过程进行分析,结果发现,有超过99种lncRNA参与这一过程,其中有4种lncRNA通过调节靶基因在WNT信号通路中起重要作用。Hou等[24]研究发现,lncRNA-ROR在乳腺癌组织表达上调的同时,还可以检测出EMT特征分子的变化。LncRNA-ROR可以通过对miR-205发挥“海绵”作用,阻止miR-205靶基因ZEB2降解,诱导EMT发生,从而使乳腺癌细胞获得干细胞潜能,促进乳腺癌的浸润和转移。体内研究进一步证实,通过基因沉默lncRNA-ROR可以抑制乳腺癌细胞生长和肺转移。此外,Matouk等[31]研究发现,lncRNA H19表达与乳腺癌转移密切相关,许多EMT诱导因子(包括转录因子Slug)可以上调lncRNA H19的表达,而lncRNA H19又通过作用抑制因子促进Slug表达,形成一个正反馈循环,促进乳腺癌浸润转移。另外,大量研究发现,lncRNA还可以通过作用相关信号通路调控乳腺癌EMT过程。如lncRNA MALAT1[26]与乳腺癌无复发生存期呈正相关,基因沉默lncRNA MALAT1,可以通过PI3K-AKT路径调控EMT,促进乳腺癌细胞转移。
2.3.2 lncRNA参与乳腺癌的表观遗传调控
表观遗传学是指不依赖于DNA序列的改变所引起的稳定可遗传的表现型。近年来研究发现,表观遗传调控在许多肿瘤的发生、发展中起重要作用。目前与乳腺癌有关的表观遗传修饰主要包括染色质重构、组蛋白修饰及诱导DNA甲基化。
2.3.2.1 染色质重构
LncRNA可以招募染色质重构复合体到特定位点进,介导相关基因的表达沉默。同源异形盒基因转录的反义RNA(hox transcript antisense RNA,HOTAIR)是转录自同源基因C(homeobox C cluster,HOXC)位点的一类lncRNA,有研究发现,它能够通过5’端招募PRC2复合体到靶基因,导致组蛋白H3K27甲基化和染色体重构,以表观遗传方式抑制或沉默乳腺癌转移相关基因的表达,促进乳腺癌的侵袭[23]。
2.3.2.2 组蛋白修饰
LncRNA可以通过组蛋白甲基化或乙酰化修饰,抑制相应的抑癌基因,影响肿瘤的发生。Wan等[32]研究发现,与正常乳腺组织相比较,lncRNA-JADE在乳腺癌组织中高表达。由肿瘤相关DNA损伤而诱发的lncRNA-JADE,能够使组蛋白H4乙酰化,通过敲除lncRNAJADE,能显著抑制乳腺肿瘤的体内生长。前期研究发现,胶质瘤相关癌基因(glioma associated oncogene homolog,GLI)1/2依赖的靶基因转录在实体肿瘤中可以促进肿瘤细胞的生长和转移。Xing等[20]研究证实,lncRNA BCAR4可以在趋化因子CCL21的诱导下,招募Smad核内相关蛋白1(Smad nuclear-interacting protein 1,SNIP1)和丝氨酸/苏氨酸蛋白磷酸酶1调节亚基10(Serine/ threonine-protein phosphatase 1 regulatory subunit 10,PPP1R10),使组蛋白H3K18ac乙酰化,并通过进一步释放RNA聚合酶Ⅱ抑制剂,激活Hedgehog/GLI2转录通路,促进乳腺癌细胞迁移。
2.3.2.3 诱导DNA甲基化
LncRNA可以通过和DNA甲基化酶相互作用,介导后者锚定特殊靶点,诱发启动子甲基化,下调抑癌基因的表达。Augoff等[33]首先发现lncRNA LOC554202是miR-31的宿主基因,二者在三阴性乳腺癌中都受到启动子高甲基化调节,从而下调抑癌基因表达,促进癌细胞的侵袭转移。
3 lncRNA在乳腺癌诊治中的作用
由于lncRNA在乳腺癌的发生、增殖凋亡、转移浸润及信号转导等过程中起重要作用,因此lncRNA可以为临床早期诊断、预后判断等提供新的标志物,同时为肿瘤的临床耐药治疗提供一种新的思路。外周血循环lncRNA在恶性肿瘤诊断中的作用是最近研究的热点[34]。有研究发现,与健康对照相比,循环lncRNA H19在乳腺癌患者显著高表达,其灵敏度和特异度也均优于乳癌常见的诊断指标癌胚抗原(carcinoembryonic antigen,CEA)、CA153,且在术后表达明显降低,可以作为乳腺癌早起诊断的潜在指标[35]。由此可见,lncRNA在乳腺癌临床诊断方面亦具有巨大潜力。
3.1 lncRNA介导乳腺癌治疗耐药
乳腺癌耐药是一个多机制联合作用的结果,包括耐药基因的异常表达、药物作用靶点下调等。研究发现lncRNA BCAR4不仅与乳腺癌侵袭转移密切相关,在乳腺癌他莫昔芬内分泌治疗的耐药机制中也起到重要作用[21]。基因沉默BCAR4可抑制乳腺癌细胞增殖,而在BCAR4的耐药实验中,敲除基因ERBB2/3和使用拉帕替尼可出现类似效应,基于拉帕替尼主要对表皮生长因子受体(epidermal growth factor receptor,EGFR)和HER-2/ERBB2起抑制作用,这意味着lncRNA BCAR4可能通过ERBB2/3依赖性方式,在他莫昔芬内分泌治疗耐药中起重要作用。此外,研究数据表明,lncRNA还可以降低肿瘤对化疗药物的敏感性而产生化疗耐药。比如,lncRNA CCAT2高表达的乳腺癌患者从CMF辅助化疗方案中获益较小,而且会下调患者对药物氟尿嘧啶的化疗敏感性[36]。Shi等[37]研究发现,转化生长因子-β(transforming growth factor-β,TGF-β)通路诱导的EMT在乳腺癌曲妥珠单抗耐药机制中起重要作用。该团队进一步发现,lncRNA-ATB可以通过竞争性结合miR-200c,上调ZEB1(TGF-β转录激活因子)和ZNF-217(TGF-β信号通路重要递质)表达,促进TGF-β通路诱导的上皮-间质转化,从而使lncRNA-ATB高表达的患者更容易出现曲妥珠单抗耐药。相信随着相关研究的不断深入,lncRNA有望成为乳腺癌耐药治疗的新靶点。
3.2 lncRNA与乳腺癌预后
大量回顾性研究显示,乳腺癌组织中lncRNA的表达异常往往与患者的不良预后有很大关联。Sorensen等[38]对164个原发未进行辅助治疗的乳腺肿瘤患者进行回顾性研究,发现lncRNA HOTAIR在发生转移和未发生转移的乳腺癌组织中存在差异性表达,并且高表达lncRNA HOTAIR的原发乳腺癌患者提示预后不良,研究进一步发现,这种预后价值仅出现在ER阳性的乳腺癌患者中,可见lncRNA HOTAIR可以作为ER阳性乳腺癌转移和预后的独立预测因子。Zhou等[39]利用基因芯片数据库,对12个与乳癌复发密切相关的lncRNA进行联合分析,发现12-lncRNA表达可以作为乳腺癌患者的独立预后指标。这预示着lncRNA的联合分析有望避免单一linRNA检测的局限,为乳腺癌患者的预后提供新的预测工具。
3.3 LncRNA作为分子标志物及其潜在的治疗价值
LncRNA与乳腺癌的发生、发展关系密切,对lncRNA作用机制的深入研究,可以更好的为乳腺癌的靶向治疗提供新的靶点。Gas5与细胞凋亡密切相关,在乳腺癌组织中表达下调,其低表达预示乳癌患者预后不良[7]。因此,近年来研究者致力于通过应用新型靶向药物或联合治疗来提高lncRNA Gas5转录水平,以改善乳腺癌患者预后。Pickard等[40]体外研究发现,只有同时抑制PI3K/mTOR双通路,lncRNA Gas5才能有效促进三阴性乳腺癌和雌激素受体阳性的乳腺癌细胞系凋亡。这为三阴性乳腺癌和luminal型乳腺癌的未来治疗提供一个新的靶点。同样有研究发现,lncRNA BCAR4不仅在他莫昔芬内分泌治疗耐药中起重要作用,还可以促进乳腺癌细胞对拉帕替尼的敏感性[41]。鉴于lncRNA BCAR4主要通过ERBB2/3依赖性方式起重要作用,拉帕替尼的有益效应也可以通过抑制lncRNA BCAR4起作用。这为拉帕替尼在HER-2阴性、BCAR4阳性肿瘤的临床试验奠定了理论基础。
4 结语
尽管大量研究显示,lncRNA在乳腺癌的发生、发展中起重要作用,但相对于蛋白编码基因和miRNA而言,lncRNA的研究仍处于初始阶段。目前针对lncRNA与乳腺癌的相关研究,主要是通过分析某一特定lncRNA在乳腺癌细胞中的异常表达,从基因表达调控的角度对乳腺癌的发生、发展进行研究。由于缺乏有效的技术手段,目前有关研究大多局限于某一种lncRNA对乳腺癌的发生、增殖、凋亡、侵袭及转移等方面的影响,较少涉及深入探讨其具体的作用机制,更无法探知是否有多种lncRNA的共同参与而形成调控网络。此外,lncRNA还尚缺乏统一规范的命名方式,目前只是研究者根据其功能、结构特点及作用机制等进行命名,而且相对于其他非编码RNA数据库,lncRNA相关数据库的内容还都不够全,这都在一定程度上限制了人们对lncRNA的进一步研究。相信随着分子生物学技术的不断进步,lncRNA联合分析和循环lncRNA等研究手段的出现和不断深入,lncRNA在乳腺癌临床诊断与治疗中的巨大潜力将不断被挖掘,对乳腺肿瘤复杂调控网络的认识也将不断更新。LncRNA有望成为未来乳腺癌预测、诊断及个体化治疗的重要工具。
[1] DJEBALI S, DAVIS C A, MERKEL A, et al. Landscape of transcription in human cells[J]. Nature, 2012, 489(7414): 101-108.
[2] GUTTMAN M, RINN J L. Modular regulatory principles of large non-coding RNAs[J]. Nature, 2012, 482(7385): 339-346.
[3] MAASS P G, LUFT F C, BAHRING S. Long non-coding RNA in health and disease[J]. J Mol Med (Berl), 2014, 92(4): 337-346.
[4] DVINGE H, GIT A, GRAF S, et al. The shaping and functional consequences of the microRNA landscape in breast cancer[J]. Nature, 2013, 497(7449): 378-382.
[5] PONTING C P, OLIVER P L, REIK W. Evolution and functions of long non-coding RNAs[J]. Cell, 2009, 136(4): 629-641.
[6] HAJJARI M, SALAVATY A. HOTAIR: an oncogenic long non-coding RNA in different cancers[J]. Cancer Biol Med, 2015, 12(1): 1-9.
[7] PICKARD M R, WILLIAMS G T. Molecular and cellular mechanisms of action of tumour suppressor GAS5 lncRNA[J]. Genes (Basel), 2015, 6(3): 484-499.
[8] PIAO H L, MA L. Non-coding RNAs as regulators of mammary development and breast cancer[J]. J Mammary Gland Biol Neoplasia, 2012, 17(1): 33-42.
[9] REICHE K, KASACK K, SCHREIBER S, et al. Long noncoding RNAs di ff erentially expressed between normal versus primary breast tumor tissues disclose converse changes to breast cancer-related protein-coding genes[J]. PLoS One, 2014, 9(9): e106076.
[10] GIBB E A, VUCIC E A, ENFIELD K S, et al. Human cancer long non-coding RNA transcriptomes[J]. PLoS One, 2011, 6(10): e25915.
[11] HUNG T, WANG Y, LIN M F, et al. Extensive and coordinated transcription of noncoding RNAs within cellcycle promoters[J]. Nat Genet, 2011, 43(7): 621-629.
[12] SUN H, WANG G, PENG Y, et al. H19 lncRNA mediates 17beta-estradiol-induced cell proliferation in MCF-7 breast cancer cells[J]. Oncol Rep, 2015, 33(6): 3045-3052.
[13] MILEVSKIY M J, AL-EJEH F, SAUNUS J M, et al. Longrange regulators of the lncRNA HOTAIR enhance its prognostic potential in breast cancer[J]. Hum Mol Genet, 2016, 25(15): 3269-3283.
[14] KANG L, SUN J, WEN X, et al. Aberrant allele-switch imprinting of a novel IGF1R intragenic antisense non-coding RNA in breast cancers[J]. Eur J Cancer, 2015, 51(2): 260-270.
[15] SHI Y, LI J, LIU Y, et al. The long non-coding RNA SPRY4-IT1 increases the proliferation of human breast cancer cells by upregulating ZNF703 expression[J]. Mol Cancer, 2015, 14: 51.
[16] HUANG J, ZHOU N, WATABE K, et al. Long non-coding RNA UCA1 promotes breast tumor growth by suppression of p27 (Kip1)[J]. Cell Death Dis, 2014, 5: e1008.
[17] CAI Y, HE J, ZHANG D. Long non-coding RNA CCAT2 promotes breast tumor growth by regulating the Wnt signaling pathway[J]. Onco Targets Ther, 2015, 8: 2657-2664.
[18] SHI R, ZHOU J Y, ZHOU H, et al. The role of PinX1 in growth control of breast cancer cells and its potential molecular mechanism by mRNA and lncRNA expression profiles screening[J]. Biomed Res Int, 2014, 2014: 978984.
[19] GOMEZ-MALDONADO L, TIANA M, ROCHE O, et al. EFNA3 long noncoding RNAs induced by hypoxia promote metastatic dissemination[J]. Oncogene, 2015, 34(20): 2609-2620.
[20] XING Z, LIN A, LI C, et al. lncRNA directs cooperative epigenetic regulation downstream of chemokine signals[J]. Cell, 2014, 159(5): 1110-1125.
[21] GODINHO M F, WULFKUHLE J D, LOOK M P, et al. BCAR4 induces antioestrogen resistance but sensitises breast cancer to lapatinib[J]. Br J Cancer, 2012, 107(6): 947-955.
[22] VENNIN C, SPRUYT N, DAHMANI F, et al. H19 non coding RNA-derived miR-675 enhances tumorigenesis and metastasis of breast cancer cells by downregulating c-Cbl and Cbl-b[J]. Oncotarget, 2015, 6(30): 29209-29223.
[23] GUPTA R A, SHAH N, WANG K C, et al. Long non-coding RNA HOTAIR reprograms chromatin state to promotecancer metastasis[J]. Nature, 2010, 464(7291): 1071-1076.
[24] HOU P, ZHAO Y, LI Z, et al. LincRNA-ROR induces epithelial-to-mesenchymal transition and contributes to breast cancer tumorigenesis and metastasis[J]. Cell Death Dis, 2014, 5: e1287.
[25] WU Z J, LI Y, WU Y Z, et al. Long non-coding RNA CCAT2 promotes the breast cancer growth and metastasis by regulating TGF-beta signaling pathway[J]. Eur Rev Med Pharmacol Sci, 2017, 21(4): 706-714.
[26] XU S, SUI S, ZHANG J, et al. Downregulation of long noncoding RNA MALAT1 induces epithelial-tomesenchymal transition via the PI3K-AKT pathway in breast cancer[J]. Int J Clin Exp Pathol, 2015, 8(5): 4881-4891.
[27] VENNIN C, SPRUYT N, ROBIN Y M, et al. The long noncoding RNA 91H increases aggressive phenotype of breast cancer cells and up-regulates H19/IGF2 expression through epigenetic modi fi cations[J]. Cancer Lett, 2017, 385: 198-206.
[28] LIU B, SUN L, LIU Q, et al. A cytoplasmic NF-κB interacting long noncoding RNA blocks IkappaB phosphorylation and suppresses breast cancer metastasis[J]. Cancer Cell, 2015, 27(3): 370-381.
[29] ZHAO Z, CHEN C, LIU Y, et al. 17β-estradiol treatment inhibits breast cell proliferation, migration and invasion by decreasing MALAT-1 RNA level[J]. Biochem Biophys Res Commun, 2014, 445(2): 388-393.
[30] HU P, YANG J, HOU Y, et al. LncRNA expression signatures of twist-induced epithelial-to-mesenchymal transition in MCF10A cells[J]. Cell Signal, 2014, 26(1): 83-93.
[31] MATOUK I J, RAVEH E, ABU-LAIL R, et al. Oncofetal H19 RNA promotes tumor metastasis[J]. Biochim Biophys Acta, 2014, 1843(7): 1414-1426.
[32] WAN G, HU X, LIU Y, et al. A novel non-coding RNA lncRNA-JADE connects DNA damage signalling to histone H4 acetylation[J]. EMBO J, 2013, 32(21): 2833-2847.
[33] AUGOFF K, MCCUE B, PLOW E F, et al. miR-31 and its host gene lncRNA LOC554202 are regulated by promoter hypermethylation in triple-negative breast cancer[J]. Mol Cancer, 2012, 11: 5.
[34] QI P, ZHOU X Y, DU X. Circulating long non-coding RNAs in cancer: current status and future perspectives[J]. Mol Cancer, 2016, 15(1): 39.
[35] ZHANG K, LUO Z, ZHANG Y, et al. Circulating lncRNA H19 in plasma as a novel biomarker for breast cancer[J]. Cancer Biomark, 2016, 17(2): 187-194.
[36] REDIS R S, SIEUWERTS A M, LOOK M P, et al. CCAT2, a novel long non-coding RNA in breast cancer: expression study and clinical correlations[J]. Oncotarget, 2013, 4(10): 1748-1762.
[37] SHI S J, WANG L J, YU B, et al. LncRNA-ATB promotes trastuzumab resistance and invasion-metastasis cascade in breast cancer[J]. Oncotarget, 2015, 6(13): 11652-11663.
[38] SORENSEN K P, THOMASSEN M, TAN Q, et al. Long non-coding RNA HOTAIR is an independent prognostic marker of metastasis in estrogen receptor-positive primary breast cancer[J]. Breast Cancer Res Treat, 2013, 142(3):529-536.
[39] ZHOU M, ZHONG L, XU W, et al. Discovery of potential prognostic long non-coding RNA biomarkers for predicting the risk of tumor recurrence of breast cancer patients[J]. Sci Rep, 2016, 6: 31038.
[40] PICKARD M R, WILLIAMS G T. Regulation of apoptosis by long non-coding RNA GAS5 in breast cancer cells: implications for chemotherapy[J]. Breast Cancer Res Treat, 2014, 145(2): 359-370.
[41] VAN AGTHOVEN T, DORSSERS L C, LEHMANN U, et al. Breast cancer anti-estrogen resistance 4 (BCAR4) drives proliferation of IPH-926 lobular carcinoma cells[J]. PLoS One, 2015, 10(8): e0136845.
Research progress of long non-coding RNA related to breast cancer
LIU Lei1,2,WU Jiong1
(1. Department of Breast Surgery, Fudan University Shanghai Cancer Center, Department of Oncology, Shanghai Medical College, Fudan University, Shanghai 200032, China; 2. Department of Breast Surgery, the Second Affiliated Hospital to Nanchang University, Nanchang 330006, Jiangxi Province, China)
Long non-coding RNA (lncRNA) is a group of functional RNA molecules, which is more than 200 nucleotides in length, lacks ability of encoding protein and participates in all aspects of gene regulation. The current studies have indicated that some lncRNAs take part in regulating the process of breast cancer tumorigenesis and progression. This article reviewed the abnormal expression of lncRNA in breast cancer, its relationship to breast cancer growth, apoptosis, invasion and metastasis, and its function in early diagnosis, drug resistance and prognosis of breast cancer. This review was expected to offer an insight into a new target for the prediction, diagnosis and individual treatment of breast cancer.
Long non-coding RNA; Breast cancer; Tumorigenesis; Progression; Molecular marker
WU Jiong E-mail: wujiong1122@vip.sina.com
10.19401/j.cnki.1007-3639.2017.08.011
R737.9
A
1007-3639(2017)08-0668-07
2017-02-27
2017-04-18)
吴 炅 E-mail: wujiong1122@vip.sina.com
