过氧化物还原酶Ⅱ在胃癌中的表达及临床病理意义
2017-09-21牛林军马高磊顾玉明
牛林军,徐 浩,马高磊,顾玉明
1.徐州医科大学研究生学院,江苏 徐州 221004;2.徐州医科大学附属医院介入放射科,江苏 徐州 221002
过氧化物还原酶Ⅱ在胃癌中的表达及临床病理意义
牛林军1,徐 浩1,马高磊1,顾玉明2
1.徐州医科大学研究生学院,江苏 徐州 221004;2.徐州医科大学附属医院介入放射科,江苏 徐州 221002
背景与目的:过氧化物还原酶Ⅱ(peroxiredoxin Ⅱ,PrxⅡ)是具有过氧化物酶活性的蛋白,相关研究提示其参与多种恶性肿瘤的发生、发展。该实验通过研究人类胃癌组织及细胞中的PrxⅡ的表达情况,分析其与胃癌临床病理特征的关系,探讨其与胃癌发生、发展及预后的关系。方法:采用实时荧光定量聚合酶链反应(real-time fl uorescent quantitative polymerase chain reaction,RTFQ-PCR)和蛋白[质]印迹法(Western blot)检测45例胃癌患者的癌组织及相应的癌旁组织、胃正常细胞(GES-1)及胃腺癌细胞(MGC-803、MKN-45和MKN-28)的PrxⅡ mRNA及蛋白表达情况。应用免疫组织化学S-P法检测胃癌组织芯片中116例胃癌患者癌组织及癌旁组织的Prx Ⅱ的表达量,分析Prx Ⅱ表达与胃癌临床病理特征的关系并做生存分析。结果:RTFQ-PCR和Western blot检测结果显示,胃癌组织中PrxⅡ mRNA及蛋白表达水平明显高于相应的癌旁组织(P<0.05)。胃癌细胞中PrxⅡ mRNA及蛋白表达水平明显高于胃正常细胞(P<0.01)。免疫组织化学结果显示,胃癌组织中PrxⅡ蛋白的表达阳性率(76.7%)同样明显高于相应癌旁组织(30.1%,P<0.01)。PrxⅡ蛋白表达与胃癌的肿瘤大小、分化程度、浸润深度、TNM分期及淋巴结转移密切相关(P<0.05),而与患者的性别、年龄、肿瘤部位及远处转移无关(P>0.05)。PrxⅡ蛋白高表达者的生存时间要显著低于低表达者(P<0.01),Prx Ⅱ是影响胃癌预后的独立危险因素。结论:PrxⅡ促进胃癌的发生、发展,是胃癌的不良预后因素,其研究可能为胃癌的治疗提供新的靶点。
过氧化物还原酶Ⅱ;胃癌;实时荧光定量聚合酶链反应;组织芯片
胃癌是常见的恶性肿瘤之一,世界及中国范围内胃癌死亡率在恶性肿瘤中都位居第三位[1-2]。尽管近年来胃癌的治疗方法(如手术、放疗、化疗及靶向治疗)取得了明显的进步,但其5年生存率仍只有20%~30%,其原因与胃癌高度恶性及生物学的复杂性密切相关[3-5]。有研究表明,许多肿瘤抑制物的下调或致癌基因参与了胃癌的发展[6],但对其分子发病机制仍然知之甚少。因此,加强对胃癌的病理机制的研究是当前胃癌研究的迫切任务。过氧化物还原酶Ⅱ(peroxiredoxin Ⅱ,PrxⅡ)属于抗氧化蛋白超家族,它们广泛存在于原核和真核生物中并维持体内氧化还原态的稳定[7]。据报道,PrxⅡ在人类肝癌[8]、肾癌[9]、肺癌[10]及乳腺癌[11]等恶性肿瘤中高表达,并证实其参与肿瘤的发生、发展。因此,本研究通过检测人类胃癌组织及细胞的PrxⅡ的表达情况,探讨其与胃癌发生、发展及预后的关系。
1 材料和方法
1.1 材料
选取徐州医科大学附属医院肿瘤外科及肝胆外科2015年9月—2016年1月的45例胃癌手术标本,45例胃癌患者术前均未接受任何抗肿瘤治疗且均为腺癌,术后均经病理证实。所有组织标本均于样本离体后立即取材,每份标本分别取癌组织和癌旁组织,癌旁组织取自距癌组织边缘5 cm以上的胃组织。标本用液氮速冻后于-80 ℃冰箱中保存用于提取组织总蛋白及总RNA。选取2009年1月—2010年12月于徐州医科大学附属医院肿瘤外科及肝胆外科行根治性手术的116例胃癌患者手术标本蜡块制成胃癌组织芯片。116例胃癌患者临床病理资料完整。手术病理诊断明确为胃癌,可以随访到。其中男性78例,女性38例,年龄25~85岁,中位年龄59岁。
1.2 主要试剂
GES-1、MGC-803、MKN-45和MKN-28细胞株购买自中国科学院上海生命科学研究院生物化学与细胞生物学研究所细胞库,PrxⅡ兔抗人多克隆抗体购自美国Bioworld公司,RNA提取试剂TRIzol购自美国Invitrogen公司,实时荧光定量聚合酶链反应(real-time fluorescent quantitative polymerase chain reaction,RTFQPCR)试剂盒购自宝日医生物技术(北京)有限公司,免疫组织化学试剂盒、浓缩型DAB试剂盒购自北京中杉金桥生物技术有限公司。
1.3 RNA提取及RTFQ-PCR检测
按照TRIzol试剂说明书操作提取组织及细胞总RNA,紫外分光光度计检测其浓度及D260nm/D280nm比值。取总RNA 3 µg,按照PrimeScriptTMRT Master Mix[宝生物工程(大连)有限公司]反转录试剂盒说明书合成cDNA,然后通过美国ABI公司的7500型荧光定量PCR仪进行RTFQ-PCR检测,PrxⅡ基因上游引物序列为5’-GTGTCCTTCGCCAGATCACT-3’,下游引物序列为5’-AAACTTCCCCATGCTCGTCT-3’;GAPDH基因作为内参对照,上游引物序列为5’-GCAAATTCCATGGCACCGT-3’,下游引物序列为5’-TCGCCCCACTTGATTTTGG-3’。RTFQ-PCR反应体系为10 µL,反应条件:95 ℃ 30 s,95 ℃ 5 s,60 ℃ 34 s,共40个循环。样本均设3个复孔。采用相对定量的方法,取2-△△CT值进行比较。
1.4 蛋白[质]印迹法(Western blot)检测
一定量的细胞及组织加裂解液,冰浴制匀浆后提取总蛋白,二喹啉甲酸(BCA)试剂盒测定蛋白浓度,取适量蛋白质样品后电泳、转膜。硝酸纤维素(NC)膜在5%的脱脂牛奶中封闭1.5 h,然后加入Prx Ⅱ一抗温育,4 ℃过夜后二抗室温温育2 h,TBST洗膜后避光拍照,实验重复3次。用Image J灰度分析软件分析相应灰度值判断目的蛋白的表达水平。
1.5 免疫组织化学S-P法及结果判定
具体实验操作步骤按照试剂盒说明书进行;以PBS缓冲液替代一抗作为阴性对照,用已知阳性切片作为阳性对照。免疫组织化学结果判断:Prx Ⅱ免疫组织化学以细胞质内出现棕黄色颗粒或棕褐色颗粒为阳性结果。根据染色细胞百分比及着色强度进行评判及分析,着色强度计分:棕褐色为3分,棕黄色为2分,浅棕黄色为1分,无着色为0分。阳性染色细胞数的百分比计分:大于75%为4分,51%~75%为3分,26%~50%为2分,6%~25%为1分,小于5%为0分。两项结果乘积为最后评价结果。在统计分析中将小于等于4分定为阴性表达,将大于4分定为阳性表达。
1.6 统计学处理
运用 SPSS 16.0软件进行统计学分析。计量资料数据采用以表示,差异性采用ANVOA检验或t检验;计数资料的差异性采用Pearsonχ2检验法。对生存数据采用 Kaplan-Meier生存曲线进行分析;两曲线之间的差异采用 Log-rank检验;独立预后因素采用单多因素Cox比例风险模型分析。P<0.05为差异有统计学意义。
2 结 果
2.1 PrxⅡ mRNA在胃癌组织及细胞中的表达
RTFQ-PCR检测结果显示,定义癌旁组织及胃正常细胞PrxⅡ mRNA相对表达量为1,胃癌组织中PrxⅡ mRNA表达量约为癌旁组织的(1.38±0.22)倍,明显高于癌旁组织,差异有统计学意义(P<0.05) ;MGC-803、MKN-45和MKN-28细胞中PrxⅡ mRNA表达量分别约为GES-1细胞的(1.45±0.06)、(1.64±0.15)和(1.26±0.09)倍,差异有统计学意义(P<0.01,图1)。
2.2 Western blot检测PrxⅡ蛋白在胃癌组织及细胞中的表达

图 1 PrxⅡ mRNA在胃癌组织中的相对表达情况Fig. 1 The relative expression of PrxⅡmRNA in gastric cancer tissues
Western blot结果显示,PrxⅡ蛋白在胃癌组织和癌旁组织中的相对表达量分别为0.827±0.168和0.460±0.211,PrxⅡ蛋白在胃癌组织中的表达量明显高于癌旁组织,差异显著,有统计学意义(P<0.05);在GES-1、MGC-803、MKN-45和MKN-28细胞中的相对表达量分别为0.406±0.022、0.677±0.073、0.895±0.041和0.643±0.036,PrxⅡ蛋白在MGC-803、MKN-45和MKN-28细胞中的表达量明显高于GES-1细胞,差异有统计学意义(P<0.01,图2)。
2.3 免疫组织化学检测胃癌及其癌旁组织中PrxⅡ蛋白的表达
免疫组织化学结果显示,在癌旁组织中PrxⅡ蛋白多呈现出低表达或阴性表达,而癌组织多为细胞质内均匀分布的棕褐色颗粒(图3)。癌组织阳性表达率为76.7%(89/116),癌旁组织阳性表达率为30.1%(27/116),癌组织中PrxⅡ蛋白阳性表达率显著高于癌旁组织,差异有统计学意义(χ2=50.516,P<0.01)。
2.4 PrxⅡ蛋白表达与胃癌临床病理因素的关系
PrxⅡ蛋白表达与胃癌临床病理因素的关系:胃癌组织中,PrxⅡ蛋白表达与肿瘤大小、肿瘤分化程度、浸润深度、TNM分期及淋巴结转移相关,差异有统计学意义(P<0.05), 而与患者的性别、年龄、肿瘤部位及远处转移无关,差异无统计学意义(P>0.05,表1)。

图 2 PrxⅡ蛋白在胃癌组织中的相对表达情况Fig. 2 The relative expression of PrxⅡprotein in gastric cancer tissues

图 3 免疫组织化学法检测PrxⅡ蛋白在胃癌组织及癌旁组织中的表达Fig. 3 Detection of PrxⅡprotein expression in non-cancerous gastric tissues or gastric cancer tissues by immunohistochemistry

表 1 胃癌组织中PrxⅡ蛋白表达与胃癌临床病理因素的关系Tab. 1 The correlation between the protein expression of PrxⅡand clinical pathological parameters in gastric cancertissues [n(%)]
2.5 PrxⅡ蛋白表达情况与总生存期(overall survival,OS)、无病生存期 (disease-free survival,DFS)之间的生存分析
PrxⅡ蛋白表达情况与OS、DFS之间的关系采用Kaplan-Meier法生存分析,两曲线之间的差异采用log-rank检验。分析结果显示,PrxⅡ蛋白阳性患者的术后OS、DFS显著低于PrxⅡ蛋白阴性患者,差异有统计学意义(P<0.01,图4)。
2.6 PrxⅡ蛋白表达及各临床病理参数与胃癌患者OS的关系
通过Cox比例风险模型来分析实验结果,结果显示,PrxⅡ蛋白表达、浸润深度、TNM分期、淋巴结转移及远处转移是影响胃癌预后的独立危险因素(P<0.05,表2)。在研究与DFS的关系时得到了相同的结论。
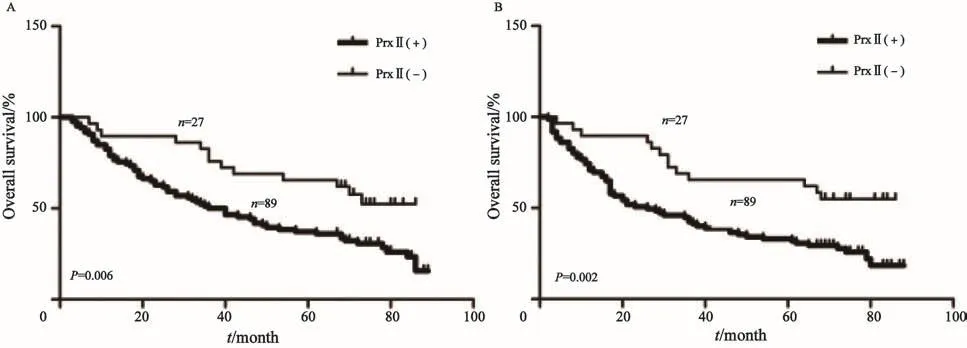
图 4 PrxⅡ蛋白表达水平与患者OS、DFS之间的生存关系Fig. 4 The relationship between PrxⅡprotein expression and OS, DFS of the patients

表 2 单因素和多因素Cox比例风险模型分析Tab. 2 Univariable and multivariable analysis of predictors of overall survival in gastric cancer patients.
3 讨 论
哺乳动物的Prxs家族包括PrxⅠ~Ⅵ共6个成员,根据半胱氨基酸残基(cysteine,Cys)的数目及其保守性将Prxs家族成员分为1-Cys Prx和2-Cys Prx,PrxⅡ属于2-Cys Prx[12]。PrxⅡ广泛参与细胞的增殖与凋亡、迁移、分化及信号转导等多种功能活动。据报道,PrxⅡ的高表达可减轻由甲状腺激素诱导产生的H2O2导致的细胞凋亡[13];PrxⅡ基因下降可导致体内H2O2增多,导致由PDFG介导的细胞增殖和迁移能力增强[14];Kang等[15]发现高表达的PrxⅡ可通过抑制核因子NF-κB的活化来参与细胞的分化和凋亡。
本研究前期结果显示,通过RTFQ-PCR、Western blot及免疫组织化学S-P实验检测胃癌细胞及组织中PrxⅡ mRNA及蛋白的表达量,发现其明显高于正常胃细胞及对应的癌旁组织。相关报道表明,PrxⅡ在人类多种恶性肿瘤中高表达[8-11],将细胞快速置于亚致死的氧化状态下不能引起PrxⅡ的明显增加或降低,但若置于严重的氧化状态下则可导致PrxⅡ增加、细胞内氧化还原状和过氧化作用加剧[16],表明其高表达可能与恶性肿瘤组织内的持久氧化状态有关。
通过进一步分析表明,PrxⅡ蛋白表达与胃癌的分化过程、侵袭、迁移及预后密切相关。此外,通过Cox比例风险模型分析数据表明,PrxⅡ蛋白表达、浸润深度、TNM分期、淋巴结转移及远处转移是影响胃癌预后的独立危险因素。PrxⅡ促进胃癌发生、发展的机制尚不明确,可能与活性氧(reactive oxygen species,ROS)密切相关。ROS及其引发的氧化应激在胃癌发生中的作用受到越来越多的关注,其在体内的致癌作用已为越来越多的研究所证实[17],高表达的PrxⅡ可能通过减少ROS,增强肿瘤的抗氧化能力,从而促进肿瘤的发生、发展。此外, Park等[8]发现 PrxⅡ可以通过Ras/FoxM1信号通路调节肝癌细胞的增殖;Leak等[18]利用过表达PrxⅡ的转基因小鼠研究表明,PrxⅡ可以通过多聚ADP核糖多聚酶1介导的细胞死亡和p53基因介导的细胞来发挥作用。这些都说明PrxⅡ促进胃癌的发展可能有多种途径存在。本实验表明了PrxⅡ基因可能是一个潜在的基因治疗靶点,但本实验仅是初步探讨了PrxⅡ与胃癌的关系,今后尚须在动物实验中验证。而且,PrxⅡ通过何种机制促进胃癌的发生、发展也需要进一步的深入研究。
[1] 陈万青, 郑荣寿, 张思维, 等. 2012年中国恶性肿瘤发病和死亡分析[J]. 中国肿瘤, 2016, 25(1): 1-8.
[2] YUAN D D, ZHU Z X, ZHANG X, et al. Targeted therapy for gastric cancer: current status and future directions (Review)[J]. Oncol Rep, 2016, 35(3): 1245-1254.
[3] CHEAH I K, FENG L, TANG R M, et al. Biochemical and biophysical research communications ergothioneine levels in an elderly population decrease with age and incidence of cognitive decline; a risk factor for neurodegeneration?[J]. Biochem Biophys Res Commun, 2016, 478(1):162-167.
[4] MEMON M A, SUBRAMANYA M S, KHAN S, et al. Meta-analysis of D1 versus D2 gastrectomy for gastric adenocarcinoma[J]. Ann Surg, 2011, 253(5): 900-911.
[5] CALCAGNO D Q, DE ARRUDA CARDOSO SMITH M, BURBANO R R. Cancer type-speci fi c epigenetic changes:gastric cancer[J]. Methods Mol Biol, 2015, 1238: 79-101.
[6] GRABSCH H I, TAN P. Gastric cancer pathology and underlying molecular mechanisms[J]. Dig Surg, 2013, 30(2): 150-158.
[7] PERKINS A, NELSON K J, PARSONAGE D, et al. Peroxiredoxins: guardians against oxidative stress and modulators of peroxide signaling[J]. Trends Biochem Sci, 2015, 40(8): 435-445.
[8] PARK Y H, KIM S U, KWON T H, et al. Peroxiredoxin Ⅱpromotes hepatic tumorigenesis through cooperation with Ras/Forkhead box M1 signaling pathway[J]. Oncogene, 2016, 35(27): 3503-3513.
[9] SOINI Y, KALLIO J P, HIRVIKOSKI P, et al. Oxidative/ nitrosative stress and peroxiredoxin 2 are associated with grade and prognosis of human renal carcinoma[J]. APMIS, 2006, 114(5): 329-337.
[10] LEHTONEN S T, SVENSK A M, SOINI Y, et al. Peroxiredoxins, a novel protein family in lung cancer[J]. Int J Cancer, 2004, 111(4): 514-521.
[11] KARIHTALA P, MANTYNIEMI A, KANG S W, et al. Peroxiredoxins in breast carcinoma[J]. Clin Cancer Res, 2003, 9(9): 3418-3424.
[12] OW S H, CHUA P J, BAY B H. Epigenetic regulation of peroxiredoxins: Implications in the pathogenesis of cancer[J]. Exp Biol Med (Maywood), 2017, 242(2): 140-147.
[13] KIM H, LEE T H, PARK E S, et al. Role of peroxiredoxins in regulating intracellular hydrogen peroxide and hydrogen peroxide-induced apoptosis in thyroid cells[J]. J Biol Chem, 2000, 275(24): 18266-18270.
[14] CHOI M H, LEE I K, KIM G W, et al. Regulation of PDGF signalling and vascular remodelling by peroxiredoxin Ⅱ[J]. Nature, 2005, 435(7040): 347-353.
[15] KANG S W, CHAE H Z, SEO M S, et al. Mammalian peroxiredoxin isoforms can reduce hydrogen peroxide generated in response to growth factors and tumor necrosis factor-alpha[J]. J Biol Chem, 1998, 273(11): 6297-6302.
[16] LEHTONEN S T, MARKKANEN P M, PELTONIEMI M, et al. Variable overoxidation of peroxiredoxins in human lung cells in severe oxidative stress[J]. Am J Physiol Lung Cell Mol Physiol, 2005, 288(5): 997-1001.
[17] MARENGO B, NITTI M, FURFARO A L, et al. Redox homeostasis and cellular antioxidant systems: crucial players in cancer growth and therapy[J]. Oxid Med Cell Longev, 2016, 2016(22):1-16.
[18] LEAK R K, ZHANG L, LUO Y, et al. Peroxiredoxin 2 battles poly (ADP-ribose) polymerase 1- and p53-dependent prodeath pathways after ischemic injury[J]. Stroke, 2013, 44(4): 1124-1134.
Expression and clinicopathologic signi fi cance of peroxiredoxin Ⅱ in gastric cancer
NIU Linjun1, XU Hao1, MA Gaolei1, GU Yuming2
(1. Graduate School, Xuzhou Medical College, Xuzhou 221004, Jiangsu Province, China; 2. Department of Interventional Radiology, the Affiliated Hospital of Xuzhou Medical College, Xuzhou 221002, Jiangsu Province, China)
Background and purpose:Peroxiredoxin Ⅱ (PrxⅡ) has the activity of peroxidase. The relevant studies found it played an important role in gastric cancer. This study aimed to investigate the expression of PrxⅡ in human gastric cancer tissues and cells, analyze its relationship with clinicopathological characteristics, and explore the relationship between PrxⅡ and the prognosis and the development of gastric cancer.Methods:The expression of PrxⅡmRNA and protein in gastric cancer tissues and the paired adjacent normal tissues from 45 patients was detected by real-time fl uorescent quantitative polymerase chain reaction (RTFQ-PCR) and Western blot. The same methods were used to detect the expression of PrxⅡ mRNA and protein in GES-1, MGC-803, MKN-45 and MKN-28. Tissue microarray and immunohistochemistry were used to detect the expression of PrxⅡ protein in gastric cancer tissues and the paired adjacent normal tissues from 116 patients. The relationship between the results and clinicopathological characteristics was analyzed. The prognosis was analyzed.Results:According to results of RTFQ-PCR and Western blot, we found that PrxⅡ mRNA and protein in gastric cancer tissues were signi fi cantly higher than that in adjacent normal tissues (P<0.05). PrxⅡ mRNA and protein in gastric cancer cells were higher than that in normal gastric cells (P<0.01).Immunohistochemistry revealed that the expression of PrxⅡ protein in gastric cancer tissues (76.7%) was also significantly higher (P<0.01) than that in adjacent normal tissues (30.1%). The expression of PrxⅡ protein is signi fi cantly related to tumor size, histological di ff erentiation, depth of invasion, TNM stage and lymph node metastasis (P<0.05), but had no signi fi cant relationship with the gender, age, tumor location and distant metastasis. Survival in patients with higher PrxⅡ expression signi fi cantly shorter than in those with lower expression (P<0.01). PrxⅡ is an independent prognostic factor of gastric cancer (P<0.05).Conclusion:PrxⅡ promotes the development of gastric cancer. It is one of the adverse prognostic factors of gastric cancer and may serve as a new therapeutic target for gastric cancer.
Peroxiredoxin Ⅱ; Gastric cancer; Real-time fl uorescent quantitative polymerase chain reaction; Tissue microarray
GU Yuming E-mail: guyuming_2006@163.com
10.19401/j.cnki.1007-3639.2017.08.007
R735.2
A
1007-3639(2017)08-0641-07
2017-02-10
2017-04-25)
顾玉明 E-mail: guyuming_2006@163.com
