基于ITS2序列的维吾尔药材神香草鉴定研究△
2017-09-21杨珺樊丛照李晓瑾
杨珺,樊丛照,李晓瑾*
(1.昌吉职业技术学院药学院,新疆 昌吉 831100;2.新疆维吾尔自治区中药民族药研究所 国家中医药管理局新疆中药民族药资源重点实验室,新疆 乌鲁木齐 830002)
·基础研究·
基于ITS2序列的维吾尔药材神香草鉴定研究△
杨珺1,樊丛照2,李晓瑾2*
(1.昌吉职业技术学院药学院,新疆 昌吉 831100;2.新疆维吾尔自治区中药民族药研究所 国家中医药管理局新疆中药民族药资源重点实验室,新疆 乌鲁木齐 830002)
目的:采用DNA条形码技术建立维吾尔药材神香草鉴别的方法。方法:使用DNA条形码ITS2序列,建立了维吾尔药材神香草基原植物DNA条形码ITS2序列标准数据库,对市售11份“神香草”药材进行鉴定。结果:市售神香草药材仅有2份为维吾尔药材标准中收录的硬尖神香草,1份为神香草属植物,1份为鼠尾草属植物,其余7份来源于荆芥属植物。结论:DNA条形码ITS2序列可作为鉴定维吾尔药材神香草及其伪品药材的有效工具。
神香草;ITS2;鉴定;DNA条形码
维吾尔常用药材神香草,维吾尔语名“祖帕”,维吾尔药材标准中记载其基原植物为唇形科(Lamiaceae)多年生草本植物硬尖神香草H.cuspidatus,其全草均可入药,维医广泛用其治疗气管炎的咳嗽、气喘、感冒发烧和风湿等病证[1-4]。目前硬尖神香草多为野生,由于资源短缺,使市场供应不足而出现混淆品,主要为大苞荆芥Nepetabracteata[5]。大苞荆芥维吾尔语名亦为“祖帕”,易与硬尖神香草混淆,但其化学成分,药性及作用功效与硬尖神香草存在显著差异[6-7],误用会危害患者的生命健康。针对市场上出现的混淆品,已有研究者采用性状、显微及理化鉴别等方法对硬尖神香草与大苞荆芥进行了鉴定[5],虽然为维吾尔药材神香草的质量控制提供了一定的依据,但这些鉴定方法需要很强的专业性,不适于推广应用。
相比之下,DNA条形码技术[8]能够实现快速、准确和自动化的物种鉴定,适用于非专业工作者。2011年,中国植物条形码工作组(Chinese Plant BOL Group)建议将ITS/ITS2序列作为种子植物的核心DNA条形码[9]。ITS2序列作为药材鉴别的DNA条形码,已被载入《中华人民共和国药典》2010版第三增补本[10]和2015版[11],在常用中药民族药材红景天[12]、枸杞[13]、蜀葵[14]等药材真伪鉴别中得到验证。
1 材料与方法
1.1实验材料
此研究中所使用的16份神香草属植物样本采自新疆不同地区,包括11份硬尖神香草及5份大花神香草,由新疆中药民族药研究所副研究员王果平鉴定,凭证标本保存于新疆中药民族药研究所标本馆(新疆XTNM);自市场收集11份“神香草”药材样品。神香草基原植物样本ITS2单倍型序列已提交至GenBank(表1)。

表1 实验材料信息
1.2试剂
PCR扩增所用引物由生工生物工程合成,ITS2正向序列:5’-ATGCGATACTTGGTGTGAAT-3’,反向:5’-GACGCTTCTCCAGACTACAAT-3’;DNA提取试剂盒(DP305-03)、DNA聚合酶及dNTP等均购自天根生物(TIANGEN)。
1.3实验仪器
实验所使用的DNA提取研磨仪为GRINDER,型号GT-100;离心机为上海安亭科学仪器,型号AnkerTGL-16C;PCR扩增仪为AnAnalytikJenacompany,型号070-851。
1.4方法
1.4.1DNA提取及检测 称取干燥药材(枝叶)30mg,DNA提取研磨仪1000r·min-1研磨2min,植物DNA提取试剂盒提取总DNA,1%琼脂糖凝胶电泳检测基因组DNA的质量。
1.4.2PCR扩增及测序 反应体积25μL,dNTP0.4μL(10mmol·L-1),PCR缓冲液2.5μL(10×),引物各1.0μL(2.5μmol·L-1),聚合酶1.0U,总DNA1μL(约30ng)。引物ITS2扩增程序:94℃,变性5min;94℃变性30s,56℃退火30s,72℃延伸45s(40个循环);72℃延伸10min[15]。PCR扩增产物经琼脂糖电泳检测并纯化后,使用ABI3730XL(AppliedBiosystemsCo.,USA)测序仪由美吉生物测序公司进行双向测序。
1.5数据处理
测序峰图用CodonCodeAlignerV4.0.4(CodonCodeCo.,USA)校对拼接,去除引物区。将所有序列由软件MEGA5.0(molecularevolutionarygeneticsanalysis)分析比对[16],ITS2序列基于隐马尔可夫模型的HMMer注释方法,去除两端5.8S和28S区段获得ITS2间隔区序列[17],用邻接(NJ)构建系统聚类树,使用bootstrap(1000次重复)检验各分支的支持率[18]。
1.6BLAST鉴定
将测序获得的药材样本序列在GenBank数据库(https://blast.ncbi.nlm.nih.gov/Blast)进行BLAST鉴定,搜索相似性最高的植物序列。
2 结果
2.1序列信息分析
ITS2序列分析结果显示,硬尖神香草为2个单倍型,长度均为219bp,GC含量变化为68.0%~68.5%;大花神香草单倍型数为2,长度为219bp,GC含量为68.0%;11个药材样本有7个单倍型,其中编号为YC130006、YC130008、YC130011为同一单倍型,编号YC130007与YC130010序列一致,YC130005与YC130009一致。
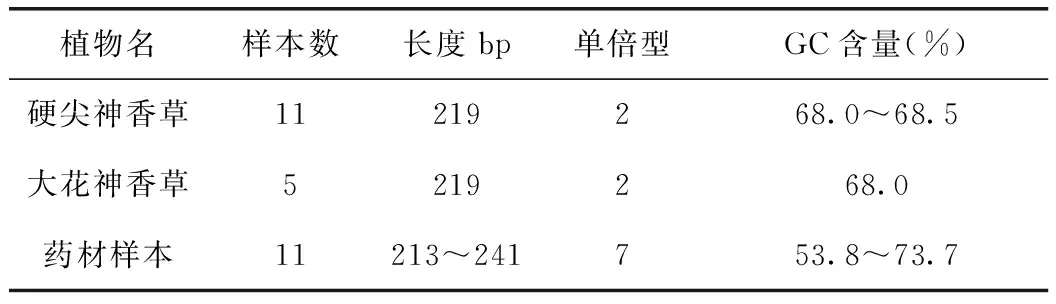
表2 ITS2序列信息
2.2种内及种间变异位点分析
16份植物样本中,硬尖神香草种内存在1个变异位点,为187bp位点的A-C变异,大花神香草种内有2个变异位点,分别为164bp位点的C-T变异及187bp位点的A-C变异,硬尖神香草与大花神香草种间差异不显著。在7个单倍型的神香草药材序列中,编号为YC130001的药材与硬尖神香草相似,编号为YC130009的药材序列与硬尖神香草一致,其余序列均与硬尖神香草之间变异较大。
2.3ITS2序列BLAST鉴定结果
11条药材序列GenBank数据库BLAST结果如表3所示,仅编号为YC130001、YC130005及YC130009的药材与神香草属植物序列相似度较高,其中标号为YC130005及YC130009的药材与硬尖神香草一致,判定为正品药材,编号为YC130001的药材来源于神香草属其他植物。编号为YC130004的药材来源于鼠尾草属植物,其余7份药材均来源于荆芥属植物。
2.4神香草属植物及药材NJ树鉴定结果
基于硬尖神香草、大花神香草及药材单倍型序列构建NJ鉴别树,结果如图2所示,仅编号为YC130001及YC130009的药材与硬尖神香草及同属植物聚在一起,支持率为99%;编号为YC130002、YC130003、YC130006及YC130007的药材聚为一支;YC130004的药材单独为一支。

图1 不同单倍型实验样本种内及种间变异位点比较

药材编号相似度最高植物拉丁名相似度最高植物GenBank登录号中文名相似度(%)YC130001H.cuspidatusKF454217神香草属植物95YC130002NepetabinaloudensisAJ515311荆芥属的一种92YC130003NepetaassurgensAJ515316荆芥属的一种93YC130004SalviadaghestanicaKU563878鼠尾草属的一种89YC130005H.cuspidatusKF454217硬尖神香草100YC130006NepetaassurgensAJ515316荆芥属的一种94YC130007NepetaassurgensAJ515316荆芥属的一种93YC130008NepetaassurgensAJ515316荆芥属的一种94YC130009H.cuspidatusKF454217硬尖神香草100YC130010NepetaassurgensAJ515316荆芥属的一种94YC130011NepetaassurgensAJ515316荆芥属的一种94
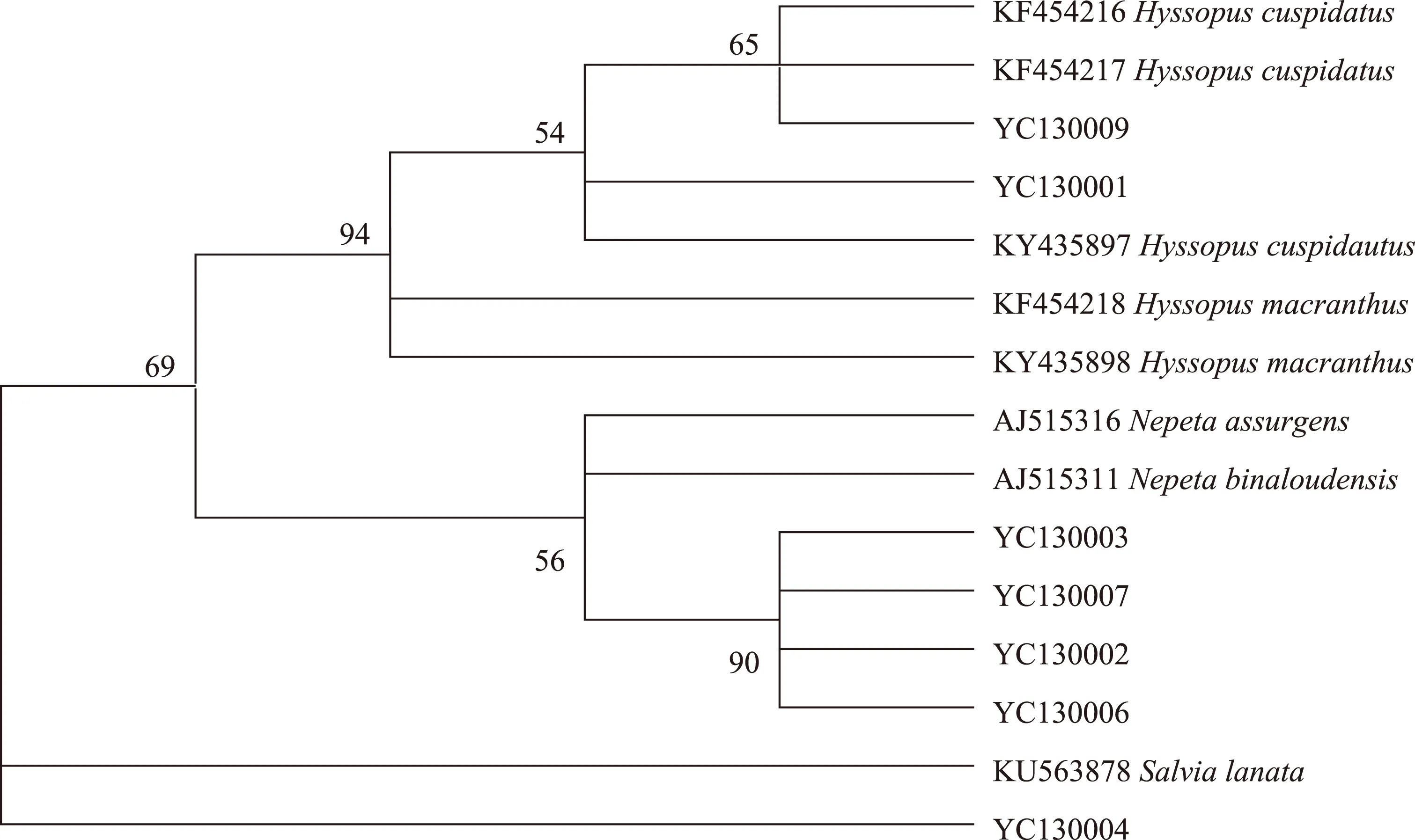
图2 基于ITS2序列的单倍型NJ鉴别树,在图中显示分支支持率(≥50%,bootstrap 1000次重复)
3 讨论
本研究首次采用DNA条形码技术对市售维吾尔药材“神香草”进行鉴定,与以往的鉴定方法相比,DNA条形码鉴定不需要样本性状完整,仅需要微量的入药部位即可。研究结果表明,从维吾尔药材“神香草”药用部位枝叶中可成功提取基因组DNA,其DNA质量可满足DNA条形码鉴定的需求。
本研究以多途径来源的硬尖神香草及大花神香草植物ITS2序列建立了鉴定数据库,将市售药材中获得的ITS2序列与鉴定数据库比对,虽然NJ树鉴定结果显示,编号为YC130001及YC130009的药材均与硬尖神香草基原植物聚在一起,但NJ树并不能完全鉴定植物种,进一步BLAST鉴定结果表明,编号为YC130009的药材来源于硬尖神香草,编号为YC130001的药材来源于神香草属其他植物;大花神香草由于其资源分布有限,作为药材的可能性较小。
在GenBank中经过BLAST对比,11份药材样品中有7份与荆芥属植物相似度较高,因此推测此7份药材可能为报道的大苞荆芥,大苞荆芥维吾尔语名为祖帕,与神香草维语同名,使得神香草药材来源混乱,市场伪品及混淆品数量多。此外,编号为YC130004的药材经比对与鼠尾草属植物,可由此判断市场上存在使用鼠尾草属植物充当神香草的现象。
DNA条形码在已经在植物分类及草药鉴定等诸多领域广泛的应用[19-22],本文将DNA条形码应用到维吾尔药材鉴定领域,应用此技术成功鉴定出市售药材神香草的真伪,随着研究的深入,相信DNA条形码技术会不断应用于其他维吾尔药材鉴定领域,为维吾尔药材的真伪鉴别提供一个可靠的技术手段,以保障药材的正确性,保护使用者的利益,同时有利于药材监管部门对进出口维吾尔药材进行监测。
[1] 中华人民共和国卫生部药典委员会.中华人民共和国药品标准·维药分册[S].乌鲁木齐:新疆科技卫生出版社,1999:78.
[2] 新疆维吾尔自治区食品药品监督管理局.新疆维吾尔自治区中药维吾尔药饮片炮制规范[S].乌鲁木齐:新疆人民卫生出版社,2010:220.
[3] 刘勇民.维吾尔药志[M].乌鲁木齐:新疆科技卫生出版社,1999:423-429.
[4] 国家中医药管理局《中华本草》编委会.中华本草:第7册[M].上海:上海科学技术出版社,1999:52-53.
[5] 徐芳,赵军,谭为,等.维药硬尖神香草与其混淆品大苞荆芥的生药学鉴别[J].中国药房,2012,23(35):3321-3323.
[6] 《中国医学百科全书》编辑委员会.中国医学百科全书(维吾尔医学)[M].上海:上海科学技术出版社,2005:229.
[7] 阿提坎木·瓦合甫,热娜·卡斯木,丛媛媛,等.神香草与大苞荆芥体外抗氧化活性研究[J].中国实验方剂学杂志,2014,20(5):106.
[8] Kress W J,Wurdack K J,Zimmer E A,et al.Use of DNA barcodes to identify flowering plants[J].Proc Natl Acad Sci U S A,2005,102(23):8369-8374.
[9] De-Zhu L,Lian-Ming G,Hong-Tao L,et al.Comparative analysis of a large dataset indicates that internal transcribed spacer (ITS) should be incorporated into the core barcode for seed plants[J].Proc.Natl.Acad.Sci.USA,2011,108(49):19641-19646.
[10]国家药典委员会.中华人民共和国药典:一部·第三增补本[S].北京:中国医药科技出版社,2010:92-94.
[11]国家药典委员会.中华人民共和国药典:四部[S].北京:中国医药科技出版社,2015:383-384.
[12]Tianyi Xin,Xiaojin Li,Shilin Chen,et al.Survey of commercial Rhodiola products revealed species diversity and potential safety issues[J].Scientific reports,2015,5:8337.
[13]T.Y.Xin,H.Yao,S.L.Chen et al.Super food Lycium barbarum (Solanaceae) traceability via an internal transcribed spacer 2 barcode[J].Food Research International,2013,54:1699-1704.
[14]樊丛照,坤肚子·阿依,李晓瑾.基于ITS2序列的维吾尔药材蜀葵及其近缘种鉴定研究[J].中国现代中药,2016,18(10):1077-1081.
[15]陈士林.中药DNA条形码分子鉴定[M].北京:人民卫生出版社,2012:14.
[16]Tamura K.,Peterson D.,Peterson N,et al.MEGA5:molecular evolutionary genetics analysis using maximum likelihood,evolutionary distance,and maximum parsimony methods[J].Mol Biol Evol,2011,28(10):2731-2739.
[17]Keller A,Schleicher T,Schultz J,et al.5.8S-28S rRNA interaction and HMM-based ITS2 annotation[J].Gene,2009,430(1):50-57.
[18]Koetschan C,Hackl T,Müller T,et al.ITS2 Database IV:Interactive taxon sampling for internal transcribed spacer 2 based phylogenies[J].Mol Phylogenet Evol,2012,63(3):585-588.
[19]Stoeckle MY,Gamble CC,Kirpekar R.,et al.Commercial teas highlight plant DNA barcode identification successes and obstacles[J].Sci.Rep.2011,1(7):42.
[20]Newmaster S.G.,Grguric M.,Shanmughanandhan D.,et al.DNA barcoding detects contamination and substitution in North American herbal products[J].BMC Med.,2013,11:222.
[21]Kool A,de Boer H J,Martin G.,et al.Molecular identification of commercialized medicinal plants in southern Morocco[J].PLoS ONE,2012:e39459.
[22]Di Pinto A.,Di Pinto P.,Terio V.,et al.DNA barcoding for detecting market substitution in salted cod fillets and battered cod chunks[J].Food Chem.2013,141(3):1757-1762.
StudyonOriginPlantofUygurMedicineHyssopuscuspidatusBasedonITS2Sequence
YANG Jun1,FAN Congzhao2,LI Xiaojin2*
(1.ChangjivocationalandtechnicalcollegeofPharmacy,Changji,831100China;2.XinjiangInstituteofChineseMateriaMedicaandEthnicalMateria,StateAdministrationoftraditionalChinesemedicineKeyLaboratoryoftraditionalChinesemedicineandethnicmedicineresources,Urumqi830002,China)
Objective:To establish a method for identification of identify the origin plant of Uygur medicineHyssopuscuspidatusby DNA barcode technology.Methods:DNA barcode ITS2 sequence was used to establish a standard database ofH.cuspidatus,and eleven medicinal materials “H.cuspidatus” were authenticated by the identification system.Results:Only two medicinal materials were fromH.cuspidatus,one of them was fromHyssopusgenus,and one was fromSalviagenus,the other 7 samples were fromNepetagenus.Conclusion:ITS2 sequence can be used as an effective barcode to identify Uygur MedicineH.cuspidatusfrom its adulterants.
Hyssopuscuspidatus;ITS2;identification;DNA barcode
新疆维吾尔自治区科技厅高新技术研究发展项目(201517107)
] 李晓瑾,研究员,研究方向:中药资源;Tel:(0991)2665614,E-mail:xjlxj@126.com
10.13313/j.issn.1673-4890.2017.5.006
2017-02-28)
*[
