蓝莓果实中花青素类成分的超声波提取工艺研究△
2017-09-21杨莉李珂珂李沙沙陈书笑陶丽弓晓杰
杨莉,李珂珂,李沙沙,陈书笑,陶丽,弓晓杰
(1.大连大学 环境与化学工程学院,辽宁 大连 116622;2.大连大学 医学院,辽宁 大连 116622)
蓝莓果实中花青素类成分的超声波提取工艺研究△
杨莉1,李珂珂2*,李沙沙2,陈书笑1,陶丽2,弓晓杰2*
(1.大连大学 环境与化学工程学院,辽宁 大连 116622;2.大连大学 医学院,辽宁 大连 116622)
目的:研究超声波提取法提取蓝莓中花青素类成分的工艺方法。方法:采用正交试验,选用L9(34)正交表考察超声波提取法提取时,提取液的甲醇比例、提取液的盐酸含量、提取时间和料液比对蓝莓中花青素类成分提取率的影响。花青素的总含量用HPLC法测定。结果:超声波提取法提取花青素类成分影响因素的大小顺序为盐酸含量>甲醇比例>提取时间>料液比,最佳提取工艺条件为提取液80%甲醇-水溶液,提取液含盐酸0.2%,料液比1 ∶25(g ∶mL),提取时间50 min。结论:采用优化的工艺条件稳定可行,蓝莓中花青素类成分的含量为5.12 mg·g-1。
蓝莓;花青素;超声波提取;正交试验
蓝莓,又名蓝浆果、越橘,为杜鹃花科(Ericaceae)越橘属Vaccinium多年生灌木果树。蓝莓果实风味独特,除富含维生素、蛋白质和矿物质等常规营养成分以外,还富含花青素,并且种类丰富。花青素又称花色素,是一类水溶性黄酮类化合物,广泛存在于被子植物中[1-2]。花青素作为一种天然食用色素,具有较好的营养及药理作用。目前研究表明,蓝莓中花青素类成分具有抗糖尿病作用[3-4]、抗肿瘤作用[5-6]及保护心血管作用[7]等,因此未来在医药应用方面,蓝莓花青素将具有很大的发展前景。
花青素类成分常见的提取方法有溶剂浸提法、微波辅助提取法、超声波辅助提取法等,超声波法作为一种简便快捷的提取方法,已广泛应用于提取实验[8-9]。本文采用超声波提取法,通过正交试验优化蓝莓中花青素的提取工艺,预期为从蓝莓果实中获得较高含量的花青素类成分提供方法参考。
1 仪器与试药
1.1 仪器
高效液相色谱仪[Agilent 1260,Agilent Zorbax Eclipse XDB C18(250 mm×4.6 mm,5 μm),美国安捷伦科技公司];超声波清洗机(SB-5200DTD,宁波新芝生物科技股份有限公司);旋转蒸发仪(EYELA N-1100,上海爱朗仪器有限公司);低温冷却液循环泵(DLSB-5/20,郑州长城科工贸有限公司);电子天平[ME204/02,梅特勒-托利多仪器(上海)有限公司]。
1.2 试药
矢车菊素-3-O-葡萄糖苷 (Cy-glc)(北京恒元启天化工技术研究院);甲醇(色谱纯,美国TEDIA 公司);纯净水(杭州娃哈哈集团有限公司);甲醇、丙酮、甲酸、盐酸(分析纯,天津科密欧化学试剂有限公司);无水乙醇(分析纯,天津市大茂化学试剂厂);蒸馏水为双蒸水。
蓝莓果实(北陆)采自辽宁省大连市亮甲店镇蓝莓种植基地,4 ℃保存。
2 方法和结果
2.1 总花青素含量的测定
总花青素含量的测定采用高效液相色谱法(HPLC)。色谱条件为流速:0.8 mL·min-1;柱温:35 ℃;检测波长:520 nm;进样量:10 μL;流动相:A相为6%甲酸-水,B相为甲醇。洗脱条件:0 min:10%B;30 min:25%B;40 min:45%B。
以矢车菊素-3-O-葡萄糖苷(见图1中色谱峰1)为对照品,花青素总量以矢车菊素-3-O-葡萄糖苷的含量表示。按标准曲线计算总花青素浓度[10]。花青素总量计算式:
Z总=C总× d/W
(1)
式中:Z为花青素总含量(mg·g-1);C为花青素总浓度(mg·mL-1);d为花青素提取液总体积(mL);W为蓝莓样品质量(g)。
2.2 提取方法的确定
本实验首先选用超声法及回流法两种提取方法,通过对比提取物在HPLC中的图谱特征,比较两种提取方法的优劣。
超声提取法的提取条件:准确称取2 g干燥至恒重的蓝莓果于250 mL锥形瓶中,按照料液比1∶10加入20 mL含0.2%盐酸的甲醇,40 ℃、300 W下超声提取30 min,抽滤,滤渣以上述操作重复提取一次,合并两次滤液。将上述滤液在40 ℃下于旋转蒸发仪真空浓缩,用甲醇定容至10 mL容量瓶中,得样品溶液,经0.45 μm微孔滤膜过滤,进样10 μL进行HPLC分析。色谱图见图1A。
回流法的提取条件:准确称取2 g干燥至恒重的蓝莓果于250 mL圆底烧瓶中,加入20 mL含0.2%盐酸的甲醇,70 ℃下回流提取30 min,抽滤,滤渣以上述操作重复提取一次,合并两次滤液,冷却至室温。将上述滤液在40 ℃于旋转蒸发仪真空浓缩,用甲醇定容至10 mL容量瓶中,得样品溶液,经0.45 μm微孔滤膜过滤,进样10 μL进行HPLC分析。色谱图见图1B。
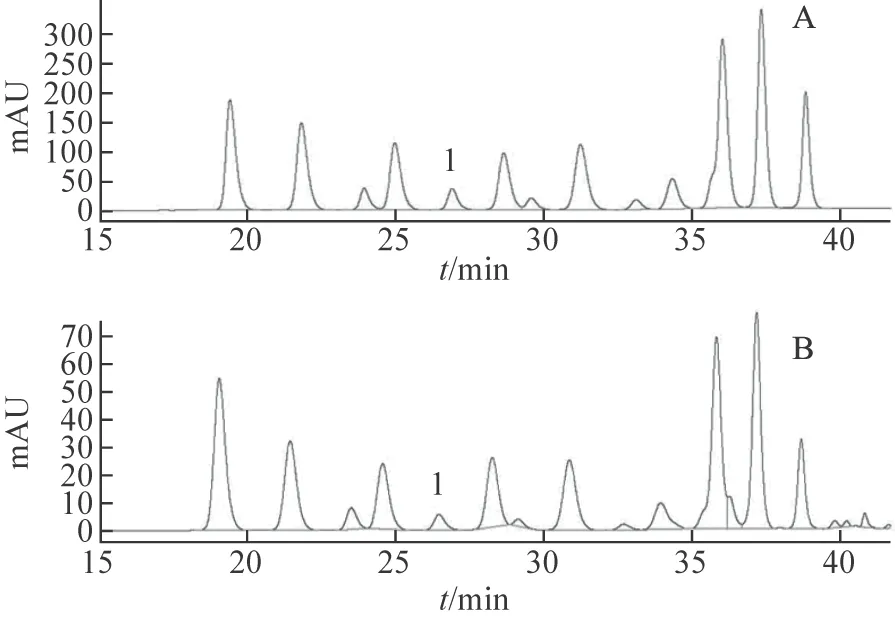
注:A.超声法;B.回流法;峰1为矢车菊素-3-O-葡萄糖苷。图1 超声法和回流法得到蓝莓提取物的色谱图
对比图1A和图1B可知,尽管两者提取出的花青素种类差别不大,但超声法提取时,得到的花青素类化合物的峰面积要明显大于回流法,进一步计算其含量,超声法提取时得到的总花青素含量为4.26 mg·g-1,回流法提取时得到的总花青素含量为1.58 mg·g-1,因此超声法比较适合提取蓝莓花青素类化合物。
2.3 提取溶剂的选择
准确称取2 g干燥至恒重的蓝莓果于250 mL锥形瓶中,分别按照料液比1∶10加入20 mL含0.2%盐酸的甲醇、无水乙醇、蒸馏水、丙酮,40 ℃、300 W下超声提取30 min,抽滤,滤渣以上述操作重复提取一次,合并两次滤液。将上述滤液在40 ℃于旋转蒸发仪真空浓缩,用甲醇定容至10 mL容量瓶中,得样品溶液,经0.45 μm微孔滤膜过滤,进样10 μL进行HPLC分析。结果见图2。
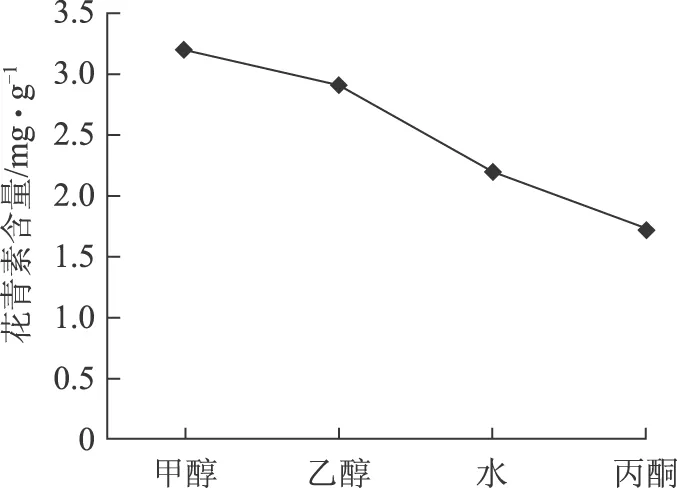
图2 不同提取溶剂对蓝莓花青素提取含量的影响
2.4 提取次数的选择
准确称取2 g干燥至恒重的蓝莓果于250 mL锥形瓶中,按照料液比1∶10加入20 mL含0.2%盐酸的甲醇,40 ℃、300 W下超声提取30 min,抽滤,得滤液。分别以上述操作提取1次、2次及3次,合并滤液。将上述滤液在40 ℃于旋转蒸发仪真空浓缩,用甲醇定容至10 mL容量瓶中,所得溶液经0.45 μm微孔滤膜过滤,进样10 μL进行HPLC分析。
根据测定的结果,提取1次即可提取出绝大部分花青素(4.86 mg·g-1),提取2次基本提取完全(5.06 mg·g-1),提取3次,花青素总量与2次时基本相同,因此,综合考量时间、成本、效果等多方面因素,本实验选择超声波提取次数为2次。
2.5 单因素试验
本实验分别考察了提取液浓度、提取液酸度、提取时间、料液比这4种因素在超声波提取时对花青素提取量的影响。
2.5.1 提取液浓度的影响 选甲醇为提取溶剂,甲醇浓度依次为100%、95%、90%、85%、80%、75%、70%、65%、60%。结果见图3。
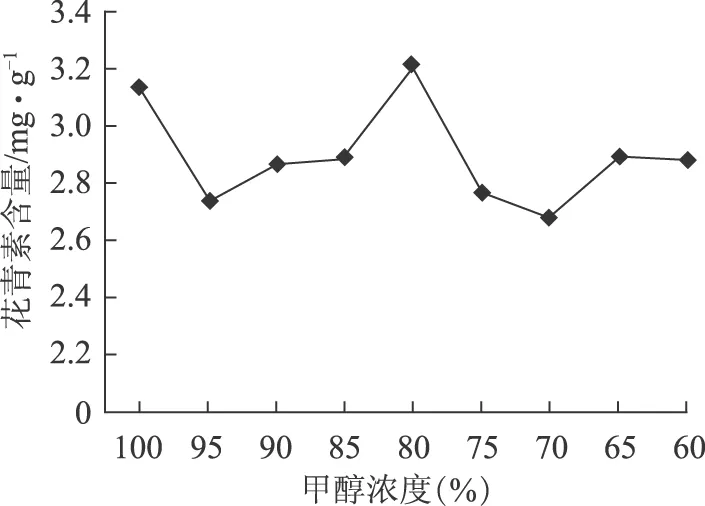
图3 提取液中甲醇浓度对蓝莓花青素提取含量的影响
由图3可知,花青素总提取含量随着甲醇浓度的减小先减小后增大再减小,当甲醇浓度为80%时达到最大值,最终选择甲醇浓度是80%作为最佳条件。
2.5.2 提取液盐酸含量的影响 提取液中盐酸的含量依次为0、0.1%、0.2%、0.3%、0.4%、0.5%、0.6%、0.7%、0.8%。结果见图4。
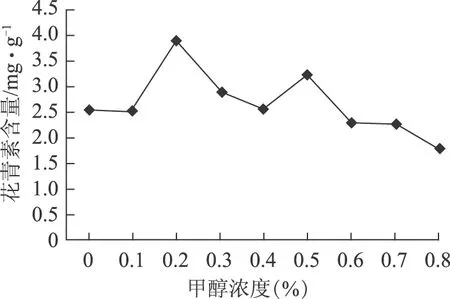
图4 提取液中盐酸含量对蓝莓花青素提取含量的影响
由图4可知,随着盐酸浓度的增大,花青素的提取率基本呈现先增大后减小的趋势,在盐酸含量为0.2%时总含量达到最大值,随后花青素提取率开始下降,分析原因可能是酸度过大,破坏花青素自身结构导致,因此选择提取液中盐酸的最佳浓度为0.2%。
2.5.3 提取时间的影响 提取时间分别选择20、25、30、35、40、45、50、55、60 min。结果见图5。
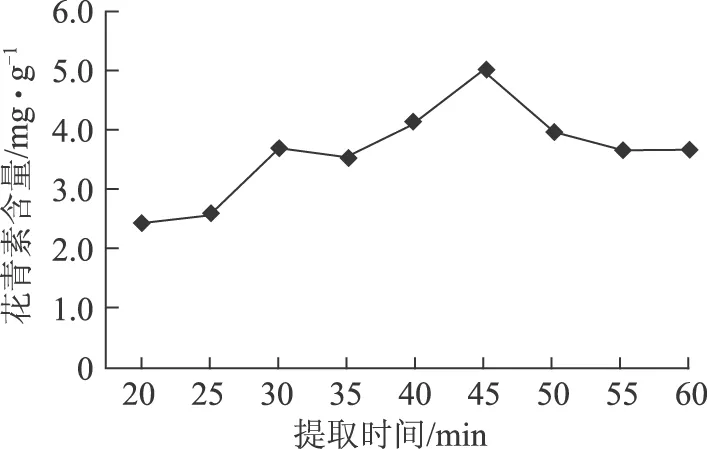
图5 不同提取时间对蓝莓花青素提取含量的影响
由图5可知,随着超声时间的延长,花青素总量呈现先增大后减小的趋势,在45 min时为最大得率,随后开始下降。原因可能为超声时间过长,超声波的剪切作用导致花青素结构遭到破坏[11]。因此,超声波条件下提取的最佳时间为45 min。
2.5.4 料液比的影响 本实验所考察的料液比分别为1∶5、1∶10、1∶15、1∶20、1∶25、1∶30、1∶35及1∶45。结果见图6。
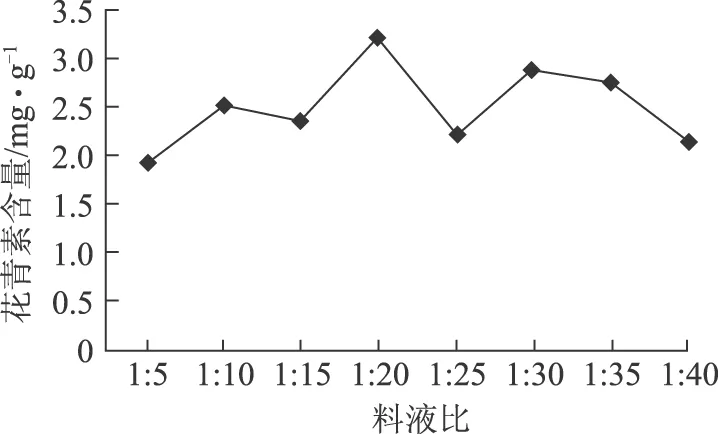
图6 料液比对花青素提取含量的影响
由图6可知,当料液比为较小值1∶5时,花青素提取率较低,当料液比增大到1∶20时,提取率达到最高,之后随着料液比继续增加,提取率有所降低。这可能是由于液料比越大,植物细胞内外的浓度差越大,传质推动力也就越大,有效成分扩散到细胞外的速度越大,越有利于花青素的析出,所以随着料液比的增大,提取率开始是增大的。而当溶剂太多时,辐射出的超声波被溶剂大量吸收,不能被蓝莓完全吸收,蓝莓的提取效果越来越差。
2.6 正交试验
根据单因素试验的考察结果,对提取液甲醇浓度(%)、盐酸含量(%)、超声时间(min)、料液比(g∶mL)进行4个因素3个水平的正交试验设计,因素水平设计见表1,正交试验结果见表2。
由表2可知,蓝莓超声提取最佳工艺组合为A2B2C3D3,即甲醇浓度为80%,盐酸含量为0.2%,时间为50 min,料液比1∶25。结果与单因素试验有所偏差,这是由于各因素之间有交互作用引起的。由极差分析可知,超声提取时影响花青素含量因素的主次顺序为B>A>C>D,即盐酸含量的影响最大,其余依次为甲醇浓度、时间,料液比的影响最小。
2.7 验证试验
按最佳组合做平行实验,3次测量所测得蓝莓中花青素含量为5.12 mg·g-1,高于正交试验中的最高组合第5号实验结果5.06 mg·g-1,这说明实验所确定的最佳提取工艺条件是可靠的。
2.8 总花青素含量测定的方法学考察
2.8.1 标准曲线的制作 将花青素对照品矢车菊素-3-O-葡萄糖苷配制成不同浓度的标准溶液,按照2.1的色谱条件,测定各浓度标准溶液的峰面积,以浓度为横坐标,峰面积为纵坐标,绘制标准曲线。得到矢车菊素-3-O-葡萄糖苷的线性关系方程:Y=19 845X-103.66,相关系数r为0.999 5,线性范围为0.007 5 ~0.21 mg·mL-1。
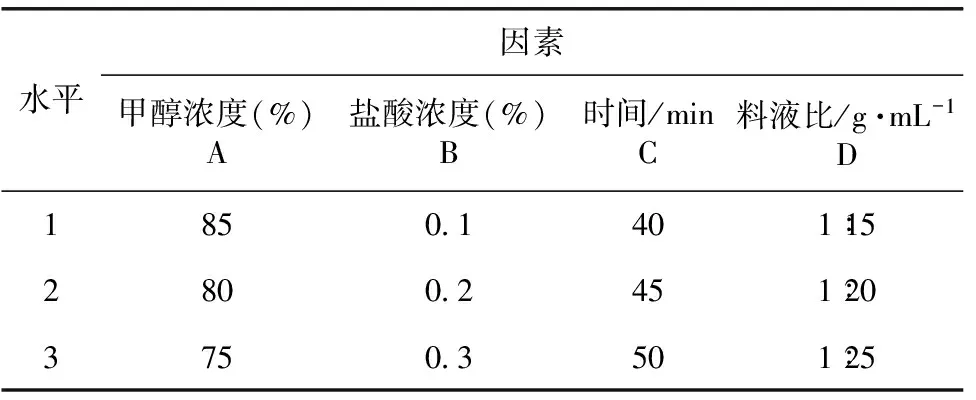
表1 蓝莓花青素提取的正交试验因素水平表
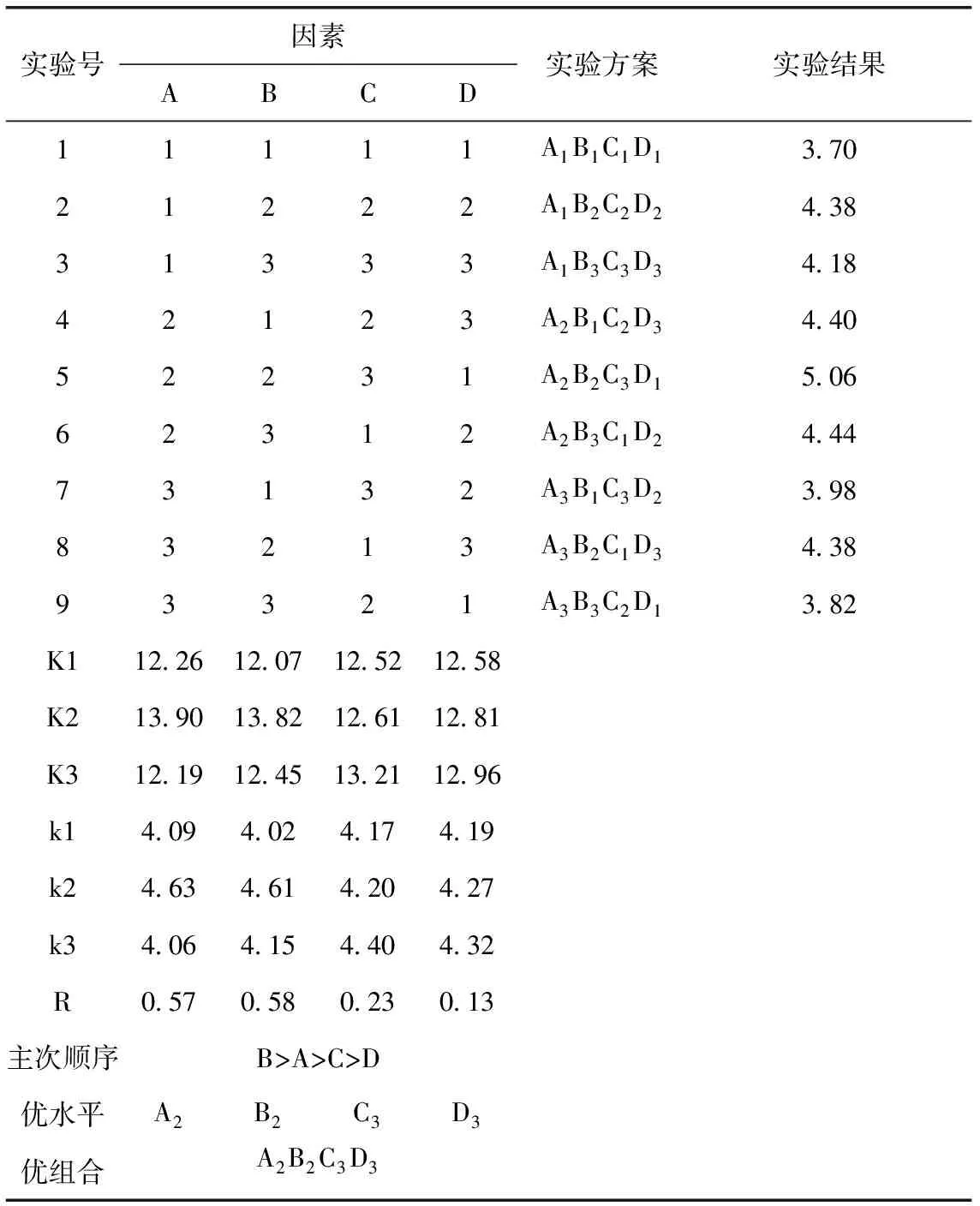
表2 蓝莓花青素提取的正交试验结果
2.8.2 检出限和定量限 将所配制的标准溶液按照2.1中的色谱条件进样10 μL,调整进样浓度至信噪比分别为3和10,其相应浓度即为所求,最终测得检出限为0.30 μg·mL-1,定量限为0.75 μg·mL-1。
2.8.3 精密度 精确移取花青素对照品溶液,按照2.1中的色谱条件重复进样5次,计算峰面积值的相对标准偏差。结果其RSD值为0.91%,表明该方法精密度较高。
2.8.4 稳定性 取同一个蓝莓样品溶液,按照2.1中的色谱条件每隔2 h进样一次,同一天内共进样5次,计算日内精密度;每天进样一次,连续进样5 h,计算日间精密度。结果表明,日内精密度试验的RSD值为0.85%,日间精密度试验的RSD值为1.02%,表明所测样品溶液的稳定性良好。
2.8.5 准确度 分别取1 mL已知浓度的蓝莓样品溶液3份,分别加入1 mL不同浓度的矢车菊素-3-O-葡萄糖苷对照品溶液,混合后按照2.1中的色谱条件进样3次,计算加样回收率,结果表明,平均回收率为99.97%,RSD值为1.81%,说明该方法准确度较高。
3 结论
本实验选用4种溶剂对蓝莓果实总花青素进行提取,筛选出最佳提取剂为甲醇,并通过单因素和正交试验研究了甲醇提取液浓度、盐酸含量、提取时间、料液比这4个因素对蓝莓花青素提取含量的影响。在实验考察的4种因素中,影响主次顺序为:盐酸含量>甲醇提取液浓度>时间>料液比,得到的最佳提取工艺条件为:甲醇浓度80%、盐酸含量0.2%、提取时间50 min、料液比1∶25。此工艺方法简单、成本较低、可操作性强,可以应用于蓝莓花青素的工业提取,具有一定的开发和应用前景。
[1] 朱晓双,刘春燕,杨振.花青素合成关键酶基因的定位及结构分析[J].大豆科学,2011,30(1):24-28,32.
[2] 肖丽霞,汪芬,张超,等.提取剂对紫玉米花青素提取量的影响[J].农产品加工,2009,8(6):38-40.
[3] Liu J,Gao F Y,Ji B P,et al.Anthocyanins-rich extract of wild Chinese blueberry protects glucolipotoxicity-induced INS832/13β-cell against dysfunction and death[J].J Food Sci Technol,2015,52(5):3022-3029.
[4] Martineau L C,Couture A,Spoor D,et al.Anti-diabetic properties of the Canadian lowbush blueberryVacciniumangustifoliumAit[J].Phytomedicine,2006,13(9/10):612-623.
[5] Sun J,Chu Y F,Wu X,et al.Antioxidant and antiproliferative activities of common vegetables[J].J Agric Food Chem,2002,50(25):7449-7454.
[6] Duthie S J.Berry phytochemicals,genomic stability and cancer:evidence for chemoprotection at several stages in the carcinogenic process[J].Mol Nutr Food Res, 2007,51(6):665-674.
[7] Vendrame S,Daugherty A,Kristo A S,et al.Wild blueberry (Vacciniumangustifolium) consumption improves inflammatory status in the obese Zucker rat model of the metabolic syndrome[J].J Nutr Biochem,2013,24(8):1508-1512.
[8] 李婷,侯晓东,陈文学,等.超声波萃取技术的研究现状及展望[J].安徽农业科学,2006,34(13):3188-3190.
[9] 赵旭博,董文宾,于琴,等.超声波技术在食品工业应用新进展[J].食品研究与开发,2005,26(1):3-7.
[10]周方,赵宏飞,杨洋,等.高丛蓝莓品种花青素含量与抗氧化能力比较[J].西南林业大学学报,2011,31(5):53-57.
[11]Yao G L,Ma X H,Cao X Y,et al.Effects of power ultrasound on stability of cyanidin-3-glucoside obtained from blueberry[J].Molecules,2016,21(11),1564.
StudyonUltrasonicExtractionofAnthocyaninsfromBlueberryFruit
YANG Li1,LIKeke2*,LIShasha2,CHENShuxiao1,TAOLi2,GONGXiaojie2*
(1.CollegeofEnvironmentalandChemicalEngineering,DalianUniversity,Dalian116622,China;2.CollegeofMedical,DalianUniversity,Dalian116622,China)
Objective:To study the method of extraction of anthocyanins from blueberry by ultrasonic extraction.Methods:Taking the ratio of methanol solvent,the ratio of added hydrochloric acid,the time of extraction and liquid to feed ratio as indexes,L9(34) orthogonal test was adopted to investigate the extraction of blueberry anthocyanins.The total content of anthocyanins was determined by HPLC.Results:The order of the influencing factors of ultrasonic extraction of anthocyanins from high to low was as follows:the content of hydrochloric acid,the ratio of methanol and the extraction time and liquid to feed ratio.Optimal ultrasonic extraction conditions were as follow:80% methanol-water as solvent which contained 0.2% hydrochloric acid,liquid to feed ratio was 25∶1(mL∶g),50 min per time.Conclusion:The developed extraction process was stable and feasible,the content of anthocyanins in blueberry fruit was 5.12 mg·g-1.
Blueberry;anthocyanin;ultrasonic extraction;orthogonal test
辽宁省科技厅科学技术计划项目(2014204007);辽宁省优秀人才支持计划(LR2013058);辽宁省自然科学基金(2015020657);国家自然科学基金 (81603272)
] 弓晓杰,教授,研究方向:中药新药开发,E-mail:gxjclr@163.com;李珂珂,博士,研究方向:活性天然产物分离与活性筛选,E-mail:like905219@163.com
10.13313/j.issn.1673-4890.2017.7.022
2017-03-13)
*[
