人参幼根对苯甲酸胁迫的形态学响应及基因差异表达△
2017-09-21李勇王梓龙期良高原丁万隆
李勇,王梓,龙期良,高原,丁万隆
(中国医学科学院 北京协和医学院 药用植物研究所,北京 100193)
·中药农业·
人参幼根对苯甲酸胁迫的形态学响应及基因差异表达△
李勇,王梓,龙期良,高原,丁万隆
(中国医学科学院 北京协和医学院 药用植物研究所,北京 100193)
目的:研究苯甲酸胁迫对人参幼根生长、根尖细胞显微结构、超微结构以及功能基因表达的影响。方法:采用体视显微镜观察人参幼根根尖形态结构;采用光学显微镜观察人参幼根显微结构;采用透射电镜研究苯甲酸对人参根尖超微结构的影响;采用qRT-PCR方法研究功能基因差异表达情况。结果:苯甲酸能够抑制人参根尖根毛的生长,根尖表皮组织排列疏松,并导致细胞内含物出现异常,细胞壁增厚;核仁核膜解体、消失;细胞内淀粉颗粒空泡化,逐渐解体消失。另外,苯甲酸胁迫还导致1个ARF-GEF,1个bHLH,2个XTH,1个MYB,1个ZAT和1个sHSP基因的差异表达。结论:苯甲酸胁迫对人参根尖细胞结构及功能基因表达均有影响。
自毒作用;苯甲酸;人参;根尖,胁迫响应
人参(PanaxginsengC.A.Meyer)是五加科人参属多年生药用植物,我国传统名贵中药材。人参从播种到收获通常需要5~6年时间,加之人参严重的连作障碍问题,导致老参地问题十分突出。老参地重茬栽参会出现烧须、病害高发等问题,严重影响人参产量和品质,甚至造成绝收。通常情况下老参地恢复至少需要30年,甚至更久[1]。据已有报道,人们将人参连作障碍归因于土壤微生物区系失衡、土传致病菌积累、养分亏缺以及土壤酸化[2-3]。然而,针对上述连作障碍因子的田间改良无法彻底消除人参连作障碍问题。
自毒作用是指植物通过根系分泌、挥发、淋溶、腐解等途径释放到环境中的化感物质对自身生长产生的不利影响[4]。药用植物含有多种具有生物活性的次生代谢产物,其中部分化学物质与化感物质有密切联系[5]。课题组前期研究发现,人参根系分泌物中含有多种抑制自身生长的化感自毒物质,苯甲酸是其中的主要化感物质之一,其在很低浓度时即可抑制人参正常生长[6-8]。然而,苯甲酸对人参化感自毒的作用机理迄今尚不明确。为此,本研究对苯甲酸处理后人参根尖显微结构和超微结构进行研究,在组织水平和细胞水平揭示苯甲酸对人参化感自毒的作用机制;同时,借助高通量测序技术研究苯甲酸胁迫对人参基因表达的影响,研究结果将有助于进一步揭示人参自毒作用机理。
1 材料与方法
1.1 人参幼苗培养及苯甲酸胁迫
三年生人参根经50%多菌灵可湿性粉剂800倍液消毒10 min后,自来水去除残余杀菌剂,然后将人参根移栽到盛有石英砂的塑料盒(40 cm×20 cm×15 cm)中,25 °C温室16 h光照/8 h黑暗培养。参考Taffouo等[9]的方法,用Hoagland营养液为人参生长提供营养。待叶片完全展开后,将200 mL苯甲酸(25 mg·L-1)均匀喷洒在人参根旁的石英砂上,对照用不含苯甲酸的Hoagland营养液代替。
1.2 人参受苯甲酸胁迫的显微形态学观察
Leica S8APO体视显微镜(Leica Co.Ltd.,德国)及Anymicro DSS YT-7M显微数字成像系统用于人参根形态学观察。Leica DM 2500显微镜(Leica Co.Ltd.,德国)用于人参根横切、纵切的观察。Jeol JEM-1400电子显微镜(JEOL Ltd.,日本)用于人参根细胞超薄切片观察。
1.3 差异表达基因筛选
在先期研究过程中,我们通过RNA-Seq高通量测序技术研究了25 mg·kg-1苯甲酸胁迫后人参根、茎、叶功能基因在转录组水平的变化[10]。结合苯甲酸胁迫对人参幼根形态学的影响及基因功能注释,我们从差异表达基因中筛选到2个根毛生长相关基因和5个胁迫相关基因。
1.4 差异表达基因qRT-PCR验证
qRT-PCR反应体系10 μL,包括:1 μg总RNA,200 U M-MLV转录酶(TaKaRa)。PCR反应程序:70 ℃ 10 min;42 ℃60 min;70 ℃ 15 min。生成的cDNA用800 μL重蒸水稀释。BIO-RAD CFX系统(BIO-RAD)上完成qRT-PCR扩增。基因特异性引物(见表1)用Primer3 (http://bioinfo.ut.ee/primer3/)设计。PCR反应体系及扩增程序参考Wu等[11]。Bio-Rad CFX Manage软件中的溶解曲线分析引物的特异性,2-ΔΔCT方法[11]用于计算基因的相对表达水平。40S核糖体蛋白S8基因(c42687_g2)作为qRT-PCR的内参基因。

表1 用于差异基因表达分析的qRT-PCR引物
2 结果与分析
2.1 人参受苯甲酸胁迫的显微形态学变化
Leica S8 APO体视显微镜观察发现,0.25 mg·L-1浓度苯甲酸处理下,人参根尖生长与对照组无明显差异。当浓度达到2.5 mg·L-1时,根尖部位的根毛数明显少于对照组;当浓度大于25 mg·L-1时,根尖部位根毛基本不生长,且根尖顶端生长出现膨大或坏死(图1)。
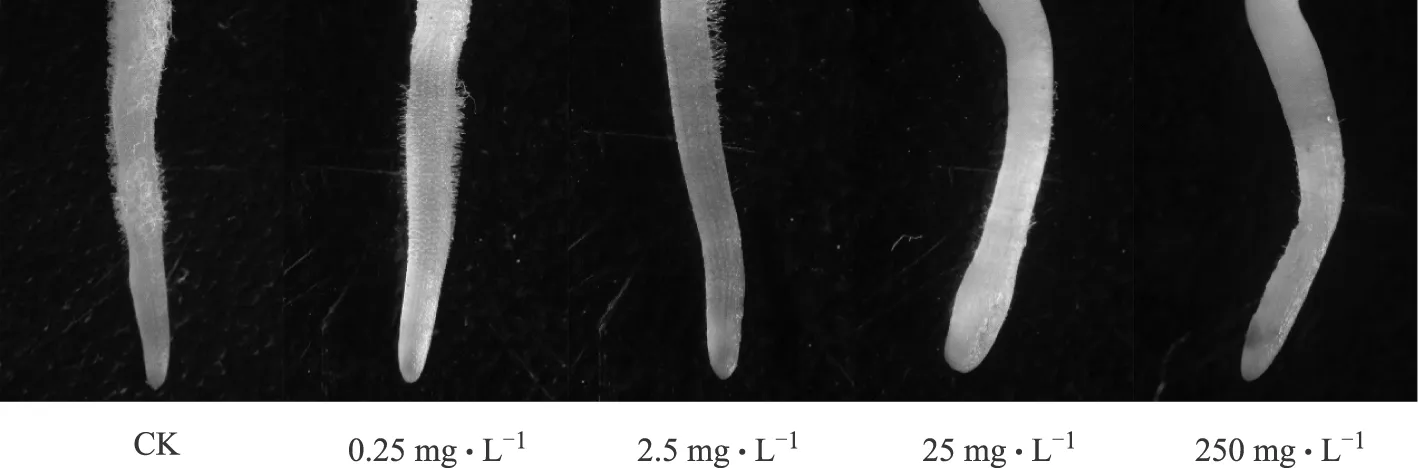
图1 苯甲酸对人参根尖形态的影响
如图2所示,通过观察人参根尖组织横切石蜡切片发现,当苯甲酸浓度低于2.5 mg·L-1时,人参幼苗根尖横切面细胞排列规则、均匀,细胞饱满,表皮、皮层薄壁组织和中柱鞘等结构清晰可辨。当苯甲酸浓度达到25 mg·L-1时,表皮细胞大量脱落。250 mg·L-1处理时,表皮细胞脱落加重,皮层薄壁组织细胞的细胞壁形态异常甚至破裂,中柱鞘细胞明显膨胀。

图2 人参根尖横切面石蜡切片观察
由人参根尖组织纵切面观察可见,当苯甲酸处理浓度低于0.25 mg·L-1时,根尖细胞排列规则、清晰,表皮层、顶端分生组织等分界明显。当苯甲酸浓度为2.5 mg·L-1时,人参幼苗根尖细胞间隙明显加大,表皮层细胞部分脱落。25 mg·L-1处理时,顶端分生组织和根冠细胞排列出现混乱。250 mg·L-1处理时,顶端分生组织细胞形态出现异常甚至破裂(图3)。
电镜观察人参根尖细胞超微结构发现,对照组细胞结构完整,各类细胞器健全,细胞壁形态正常,细胞间隙清晰可见,细胞质较浓,内容物丰富。细胞核大而圆,位于细胞质中央,核仁核膜完整且清楚可辨。细胞质中可清晰地看到结构完整的液泡、高尔基体、线粒体和淀粉粒等细胞器。25 mg·L-1苯甲酸处理后根尖细胞形态结构出现异常,细胞壁出现异常增厚;核仁、核膜开始解体、消散;细胞内淀粉颗粒出现不同程度空泡化现象,并逐渐解体、消散(图4)。淀粉是重要的多糖,是细胞活动的能量来源。出现淀粉颗粒的空泡化和液泡异常变大,表明细胞正丧失正常的生理功能,不能完成正常的生命活动。
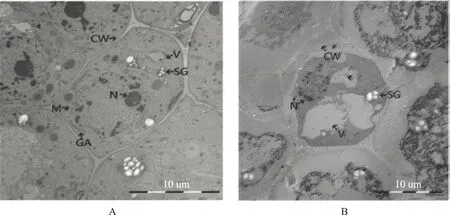
注:A.对照组;B.25 mg·L-1苯甲酸处理组;CW.细胞壁;M.线粒体;N.核仁;SG.淀粉粒;V.液泡;GA.高尔基体图4 人参根尖细胞超微结构
2.2 苯甲酸胁迫响应基因的差异性表达谱
借助高通量RNA-Seq测序,共发现2个根毛形态建成相关基因和5个苯甲酸胁迫相关基因,分别是:1个小G蛋白ADP核糖基化因子的鸟苷酸交换因子(ADP-ribosylation factor guaninenucleotide exchange factor,ARF-GEF),1个碱性螺旋-环-螺旋蛋白基因(basic helix-loop-helix protein,bHLH),2个木葡聚糖内转糖苷酶基因(Xyloglucanendotransglucosylase/hydrolases,XTH),1个MYBB相关蛋白基因(MYBB),1个锌指蛋白基因(ZAT10)和1个小热激蛋白基因(small heat shock protein,sHSP)。
根据RNA-Seq测序结果和qRT-PCR结果,苯甲酸胁迫诱导下,与根毛形态建成相关的ARF-GEF(c60670_g1)和bHLH(c59443_g4)基因上调表达,且其在人参根中的表达明显高于其在人参茎、叶的表达量(图5)。这说明ARF-GEF和bHLH在人参幼根生长中可能起着重要的作用。
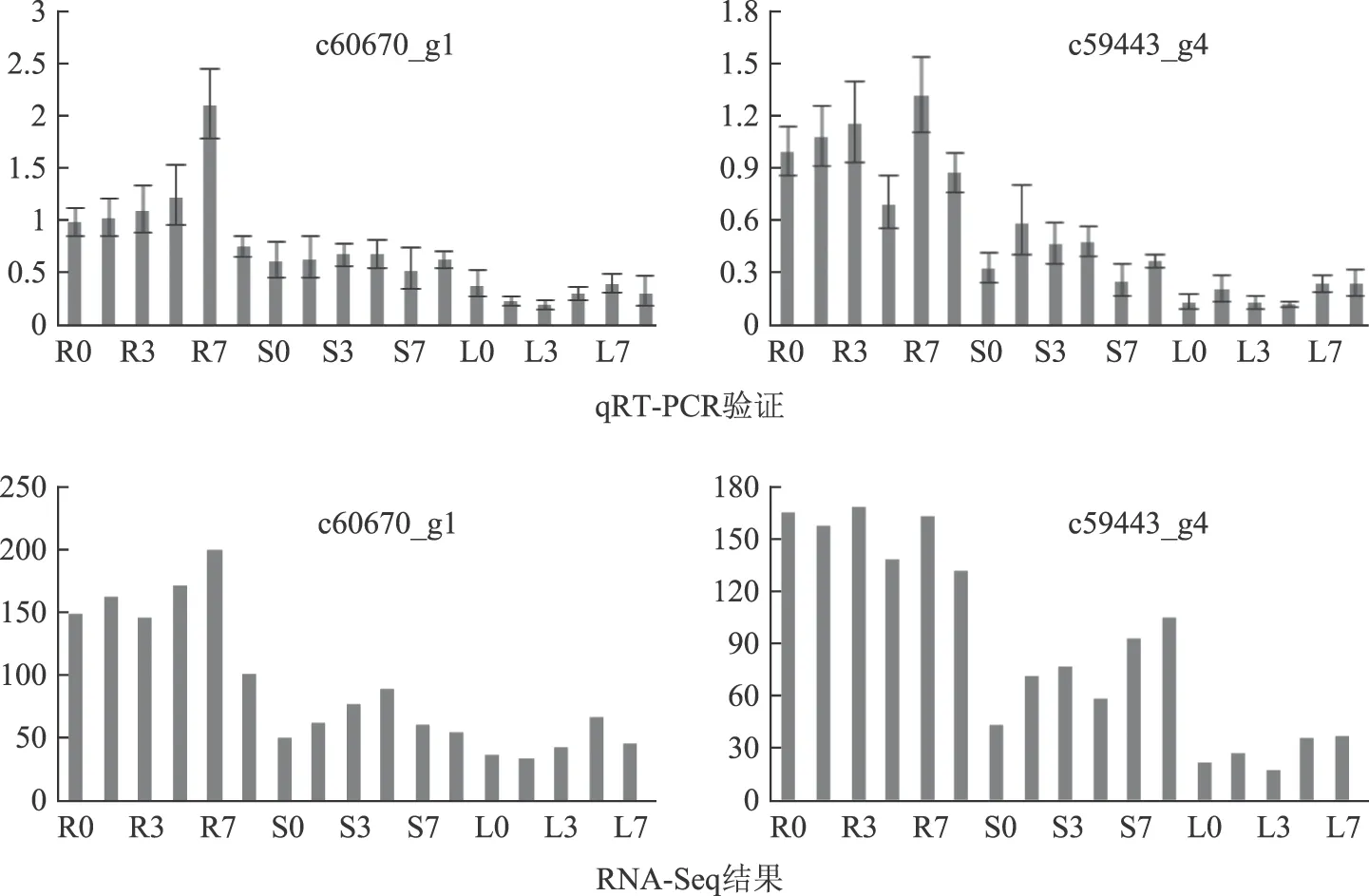
注:横坐标为处理时间;纵坐标为基因表达量;字母后数值为处理天数R.根;L.叶;S.茎图5 人参根毛形态建成相关基因的差异表达情况
根据RNA-Seq测序结果和qRT-PCR结果,5个胁迫相关基因:XTH基因(c37513_g1和c59133_g3)、MYBB(c42409_g1)、ZAT10(c50712_g1)和sHSP(c63168_g1)经苯甲酸处理后均上调表达(图6)。
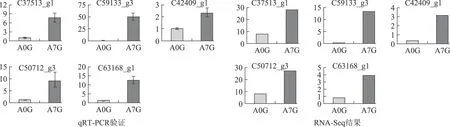
注:横坐标为苯甲酸处理时间;纵坐标为基因表达量图6 人参苯甲酸胁迫相关基因的差异表达情况
3 讨论
植物通过形态结构或生长方面的直观变化,以达到适应环境的目的。了解环境胁迫下植物细胞结构的变化规律,可为植物受损机理以及抗逆机制的研究提供细胞学证据[12]。本研究借助体视显微镜观察了苯甲酸胁迫前后人参根尖的形态结构变化,发现25 mg·L-1苯甲酸能够明显抑制人参幼根根毛的生长。另外,研究还发现,ARF-GEF(c60670_g1)和bHLH(c59443_g4)基因在苯甲酸胁迫后显著上调表达,并且其在根中的表达量明显较茎、叶高。ARF-GEF蛋白能够影响生长素极性运输,进而影响根系的生长发育[13-14]。bHLH是真核生物中广泛存在的一大类转录因子,其在植物响应逆境胁迫中起着重要作用[15]。Qing等[16]研究表明bHLH在植物根系生长中起着重要的调控作用。由此笔者推测,苯甲酸胁迫导致的ARF-GEF和bHLH基因在人参幼根中的差异表达是造成人参幼根根毛生长抑制的关键因素。
植物根系解剖结构是其发育水平的直接体现,并与根系生理功能密切相关。植物根尖能通过改变不同部位细胞结构以及细胞器响应外界环境胁迫,提高植物的耐受性[17]。本研究通过石蜡切片观察发现,25 mg·L-1苯甲酸对人参具有强烈的化感自毒作用,人参幼根表皮细胞排列出现混乱,细胞间隙变大。环境胁迫下植物细胞形态结构受到影响而发生改变,根尖细胞亚显微结构分析已经成为植物化感作用研究最直接的实验证据之一[18]。本研究发现,苯甲酸对人参幼根细胞的影响主要表现在破坏了细胞核和核膜结构,尤其是加速生物膜解体,增加细胞壁厚度,使细胞内容物散乱,进而干扰细胞正常代谢。细胞壁是植物免受外界环境伤害的第一道结构屏障,其在植物生长中主要起结构支持、物质运输和抵御逆境的作用[19]。兰世超等[20]研究表明,病原菌侵染胁迫下植物体内胼胝质、富含羟脯氨酸糖蛋白和木质素等大量合成,加强了细胞壁的机械强度,从而为植物提供结构屏障而起到抗病作用。本研究还发现苯甲酸胁迫下人参根尖细胞壁出现明显增厚,推测细胞壁增厚是人参对苯甲酸胁迫的一种自我防御。本研究发现2个XTH基因(c37513_g1和c59133_g3)在苯甲酸胁迫下出现上调表达。XTH能够使植物细胞壁松弛,且更具延展性[21]。由此我们推测XTH基因上调表达可能与人参根细胞壁增厚存在密切关联。核仁是植物胁迫响应的协调反应中心,具有感受外界胁迫的功能[22]。细胞核在受到外界胁迫时常表现为核膜、核仁消失[23-24]。本研究观察到人参根尖细胞核解体,表明苯甲酸对人参细胞生长产生了影响。液泡在植物细胞物质储藏、胞内环境稳定和防御反应中具有重要作用[25]。植物在受到外界胁迫时,液泡能够通过调节液泡膜上的蛋白或者酶活性来调节细胞渗透压平衡,从而保护细胞免受外界环境伤害[26]。本研究发现人参根尖细胞的液泡在苯甲酸胁迫下出现了明显的增大,这可能是人参细胞在苯甲酸胁迫下的自我保护。
此外,本研究还发现MYBB(c42409_g1),ZAT10(c50712_g3)和sHSP(c63168_g1)受苯甲酸胁迫上调表达。MYBB属于MYB转录因子家族,其在调控细胞进入衰老过程中起重要作用[27]。ZAT10过表达能够提高植物对环境胁迫的耐受性[28]。sHSP在维持细胞内稳态中起着重要的作用[29]。上述基因受苯甲酸胁迫而上调表达,说明其在响应苯甲酸胁迫过程中可能起重要作用,这为深入研究人参在苯甲酸胁迫下响应基因的生物学功能奠定了理论基础。
[1] 吴连举,赵亚会,关一鸣,等.人参连作障碍原因及其防治途径研究进展[J].特产研究,2008,30(2):68-72.
[2] 张连学,陈长宝,王英平,等.人参忌连作研究及其解决途径[J].吉林农业大学学报,2008,30(4):481-485.
[3] 简在友,王文全,孟丽,等.人参属药用植物连作障碍研究进展[J].中国现代中药,2008,10(6):3-5.
[4] Singh H P,Batish D R,Kohli R K.Autotoxicity:Concept,Organisms,and Ecological Significance[J].Critical Reviews in Plant Sciences,1999,18(6):757-772.
[5] 张重义,林文雄.药用植物的化感自毒作用与连作障碍[J].中国生态农业学报,2009,17(1):189-196.
[6] 黄小芳,李勇,易茜茜,等.五种化感物质对人参根系酶活性的影响[J].中草药,2010,41(1):117-121.
[7] 黄小芳,李勇,刘时轮,等.五种化感物质对人参幼根皂苷含量的影响[J].世界科学技术-中医药现代化,2009,11(1):71-74.
[8] 黄小芳,李勇,丁万隆.人参根系分泌物对种子萌发的自毒效应[J].种子,2009,28(10):4-7.
[9] Taffouo V D,Ngwene B,Akoa A,et al.Influence of phosphorus application and arbuscular mycorrhizal inoculation on growth,foliar nitrogen mobilization,and phosphorus partitioning in cowpea plants[J].Mycorrhiza,2014,24(5):361-368.
[10]Bin W,Qiliang L,Yuan G,et al.Comprehensive characterization of a time-course transcriptional response induced by autotoxins in Panax ginseng using RNA-Seq[J].BMC genomics,2015,16(1):1010.
[11]Bin W,Meizhen W,Yimian M,et al.High-throughput sequencing and characterization of the small RNA transcriptome reveal features of novel and conserved microRNAs in Panax ginseng[J].PLoS One,2012,7(9):e44385.
[12]吴凯,周晓阳.环境胁迫对植物超微结构的影响[J].山东林业科技,2007,170(3):80-83.
[13]Shiping L,Jirong W,Lu W,et al.Adventitious root formation in rice requires OsGNOM1 and is mediated by the OsPINs family[J].Cell Research,2009,19(9):1110-1119.
[14]刘士平,王璐,薛艳红,等.ARF-GEF基因家族的研究进展[J].遗传,2009,31(10):982-992.
[15]王艳敏,白卉,曹焱.bHLH转录因子研究进展及其在植物抗逆中的应用[J].安徽农业科学,2015,43(21):34-35.
[16]Qing L,Yohei O,Mariko K,et al.GLABRA2 Directly Suppresses Basic Helix-Loop-Helix Transcription Factor Genes with Diverse Functions in Root Hair Development[J].The Plant Cell,2015,27(10):2894-2906.
[17]杨春雪,卓丽环,柳参奎.植物显微及超微结构变化与其抗逆性关系的研究进展[J].分子植物育种,2008,6(2):341-346.
[18]Zeng R S,Luo S M,Yue H S,et al.Physiological and Biochemical Mechanism of Allelopathy of Secalonic Acid F on higher Plants[J].Agronomy Journal,2001,93(1):72-79.
[19]Tenhaken R.Cell wall remodeling under abiotic stress[J].Frontiers in plant science,2014,5(771):1-9.
[20]兰世超,姜山.病原体胁迫下植物细胞壁的变化[J].贵州科学,2013,31(3):17-24.
[21]Van Sandt Vicky S T,Dmitry S,Jean-Pierre V,et al.Xyloglucan endotransglucosylase activity loosens a plant cell wall[J].Annals of Botany,2007,100(7):1467-1473.
[22]Séverine B,J W B,Saskia H,et al.The nucleolus under stress[J].Molecular Cell,2010,40(2):216-227.
[23]代容春,何文锦,林荣华,等.NaCl胁迫下萝卜幼苗根系生理和细胞核形态的变化[J].干旱地区农业研究,2012,30(6):124-127.
[24]王如平,解凯彬,徐楠,等.Cd~(2+)胁迫下浮萍叶细胞核超微结构、nDNA损伤及抗氧化酶系的变化[J].广西植物,2009,29(4):502-505.
[25]廖祥儒,陈彤,刘小丽.植物液泡的形成及其功能[J].细胞生物学杂志,2002,24(2):95-101.
[26]Gao C,Zhao Q,Jiang L.Vacuoles protect plants from high magnesium stress[J].P Natl Acad Sci USA,2015,10(112):2931-2932.
[27]Mowla S N,Lam E W F,Jat P S.Cellular senescence and aging:the role of B- MYB[J].Aging Cell,2014,13(5):773-779.
[28]Mittler R,Kim Y,Song L,et al.Gain- and loss-of-function mutations in Zat10 enhance the tolerance of plants to abiotic stress[J].FEBS letters,2006,580(28):6537-6542.
[29]Treweek T M,Meehan S,Ecroyd H,et al.Small heat-shock proteins:important players in regulating cellular proteostasis[J].Cellular and Molecular Life Sciences,2015,72(3):429-451.
MorphologicalResponseofGinsengRoottoBenzoicAcidandDifferentialGenesExpressionAnalysis
LI Yong,WANGZi,LONGQiliang,GAOYuan,DINGWangLong
(InstituteofMedicinalPlantDevelopment,ChineseAcademyofMedicalSciences&PekingUnionMedicalCollege,Beijing100193,China)
Objective:To study the influence of benzoic acid stress on root growth,micro- and ultra-structures of root tip cells,expression of functional genes ofPanaxginseng.Methods:The root morphological structure of ginseng root tips was observed by stereomicroscope.The microstructure of root was observed by traditional optical microscope.The influence of benzoic acid on the ultrastructure of root tip ofP.ginsengwas observed by transmission electron microscope.The expression of differentially expressed genes was analyzed by RT-PCR.Results:The growth of fibril on the root tips was inhibited by benzoic acid,and resulted in the loosely arrangement of apical epidermal tissue.The cell contents was abnormally changed,the cell wall was thicken,the nuclear membrane and nucleolus disappeared,starch grains were of vacuolation and even disappeared.Furthermore,benzoic acid stress also resulted in the differential expression of ARF-GEF,bHLH,XTH,MYB,ZAT and sHSP genes.Conclusion:Benzoic acid stress has significant influences on the structure of root tip cells and the expression of functional genes ofP.ginseng.
Autotoxicity;benzoic acid;P.ginseng;root tips;stress response
国家自然科学基金项目(81373911);协和创新团队项目(2016-I2M-3-017)
] 丁万隆,研究员,研究方向:药用植物栽培及病害防治技术研究;Tel:(010)57833360,E-mail:wlding@implad.ac.cn
10.13313/j.issn.1673-4890.2017.7.018
2016-11-19)
*[
