高脂饮食联合链脲佐菌素诱导2型糖尿病合并非酒精性脂肪肝大鼠模型的建立△
2017-09-21孙乐彭军杨润梅许利嘉
孙乐,彭军,杨润梅*,许利嘉
(1.中国医学科学院 北京协和医学院 药用植物研究所 中草药物质基础与资源利用教育部重点实验室,北京 100193;2.贵州医科大学药学院,贵州 贵阳 550025)
·基础研究·
高脂饮食联合链脲佐菌素诱导2型糖尿病合并非酒精性脂肪肝大鼠模型的建立△
孙乐1,彭军2,杨润梅1*,许利嘉1
(1.中国医学科学院 北京协和医学院 药用植物研究所 中草药物质基础与资源利用教育部重点实验室,北京 100193;2.贵州医科大学药学院,贵州 贵阳 550025)
目的:高脂饮食联合链脲佐菌素(STZ)建立2型糖尿病合并非酒精性脂肪肝(NAFLD)大鼠模型。方法:大鼠随机分为正常对照组和造模组,造模组大鼠喂饲高脂高糖饲料诱导4周后,腹腔注射STZ 30 mg·kg-1并继续高脂饮食进行造模。造模8周后,测定大鼠空腹血糖(FBG)及胰岛素含量,并计算胰岛素敏感指数(ISI),同时测定各组大鼠的肝功水平。将造模成功的大鼠根据血糖水平分为模型组、盐酸二甲双胍组。连续给药4周即造模12周后进行大鼠糖耐量试验,测定血清生化指标和肝脏脂质含量;另取部分肝脏组织进行病理学检测。结果:注射STZ后,造模组大鼠出现明显的体重下降、多饮多尿的糖尿病症状。造模8周和12周后,与正常对照组比较,模型组大鼠ISI明显下降;FBG和血清丙氨酸氨基转移酶(ALT)活性明显升高。给药4周后,与模型组相比,盐酸二甲双胍组大鼠ISI明显升高,糖耐量(AUCG)、FBG、血清ALT活性以及肝脏中总胆固醇(TC)含量均明显降低。结论:利用高脂高糖饲料喂养配合腹腔注射STZ可以成功建立2型糖尿病与非酒精性脂肪肝大鼠模型。
2型糖尿病;非酒精性脂肪肝;高脂饮食;链脲佐菌素
随着人们生活水平的提高,一些不健康的生活方式和饮食方式大量出现,导致2型糖尿病的发病率急剧上升。2型糖尿病是糖尿病的一种,又称为非胰岛素依赖型糖尿病(Non-insulin-dependent diabetes mellitus,NIDDM),是以机体胰岛素分泌不足和胰岛素抵抗为主要病理生理特征的一类慢性代谢性疾病[1],可引发糖脂代谢紊乱的一系列并发症,其中以非酒精性脂肪肝(nonalcoholic fatty liver disease,NAFLD)最为多发。目前临床上对2型糖尿病尚无完全治愈的方法,只能采用控制或治疗并发症的手段来缓解糖尿病的发展。20世纪以后,分子生物学和遗传学手段的应用从分子角度剖析了糖尿病的病因和遗传特性,而建立一个稳定的2型糖尿病模型对于深入研究其发病机理、预防和治疗措施等至关重要。
高脂高糖饮食会造成大鼠胰岛素抵抗和非酒精性脂肪肝,但仅凭高脂高糖刺激很难改变血糖水平,20世纪开始有研究者用链脲佐菌素(STZ)诱发糖尿病的产生[2],STZ的作用机理是选择性地破坏胰岛β细胞,从而造成胰岛素分泌降低,但形成的糖尿病模型不具有2型糖尿病的特征。因此本实验将采用高糖高脂饮食联合链脲佐菌素注射来建立稳定的2型糖尿病合并非酒精性脂肪肝模型,并应用盐酸二甲双胍验证模型的稳定性。
1 材料
1.1动物
雄性Wistar大鼠,体重190~210g,购自中国人民解放军军事医学科学院实验动物中心,许可证号:SCXK-(军)2012-0004。
1.2饲料
大鼠常规饲料和高脂饲料(北京华阜康生物科技股份有限公司),生产许可证:SCXK(京)2014-0008。高脂饲料配方如下:1%胆固醇,0.5%胆酸盐,15%猪油,20%蔗糖,63.5%基础饲料。
1.3动物饲养条件
大鼠在SPF级环境中饲养,温度20~25℃,湿度40%~70%,10只/笼,定量给予常规饲料或高脂饲料,自由饮水。
1.4阳性对照药
格华止(盐酸二甲双胍片):中美上海施贵宝制药有限公司,规格:0.5g/片,批号:AAC8300,有效期至2017年6月。
1.5主要试剂
链脲佐菌素(Streptozocin,STZ):Sigma公司,批号:18883-66-4;
血糖试纸:德国罗氏诊断有限公司,批号:23470337。
肝脏总胆固醇(TC),批号:151841,有效期至2018年6月;肝脏甘油三酯 (TG),批号:157201,有效期至2018年5月,以上测定试剂盒均来源于中生北控生物科技股份有限公司。
天门冬氨酸氨基转移酶(AST),批号:AUZ2686,有效期至2017年1月;丙氨酸氨基转移酶(ALT),批号:AUZ2678,有效期至2017年1月,以上检测试剂盒均由贝克曼库尔特实验系统(苏州)有限公司提供。
1.6主要仪器
贝克曼AU480全自动生化分析系统;美国FLUKOF6/10超细匀浆器;美国Bio-TEK微孔板扫描分光光度计(MQX200);上海安亭TGL-16G型台式高速离心机。
2 方法
2.1选模
35只Wistar大鼠适应性饲养1周。于第2周起,根据体重随机分为正常对照组(10只)和造模组(25只),正常对照组喂饲基础饲料、造模组喂饲高脂高糖饲料。诱导4周后,造模组大鼠腹腔注射链脲霉素(STZ)30mg·kg-1并继续高脂饮食,正常对照组等体积腹腔内注射枸橼酸-枸橼酸钠缓冲液并继续正常饮食。第8周末,大鼠禁食不禁水过夜,测定以下2型糖尿病指标:空腹血糖(FBG)含量及胰岛素含量,并计算胰岛素敏感指数(ISI)。以FBG>11.1mmol·L-1且ISI降低认为模型建立成功。同时用全自动生化分析系统测定脂肪肝指标,即肝功能指标(ALT、AST),测定方法分别为乳酸脱氢酶法和苹果酸脱氢酶法。
将造模成功的大鼠(20只)随机分为模型组、盐酸二甲双胍组,每组10只。盐酸二甲双胍组大鼠灌胃(ig.)给予200mg·kg-1剂量的药物,连续给药4周。在此期间除正常对照组喂饲基础饲料外,其余两组仍喂饲高脂高糖饲料,每周测定大鼠体重。给药4周,即造模12周后,测定FBG、血胰岛素含量等2型糖尿病指标,并利用血糖试纸进行糖耐量试验(OGTT:分别测定FBG和ig.葡萄糖2g·kg-1后30、60、120、180min的血糖)。测定脂肪肝相关指标:利用全自动生化仪测定肝功指标;取肝脏组织,称重,计算肝重指数(肝重/体重×100);取部分肝脏组织制备10%肝匀浆,用CHOD-PAP和GPO-PAP法测定肝脏TC、TG含量;另取部分肝脏组织以10%甲醛固定,供病理学检测使用,病理学检测评分标准如下:-未见病变;+轻度病变;++中度病变;+++重度病变。流程图如图1所示。
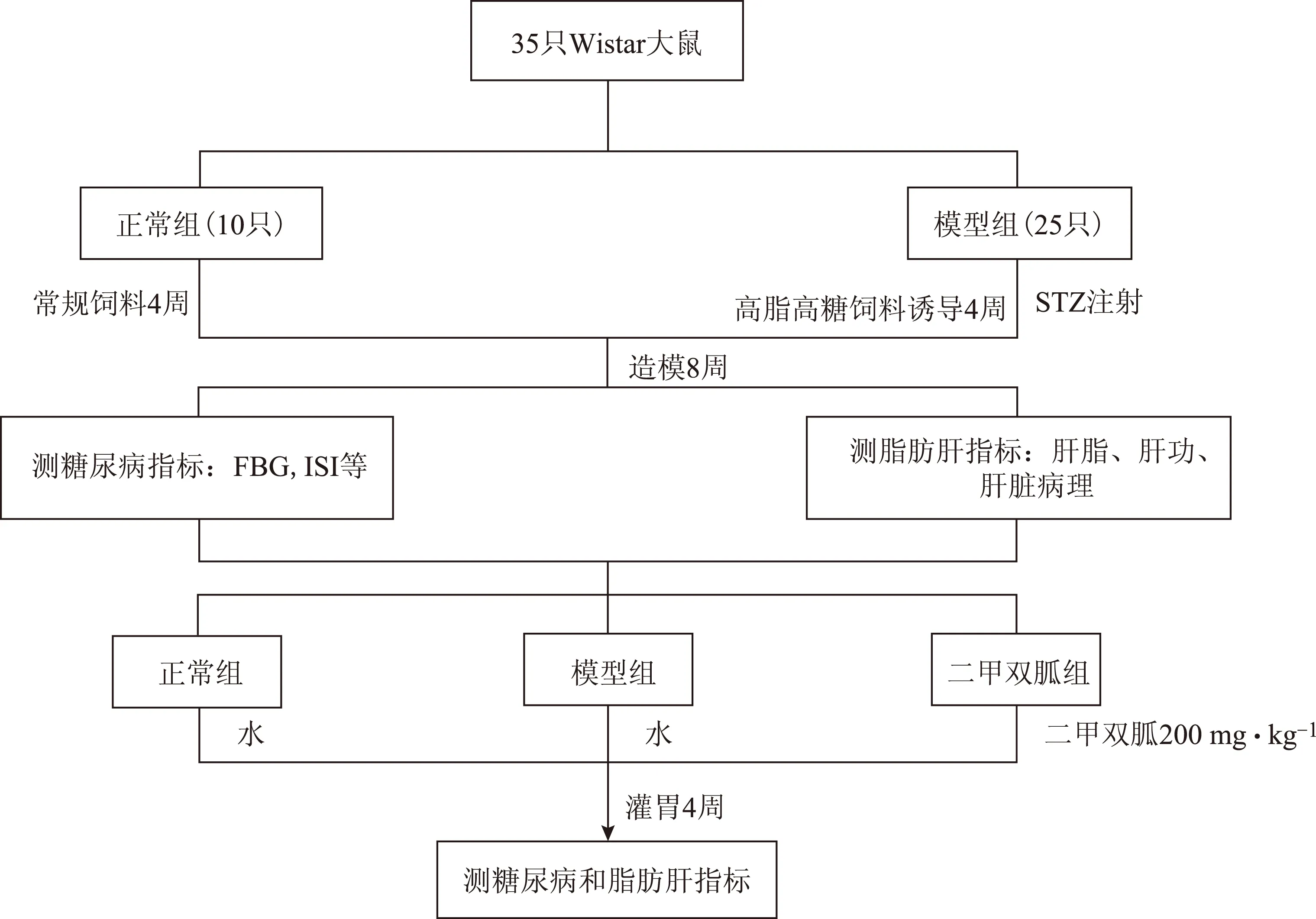
图1 2型糖尿病合并非酒精性脂肪肝大鼠造模实验流程示意图
2.2数据处理
3 结果
3.1模型的建立结果
3.1.1一般观察 高脂饲料诱导期间,各组大鼠活动正常。诱导4周后腹腔注射STZ进行造模,造模大鼠出现明显的体重下降、多饮多尿的糖尿病症状。造模期间,模型组体重低于正常组,差异有统计学意义;模型组大鼠一直持续多饮多尿的症状至实验结束。实验期间各组大鼠体重见图2。
3.1.2造模8周后大鼠各项指标变化
3.1.2.1大鼠空腹血糖、血胰岛素含量及胰岛素敏感指数、糖耐量变化 造模8周后,模型组大鼠与正常组大鼠比较,空腹血糖明显升高,而空腹血胰岛素含量无明显变化,由此换算出胰岛素敏感指数明显下降(见表1)。
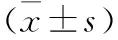
表1 造模8周后大鼠空腹血糖、血胰岛素含量及胰岛素敏感指数
注:与正常组比较,***P<0.001。
3.1.2.2 大鼠肝重系数及血清ALT、AST活性变化 造模8周后,模型组大鼠与正常组大鼠比较,血清中ALT活性明显升高,而AST活性无明显变化。表明本次建立的模型大鼠存在一定的肝损伤(见表2)。

表2 造模8周各组大鼠血清ALT、AST活性 U·L-1
注:与正常组比较,*P<0.05。
3.1.3 造模12周后大鼠各项指标变化
3.1.3.1 大鼠空腹血糖、血胰岛素含量及胰岛素敏感指数、糖耐量变化 造模12周后,模型组大鼠与正常组大鼠相比,空腹血糖明显升高,糖耐量曲线下面积(AUCG)明显增大,空腹血胰岛素含量明显减少,胰岛素敏感指数明显下降,差异有统计学意义,见表3。

表3 造模12周(给药4周)后模型大鼠空腹血糖、血胰岛素含量及胰岛素敏感指数、糖耐量的变化
注:与正常组比较,***P<0.001;与模型组比较,▲▲P<0.01,▲▲▲P<0.001。
3.1.3.2 大鼠肝重系数及血清ALT、AST活性变化 造模12周后,模型组大鼠肝重系数、血清ALT活性明显升高,与正常组大鼠比较差异有统计学意义,表明肝损伤在持续发生(见表4)。

表4 造模12周(给药4周)后模型大鼠肝重系数及血清ALT、AST活性变化
注:与正常组比较,**P<0.01,***P<0.001;与模型组比较,▲▲P<0.01。
3.1.4 大鼠肝脂水平 实验结束时,模型组大鼠与正常对照组比较,肝脏中TC、TG均明显升高,差异有统计学意义,见表5。

表5 造模12周(给药4周)后模型大鼠肝脂水平的变化 /mg·g-1
注:与正常组比较,***P<0.001;与模型组比较,▲P<0.05。
3.1.5 大鼠肝脏病理检测结果 实验结束时,正常组大鼠肝脏未见明显病理改变。模型组大鼠出现10例(10/10)肝细胞肿胀,其中3例重度病变,6例中度病变,1例轻度病变;7例(7/10)轻度肝细胞脂肪变性;1例(1/10)肝脏内小灶性炎细胞浸润。表明模型组大鼠出现了以肝细胞肿胀和轻度脂肪变性为主要表现的肝脏病变,见图3、表6。

注:A.正常组;B.模型组;C.给药组。图3 肝脏组织病理切片HE染色(HE×100)

动物号肝细胞肿胀肝细胞脂肪变性炎细胞浸润其他病变动物号肝细胞肿胀肝细胞脂肪变性炎细胞浸润其他病变1----16+++--2----17+++--3----18++++--4----19++---5----20++---6----21+++--7----22+---8----23+++--9----24+---10----25++---11+---26++--12+++++-27+++--13+++--28++++-14+++--29----15++++--
注:-表示未见病变;+表示轻度病变;++表示中度病变;+++表示重度病变;正常组:1~10,模型组:11~20,给药组:21~29。
3.2二甲双胍对模型大鼠的作用
3.2.1二甲双胍对模型大鼠空腹血糖、血胰岛素含量及胰岛素敏感指数、糖耐量的影响 给药4周后,二甲双胍能明显降低模型大鼠空腹血糖,提高胰岛素敏感指数,并改善模型大鼠糖耐量异常的状况,与模型组大鼠相比,差异均有统计学意义(见表3)。
3.2.2二甲双胍对模型大鼠肝重系数及血清ALT、AST活性的影响 给药4周后,二甲双胍能明显降低模型大鼠血清ALT活性,与模型组大鼠相比,差异有非常显著性意义;而对AST活性和肝重系数无明显影响(见表4)。
3.2.3二甲双胍对模型大鼠肝脂的影响 给药4周后,二甲双胍能明显降低模型大鼠肝脏TC含量,但对TG含量没有明显影响(见表5)。
3.2.4二甲双胍对模型大鼠肝脏病理的影响 给药4周后,二甲双胍组出现8例(8/9)肝细胞肿胀,其中5例中度病变,3例轻度病变;5例(5/9)轻度肝细胞脂肪变性;1例(1/9)肝脏内小灶性炎细胞浸润(见图3、表6)。与模型组相比,二甲双胍组肝细胞肿胀和脂肪变性有所减轻,表明二甲双胍对模型大鼠肝脏病变有一定的改善作用。
4 讨论
2型糖尿病是由遗传、环境等多种因素引起的代谢异常综合征,表现为胰岛素分泌相对匮乏或胰岛素抵抗。2型糖尿病的发病率占全球糖尿病患者的90%~95%,目前已成为十分严重的威胁人类健康的慢性代谢性疾病[3]。伴随2型糖尿病产生的并发症严重威胁人类健康,其中非酒精性脂肪肝是最常见的并发症。非酒精性脂肪肝是无酗酒而出现肝实质细胞脂肪变性和脂肪贮积为特征的肝病综合征[4]。目前关于非酒精性脂肪肝的发病机制尚未完全明确,与肥胖、糖尿病、高血压、胰岛素抵抗、脂肪酸代谢紊乱和高脂血症等很多因素都有关[5-6]。因此建立一个稳定的2型糖尿病合并非酒精性脂肪肝的动物模型有利于对这两种疾病各自的发病机制及两者之间的相互作用机制进行研究。本研究应用高脂饮食诱导联合STZ注射造模,建立2型糖尿病合并非酒精性脂肪肝大鼠模型,符合这两种疾病的临床病因病机和发病过程。
长期高脂高糖饮食会造成大鼠胰岛素抵抗,胰岛素抵抗是2型糖尿病的发病基础[7-8]。STZ分子结构中的葡萄糖基使STZ选择性地进入胰岛β细胞,其解离的自由基可以破坏DNA结构,并抑制DNA多聚酶的活性,细胞内DNA含量减少,从而高度选择性地损伤大鼠胰岛β细胞,造成血糖的明显上升[2,9]。但是,单纯的STZ注射不能维持模型大鼠的持续高血糖状态,同时继续给予高脂饮食喂养造成持续的胰岛素抵抗,从而维持模型的稳定[10-11]。我们的研究结果显示大鼠高糖高脂饮食诱导4周后腹腔注射STZ造模,能使大鼠空腹血糖明显升高,胰岛素敏感指数明显下降,并出现体重下降、多饮多尿的糖尿病症状,这些症状一直持续至建模12周实验结束时。然而在实验过程中,我们发现建模8周时模型组大鼠的胰岛素水平并没有明显降低,而到了建模12周时才显著降低。可能是由于STZ注射造成大鼠胰岛β细胞部分被破坏,初期出现了胰岛素代偿性分泌,而随着造模时间的延长,这种代偿作用逐渐消失。同时,与正常对照组比较,造模大鼠肝脏总胆固醇、甘油三酯含量均明显升高,肝脏病理检测结果显示造模大鼠肝脏病变表现为肝细胞肿胀和轻度脂肪变性,同时血清中丙氨酸氨基转移酶活性明显升高,表明大鼠模型具有明显的非酒精性脂肪肝特征。综上所述,本研究利用高脂高糖饲料喂养联合腹腔注射STZ成功建立了2型糖尿病合并非酒精性脂肪肝大鼠模型。
为了进一步验证该大鼠模型,本研究利用其评价了常用降糖药二甲双胍的作用。二甲双胍自1957年问世以来,在临床上作为降糖药应用已经有超过50年的历史,其治疗糖尿病的作用机制复杂,主要包括:可直接抑制肝脏的糖异生作用从而降低空腹血糖[12];提高肌肉和脂肪组织对葡萄糖的摄取和利用率[13];减少小肠对葡萄糖的吸收;激活腺苷酸AMP活化的蛋白激酶(AMPK)通路,促进脂肪酸进入线粒体进行脂肪酸β氧化,从而减少脂肪的合成[14]。同时二甲双胍作为胰岛素增敏剂可以增强胰岛素与外周组织胰岛素受体的亲合力,促进葡萄糖的摄取和利用,改善组织对胰岛素的敏感性[15]。除了作为降糖药被广泛应用,目前二甲双胍在治疗非酒精性脂肪肝、多囊卵巢综合征、癌症等方面的潜力也被挖掘出来,逐渐成为研究的热点。有研究表明二甲双胍可改善肥胖小鼠肝脏的脂肪变性,对脂肪肝具有一定的治疗作用[16]。然而目前二甲双胍降脂的分子机制不甚明确,可能与腺苷酸活化蛋白激酶AMPK介导的脂肪酸氧化增加和脂肪合成减少有关[17]。本研究结果显示盐酸二甲双胍连续给药四周能明显降低模型大鼠空腹血糖,提高胰岛素敏感指数,改善糖耐量异常的状况;同时能明显降低肝脏TC含量。肝脏病理结果显示,盐酸二甲双胍可以改善模型大鼠的肝细胞肿胀和脂肪变性情况,减轻脂肪肝病变。因此可以认为该2型糖尿病合并非酒精性脂肪肝大鼠模型适合于降糖药物的筛选和评价研究。并且,此模型造模方法简单、易复制、模型稳定,可以广泛用于2型糖尿病及其并发症非酒精性脂肪肝的发病机制研究。
[1] DeFronzo R A.Pathogenesis of type2(non-insulin dependent) diabetes mellitus:a balanced overview[J].Diabetologia,1992,35(4):389-397.
[2] Junod A,Lambert A E,Orci L,et al.Studies of the diabetogenic action of streptozotocin[J].Experimental Biology and Medicine,1967,126(1):201-205.
[3] Rees D A,Alcolado J C.Animal models of diabetes mellitus[J].Diabetic medicine,2005,22(4):359-370.
[4] Greenfield V,Cheung O,Sanyal A J.Recent advances in nonalcoholic fatty liver disease[J].Current opinion in gastroenterology,2008,24(3):320-327.
[5] Angulo P.Nonalcoholic fatty liver disease[J].New England Journal of Medicine,2002,346(16):1221-1231.
[6] Choudhury J,Sanyal A J.Insulin resistance and the pathogenesis of nonalcoholic fatty liver disease[J].Clinics in liver disease,2004,8(3):575-594.
[7] Spady D K,Dietschy J M.Dietary saturated triacylglycerols suppress hepatic low density lipoprotein receptor activity in the hamster[J].Proceedings of the National Academy of Sciences,1985,82(13):4526-4530.
[8] Boden G.Fatty acid—induced inflammation and insulin resistance in skeletal muscle and liver[J].Current diabetes reports,2006,6(3):177-181.
[9] Ganda O P,Rossini A A,Like A A.Studies on streptozotocin diabetes[J].Diabetes,1976,25(7):595-603.
[10]Hildebrandt A L,Kelly-Sullivan D M,Black S C.Antiobesity effects of chronic cannabinoid CB1receptor antagonist treatment in diet-induced obese mice[J].European journal of pharmacology,2003,462(1):125-132.
[11]Yamashita T,Hashiramoto A,Haluzik M,et al.Enhanced insulin sensitivity in mice lacking ganglioside GM3[J].Proceedings of the National Academy of Sciences,2003,100(6):3445-3449.
[12]Foretz M,Hébrard S,Leclerc J,et al.Metformin inhibits hepatic gluconeogenesis in mice independently of the LKB1/AMPK pathway via a decrease in hepatic energy state[J].The Journal of clinical investigation,2010,120(7):2355-2369.
[13]Sarabia V,Lam L,Burdett E,et al.Glucose transport in human skeletal muscle cells in culture.Stimulation by insulin and metformin[J].Journal of Clinical Investigation,1992,90(4):1386.
[14]Zhou G,Myers R,Li Y,et al.Role of AMP-activated protein kinase in mechanism of metformin action[J].Journal of clinical investigation,2001,108(8):1167.
[15]Cohen S E, Tseng Y H, Michael M D. Effects of insulin-sensitising agents in mice with hepatic insulin resistance[J].Diabetologia,2004,47(3):407-411.
[16]Raso G M,Esposito E,Iacono A,et al.Comparative therapeutic effects of metformin and vitamin E in a model of non-alcoholic steatohepatitis in the young rat[J].European journal of pharmacology,2009,604(1):125-131.
[17]Musi N,Hirshman M F,Nygren J,et al.Metformin increases AMP-activated protein kinase activity in skeletal muscle of subjects with type 2 diabetes[J].Diabetes,2002,51(7):2074-2081.
EstablishmentofRatModelofType2DiabeteswithStreptozotocinandHigh-fatDiet
SUN Le1,PENG Jun2,YANG Runmei1*,XU Lijia1
(1.Key Laboratory of Bioactive Substances and Resources Utilization of Chinese Herbal Medicine,Ministry of Education,Institute of Medicinal Plant Development,Chinese Academy of Medical Science,Peking Union Medical College,Beijing 100093,China;2.School of Pharmacy,Guizhou Medical University,Guiyang 550025,China)
Objective:To establish a rat model of type-2 diabetes with nonalcoholic fatty liver disease (NAFLD) induced by streptozotocin (STZ) and high-fat diet.Methods:35 Wistar male rats were randomly divided into two groups:the control group and the model group,which were given the control diet and the high-fat diet respectively.The rats in the model group were induced diabetes by intraperitoneal injection of 30 mg·kg-1STZ after 4 weeks.Then we measured and analyzed the changes of fasting blood glucose level (FBG),insulin concentrations,and insulin sensitivity index (ISI) at the 8thweek.The rats in the model group that were successfully induced diabetes were further divided into two groups based on FBG:the model group and metformin group.The rats in the metformin group were administered with 200 mg·kg-1metformin for 4 weeks.At the end of the experiment,the oral glucose tolerance test (OGTT) was performed,also the FBG,ISI,hepatic lipid concentrations were detected.Results:The rats in the model group showed the typical symptoms of diabetes:weight loss,polydipsia and polyuria.Moreover,compared to the control group,the FBG significantly increased (P<0.001)and ISI significantly decreased (P<0.001) in the rats of model group at the 8th and 12thweek.At the 12thweek,the AUCG significantly decreased (P<0.001),and the FBG,serum ALT activity significantly decreased (P<0.01) and hepatic TC concentration obviously decreased (P<0.5) in the metformin group compared with the model.Conclusion:A stable rat model for type-2 diabetes was successfully established by the induction of high-fat diet combined with the injection of STZ.The effect of metformin in the experiment suggests that the model was proper for evaluating the hypoglycemic agent.
Type-2 diabetes;nonalcoholic fatty liver disease;high-fat diet;streptozotocin
协和青年基金资助项目(3332015142);中国医学科学院医学与健康科技创新工程(2016-I2M-1-012)
] 杨润梅,副研究员,研究方向:中药药理学;E-mail:rmyang@implad.ac.cn
10.13313/j.issn.1673-4890.2017.8.018
2016-11-22)
*[
