动物毒素多肽物质基础和药理机制△
2017-09-21吕秋敏赖仞张恬李军德
吕秋敏,赖仞*,张恬,李军德*
(1.中国科学院 昆明动物研究所,云南 昆明 650223;2.道地药材国家重点实验室培育基地,中国中医科学院中药资源中心,北京 100700)
·综述·
动物毒素多肽物质基础和药理机制△
吕秋敏1,赖仞1*,张恬2,李军德2*
(1.中国科学院 昆明动物研究所,云南 昆明650223;2.道地药材国家重点实验室培育基地,中国中医科学院中药资源中心,北京100700)
传统中医使用的有毒药用动物在临床中的长期实践和成功成为现代药物开发的宝贵经验和资源。它们被用来治疗多种心血管、神经和免疫等相关疾病。有毒药用动物来源的动物多肽毒素成为开发针对人类重大疾病的重要药物候选分子。本文概述了有毒药用动物来源的蛋白多肽药物的结构特征和药理学作用机制,同时着重介绍了我国具有潜在开发和利用价值的动物毒素的研究进展。
动物药材;有毒动物;多肽毒素;药理机制;药物开发
随着现代科学技术特别是生物化学与分子生物学理论和技术的发展,大量对动物毒素在分子水平的研究揭示,动物多肽毒素是现代创新药物的宝贵资源[1-4]。常见和熟知的产毒动物包括刺胞动物门的水母、海葵和水螅,软体动物门的芋螺,环节动物门的水蛭,节肢动物门的蜘蛛、蝎子、蜈蚣、蜜蜂、胡蜂、虻和蜱类,一些甲壳类动物物种,棘皮动物门的海胆、海星,脊椎动物的鱼类、蛇、蜥蜴以及哺乳动物鸭嘴兽、一些食虫类物种、吸血蝙蝠和灵长类懒猴[1-5]。我国地域辽阔,气候和生物高度多样化,为开展产毒动物研究提供了丰富的资源[1],见表1。《中华人民共和国药典》2015版收载的100多种药用动物中较多是产毒动物。这些动物类中药在临床长期的实践和成功,成为现代中药开发的宝贵资源和源泉。
1 蛇毒来源的药物
蛇毒是具有多种药理和毒理作用的毒素分子的混合物,主要分为血液毒素和神经毒素。其中很多成分已经成为药物或者具有成药潜力[8-9],见图1。
1.1神经毒与镇痛
突触后神经毒素分为2种类型,即短链和长链神经毒素。蛇毒神经毒可以和神经肌肉接头处的乙酰胆碱受体结合,阻断神经信号的传递[10]。以眼镜蛇毒神经毒为原料药研发了克洛曲片[11]。此外,神经毒素组分制成的Cobroxin和Nyloxin等制剂,分别用于治疗顽固性疼痛、恶性肿瘤疼痛和关节痛,已获美国食品药品管理局(FDA)批准[12]。
1.2去整合素与血栓
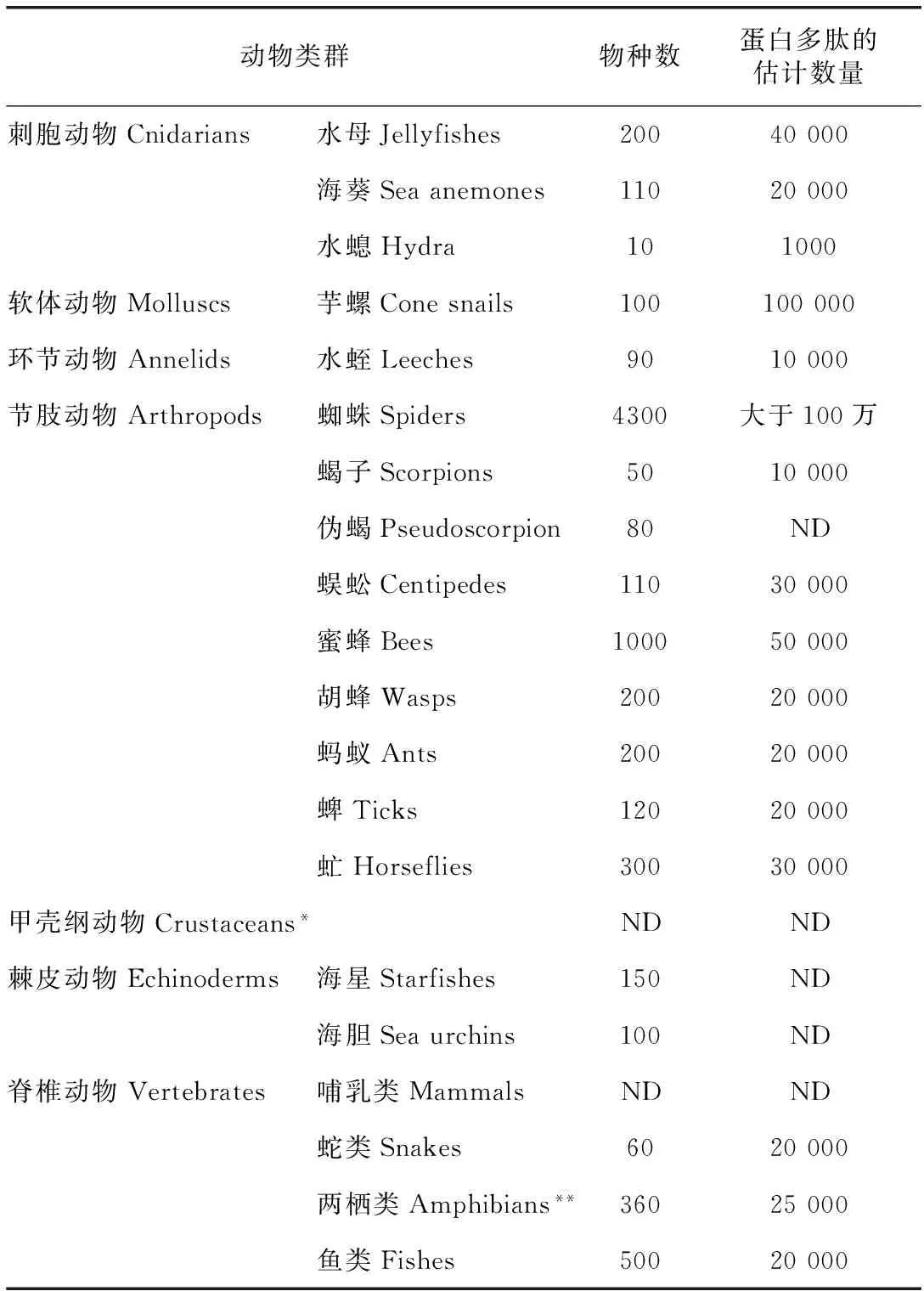
表1 中国主要产毒动物及蛋白多肽毒素分子多样性
注:中国目前已知的产毒动物类群和大致物种数量统计按动物类群列出[1];*最近的报道表明某些甲壳动物物种也拥有毒液系统和毒素成分[6];**两栖动物不是典型的产毒动物,但富含蛋白多肽活性分子[1,7];ND:无可靠的数据。
蛇毒去整合素蛋白(disintegrin)家族一般具有分子量低、半胱氨酸丰富、含RGD结构等特点[13]。去整合素能与干扰血小板膜受体αIIbβ3与纤维蛋白原有效接触,因此去整合素能抑制多种激动剂诱导的血小板聚集[14]。该类衍生物在临床实验中表现出良好的效果[14]。
1.3抗菌肽(Cathelicidin)与感染
从金环蛇和眼镜王蛇中分别克隆到cathelicidin类似物[15-16]。与人源的cathelicidin相比,眼镜王蛇的cathelicidin溶血活性较低,而且其抗菌活性不受金属离子及粘蛋白的影响[15]。以动物来源的抗菌肽cathelicidin-BF为模板,设计合成了抗临床耐药白色念球菌的优良新型抗菌肽[17]。
1.4神经生长因子与神经修复
蛇毒神经生长因子对于人们认知该类生长因子起到了极为重要的推动作用[18]。眼镜蛇中克隆和纯化的神经生长因子可以促进PC12细胞和鸡胚背根神经节的生长[19]。与人源的神经生长因子相比,它的稳定性和活性相对较高。另外,它还可以防止棉酚造成的雄性小鼠不育[20]。

注:无下画线为抑制型成分;有下画线为激活型成分。图1 蛇毒在药物中的运用
1.5CVF与器官移植
眼镜蛇毒因子(CVF,cobra venom factor)可以和血浆因子B结合,从被血浆因子切割成CVF Bb和CVF Ba。Bb是一个C3/C5转化酶,可以激活补体替代途径,消耗补体C3[21]。
云南产的孟加拉眼镜蛇蛇毒CVF(Y-CVF)由3个不同的亚基组成[22]。Y-CVF显著抑制猪-恒河猴心脏移植的急性超排反应,延长豚鼠-大鼠心脏移植的生存率,改善对循环补体的抑制[23]。眼镜王蛇(Ophiophagushannah)蛇毒CVF被命名为OVF[24]。
1.6蛋白酶与血栓
目前分离纯化得到的具有抗血栓作用的蛇毒蛋白酶大致可分为3类:类凝血酶(凝血酶样酶)、纤维蛋白(原)溶解酶和纤溶酶原激活剂[9],见图2。
蛇毒类凝血酶(snakevenomthrombin-likeenzymes,SVTLEs)是蛇毒中与血浆凝血酶性质相似的一类酶的总称。已知的SVTLEs均由一条肽链组成,一般具有6个二硫键[9]。目前用于临床的主要为安克洛酶(ancrod)和巴曲酶(batroxobin)。蕲蛇酶注射液是我国研制的蛇毒抗栓酶制剂,已广泛应用于脑血栓或静脉血栓的治疗。
蛇毒纤维蛋白(原)溶酶[fibrin(ogen)olyticenzyme,FLE]简称纤溶酶。同以往的抗栓药物相比,纤溶酶具有起效快、不良反应小等特点[9]。多种蛇毒纤溶酶类溶栓药物都已进入临床使用。另外,从竹叶青蛇毒中分离纯化出的新型酶原激活剂TSV-PA为研制新的抗栓药提供了新思路[25]。
1.7血管紧张素酶抑制剂
研究人员发现,巴西毒蛇Bothropsjararaca毒液中的一个九肽teprotide对血管紧张素转化酶(ACE)具有特异的抑制作用、降压作用[26]。以它为模板合成了一系列羧基链烷醇和巯基链烷醇的脯氨酸酯。它们均显示了良好的ACE抑制活性,其中化合物SQ14225被开发成最早的ACE抑制药,即卡托普利(captopril)[27]。
1.8利钠肽
利钠肽包括心房利钠肽(atrialnatriureticpeptide,ANP)、脑钠肽(brainnatriureticpeptide,BNP)和C型利钠肽(Ctypenatriureticpeptide,CNP)[28]。利钠肽信号系统的异常影响着临床心血管疾病的发生和发展,可造成不同器官和组织的损伤[29]。从眼镜王蛇毒腺中克隆到的编码利钠肽Oh-NP的cDNA含有2个类似的CFGXXDRIGC结构域,因而可翻译后加工为2个成熟的利钠肽分子[30]。
2 两栖动物皮肤分泌物
两栖动物的皮肤是其生存的重要器官。它担负着许多生理功能,如呼吸、水分调节、温度控制、排泄、繁殖、抵抗微生物、防御天敌等[7],其中一些成分具有重要的应用前景。见图3。
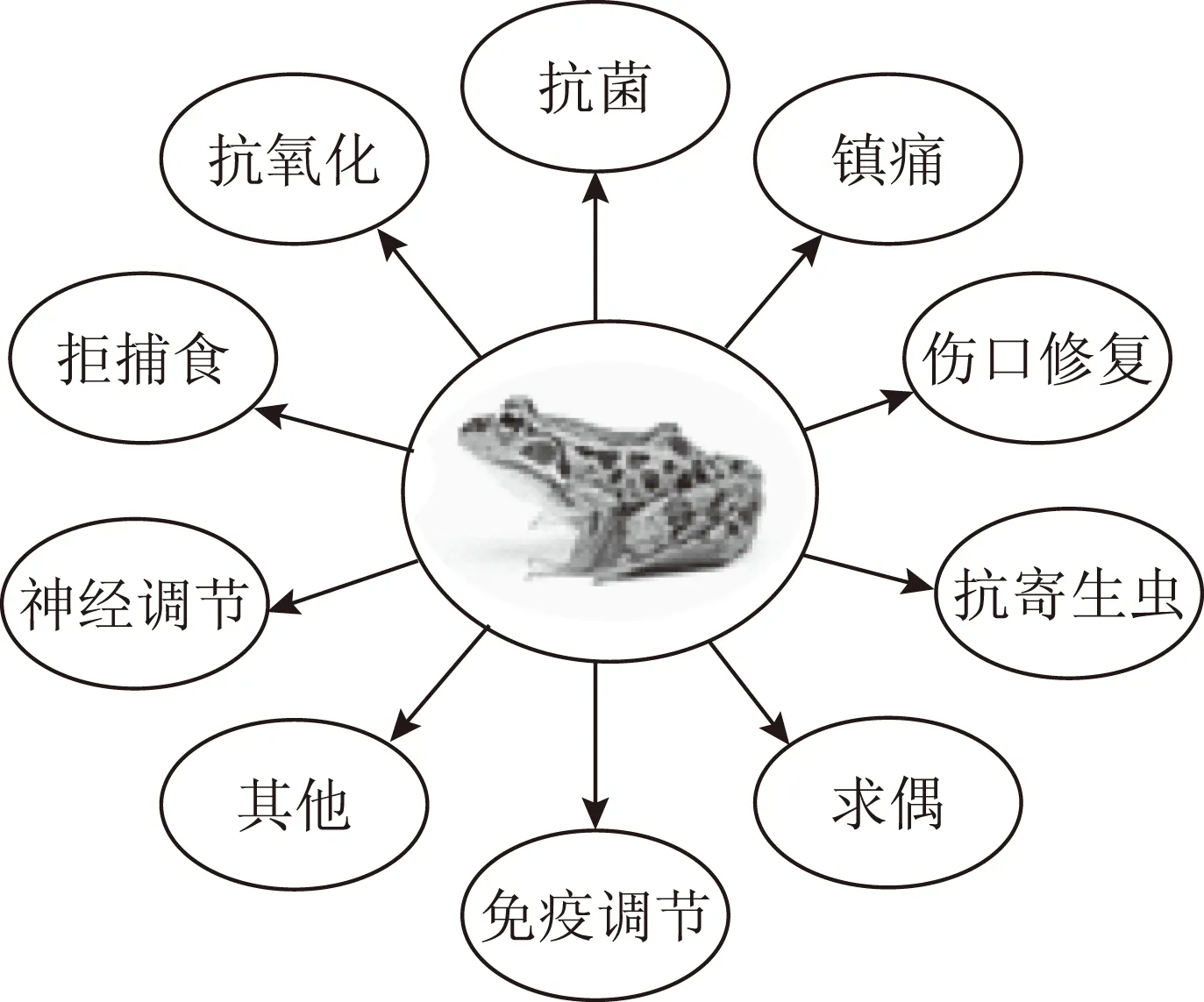
图3 两栖动物皮肤分泌物活性成分的功能
2.1抗菌肽与感染
在两栖动物的皮肤分泌物中,抗菌肽是所有多肽中数量和种类最多的。到目前为止,已经有超过1900种两栖动物皮肤抗菌肽被发现。这些抗菌肽分别属于100多个家族[7]。从双团棘胸蛙(Paayunnanensis)的皮肤中分离得到了一个cathelicidin类的抗菌肽cathelicidin-PY[31],具有很强的抗菌能力。基于已有的大量抗菌肽序列设计合成的15个氨基酸残基的小肽LZ1表现出非常强的对痤疮相关微生物的杀灭作用[32]。
2.2抗氧化肽
从滇蛙皮肤分泌液中发现了11个家族的抗氧化多肽。这些抗氧化多肽是由15~30个氨基酸组成的小肽。抗氧化多肽序列中的还原性半胱氨酸对快速清除自由基起着关键作用[33]。具有抗氧化活性小肽的发现及相关肽类的挖掘是皮肤保护、皮肤抗氧化领域的重大发现。
2.3蛙皮凝集素作为药物输送载体
从无指盘臭蛙皮肤中识别了一个小分子质量的凝集素Odorranalectin。其分子质量仅有1700Da,仅含有一对二硫键[34]。在小鼠模型中静脉注射后,Odorranalectin主要结合到肝脏、脾脏和肺等器官,因此具有药物靶向输送载体的潜力[35]。
2.4伤口修复肽
从红瘰疣螈皮肤中鉴定出了一条12个氨基酸残基的强效皮肤修复肽Tylotoin,可以促进角质细胞和成纤维细胞的增殖和迁移,从而促进受损皮肤上皮化和肉芽组织的形成[36]。从无指盘臭蛙皮肤中鉴定了AH90。在小鼠全层皮损模型中,AH90也表现出强烈的促创伤愈合活性[37]。
2.5神经毒素类似肽
从华西雨蛙皮肤分泌液中发现了基因编码的神经毒anntoxin[38]。该毒素含有60个氨基酸残基,通过阻断河豚毒素敏感的钠离子通道来发挥神经毒活性。采用蛋白质组学和转录组学手段从树蛙皮肤中发现了包括神经毒素、类似蛇毒磷脂酶的多种毒素多肽与蛋白[39],其在镇痛方面的运用还需深入研究。
3 节肢动物分泌物
3.1吸血蜱分泌物
到目前为止,已发现蜱能够产生前列腺素、抗凝因子、免疫抑制剂、抗炎症蛋白和抗菌肽等来克服宿主的防御反应。从硬蜱(Amblyommahebraeum)中鉴定了一个新的凝血酶抑制剂Amblin[40]。从中华硬蜱神经节中分离出两种神经肽a和b。该阿片肽类似物为首次得到的蜱类神经肽[41]。
3.2牛虻与血栓
在长期的与宿主相互作用进化过程中,吸血节肢动物唾液腺形成了一系列有助于适应吸血生存的活性物质,见图4。
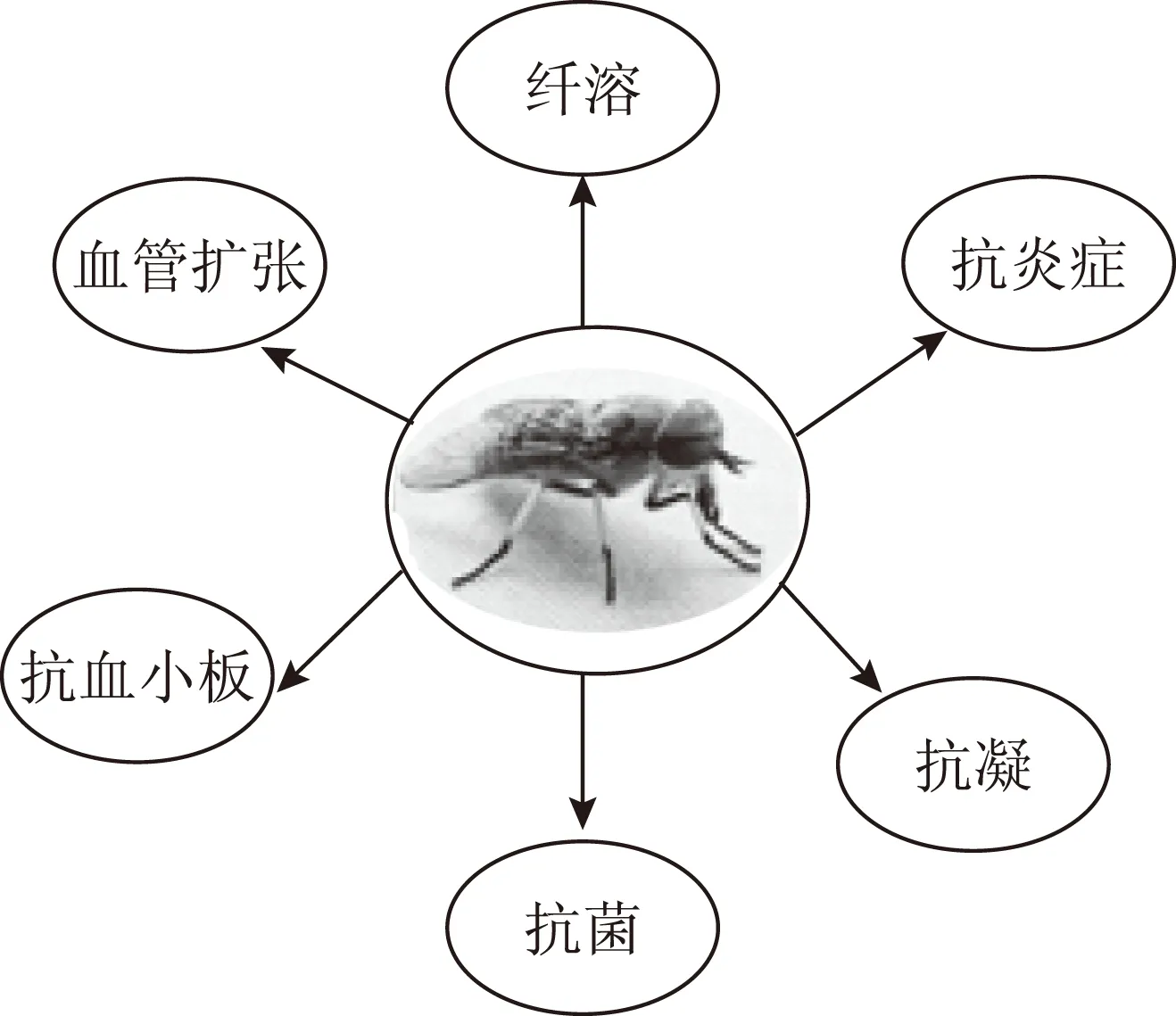
图4 牛虻唾液腺活性成分的功能
从牛虻唾液腺中获得了新型抗血小板集聚因子、新型免疫抑制剂多肽、凝血酶抑制剂、抗凝血的丝氨基酸蛋白酶、纤维蛋白原水解酶、三个家族的抗菌肽、透明质酸酶、血管舒张因子、抗氧化的金属硫蛋白九大类生物活性物质[42-43]。这些研究部分揭示了中药材虻虫作为重要传统抗血栓中药的分子机制,发现了多种具有潜在药用价值的先导结构分子。
4 海葵毒素
海葵神经毒素主要作用于细胞膜上的钠、钾等离子通道,通过改变通道活性而起到特定生物活性[44]。部分海葵多肽类神经毒素具有增强心肌收缩力的活性[44]。海葵Stichodactylahelianthus中的神经毒素ShK是一种强烈的KV1.3通道阻断剂,可以对自体免疫性疾病起到免疫调节作用[45],见图5。

图5 具运用前景的海葵毒素
5 芋螺毒素
全世界大约有5万多种芋螺毒素。其相对分子质量小,结构新颖,对离子通道、膜受体具有高度选择性和亲和力,因而其具有广阔的应用前景和潜在的开发价值[46-47]。其中,很多作用靶点直接与痛疼有关,见图6。多个大型制药公司都在进行芋螺毒素类新药的开发工作[48]。

图6 芋螺毒素的作用途径
5.1α-芋螺毒素
α-芋螺毒素结合到nAChRs的α-subunits上,阻止了乙酰胆碱及其他激动剂的结合,抑制突触(神经元或神经肌肉)连接处的信号传导,影响动作电位的变化。Metabolic Pharmaceuticals公司合成了16个氨基酸残基的α-芋螺毒素Vc1.1(ACV1),已进入Ⅱ期临床实验[49]。
5.2ω-芋螺毒素
ω-芋螺毒素由24~30个氨基酸组成,是一类作用于钙离子通道(CaV)的芋螺毒素。ω-芋螺毒素GVIA、MVIIA和CVID选择性地作用于N-type CaV通道,显示了良好的神经保护和镇痛特性[50]。MVIIA是第一种进入临床实验的ω-芋螺毒素。CVID(AM336)也已进入临床实验阶段。
5.3μ-芋螺毒素
μ-芋螺毒素家族均为钠离子通道拮抗剂,而δ-芋螺毒素也可抑制钠通道。Cognetix公司将16个氨基酸组成的Contulakin-G(CGX-1160)开发为一种用于治疗手术后短期疼痛的镇痛药,正在进行Ⅱ期临床实验[51]。
5.4其他竽螺毒素
Conantokins是一类竞争性抑制谷氨酸激活的多肽,可作用于不同的人脑NMDA受体类型。Conantokin-G衍生物(CGX-1007)能控制顽固性癫痫的发作,目前已进入Ⅱ期临床实验[52]。
ρ-Conotoxin和χ-Conotoxin中的ρTIA和χ-MrIA已被证明分别调节α1-adrenoreceptor和去甲肾上腺素神经元的转运[53]。Xen2174是Xenome公司开发的一种已进入Ⅱ期临床实验的通过鞘内注射来减轻神经性疼痛的药物[54]。
6 氯离子通道蝎毒素
蝎毒素一般含3或4对二硫键,可以选择性地与动物可兴奋细胞膜上的钠、钾、钙、氯离子通道结合,影响离子通道的状态,成为研究离子通道生理作用和功能定位的重要工具之一[55]。氯离子通道蝎毒素Chlorotoxin(Cltx)可阻断小电导氯离子通道,抑制神经胶质瘤侵袭与转移,见图7。Cltx不仅能阻断小电导氯电流,而且可特异靶向神经胶质瘤,抑制神经胶质瘤的侵袭与转移。His-Cltx可以明显的降低人基质蛋白酶2(MMP-2)的胶原酶活性,从而阻止神经胶质瘤的转移与侵袭[56]。Cltx被FDA批准进入I/II期临床实验。

图7 氯离子通道蝎毒素的肿瘤抑制作用
7 蜥蜴毒素
Exenatide(exendin-4)是大毒蜥在进食时所分泌唾液中的类GLP-1物质的人工合成物[57]。美国Amylin和礼来制药公司共同开发的新药获FDA批准。Exenatide具有刺激胰岛β细胞的增殖与分化、降低胃排空的速率、促进饱食感等多种生理活性[58],其成为治疗2型糖尿病比较理想的药物。Exenatide结合到与G蛋白偶联的特异性受体上以后,引起胰岛素释放[59]。见图8
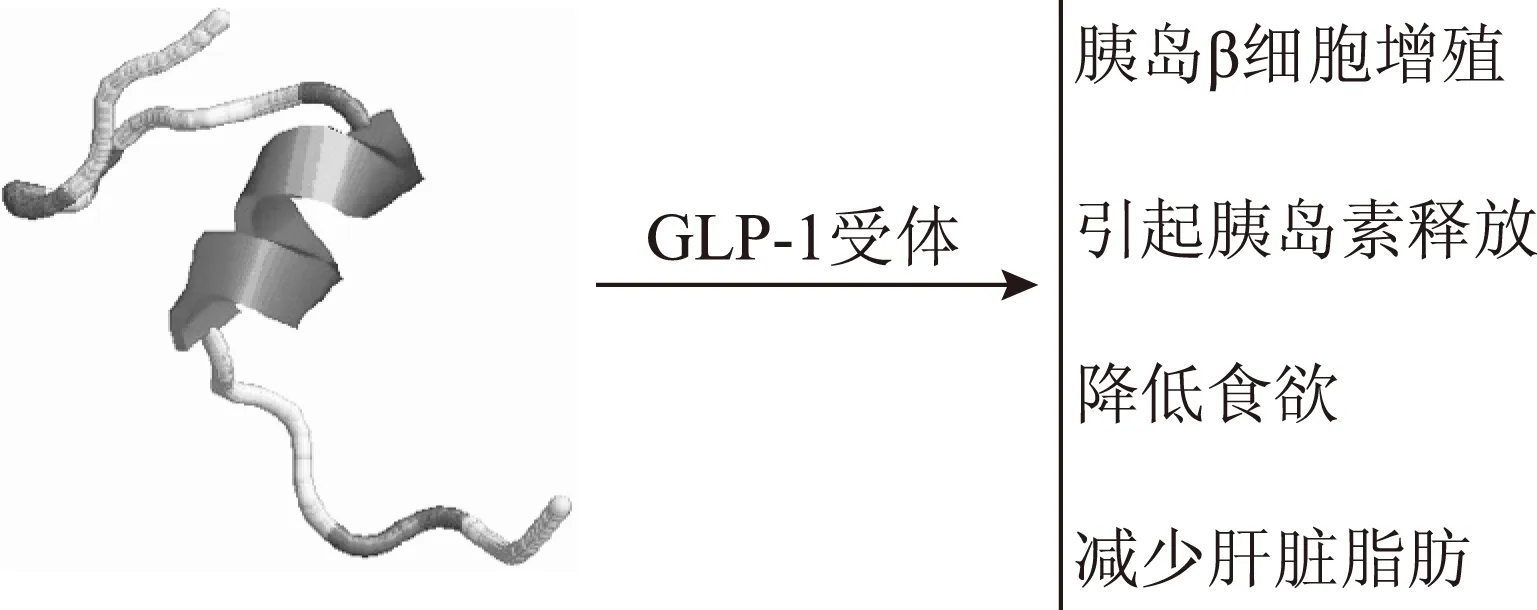
图8 蜥蜴来源的exendin-4及其作用
8 蜘蛛毒素
蜘蛛毒液中的毒素可作用于靶细胞膜上的各种离子通道,如钾、钙、钠、酸敏感通道等[2]。
部分蜘蛛多肽毒素对于通道亚型也有一定的选择性[60]。国际上已有多种蜘蛛多肽毒素作为先导分子被用于开发治疗多种疾病的药物,如心血管疾病、慢性疼痛、炎症及性功能障碍等[61]。见图9。

图9 部分具有运用潜力的蜘蛛毒素
虎纹镇痛肽-I(HWAP-I)是一种N-型电压门控钙离子通道(VGCC)专一性抑制剂,在几种疼痛动物模型中均有明显的镇痛活性[62]。HWAP-I在大鼠急性内脏疼痛模型中具有明显镇痛效应[63]。
虎纹捕鸟蛛胰蛋白酶抑制剂HWTX-XI是第一个从蜘蛛毒液中分离的具有Kunitz型结构模体的胰蛋白酶抑制剂,在治疗与胰蛋白酶相关的疾病中有较好的应用前景[64]。在小鼠急性胰腺炎模型中,HWTX-XI也表现出了优于抑肽酶和乌司他丁的治疗效果[65]。
Lycosin-I为从新疆穴居狼蛛毒液中分离的双亲性阳离子细胞毒活性肽,具有抗菌活性和抗癌活性[66]。Lycosin-I可与肿瘤细胞膜结合并进入细胞内,通过线粒体死亡通路诱导细胞凋亡和上调p27抑制细胞增殖[67]。
9 蜈蚣毒素
蜈蚣的猎物包括脊椎动物和无脊椎动物,如蝙蝠、老鼠、两栖类、爬行类和昆虫[68]。利用活性跟踪的分离方法从少棘蜈蚣中纯化了10个神经毒素[69]。运用质谱分析又发现了196个非重复的多肽[70]。金头蜈蚣来源的μ-SLPTX-Ssm6a对离子通道1.7亚型(NaV1.7)具有高度选择性。通过小鼠镇痛动物模型研究表明,μ-SLPTX-Ssm6a具有比吗啡更强的镇痛作用[71]。
少棘蜈蚣多肽神经毒素RhTx能诱导野生型小鼠产生剧烈的急性疼痛[72]。RhTx可以利用电场力和疏水力与通道的孔区转角结构和螺旋结构进行直接的相互作用,并且通过影响TRPV1的热激活门来控过程激活通道[72]。见图10。
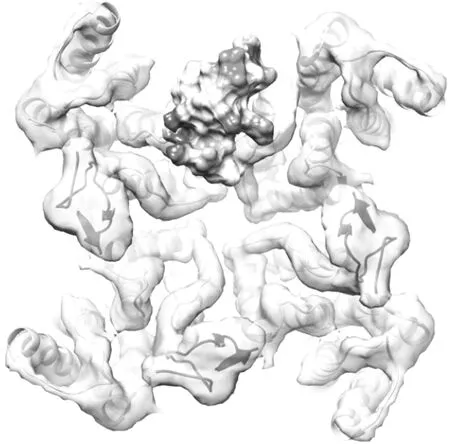
注:带状示意TRPV1的主链结构。图10 蜈蚣多肽RhTx与TRPV1离子通道孔外区结合激活通道
TRPV1已经被作为镇痛药QX-314或细胞毒素Ca2+抑制神经元的靶点来进行研究[73]。RhTx和基于RhTx的衍生物可能会开启一条崭新的控制痛觉感受器的途径。
[1] Zhang Y.Why do we study animal toxins[J].DongwuxueYanjiu,2015,36(4):183-222.
[2] Yan S,Wang X.Recent advances in research on widow spider venoms and toxins[J].Toxins(Basel),2015,7(12):5055-5067.
[3] 梁宋平.动物多肽毒素及其药物学研究[J].南师范大学学报(医学版),2012,9(1):1-5.
[4] Casewell N R,Wüster W, Vonk F J,et al.Complex cocktails:the evolutionary novelty of venoms[J].Trends Ecol Evol,2013,28(4):219-229.
[5] Prashanth J R,Brust A,Jin A H,et al.Cone snail venomics:from novel biology to novel therapeutics[J].Future Med Chem,2014,6(15):1659-1675.
[6] von Reumont B M,Blanke A,Richter S,et al.The first venomous crustacean revealed by transcriptomics and functional morphology:remipede venom glands express a unique toxin cocktail dominated by enzymes and a neurotoxin[J].Mol Biol Evol,2014,31(1):48-58.
[7] Xu X,Lai R.The chemistry and biological activities of peptides from amphibian skin secretions[J].Chem Rev,2015,115(4):1760-1846.
[8] King G F.Venoms as a platform for human drugs:translating toxins into therapeutics[J].Expert Opin Biol Ther,2011,11(11):1469-1484.
[9] Kini R M.Toxins in thrombosis and haemostasis:potential beyond imagination[J].J Thromb Haemost,2011,9(Suppl1):195-208.
[10]Dutertre S,Lewis R J.Toxin insights into nicotinic acetylcholine receptors[J].Biochem Pharmacol,2006,72(6):661-670.
[11]吕秋敏,赖仞,张云.动物毒素与人类疾病:从单一成分到组学研究,从理化性质到疾病机理,从粗毒利用到理性药物设计[J].动物学研究,2010,31(1):2-16.
[12]Reid P F.Alpha-cobratoxin as a possible therapy for multiple sclerosis:a review of the literature leading to its development for this application[J].Crit Rev Immunol,2007,27(4):291-302.
[13]Assumpcao T C,Ribeiro J M,Francischetti I M.Disintegrins from hematophagous sources[J].Toxins(Basel),2012,4(5):296-322.
[14]Arruda Macêdo J K,Fox J W,de Souza Castro M.Disintegrins from snake venoms and their applications in cancer research and therapy[J].Curr Protein Pept Sci,2015,16(6):532-548.
[15]Zhao H,Gan T X,Liu X D,et al.Identification and characterization of novel reptile cathelicidins from elapid snakes[J].Peptides,2008,29(10):1685-1691.
[16]Wang Y,Hong J,Liu X,et al.Snake cathelicidin from Bungarus fasciatus is a potent peptide antibiotics[J].PLoS One,2008,3(9):e3217.
[17]Jin L,Bai X,Luan N,et al.A Designed Tryptophan-and Lysine/Arginine-Rich Antimicrobial Peptide with Therapeutic Potential for Clinical Antibiotic-Resistant Candida albicans Vaginitis[J].J Med Chem,2016,59(5):1791-1799.
[18]Kostiza T,Meier J.Nerve growth factors from snake venoms:chemical properties,mode of action and biological significance[J].Toxicon,1996,34(7):787-806.
[19]Trummal K,Tõnismägi K,Paalme V,et al.Molecular diversity of snake venom nerve growth factors[J].Toxicon,2011,58(4):363-368.
[20]Xu T R,Wang W Y,Huang Y H,et al.A nerve growth factor from the venom of Chinese cobra(Najanajaatra)and its effects on male reproductive system in rats[J].Comp Biochem Physiol C Pharmacol Toxicol Endocrinol,1999,124(2):149-156.
[21]Vogel C W,Fritzinger D C,Gorsuch W B,et al.Complement depletion with humanised cobra venom factor:efficacy in preclinical models of vascular diseases[J].Thromb Haemost,2015,113(3):548-552.
[22]Sun Q Y,Chen G,Guo H,et al.Prolonged cardiac xenograft survival in guinea pig-to-rat model by a highly active cobra venom factor[J].Toxicon,2003,42(3):257-262.
[23]Chen Song S,Zhong S,Xiang Y,et al.Complement inhibition enables renal allograft accommodation and long-term engraftment in presensitized nonhuman primates[J].Am J Transplant,2011,11(10):2057-2066.
[24]Zeng L,Sun Q Y,Jin Y,et al.Molecular cloning and characterization of a complement-depleting factor from king cobra,OphiophagusHannah[J].Toxicon,2012,60(3):290-301.
[25]Zhang Y,Wisner A,Xiong Y,et al.A novel plasminogen activator from snake venom.Purification,characterization,and molecular cloning[J].J Biol Chem,1995,270(17):10246-1055.
[26]Rebello Horta C C,Chatzaki M,Rezende B A,et al.Cardiovascular-Active Venom Toxins:An Overview[J].Curr Med Chem,2016,23(6):603-622.
[27]Ogawa R,Stachnik J M,Echizen H.Clinical pharmacokinetics of drugs in patients with heart failure:an update(part2,drugs administered orally)[J].Clin Pharmacokinet,2014,53(12):1083-1114.
[28]Kerkelä R,Ulvila J,Magga J.Natriuretic peptides in the regulation of cardiovascular physiology and metabolic events[J].J Am Heart Assoc,2015,4(10):e002423.
[29]Sezai A,Shiono M.Natriuretic peptides for perioperative management of cardiac surgery[J].J Cardiol,2016,67(1):15-21.
[30]Lei W,Zhang Y,Yu G,et al.Cloning and sequence analysis of anOphiophagushannahcDNA encoding a precursor of two natriuretic peptide domains[J].Toxicon,2011,57(5):811-816.
[31]Wei L,Yang J,He X,et al.Structure and function of a potent lipopolysaccharide-binding antimicrobial and anti-inflammatory peptide[J].J Med Chem,2013,56(9):3546-3556.
[32]Zhang Z,Mu L,Tang J,et al.A small peptide with therapeutic potential for inflammatory acne vulgaris[J].PLoS One,2013,8(8):e72923.
[33]Yang H,Wang X,Liu X,et al.Antioxidant peptidomics reveals novel skin antioxidant system[J].Mol Cell Proteomics,2009,8(3):571-583.
[34]Li J,Wu H,Hong J,et al.Odorranalectin is a small peptide lectin with potential for drug delivery and targeting[J].PLoS One,2008,3(6):e2381.
[35]Wu H,Li J,Zhang Q,et al.A novel small Odorranalectin-bearing cubosomes:preparation,brain delivery and pharmacodynamic study on amyloid-β25-35-treated rats following intranasal administration[J].Eur J Pharm Biopharm,2012,80(2):368-378.
[36]Mu L,Tang J,Liu H,et al.A potential wound-healing-promoting peptide from salamander skin[J].FASEB J,2014,28(9):3919-3929.
[37]Liu H,Duan Z,Tang J,et al.A short peptide from frog skin accelerates diabetic wound healing[J].FEBS J,2014,281(20):4633-4643
[38]You D,Hong J,Rong M,et al.The first gene-encoded amphibian neurotoxin[J].J Biol Chem,2009,284(33):22079-22086.
[39]Wei L,Dong L,Zhao T,et al.Analgesic and anti-inflammatory effects of the amphibian neurotoxin,anntoxin[J].Biochimie,2011,93(6):995-1000.
[40]Lai R,Takeuchi H,Jonczy J,et al.A thrombin inhibitor from the ixodid tick,Amblyommahebraeum[J].Gene,2004,342(2):243-249.
[41]Liang J G,Zhang J,Lai R,et al.An opioid peptide from synganglia of the tick,Amblyommatestindinarium[J].Peptides,2005,26(4):603-606
[42]Xu X,Yang H,Ma D,et al.Toward an understanding of the molecular mechanism for successful blood feeding by coupling proteomics analysis with pharmacological testing of horsefly salivary glands[J].Mol Cell Proteomics,2008,7(3):582-590.
[43]Ma D,Wang Y,Yang H,et al.Anti-thrombosis repertoire of blood-feeding horsefly salivary glands[J].Mol Cell Proteomics,2009,8(9):2071-2079.
[44]Mariottini G L,Bonello G,Giacco E,et al.Neurotoxic and neuroactive compounds from Cnidaria:five decades of research….and more[J].Cent Nerv Syst Agents Med Chem,2015,15(2):74-80.
[45]Beeton C,Pennington M W,Norton R S.Analogs of the sea anemone potassium channel blocker ShK for the treatment of autoimmune diseases[J].Inflamm Allergy Drug Targets,2011,10(5):313-321.
[46]Essack M,Bajic V B,Archer J A.Conotoxins that confer therapeutic possibilities[J].Mar Drugs,2012,10(6):1244-1265.
[47]Rashid M H,Mahdavi S,Kuyucak S.Computational studies of marine toxins targeting ion channels[J].Mar Drugs,2013,11(3):848-869.
[48]Harvey A L.Toxins and drug discovery[J].Toxicon,2014,92:193-200.
[49]Carstens B B,Berecki G,Daniel J T,et al.Structure-activity studies of cysteine-rich α-conotoxins that inhibit high-voltage-activated calcium channels via GABAB receptor activation reveal a minimal functional motif[J].Angew Chem Int Ed Engl,2016,55(15):4692-4696.
[50]Adams D J,Callaghan B,Berecki G.Analgesic conotoxins:block and G protein-coupled receptor modulation of N-type(Ca(V)2.2)calcium channels[J].Br J Pharmacol,2012,166(2):486-500.
[51]Sang C N,Barnabe K J,Kern S E.Phase IA clinical trial evaluating the tolerability,pharmacokinetics,and analgesic efficacy of an intrathecally administered neurotensin a analogue in central neuropathic pain following spinal cord injury[J].ClinPharmacolDrugDev,2016,5(4):250-258.
[52]Alex A B,Saunders G W,Dalpé-Charron A,et al.CGX-1007prevents excitotoxic cell death via actions at multiple types of NMDA receptors[J].Neurotoxicology,2011,32(4):392-399.
[53]Lewis R J.Discovery and development of the χ-conopeptide class of analgesic peptides[J].Toxicon,2012,59(4):524-528.
[54]Sharpe I A,Gehrmann J,Loughnan M L,et al.Two new classes of conopeptides inhibit the alpha1-adrenoceptor and noradrenaline transporter[J].Nat Neurosci,2001,4(9):902-907.
[55]Janardhan B,Francois N N,More V S,et al.Scorpion toxin polyptides as therapeutic agents:an overview[J].Protein Pept Lett,2016(in press).
[56]Zhao L,Shi X,Zhao J.Chlorotoxin-conjugated nanoparticles for targeted imaging and therapy of glioma[J].Curr Top Med Chem,2015,15(13):1196-1208.
[57]Janzen K M,Steuber T D,Nisly S A.GLP-1agonists in type1diabetes mellitus[J].Ann Pharmacother,2016,50(8):656-665.
[58]Su N,Li Y,Xu T,et al.Exenatide in obese or overweight patients without diabetes:A systematic review and meta-analyses of randomized controlled trials[J].Int J Cardiol,2016,219:293-300.
[59]Uccellatore A,Genovese S,Dicembrini I,et al.Comparison review of short-acting and long-acting glucagon-like peptide-1receptor agonists[J].Diabetes Ther,2015,6(3):239-256.
[60]Kalia J,Milescu M,Salvatierra J,et al.From foe to friend:using animal toxins to investigate ion channel function[J].J Mol Biol,2015,427(1):158-175.
[61]Klint J K,Senff S,Rupasinghe D B,et al.Spider-venom peptides that target voltage-gated sodium channels:pharmacological tools and potential therapeutic leads[J].Toxicon,2012,60(4):478-491.
[62]Liang S.An overview of peptide toxins from the venom of the Chinese bird spiderSelenocosmiahuwenaWang[J].Toxicon,2004,43(5):575-585.
[63]陈嘉勤,陈威华,邓梅春,等.一种新型N-型电压敏感性钙通道拮抗剂虎纹蜘蛛毒素-I对大鼠内脏痛模型镇痛作用的研究[J].第一军医大学学报,2005,25(1):10-14.
[64]Jiang L,Deng M,Duan Z,et al.Molecular cloning,bioinformatics analysis and functional characterization of HWTX-XI toxin superfamily from the spiderOrnithoctonushuwena[J].Peptides,2014,54:9-18.
[65]邓星灿.虎纹捕鸟蛛毒素XI(HWTX-XI)对急性胰腺炎的治疗作用[D].长沙:湖南师范大学,2008.
[66]Liu Z,Deng M,Xiang J,et al.A novel spider peptide toxin suppresses tumor growth through dual signaling pathways[J].Curr Mol Med,2012,12(10):1350-1360.
[67]Tan H,Luo W,Wei L,et al.Quantifying the distribution of the stoichiometric composition of anticancer peptide lycosin-I on the lipid membrane with single molecule spectroscopy[J].J Phys Chem B,2016,120(12):3081-3088.
[68]Undheim E A,King G F.On the venom system of centipedes(Chilopoda),a neglected group of venomous animals[J].Toxicon,2011,57(4):512-524.
[69]Yang S,Liu Z,Xiao Y,et al.Chemical punch packed in venoms makes centipedes excellent predators[J].Mol Cell Proteomics,2012,11(9):640-650.
[70]Rong M,Yang S,Wen B,et al.Peptidomics combined with cDNA library unravel the diversity of centipede venom[J].J Proteomics,2015,114:28-37.
[71]Yang S,Xiao Y,Kang D,et al.Discovery of a selective NaV1.7inhibitor from centipede venom with analgesic efficacy exceeding morphine in rodent pain models[J].Proc Natl Acad Sci USA,2013,110(43):17534-17539.
[72]Yang S,Yang F,Wei N,et al.A pain-inducing centipede toxin targets the heat activation machinery of nociceptor TRPV1[J].Nat Commun,2015,6:8297.
[73]Stueber T,Eberhardt M J,Hadamitzky C,et al.Quaternary lidocaine derivative QX-314activates and permeates human TRPV1and TRPA1to produce inhibition of sodium channels and cytotoxicity[J].Anesthesiology,2016,124(5):1153-1165.
SubstanceBasesandPharmacologicalMechanismsofAnimalPeptideToxins
LYU Qiumin1,LAI Ren1*,ZHANG Tian,LI Junde2*
(1.Kunming Institute of Zoology,Chinese Academy of science,Kunming 650223,China;2.State Key Laboratory Breeding Base of Dao-di Herbs,National Resource Center for Chinese Materia Medica,China Academy of Chinese Medical Sciences,Beijing 100700,China)
The long history and successful practice of utilization of venomous animals in traditional Chinese medicines provide valuable experience and resources for modern drug development.The venomous animal medicines are used to treat many cardiovascular,nerve and immunologic diseases.Peptide toxins from venomous animals have become important targets for the development of drugs for major human diseases.The structural features and pharmacological mechanisms of protein/peptide drugs from animal toxins are reviewed.At the same time,the progress on animal toxins with potential druggability in China is stressed.
Medicinal materials of animal-derivative;venomous animals;peptide toxins;mechanism;drug development
国家自然科学基金项目(31372208,81073000);云南省应用基础研究计划项目(2016FA006)
] 赖仞,研究员,研究方向:天然活性多肽结构与功能及新药研发,E-mail:rlai@mail.kiz.ac.cn;李军德,研究员,研究方向:药用动物资源与动物药材研究,E-mail:jundeli99@163.com
10.13313/j.issn.1673-4890.2017.1.026
2016-09-02)
*[
