传染性单核细胞增多症的临床病理学特征及免疫表型分型
2017-09-19张会超陈砚凝王芃堉丁雅雯刘丽宏
张会超,陈砚凝,黄 晨,王芃堉,张 红,丁雅雯,刘丽宏
传染性单核细胞增多症的临床病理学特征及免疫表型分型
张会超,陈砚凝,黄 晨,王芃堉,张 红,丁雅雯,刘丽宏
目的探讨传染性单核细胞增多症临床病理特征、免疫表型及EBV原位感染的特点,以提高对该病的认识和诊断水平。方法收集患者临床资料、各项实验室检查、淋巴结活检病理数据,采用免疫组化EliVision两步法和EBER原位杂交双重标记检测9例传染性单核细胞增多症,并进行文献复习。结果9例患者平均年龄22岁,起病急,病程短,发热、肝脾及颈部淋巴结肿大,多数EBV CAV-IgM抗体阳性,EBV-DNA载量均增高,多数白细胞总数增高,肝功能异常;外周血淋巴细胞比例明显增高,异型淋巴细胞比例均大于10%。外周血免疫表型为高表达全T细胞标记及CD8,而CD4表达明显减低甚至不表达,CD4+/CD8+比值倒置。淋巴结结构有不同程度破坏,呈斑驳状,可见B细胞分化谱,无包膜增厚及间质纤维增生;病变以CD3阳性的淋巴细胞为主,CD20及CD30阳性的活化淋巴样母细胞及免疫母细胞散在分布,强弱不等;EBER原位杂交阳性的部位主要在T区。结论传染性单核细胞增多症是EBV引起的自限性淋巴组织增生性疾病,临床、病理工作中需综合考虑各方面的信息才能减少误诊,做出正确诊断。
传染性单核细胞增多症;流式细胞术;免疫组织化学;原位杂交
传染性单核细胞增多症是由EBV感染引起的青少年急性或亚急性的自限性疾病[1],临床表现及相关实验室检查易误诊为淋巴瘤[2-3];需根据临床表现及血清EBV抗体检测综合诊断,较少通过淋巴结病理分析做出诊断。本文现收集9例传染性单核细胞增多症,对其临床特征、实验室检查、淋巴结病理特点、EBV感染及免疫表型进行分析,探讨传染性单核细胞增多症与淋巴瘤的不同特点,以提高对其认识水平。
1 材料与方法
1.1材料收集2012年1月~2016年9月河北医科大学第四医院血液科9例传染性单核细胞增多症,入选患者发病前均为健康人,无慢性感染性或肿瘤等疾病,所有病例近期均无其他病毒感染。9例活检标本均来自颈部淋巴结。
1.2方法
1.2.1细胞形态学检查 于患者髂后上棘行骨髓穿刺,穿刺过程中避免骨髓穿刺液被血液稀释,选2块小粒较多、厚薄均匀的骨髓片,经瑞氏染色用油镜观察骨髓造血细胞及其它细胞形态。
1.2.2流式细胞学检查 流式细胞仪为Epics XL型购自Beckman Coulter公司,488 nm激发光源。单克隆抗体试剂购自美国Beckman Coulter公司。采用Expo32-ADC软件分析,设阴性对照,结果判断以细胞抗原表达>阴性对照20%为阳性。取外周血细胞经淋巴细胞分层液处理后,调整细胞数到每毫升106个,置于PBS液中待用,单细胞悬液中加入单抗:CD45、CD19、CD56、CD16、CD79a、CD7、CD2、CD23、CD20、CD19、TDT、CD34、CD5、CD4、CD8、CD3。4 ℃暗处孵育,用PBS洗浴3次,24 h内待检。
1.2.3EBER原位杂交 检测EBV的地高辛标记EBER探针购自北京中杉金桥公司,可同时检测两种EBV编码的mRNA(EBER1和EBER2)[5]。常规切片经二甲苯脱蜡,梯度乙醇脱水,入3%H2O210 min以消除内源性过氧化物酶,经蛋白酶K消化,再逆向入梯度乙醇脱水,干燥后加入探针,加盖玻片55 ℃ 1.5 h,然后37 ℃过夜,PBS洗去多余的探针,加抗地高辛抗体孵育1 h,免疫组化采用EliVision两步法检测,DAB显色,苏木精对比染色后封固。
1.2.4淋巴结活检病理 标本均采用10%中性福尔马林固定,石蜡包埋,4 μm厚切片,HE染色,光镜观察。免疫组化采用EliVision两步法,高压煮沸抗原修复,一抗包括CD2、CD3、CD4、CD8、CD20、CD5、Ki-67、CD30、CD7、CD30、CD21,一、二、三抗均购自福州迈新公司。DAB染色,HE复染。
2 结果
2.1临床特点9例传染性单核细胞增多症中男性7例,女性2例,男女比为7 ∶2,平均年龄22岁,中位年龄19岁,病程最短3周,最长6周。临床症状以发热、肝脾肿大、淋巴结肿大、扁桃体肿大最为常见,少数有皮疹及胸腹水出现。血液检查:8例肝功能轻度~中度异常,7例EBV VCA-IgM呈阳性,9例EBV-DNA载量增高,血常规显示8例白细胞升高,9例淋巴细胞比例均明显增高;其中例9白细胞最高且淋巴细胞病例亦最高,血清学检查EBV VCA-IgM呈阴性,EBV-DNA载量明显高于其它8例(表1)。
2.2细胞形态学特征9例传染性单核细胞增多症患者异型淋巴细胞形态学特点如下。(1)在同一涂片上均可发现3类异型淋巴细胞:①胞体比正常淋巴细胞稍大,多为圆形、椭圆形或不规则形,细胞核为圆形、肾形或分叶状,常偏位。染色质粗糙,呈粗网状或小块状,胞质丰富、染深蓝色、含空泡或呈泡沫状,称浆细胞型。②胞体较大,外形常不规则,可有多个伪足。核形状及结构与Ⅰ型相同,或更不规则,染色质较粗糙致密。胞质丰富,染色呈淡蓝或灰蓝色,有透明感,边缘处着色深,一般无空泡,可有少数嗜天青颗粒,称单核细胞型。③胞体较大,细胞核圆形、卵圆形,染色质细致呈网状排列,可见1~2个核仁,胞质深蓝色,可有少数空泡,称幼稚型。(2)骨髓中的此类异型淋巴细胞比例少于外周血中异型淋巴细胞比例。
2.3流式细胞术检测外周血异型淋巴细胞免疫表型:9例CD2、CD3、CD7、CD5、CD8均强表达,CD4表达明显减低,CD4+/CD8+比值倒置;9例B细胞及NK细胞的标记CD19、CD79a、CD20、CD56、CD16均不表达,原始细胞的标志物CD34及TDT均阴性。
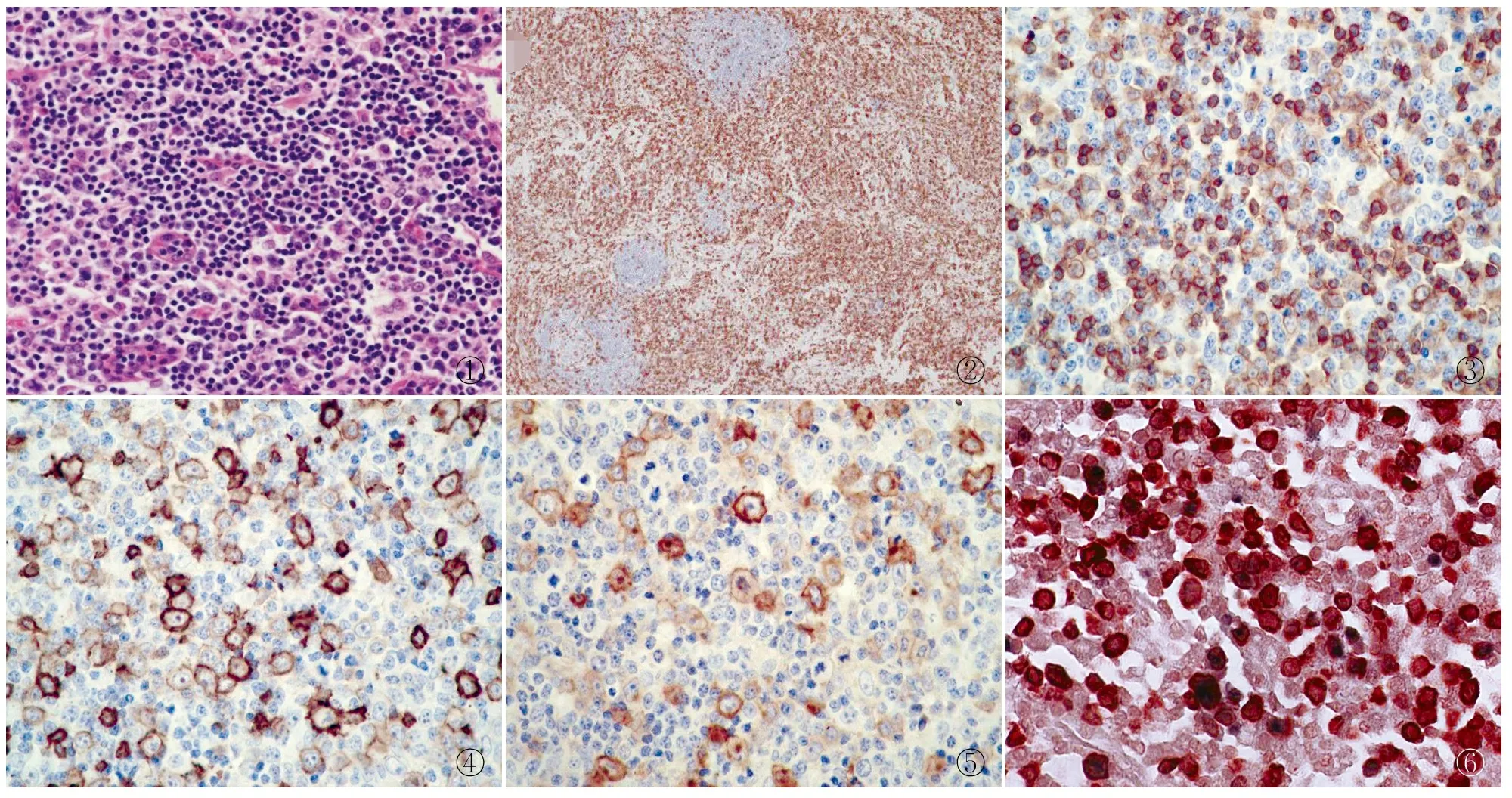
2.4淋巴结活检病理镜下见淋巴结基本结构部分破坏,胞膜均无增厚,淋巴结内未见明显纤维化和基质增多,病理改变表现:淋巴滤泡缩小和减少,T区明显增宽,可见斑驳状区域,大小细胞混杂,种类多样(图1),可见B细胞分化谱(活化淋巴样母细胞、免疫母细胞、浆样细胞、浆细胞),常见少量核碎片,少数病例可见小片状单核样B细胞,可见呈霍奇金样单核大细胞。
2.5免疫表型9例传染性单核细胞增多症均显示扩大的T区中广泛小细胞CD3阳性(图2),且CD2、CD5、CD7阳性区域与CD3阳性区域基本一致,其中例2、例9扩大T区更为显著,且CD3阳性率较其他7例高;9例CD8(图3)阳性细胞均位于滤泡间区且阳性率远大于CD4细胞阳性率;9例CD21均显示淋巴结滤泡网缩小或减少;9例CD20(图4)阳性细胞均见于缩小及减少的淋巴滤泡中,在滤泡间区有散在强弱不等大细胞阳性,其中例5滤泡间区CD20阳性的大细胞增多较为明显;9例CD30大细胞均呈强弱不等阳性(图5);9例CD56均呈阴性,9例T区Ki-67增殖指数均显著增高(>50%)。

表1 传染性单核细胞增多症临床资料
2.5免疫组化与EBER原位杂交双标记EBER阳性定位于细胞核上,呈蓝黑色,免疫组化显示CD20及CD3阳性定位于细胞膜,呈棕红色。8例均呈CD20和EBER双阳性且大于100/ HPF,1例呈CD3和EBER双阳性大于200/ HPF(图6),双阳性的细胞核呈蓝黑色、细胞膜呈棕红色。
2.6随访9例传染性单核细胞增多症患者中6例经3周对症支持治疗及抗病毒治疗后痊愈出院,2例4周痊愈出院,1例6周痊愈出院;2例经12个月随访未见复发,1例经9个月随访未见复发,3例经8个月随访未见复发,3例经6个月随访未见复发。
3 讨论
EBV为疱疹病毒4型(hunman herpesvirus type 4, HHV-4),是双链DNA病毒,完整的病毒颗粒由类核、膜壳、壳微粒、包膜组成。EBV经呼吸道感染人体,人体第一次感染EBV后绝大多数人无明显症状或有轻微的感冒症状,进入人体的绝大多数EBV被免疫系统清除,仅有少数EBV潜伏在人体的B细胞中,并终身携带。但少数人初次感染EBV后会出现明显的症状和体征,成为传染性单核细胞增多症;其主要临床特征为不规则发热、咽痛、肝、脾、淋巴结肿大,外周血中淋巴细胞比例显著增多,并出现异型淋巴细胞,血清中可检测到EBV抗体;在青年与成人发生的EBV原发性感染者,约50%患者表现为传染性单核细胞增多症。由于其临床症状复杂、多样,易误、漏诊。2016年全国儿童EBV感染协作组,推出儿童主要非肿瘤性EBV感染相关疾病的诊断和治疗原则建议,其诊断标准[4]:临床指标为发热、咽扁桃体炎、颈部浅表淋巴结肿大、脾脏肿大、肝脏肿大、眼睑水肿;实验室指标为抗EBV VCA-IgM和抗EBV VCA-IgG抗体呈阳性,且抗EBV NA-IgG呈阴性;抗EBV VCA-IgM呈阴性,但抗EBV VCA-IgM抗体呈阳性,且为低亲和力抗体;双份血清抗体EBV VCA-IgG抗体滴度4倍以上升高;外周血异型淋巴细胞≥10%和(或)淋巴细胞增多大于每毫升5.0×106个。临床诊断需满足临床指标中任意3项及实验室指标中第4项。实验室确诊:满足临床指标中任意3项及实验室指标中1~3项中任意一项。由此可见,临床上通常根据症状及检测EBV抗体确定传染性单核细胞增多症。近年关于EBV-DNA检测日益受到重视,有研究表明EBV-DNA检测较抗体检测阳性率更高[5],本组例4、例9的EBV-VCA-IgM均呈阴性,而血清EBV-DNA拷贝数增高,可见EBV-DNA检测的敏感性高于血清学抗体的检测。因此在抗体诊断不明确时,其有助于早期诊断。
①②③④⑤⑥
图1可见小淋巴细胞,背景中有多少不等的大细胞、浆样细胞和浆细胞,构成B细胞分化谱图2扩大的T区显示CD3广泛阳性,EliVision两步法图3CD8呈弥散阳性,EliVision两步法图4CD20散在大细胞阳性,强弱不等,EliVision两步法图5CD30大细胞散在强弱不等阳性,EliVision两步法图6CD3与EBER双染显示:CD3阳性细胞为细胞膜棕红色,EBER阳性为细胞核黑色,细胞膜棕红色,细胞核黑色为双阳的细胞
传染性单核细胞增多症会引起骨髓与外周血异型淋巴细胞的比例增多,其特点为外周血异型淋巴细胞比例往往高于骨髓异型淋巴细胞比例,且一般情况下,外周血异型淋巴细胞的比例大于10%,高度提示由EBV感染引起的传染性单核细胞增多症可能,大部分传染性单核细胞增多症的异型淋巴细胞形态学特征为不规则形异型淋巴细胞、浆细胞型异型淋巴细胞及幼稚型异型淋巴细胞,且在同一病例中均可见到细胞成分复杂而不是单形性的异型淋巴细胞。田文侠等[6]认为异型淋巴细胞比例与临床症状有相关性,异型淋巴细胞比例越高,临床表现越重,因此可考虑用异型淋巴细胞的比例辅助评估患者的病情。结合本组9例传染性单核细胞增多症的实验室检查,发现异型淋巴细胞的比例与EBV-DNA拷贝数的高低有关,即拷贝数越高异型淋巴细胞的比例就越高,这与周建峰等[7]的报道一致。
近年,传染性单核细胞增多症发病率有逐年上升趋势。研究发现[8]传染性单核细胞增多症的发病过程中存在细胞免疫异常。本组9例传染性单核细胞增多症患者异型淋巴细胞免疫表型均以CD3阳性为主,且CD2、CD3、CD5及CD7的表达较为一致,未见明显缺失,较为特异的表现是CD8强表达,CD4表达明显减低甚至缺失(例9),CD4+/CD8+比值倒置。目前,传染性单核细胞增多症发病原理尚未完全阐明,已知EBV进人口腔后先在咽部淋巴组织内复制,导致渗出性咽扁桃体炎,局部淋巴管受累、淋巴结肿大,继而侵入血循环产生病毒血症,进一步累及淋巴系统的各组织和脏器。因B细胞表面有EBV受体,故EBV主要感染B细胞,使B细胞表面抗原性改变。EBV在B细胞内将其基因上的各不同片断所编码的特异抗原表达在B细胞膜上,继而引起T细胞的强烈免疫应答从而转化为细胞毒性效应细胞,直接破坏携带EBV的B细胞。患者血中的大量异型淋巴细胞即具杀伤能力的细胞毒性T淋巴细胞(cytotoxic T lymphocyte, CTL)、CD8+T。因此,有学者认为细胞免疫对EBV感染起决定性作用,CD4+/CD8+比值是重要的免疫组化检测指标,其比例的降低与免疫系统损伤的程度相关[9]。本实验已证实传染性单核细胞增多症中CD3+、CD8+T细胞表达明显上升,提示患者在EBV感染后导致机体T细胞发生强烈反应。CD4+、CD4+/CD8+明显下降,显示细胞免疫功能下降。提示采用异型淋巴细胞免疫组化检测能为传染性单核细胞增多症的诊断提供重要的线索和依据。
目前,传染性单核细胞增多症的诊断主要依据临床和实验室检查,较少从病理方面做出诊断,进行免疫组化和EBV原位杂交的研究更为罕见,因而在病理诊断中难免误、漏诊,增生严重的传染性单核细胞增多症易被误诊为淋巴瘤[10]。因此,结合本组9例传染性单核细胞增多症的淋巴结活检病理观察发现其病变特征为淋巴结结构部分破坏,T区扩大,细胞成分混杂,散在较多活化的免疫母细胞,CD3广泛小细胞阳性,CD20滤泡阳性,滤泡间区散在强弱不等大细胞CD20阳性;CD30部分大细胞强弱不等阳性;T区Ki-67阳性率较高,大于50%。EBV感染特点是所有病例均可检测到EBER阳性,阳性信号定位在细胞核,所有病例EBER阳性率大于100/ HPF,例1~8中EBER阳性细胞包括大、中、小淋巴细胞,只有例9见中小淋巴细胞EBER阳性;以往通常认为EBV仅感染B细胞,即活化淋巴样母细胞和免疫母细胞这样的大细胞,本实验发现传染性单核细胞增多症中不仅有大细胞EBER阳性,还有很多中、小淋巴细胞阳性,且这些阳性细胞的数量和分布与CD20阳性细胞不吻合,提示这些阳性的中、小细胞不是B细胞。陈云昭等[11]在对传染性单核细胞增多症临床病理特征及EBV定位的实验中也发现该现象;本组进行EBER原位杂交与CD20免疫组化双染发现例1~8以双阳性大细胞为主,少量EBER单阳性为中等大小细胞及小细胞;EBER原位杂交与CD3免疫组化双染显示双阳性的细胞以中等大小的淋巴细胞为主,伴少量EBER单阳性的小淋巴细胞(例9)。提示EBV感染的细胞不仅有B细胞,还有部分病例感染的是T细胞,在日本和台湾也有类似报道[12-13]。由此可见,在中国除存在经典的传染性单核细胞增多症(EBV主要感染B细胞引起的传染性单核细胞增多症)外,还可见类似经典传染性单核细胞增多症临床表现和临床过程的主要是T细胞被EBV感染的传染性单核细胞增多症,暂时将其称为传染性单核细胞增多症-T细胞型。目前,关于EBV是如何感染T细胞的尚不清楚,还有待进一步分析。该类型的传染性单核细胞增多症极易与系统性EBV阳性的T细胞淋巴增生性疾病混淆,EBV阳性T细胞淋巴增生性疾病(EBV+T-LPD)是活化性CTL表型的EBV感染细胞系统性克隆性增生性疾病[14],该疾病与传染性单核细胞增多症在临床症状、实验室检查及免疫表型等均有重叠,主要区别在于传染性单核细胞增多症预后良好,而EBV+T-LPD预后不良,多数患者1年内死亡。
从细胞形态学上尤其是异型淋巴细胞比例明显增高的患者,需与急性淋巴细胞白血病鉴别,两者淋巴细胞比例均明显增高,传染性单核细胞增多症的幼稚型异型淋巴细胞与急性淋巴细胞白血病的原幼淋巴细胞在形态上难以区分,但传染性单核细胞增多症的异型淋巴细胞成分较为复杂,即3种类型的异型淋巴细胞均可见,而急性淋巴细胞白血病的原幼淋巴细胞较为一致,两者可资鉴别。另外,还可以通过流式细胞术进行免疫表型分析证实细胞属性,虽然传染性单核细胞增多症的异型淋巴细胞有返幼现象,但本质上是成熟的淋巴细胞;急性淋巴细胞白血病的细胞本质是恶性克隆性增生,是细胞停滞在幼稚阶段、成熟受阻的表现。从淋巴结活检病理上需鉴别淋巴瘤有非特殊类型的外周T细胞淋巴瘤、弥漫大B细胞淋巴瘤和经典霍奇金淋巴瘤,因此在做出诊断时应高度警惕[1],进行鉴别诊断。(1)当T区明显扩大,滤泡减少,免疫组化染色显示大量T细胞阳性,B细胞阳性较少,易与非特殊类型的外周T细胞淋巴瘤混淆;本组例2、例9曾被怀疑为非特殊类型的外周T细胞淋巴瘤。非特殊类型外周T细胞淋巴瘤的特点为发病年龄较大的成人或老人,青少年或儿童较少,起病较为缓慢,出现高热现象少,免疫组化标记CD3阳性,但肿瘤细胞较为一致,无明显异型性,基质或间质增多,并可见较为明显的纤维化,淋巴结结构破坏明显,无斑驳状改变、B细胞分化谱,也无散在CD20及CD30强弱不等阳性的活化淋巴母样细胞和免疫母细胞,较少检测到EBER阳性的中等大小细胞。(2)例5由于活化的淋巴母样细胞和免疫母细胞增多,曾一度被怀疑为T细胞/组织细胞丰富的大B细胞淋巴瘤混淆,临床症状及年龄特点显示T细胞/组织细胞丰富的大B细胞淋巴瘤的起病较为缓慢,发病年龄较大。免疫组化标记肿瘤大细胞CD20呈弥漫阳性且程度较为一致,而染性单核细胞增多症呈强弱不等的阳性,且不表达CD30,一般情况下EBER呈阴性。(3)当传染性单核细胞增多症出现霍奇金样细胞时,易与经典型霍奇金淋巴瘤混淆。临床症状:典型霍奇金淋巴瘤起病缓慢,淋巴结常有胞膜增厚或间质增多,但无斑驳状区、B细胞分化谱;免疫表型:经典型霍奇金淋巴瘤的瘤细胞同时表达CD30和CD15,且CD30的表达为一致强阳性,EBER阳性的细胞主要为霍奇金瘤细胞。
综上所述,传染性单核细胞增多症是EBV引起的自限性淋巴组织增生性疾病,临床病理工作中需综合考虑各方面的信息才能减少误诊,做出正确诊断。
[1] Louissaint A Jr, Ferry J A, Soupir C P,etal. Infectious mononucleosis mimicking lymphoma: distinguishing morphological and immunophenotypic features[J]. Mod Pathol, 2012,25(8):1149-1159.
[2] Kojima M, Kashimura M, Itoh H. Infectious mononucleosis lymphoadenitis showing histologic findings indistinguishable from toxoplasma lymphadenitis. A report of three cases[J]. Pathol Res Pract, 2010,206(6):361-364.
[3] Kojima M, Nakamura S, Shimizu K. Reactive lymphoid hyperplasia of the lymph nodes with giant follicles: a clinicopathologic study of 14 Japanese cases, with special reference to Epstein-Barr virus infection[J]. Int J Surg Pathol, 2005,13(3):267-272.
[4] 中华医学会儿科学分会感染学组, 全国儿童EB病毒感染协作组. 儿童主要肺肿瘤性EB病毒感染相关疾病的诊断和治疗原则建议[J]. 中华儿科学杂志, 2016,54(8):563-568.
[5] Gao Z L, Zhang C, Du G Y,etal. Clinical significance of changes in tumor markers extracellular matrix, MMP-9 and VEGF in patients with gastric carcinoma[J]. Hepatogastroenterology, 2007,54(77):1591-1595.
[6] 田文侠,姚忠强,刑雪梅,等. 异型淋巴细胞比例与EB病毒现症感染相关性分析[J]. 航空航天医药, 2009,20(1):31.
[7] 周建峰,夏献颗,陈 平,等. 荧光定量PCR分析儿童EB病毒感染与异型淋巴细胞相关性[J]. 中国当代医药, 2012,19(31):97-98.
[8] Canil C M, Tannock I F. Doctor’s dilemma: incorporating tumor markers into clinical decision-marking[J]. Semin Oncol, 2002,29(3):286-293.
[9] 张剑波,屈 艺. 传染性单核细胞增多症患儿T淋巴细胞亚群变化及临床意义[J]. 四川医学, 2009,30:1503-1504.
[10] Kojima M, Nakamura S, Ltoh H,etal. Acute viral lymphadedenitis mimicking loe-grade periphera T-cell lymphoma. A clinicopathological study of nine case[J]. APMIS, 2001,109(6):419-427.
[11] 陈云昭,周小鸽,金 研,等. 传染性单核细胞增多症的临床病理及EB病毒定位性研究[J]. 中华病理学, 2008,37(7):440-444.
[12] He H L, Wang M C, Huang W T. Infectious mononucleosis mimicking malignant T-cell lymphoma in the nasopharynx: a case report and review of the literature[J]. Int J Clin Exp Pathol, 2013,6(1): 105-109.
[13] Arai A, Yamaguchi T, Komatsu H,etal. Infectious mononucleosis accompanied by clonal proliferation of EBV-infected cells and infection of CD8-positive cells[J]. Int J Hematol, 2014,99(5):671-675.
[14] 王 觅,刘卫平,李 利. 系统性EBV阳性的T细胞淋巴增生性疾病及其研究进展[J]. 临床与实验病理学杂志, 2015,31(10):1148-1152.
Analysisofclinicopathologiccharacteristicsandimmunophenotypeofinfectiousmononucleosis
ZHANG Hui-chao, CHEN Yan-ning, HUANG Chen, WANG Peng-yu, ZHANG Hong, DING Ya-wen, LIU Li-hong
(CinicLab,theFourthHospitalofHebeiMedicalUniversity,Shijiazhuang050011,China)
PurposeTo study the clinicopathologic characteristics, immunophenotype and Epstein-Barr virus (EBV) infection in infectious mononucleosis (IM), and to enhance the knowledge and diagnosis of the disease.MethodsThe clinical data, laboratory examination, and lymph nodes biopsy of 9 cases of IM were collected. Immunohistochemistry of EliVision two-step, flow cytometry and EBER in situ hybridization double labeling were studied in 9 cases. Relevant literatures were also reviewed.ResultsThe average age of 9 cases of IM was 22 years old. Patients presented with acute onset, short disease duration, fever, and liver, spleen and lymph node enlargement, and increased abnormal lymphocyte. Also, it was positive in the anti-EBV VCA-IgM detection. EBV-DNA copy numbers were all increased. Most WBC counts were increased. Liver function index was abnormal. The ratio of peripheral blood lymphocytes obviously increased and the ratio of atypical lymphocyte was greater than 10%. Immunophenotype of peripheral blood flow cytometry was characterized by high expression of T cells markers and CD8. CD4 expression was significantly reduced or even not expressed. CD4+/CD8+ratio was reversed. Lymph nodes were destroyed in different extent and presented mottling without the thickening of the capsule and interstitial fibrous hyperplasia. B cells differentiation spectrum was visible. The lesion cells were mostly CD3-positive cells. CD20, CD30-positive activated cells and immunoblast cells diffused distribution and showed different degrees of strength. The site of EBER in situ hybridization was mainly in T region.ConclusionIM is an EBV-related acute self-limiting lymphoproliferative disease. Taking clinical characteristics, morphology, EBV infection and immunophenotype into considerations will help to correct diagnoses.
infectious mononucleosis; flow cytometry; immunohistochemistry; in situ hybridization
河北省科技厅大健康服务和生物医药专项课题(162777243)
河北医科大学第四医院东院区血液病实验室,石家庄 050011
张会超,男,硕士,主管检验师。E-mail:zhanghuichao050108@163.com 刘丽宏,女,博士,主任医师,通讯作者。E-mail:13831177920@163.com
R 446;R 392.31
:A
:1001-7399(2017)07-0763-06
10.13315/j.cnki.cjcep.2017.07.013
接受日期:2017-05-10
