肺腺癌中PD-1、PD-L1蛋白表达与K-RAS基因突变状态的相关性分析
2017-09-19董丽儒任会强刘爱东熊艳杰宋旭东
王 珊,董丽儒,任会强,刘爱东,熊艳杰,宋旭东
肺腺癌中PD-1、PD-L1蛋白表达与K-RAS基因突变状态的相关性分析
王 珊,董丽儒,任会强,刘爱东,熊艳杰,宋旭东
目的探讨肺腺癌程序性死亡分子-1(programmed death 1, PD-1)、程序性死亡分子配体-1(programmed death ligand 1, PD-L1)蛋白的表达与K-RAS基因突变的相关性。方法采用免疫组化EnVision两步法检测PD-1、PD-L1蛋白的表达,应用实时荧光定量PCR技术检测K-RAS基因的突变类型。结果肺腺癌组织中PD-1、PD-L1的阳性率均高于良性病变肺组织(P<0.01),PD-1、PD-L1蛋白表达与患者性别、年龄、吸烟史、分化程度、淋巴结转移及TNM分期均无相关性(P>0.05)。36例肺腺癌样本中发生K-RAS基因突变者8例(22.2%),K-RAS基因突变与患者性别、年龄、吸烟史、分化程度、淋巴结转移及TNM分期均无关(P>0.05)。相关分析显示PD-1、PD-L1蛋白表达与K-RAS突变无关(P>0.05)。结论PD-1、PD-L1蛋白在肺腺癌中的表达明显高于良性病变肺组织,但两者表达程度与肺腺癌的临床病理特征及K-RAS基因突变无关。
肺肿瘤;腺癌;PD-1;PD-L1;K-RAS基因突变
肺癌是全球发病率最高的实体肿瘤,其中非小细胞肺癌(non-small cell lung cancer, NSCLC)所占比例最高,NSCLC又包括鳞状细胞癌、腺癌、大细胞癌。近年,肺癌的靶向治疗以及免疫治疗已成为临床分析的热点。程序性死亡分子-1(programmed death 1, PD-1)是主要表达在活化T细胞上的抑制性受体之一,与程序性死亡分子配体-1(programmed death ligand 1, PD-L1)结合,可显著抑制T细胞的活化和增殖。最近,文献报道EGFR突变的NSCLC高表达PD-L1蛋白[1]。本文着重探讨肺腺癌中PD-1、PD-L1蛋白的表达及其与K-RAS基因突变的相关性。
1 材料与方法
1.1临床资料收集河北省唐山市人民医院2015年9月~2016年2月及华北理工大学附属医院2012年1月~2016年6月接受肺癌根治术,且组织学证实为肺腺癌患者的石蜡标本36例。所有患者术前均未行放、化疗,临床病理资料完整。患者年龄41~76岁,中位年龄61岁。另随机收集20例良性病变肺组织作为对照。
1.2主要试剂兔抗人单克隆抗体PD-1、PD-L1(Abcam公司),石蜡包埋组织DNA提取试剂盒,购自北京天根公司;K-RAS基因突变检测试剂盒(PCR-荧光探针法)购自北京鑫诺美迪公司。
1.3方法
1.3.1免疫组化 免疫组化采用EnVision两步法,石蜡切片经二甲苯透明,梯度乙醇脱蜡至水,高压修复后用3%H2O2封闭10 min,滴加一抗PD-1或PD-L1,4 ℃过夜;取出切片恢复至室温,滴加二抗;37 ℃恒温箱孵育30 min后滴加DAB显色,苏木精复染,分化,返蓝,脱水,透明,封固。
1.3.2实时荧光定量PCR 按试剂盒说明书提取DNA,配制反应体系,将反应体系置于Bio-Rad CFX96实时荧光定量PCR基因扩增仪内进行扩增(表1)。PCR反应程序:预变性95 ℃ 3 min,循环1次,变性94 ℃ 15 s,退火延伸60 ℃ 35 s,循环45次。通过Bio-Rad CFX Manager分析K-RAS突变结果。
1.4结果判断
1.4.1PD-1结果判断 PD-1主要表达于活化T细胞的胞质和胞膜,呈棕黄色粗颗粒状。以细胞计数法评估,在低倍镜下观察整张切片,寻找高密度淋巴细胞,随机选择5个高倍视野,每视野计数100个淋巴细胞中PD-1阳性细胞数,并求其平均值作为PD-1阳性细胞数。以36例肺腺癌中PD-1阳性细胞数的均值作为阈值,大于该阈值为PD-1阳性,低于该阈值为PD-1阴性[2]。
1.4.2PD-L1结果判断 PD-L1主要表达于肿瘤细胞的胞质和胞膜,呈棕黄色粗颗粒状。采用二级记分法,按细胞着色程度评分:无着色为0分,淡黄色为1分,棕黄色为2分,棕褐色为3分;按细胞阳性比例评分:阳性细胞数≤2%为0分,2%~10%为1分,10%~50%为2分,>50为3分。最后将两者相乘:得分>3分为阳性;≤3分为阴性[3]。
1.4.3K-RAS结果判断 确定每个突变反应孔Ct值(CtM)和外控Ct值(CtW),计算每个突变反应孔的△Ct(CtM - CtW)值,若△Ct≤8,且同时满足CtW<30;即可确定样本为突变型。
1.5统计学分析所有数据采用SPSS 17.0软件进行统计学分析,PD-1、PD-L1蛋白表达及K-RAS基因突变状态与肺腺癌临床病理特征分析采用χ2检验,相关性分析采用Pearson相关分析,以P<0.05为差异有统计学意义。
2 结果
2.1PD-1、PD-L1蛋白表达与肺腺癌临床病理特征的关系36例肺腺癌中PD-1阳性率为50%(18/36),PD-L1阳性率为44.4%(16/36),良性病变肺组织中PD-1、PD-L1的阳性率均为0(0/20)。肺腺癌中PD-1、PD-L1的阳性率均高于良性病变肺组织(P<0.05,表2,图1)。肺腺癌中PD-1、PD-L1蛋白表达与患者性别、年龄、吸烟与否、分化程度、淋巴结转移及TNM分期均无关(P>0.05,表3)。

表1 K-RAS扩增引物序列

表2 PD-1、PD-L1蛋白在肺腺癌及良性病变肺组织中的表达
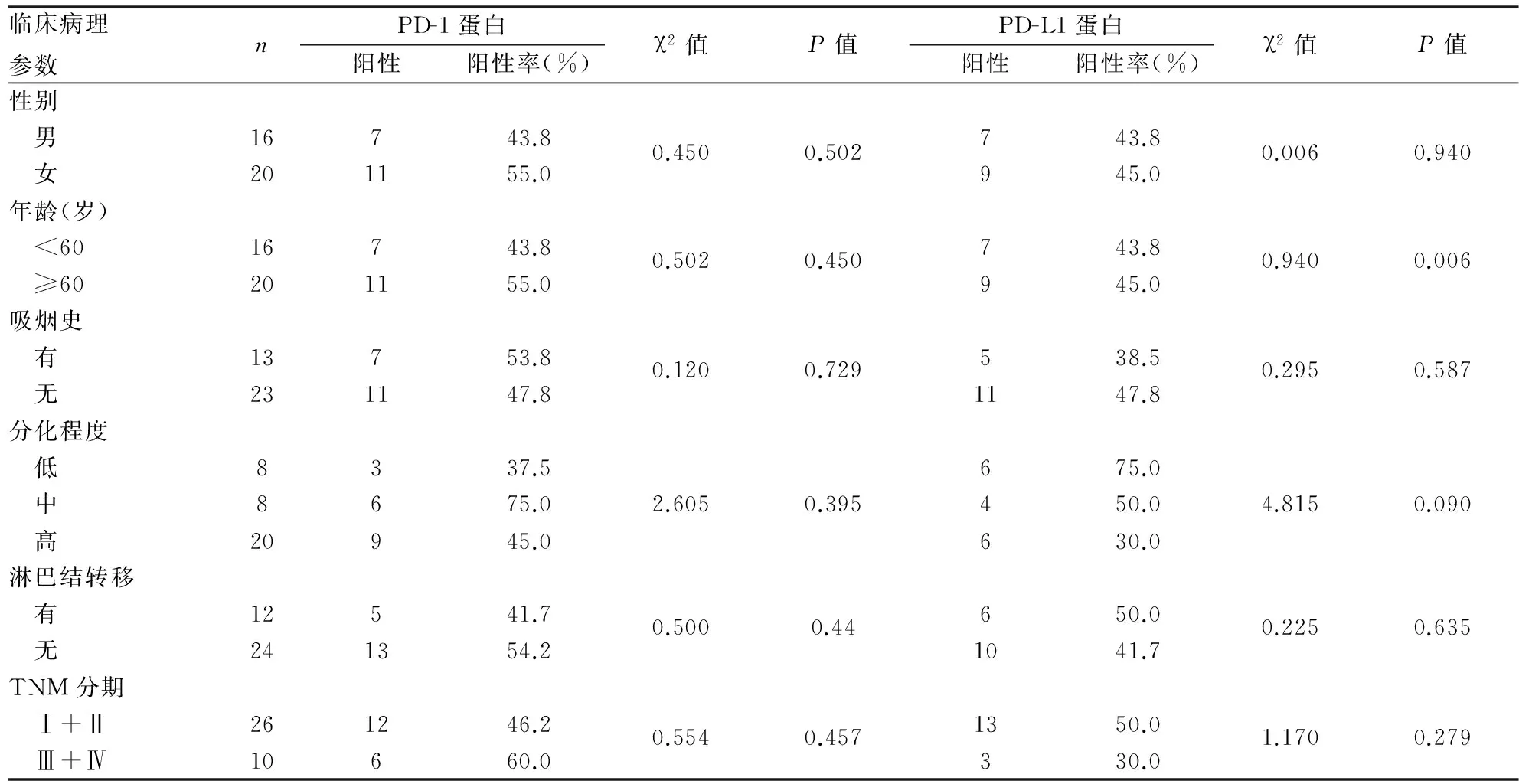
表3 PD-1、PD-L1蛋白表达与肺腺癌临床病理特征的关系(n=36)
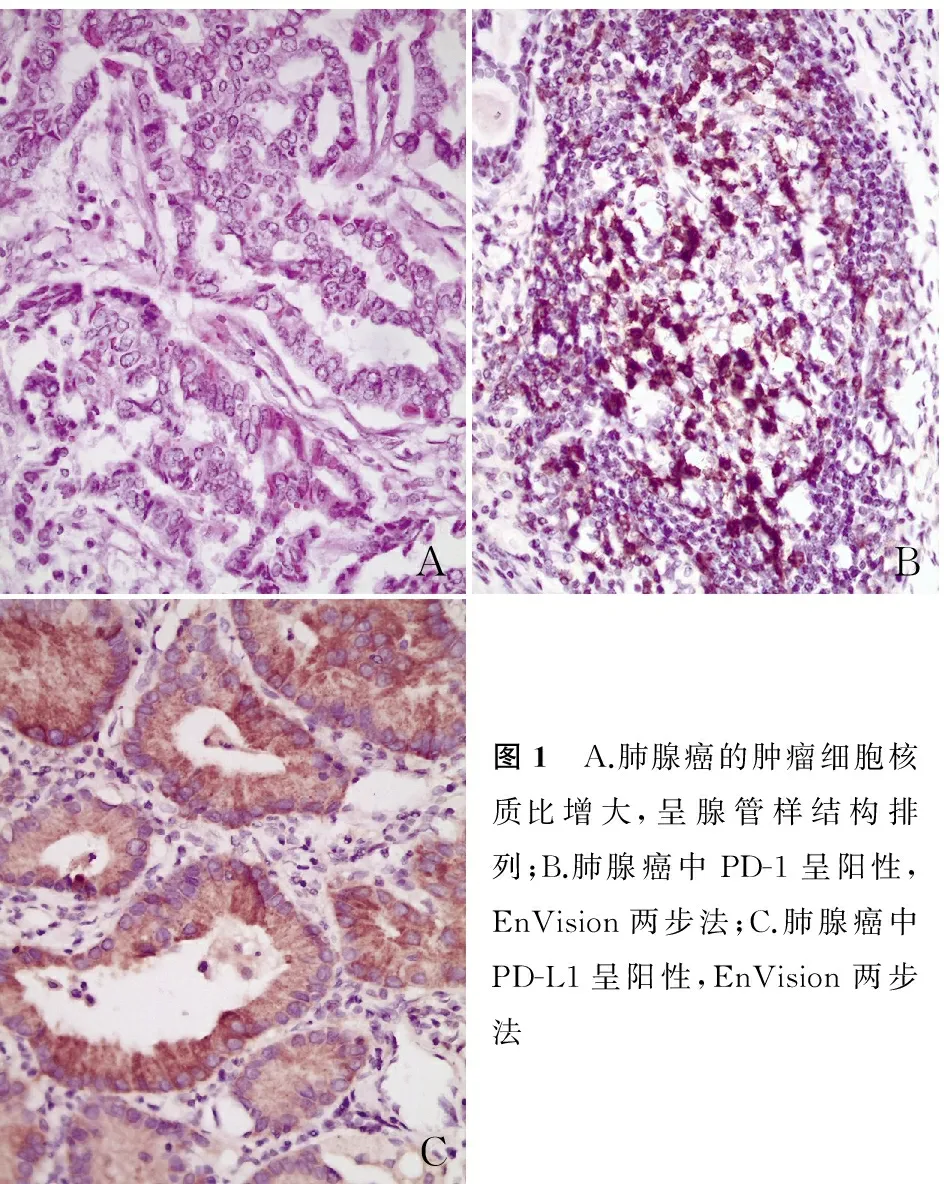
ABC图1 A.肺腺癌的肿瘤细胞核质比增大,呈腺管样结构排列;B.肺腺癌中PD-1呈阳性,EnVision两步法;C.肺腺癌中PD-L1呈阳性,EnVision两步法

表4 肺腺癌中K-RAS基因突变检测(n=36)
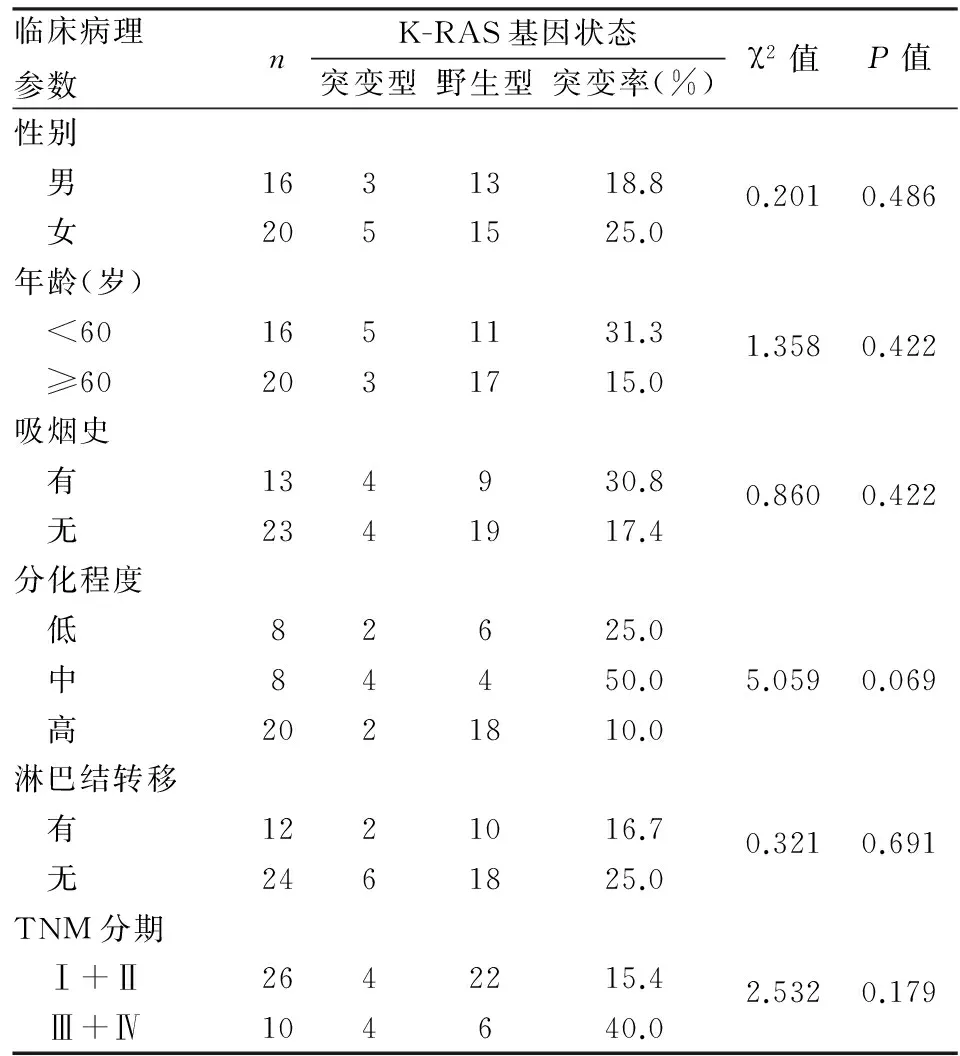
表5 K-RAS基因突变与肺腺癌临床病理特征的关系(n=36)
2.2K-RAS基因突变与肺腺癌临床病理特征的关系36例肺腺癌中检出K-RAS突变8例(表4,图2),突变率为22.2%。统计结果显示K-RAS基因突变与患者性别、年龄、吸烟与否、分化程度、有无淋巴结转移均无关(P>0.05,表5)。
2.3PD-1、PD-L1蛋白表达与K-RAS突变的相关性分析相关性分析表明,PD-1蛋白表达与K-RAS突变无关(r=0.134,P>0.05);PD-L1蛋白表达与K-RAS突变无关(r=-0.075,P>0.05)。

图2 肺腺癌K-RAS基因突变实时荧光定量PCR扩增分析 A.GGT>TGT;B.GGT>AGT;C.GGT>GTT;D.GGT>GAT
3 讨论
人PD-1基因定位于染色体2q37.3,编码免疫球蛋白超家族的Ⅰ型跨膜糖蛋白,多表达于活化的T细胞。目前,PD-1的配体被证实有2个,分别为PD-L1和PD-L2,其中PD-L1是PD-1的主要配体,普遍表达于抗原提呈细胞、活化的T细胞及B细胞、内皮细胞等。PD-L1基因定位于染色体的9p24,编码含有290个氨基酸的Ⅰ型跨膜蛋白。正常人体中,PD-1与PD-L1结合,使T细胞的活化被抑制,具有负性免疫调节作用[4]。由于正常T细胞表达PD-1,PD-L1在肿瘤细胞表面表达,故现阶段文献报道PD-L1较多。目前,关于PD-L1蛋白表达与肺癌临床病理特征的关系报道不一致。Song等[5]发现PD-L1的表达与肺癌临床病理特征均无相关性。宋燕秋等[6]实验结果表明78例肺腺癌组织中PD-L1在女性、非吸烟及Ⅱ~Ⅲ期中的表达水平高于男性、吸烟者及Ⅰ期患者。本实验结果显示PD-1、PD-L1阳性率与患者性别、年龄、吸烟与否、分化程度、淋巴结转移及TNM分期均无差异。文献报道结论不一致,可能与免疫组化检测PD-L1的阳性判读标准不统一有关。Reck等[7]比较抗PD-1的靶向药Pembrolizumab与铂类为基础的化疗药治疗PD-L1阳性NSCLC患者,发现Pembrolizumab组无进展生存期和总生存期明显延长。因此,免疫治疗有望给更多NSCLC患者带来希望。
K-RAS蛋白相对分子质量为2.1×104,故也被称为p21蛋白。K-RAS蛋白位于细胞膜内面,具有内在GTP酶活性,K-RAS蛋白通过与GTP结合后被活化,参与调节细胞的生长、增殖。K-RAS基因突变后其编码的p21蛋白活性降低,失去内在GTP酶活性,从而使信号传导一直处于激活状态,持续刺激细胞生长、发育、增殖,引起细胞恶变[8]。K-RAS基因突变率在人种之间存在差异,西方NSCLC人群中突变率较高,在肺腺癌中甚至达30%。亚洲NSCLC人群的突变率为4%~24%[9]。K-RAS基因突变主要发生于第2外显子的12及13号密码子上,其中12号密码子的突变率(92%)明显高于13号密码子(8%)[10]。本实验结果显示,肺腺癌中K-RAS基因突变率为22.2%,均发生在12号密码子,与上述文献结果相符。目前,对K-RAS基因突变与肺癌临床病理特征关系的相关分析尚未统一。Brcic等[11]分析273例肺腺癌患者的K-RAS基因状态,发现吸烟者K-RAS突变率高于非吸烟者,K-RAS突变与患者性别、年龄、临床分期均无关。张卉等[12]认为K-RAS基因突变与患者性别、年龄、分期、吸烟史无关。本实验结果与国内学者报道相符,可能由于亚洲人群肺癌K-RAS突变率较低、样本量不足导致抽样有误差。
目前,针对K-RAS基因突变患者的治疗仍未找到理想靶向药物。随着免疫治疗的不断发展,K-RAS基因突变患者能否从免疫治疗中获益也成为研究的新方向。D’Incecco等[13]在122例NSCLC样本中评估PD-1蛋白表达及K-RAS基因突变状态,发现PD-1阳性与K-RAS突变状态显著相关,K-RAS基因突变的患者有更高的PD-1蛋白表达。有学者通过分析K-RAS基因突变的肺腺癌细胞系,发现阻断K-RAS的下游通路可以减少肿瘤细胞表面PD-L1的表达。他们认为K-RAS所在的MAPK通路对细胞表面PD-L1蛋白表达起主导作用[14]。Ji等[15]结果显示PD-1蛋白表达与K-RAS基因突变呈负相关。本组通过相关性分析,并未发现PD-1、PD-L1蛋白的表达与K-RAS突变存在相关性。
综上所述,现阶段K-RAS基因突变与PD-1、PD-L1表达的相关性报道各异,可能是由于K-RAS基因突变在人种之间的差异;另外,上述报道均采用免疫组化法检测PD-1、PD-L1蛋白的表达,但目前尚无统一的阳性标准,也造成统计结果之间的差异。因此,对于K-RAS基因突变与PD-1、PD-L1蛋白表达之间的相关性,仍需更深入的分析。
[1] Lin K L, Cheng J N, Yang T,etal. EGFR-TKI down-regulates PD-L1 in EGFR mutant NSCLC through inhibiting NF-κB[J]. Biochem Biophys Res Commun, 2015,463(1-2):95-101.
[2] 马 薇,罗殿中,陈 源,等. PD-L1和PD-1在非小细胞肺癌中的表达及其临床意义[J]. 实用医学杂志, 2011,27(9):1551-1554.
[3] Mu C Y, Huang J A, Chen Y,etal. High expression of PD-L1 in lung cancer may contribute to poor prognosis and tumor cells immune escape through suppressing tumor infiltrating dendritic cells maturation[J]. Med Oncol, 2011,28(3):682-688.
[4] 刘亚岚,蒋冬先,侯英勇,等. 食管鳞状细胞癌中PD-L1的表达及其预后意义[J]. 临床与实验病理学杂志, 2017,33(4):355-359.
[5] Song Z B, Yu X M, Cheng G P,etal. Programmed death-ligand 1 expression associated with molecular characteristics in surgically resected lung adenocarcinoma[J]. J Transl Med, 2016,14(1):188.
[6] 宋燕秋,吕坤聚,王 丽,等. 肺腺癌中PD-L1、B7H3的表达与EGFR基因突变的关系[J]. 临床肺科杂志, 2016,21(5):866-873.
[7] Reck M, Rodriguez-Abreu D, Robinson A G,etal. Pembrolizumab versus chemotherapy for PD-L1-positive non-small-cell lung cancer[J]. N Engl J Med, 2016,375(19):1823-1833.
[8] Bos J L. Ras oncogenes in human cancer: a review[J]. Cancer Res, 1989,49(17):1352.
[9] 罗 炜,王 慧,徐韫健. 非小细胞肺癌患者KRAS基因突变情况分析[J]. 广东医学, 2014,13(35): 2025-2028.
[10] Yu H A, Sima C S, Shen R,etal. Prognostic impact of KRAS mutation subtypes in 677 patients with metastatic lung adenocarcinomas[J]. J Thorac Oncol, 2015,10(3):431-437.
[11] Brcic L, Jakopovic M, Misic M,etal. Analysis of the frequency of EGFR, KRAS and ALK mutations in patients with lung adenocarcinoma in Croatia[J]. Diagn Pathol, 2016,11(1):90.
[12] 张 卉,杨新杰,秦 娜,等. 肺腺癌EGFR与KRAS基因突变状态分析[J]. 中国肺癌杂志, 2015,18(11):686-690.
[13] D’Incecco A, Andreozzi M, Ludovini V. PD-1 and PD-L1 expression in molecularly selected non-small-cell lung cancer patients[J]. Br J Cancer, 2015,112(1):95-102.
[14] Sumimoto H, Takano A, Teramoto K,etal. RAS-mitogen-activated protein kinase signal is required for enhanced PD-L1 expression in human lung cancers[J]. PLoS One, 2016,11(11): e0166626.
[15] Ji M, Liu Y, Li Q,etal. PD-1/PD-L1 expression in non-small-cell lung cancer and its correlation with EGFR/KRAS mutations[J]. Cancer Biol Ther, 2016,17(4):407-413.
RelevantresearchofPD-1,PD-L1proteinexpressionandK-RASgenemutationsinlungadenocarcinoma
WANG Shan, DONG Li-ru, REN Hui-qiang, LIU Ai-dong, XIONG Yan-jie, SONG Xu-dong
(DepartmentofPathology,NorthChinaUniversityofScienceandTechnologyAffiliatedHospital,Tangshan063000,China)
PurposeTo investigate the association of the PD-1 and PD-L1 protein expression with K-RAS gene mutations in lung adenocarcinoma.MethodsThe protein expression of PD-1 and PD-L1 was detected by immunohistochemical EnVision two-step staining, the K-RAS mutation was examined by real-time fluorescent quantitative PCR.ResultsThe positive rate of PD-1 and PD-L1 was higher in lung adenocarcinoma than benign lung disease (P<0.01). There was no relationship between PD-1 and PD-L1 protein expression with the gender, age, smoking condition, differentiation, lymph node metastasis and TNM stages (P>0.05). The K-RAS gene mutations were detectable in 8 patients (22.2%) among 36 lung adenocarcinoma, there was no association between K-RAS gene mutation with the gender, age, smoking condition, differentiation, lymph node metastasis and TNM stages (P>0.05). The correction analysis showed that there was no relationship between PD-1 and PD-L1 protein expression with K-RAS mutation (P>0.05).ConclusionThe positive rate of PD-1 and PD-L1 is higher in lung adenocarcinoma than benign lung disease, but there is no relationship among PD-1 and PD-L1 protein expression with its clinal pathological characteristics and K-RAS mutation in lung adenocarcinoma.
lung neoplasm;adenocarcinoma;PD-1;PD-L1;K-RAS gene mutations
时间:2017-7-18 11:51 网络出版地址:http://kns.cnki.net/kcms/detail/34.1073.R.20170718.1151.011.html
2016年河北省政府资助临床医学优秀人才培养和基础课题研究(361036)
河北省唐山市华北理工大学附属医院病理科 063000
王 珊,女,硕士研究生。E-mail: 496874845@qq.com 宋旭东,男,教授,硕士生导师,主任医师,通讯作者。E-mail: songxd2002@sina.com
R 734.2
:A
:1001-7399(2017)07-0754-05
10.13315/j.cnki.cjcep.2017.07.011
接受日期:2017-05-22
