二甲双胍对糖尿病大鼠肾脏的保护作用及其机制研究
2017-09-19梅艳欧三桃
梅艳,欧三桃
(西南医科大学附属医院 肾内科,四川 泸州 646000)
二甲双胍对糖尿病大鼠肾脏的保护作用及其机制研究
梅艳,欧三桃
(西南医科大学附属医院 肾内科,四川 泸州 646000)
目的观察二甲双胍对链脲佐菌素(STZ)诱导糖尿病肾病大鼠肾脏的影响,分析二甲双胍的防治功效及其机制。方法选取健康雄性14周龄Wistar大鼠36只,随机分为3组:正常对照组、糖尿病模型组和二甲双胍干预组。利用STZ诱导大鼠糖尿病,正常对照组给予生理盐水,第8周时大鼠糖尿病肾病模型复制成功。采用Western blot检测各组大鼠肾脏中炎症细胞因子[肿瘤坏死因子α(TNF-α)、白介素1β(IL-1β)、白介素6(IL-6)]和抗炎症细胞因子[白介素10(IL-10)]的表达。结果糖尿病模型组TNF-α、IL-1β及IL-6的表达水平高于正常对照组(P<0.05),IL-10的表达水平低于正常对照组(P<0.05);给予二甲双胍干预后,上述结果逆转(P<0.05)。结论二甲双胍可通过抑制肾脏炎症细胞因子的表达,保护STZ诱导的糖尿病大鼠的肾脏。
二甲双胍;糖尿病;肾病;炎症细胞因子
糖尿病肾病是糖尿病患者死亡的主要病因之一,其发病机制十分复杂,可能与代谢紊乱、肾小球血流动力学异常及遗传易感性有关。最新研究发现,该病往往伴随炎症因子表达水平的增高[1-2],甚至有学者认为,糖尿病肾病本身就是一种炎症反应的过程[3-4]。二甲双胍是双胍类口服降糖药物,是目前2型糖尿病一线用药。据报道,二甲双胍可有效降低糖尿病肾病患者的尿白蛋白排泄率,降低血肌酐和尿素氮水平,表现出较为满意的肾脏保护作用[5-7]。但该种保护作用的机制目前并不清楚。大量研究发现,二甲双胍可抑制多种代谢性疾病相关的炎症因子[8-10]。因此,笔者提出假说,二甲双胍通过抑制炎症因子[肿瘤坏死因子α(tumor necrosis factor-α,TNF-α)、白介素1β(interleukin-1β,IL-1β)及白介素6(interleukin-6,IL-6)]的表达,而实现对糖尿病肾病的保护作用。为验证该假说,设计本研究,现报道如下。
1 材料与方法
1.1 动物
选取健康雄性Wistar大鼠36只,2月龄,体重220~260g[西南医科大学动物中心提供,动物许可证号:SCXK(川)2013-17],动物饲养室温23℃,湿度44%,自由摄食饮水,实验开始前测鼠尾外周血糖均正常,将动物适应性喂养1周后开始实验。
1.1.1 药品与试剂 二甲双胍、链脲佐菌素(Streptozocin,STZ)购自美国Sigma公司,TNF-α、IL-1β、IL-6及 IL-10一抗和二抗购自美国 Abcam Biotechnology公司。
1.1.2 实验动物分组 实验动物分为3组:正常对照组、糖尿病模型组及二甲双胍干预组,每组12只。单次腹腔注射STZ 65 mg/kg诱导糖尿病模型,各组大鼠均在48 h后空腹采取外周血。血糖≥16.7 mmol的大鼠模型复制成功,被视为糖尿病大鼠模型[11]。
1.2 方法
1.2.1 模型的复制 模型复制成功1周后,二甲双胍干预组大鼠灌胃二甲双胍20 mg/(kg·d),上午10∶00给药,1次/d,连续灌胃6周,糖尿病模型组和正常对照组给予等剂量的生理盐水NaCl灌胃,直至取材。
1.2.2 实验动物组织标本的收集及检测 在8周末时,使用代谢笼收集正常对照组、糖尿病模型组及二甲双胍干预组大鼠12 h尿液,混匀后取6 ml,将其置于温度<40℃的冰箱保存。然后,对糖化血红蛋白(haemoglobin A1C,HbA1c)、尿白蛋白(Albumin,ALB)、细胞间黏附分子-1(intercellular adhesion molecule-1,ICAM-1)、单核细胞趋化蛋白-1及视黄醇结合蛋白(retinol binding protein,RBP)进行检测,并对各组实验大鼠的排泄率予以合理计算;同时经大鼠股动脉取血2ml,予以肝素抗凝血,对血红蛋白(Haemoglobin,Hb)水平进行检测。将实验大鼠麻醉后,取出两侧肾脏,在4℃、NaCl中洗净,剥去肾包膜,4℃、NaCl溶液冲洗肾脏6次。称其左肾重量,计算肾脏肥大指数,肾脏肥大指数=左肾重/体重[12]。用德国罗氏血糖仪进行血糖检测,Hb和尿ALB采用微柱层析法进行检测。
1.2.3 动物处理分析 将10%水合氯醛注射于腹腔内,麻醉完成后通过颈椎脱臼的方式使大鼠死亡,将其肾脏取出,于-80℃冷冻保存。制备蛋白样品、RNA:①对60~100g大鼠肾脏组织予以冷冻处理,同时加入1 ml Trizol,根据说明书提取总RNA,将RNA的A260/A280控制在1.8~2.0;②取肾脏组织约200 mg,在2 ml含蛋白酶抑制剂磷酸盐缓冲溶液(phosphate buffer saline,PBS)中匀浆组织,离心15 min左右;③取上清液作为总蛋白样本。
1.2.4 Western blot检测 实验通过Western blot检测对肾脏中炎症细胞因子TNF-α、IL-1β、IL-6及抗炎症细胞因子IL-10表达量进行比较。①4℃裂解分离组织,匀浆液离心,提取蛋白,离心总蛋白,超声波裂解,提取破解液中的生物化蛋白;②组织匀浆后,提取蛋白变性成分,用聚丙烯酰胺凝胶对蛋白样品电泳2 h左右,将分离的蛋白转移至聚偏氟乙烯膜上;③将膜置于3%牛血清蛋白溶液中孵育;④加炎症细胞因子TNF-α、IL-1β、IL-6及抗炎症细胞因子IL-10一抗(1∶1 000),4℃孵育过夜,洗涤液洗一抗;⑤加二抗(1∶1 000),室温孵40 min,洗涤液洗二抗,发光。选取NIH Image J和Imagine软件分析图像并统计数据。
1.3 统计学方法
数据分析采用SPSS 19.0统计软件,计量资料以均数±标准差(±s)表示,多组间比较用方差分析,两两比较用SNK-q检验,P<0.05为差异有统计学意义。
2 结果
2.1 3组大鼠血糖、H bA1c比较
3组大鼠血糖、HbA1c比较,经方差分析,差异有统计学意义(P<0.05)。两两比较采用SNK-q检验,糖尿病模型组与正常对照组的血糖、HbA1c比较,差异有统计学意义(q=18.256和20.284,P=0.004和0.000),糖尿病模型组的血糖、HbA1c高于正常对照组;二甲双胍干预组与糖尿病模型组的血糖、HbA1c比较,差异有统计学意义(q=11.933和30.203,P= 0.009和0.000),二甲双胍干预组的血糖、HbA1c低于糖尿病模型组。见表1。
表1 3组大鼠血糖、H bA1c水平比较 (±s)
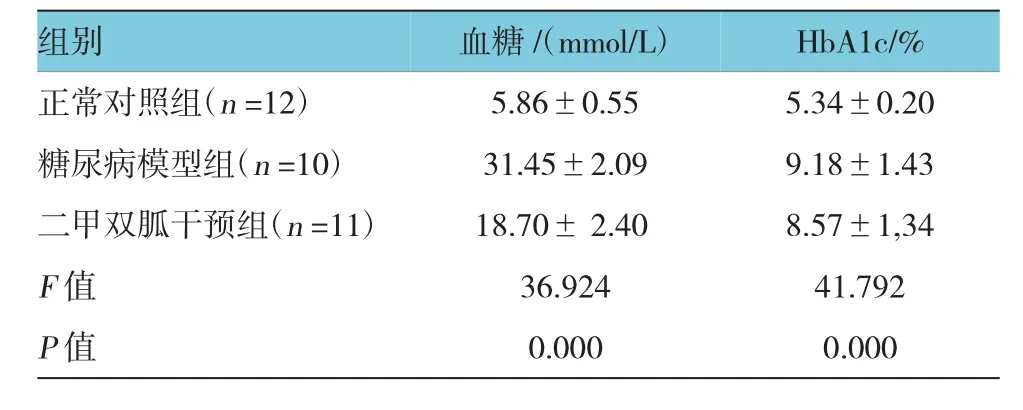
表1 3组大鼠血糖、H bA1c水平比较 (±s)
组别HbA1c/%正常对照组(n=12) 5.86±0.55 5.34±0.20糖尿病模型组(n=10) 31.45±2.09 9.18±1.43二甲双胍干预组(n=11) 18.70±2.40 8.57±1,34 F值 36.924 41.792 P值 0.000 0.000血糖/(mmol/L)
2.2 尿生化、肾脏肥大指数比较
3组大鼠的ALB、RBP及肾脏肥大指数比较,经方差分析,差异有统计学意义(P<0.05)。两两比较采用SNK-q检验,糖尿病模型组与正常对照组的ALB、RBP及肾脏肥大指数比较,差异有统计学意义(q=23.940、20.810和49.117,均P=0.000),糖尿病模型组的ALB、RBP及肾脏肥大指数高于正常对照组;二甲双胍干预组与糖尿病模型组的ALB、RBP及肾脏肥大指数比较,差异有统计学意义(q=19.051、23.305和36.721,均P=0.000),二甲双胍干预组的ALB、RBP及肾脏肥大指数低于糖尿病模型组。见表2。
2.3 肾脏病理学改变
二甲双胍干预治疗6周时,正常对照组的基底膜处于同一状态,未出现显著增厚,也未出现足突细胞融合;糖尿病模型组出现毛细血管基底膜增厚,结构模糊不清,发生足突破坏、融合及消失,系膜基质增多,且出现肿胀;二甲双胍干预组出现少量足突融合,系膜区细胞出现轻度增生,胞浆肿胀变性。见图1。
表2 3组大鼠尿生化、肾脏肥大指数的比较 (±s)
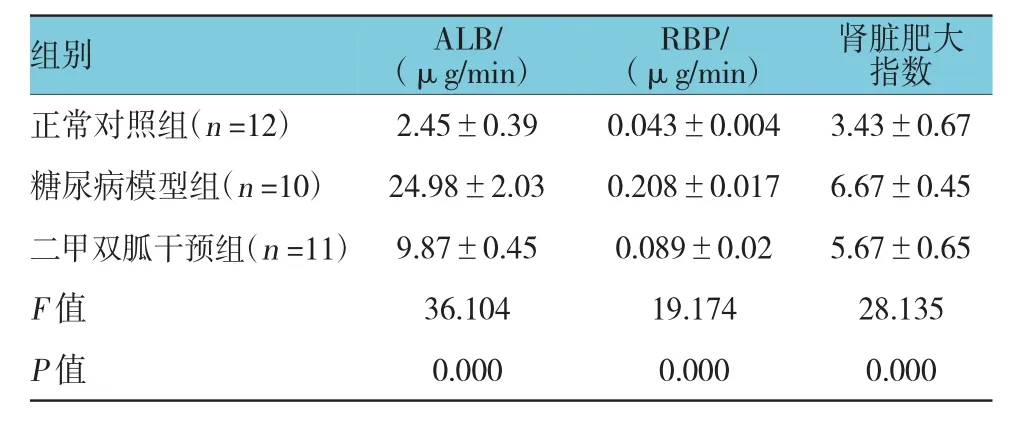
表2 3组大鼠尿生化、肾脏肥大指数的比较 (±s)
组别肾脏肥大指数正常对照组(n=12) 2.45±0.39 0.043±0.004 3.43±0.67糖尿病模型组(n=10) 24.98±2.03 0.208±0.017 6.67±0.45二甲双胍干预组(n=11) 9.87±0.45 0.089±0.02 5.67±0.65 F值 36.104 19.174 28.135 P值 0.000 0.000 0.000ALB/(μg/min)RBP/(μg/min)
2.4 各组大鼠肾脏中TNF-α、IL-1β、I L-6及I L-10表达水平比较
3组大鼠肾脏中TNF-α、IL-1β、IL-6及IL-10表达水平比较,经方差分析,差异有统计学意义(P<0.05)。两两比较采用SNK-q检验,糖尿病模型组与正常对照组TNF-α、IL-1β、IL-6及IL-10表达水平比较,差异有统计学意义(q=15.194、28.382、19.100和9.287,P=0.002、0.000、0.000和0.007),糖尿病模型组的TNF-α、IL-1β、IL-6的表达水平高于正常对照组,而IL-10的表达水平低于正常对照组;二甲双胍干预组与糖尿病模型组TNF-α、IL-1β、IL-6及IL-10表达水平比较,差异有统计学意义(q= 17.828、23.092、28.124和 12.160,P=0.001、0.000、0.000和0.003),二甲双胍干预组的TNF-α、IL-1β、IL-6的表达水平低于糖尿病模型组,而IL-10的表达水平较糖尿病模型组升高。见图2、3。
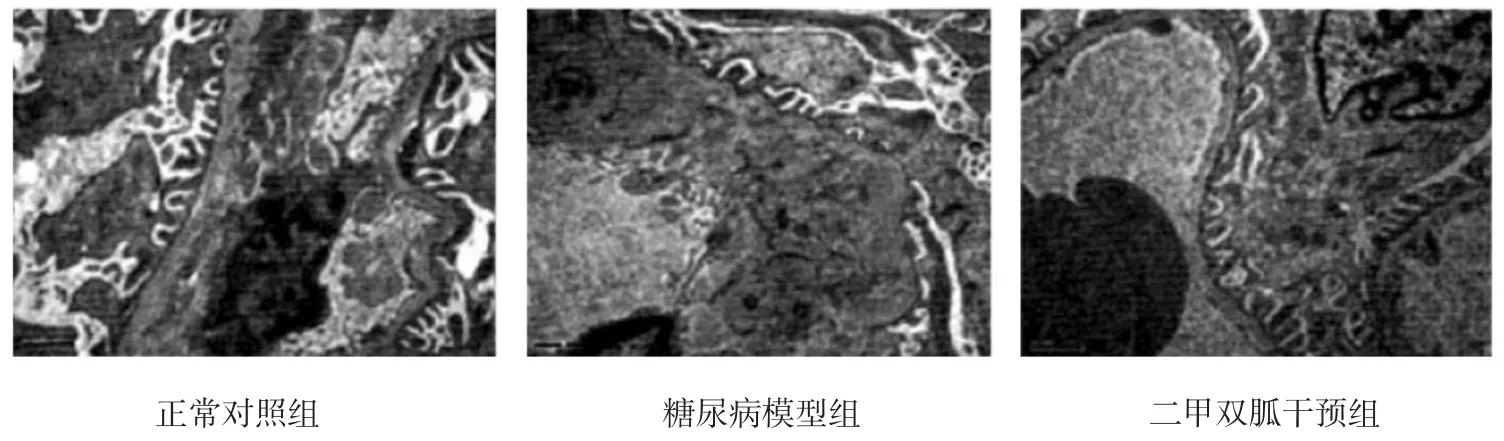
图1 3组大鼠肾脏病理学改变 (电镜×1 000)

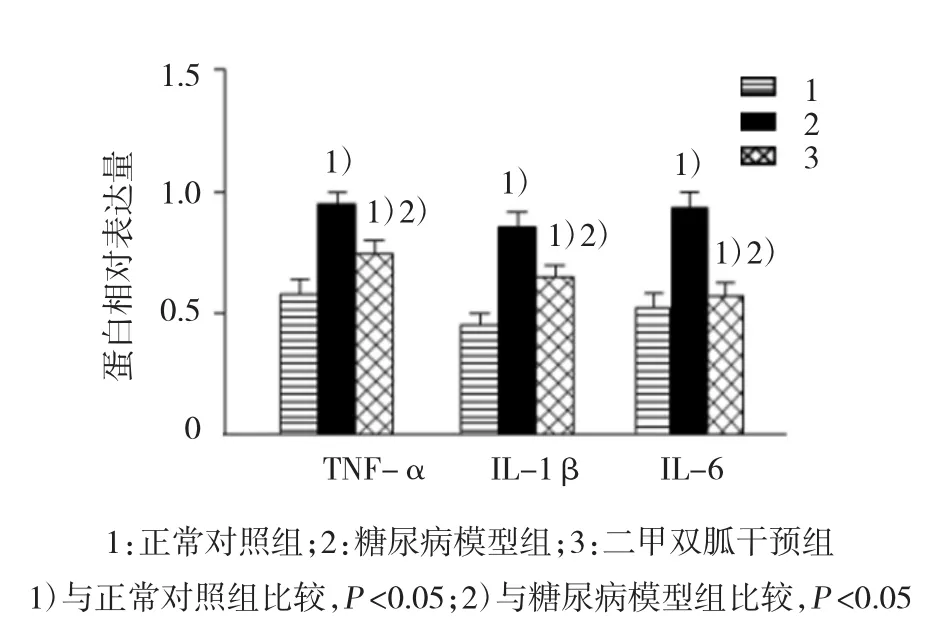
图2 各组大鼠肾脏炎症因子TNF-α、IL-1β及I L-6的表达 (±s)
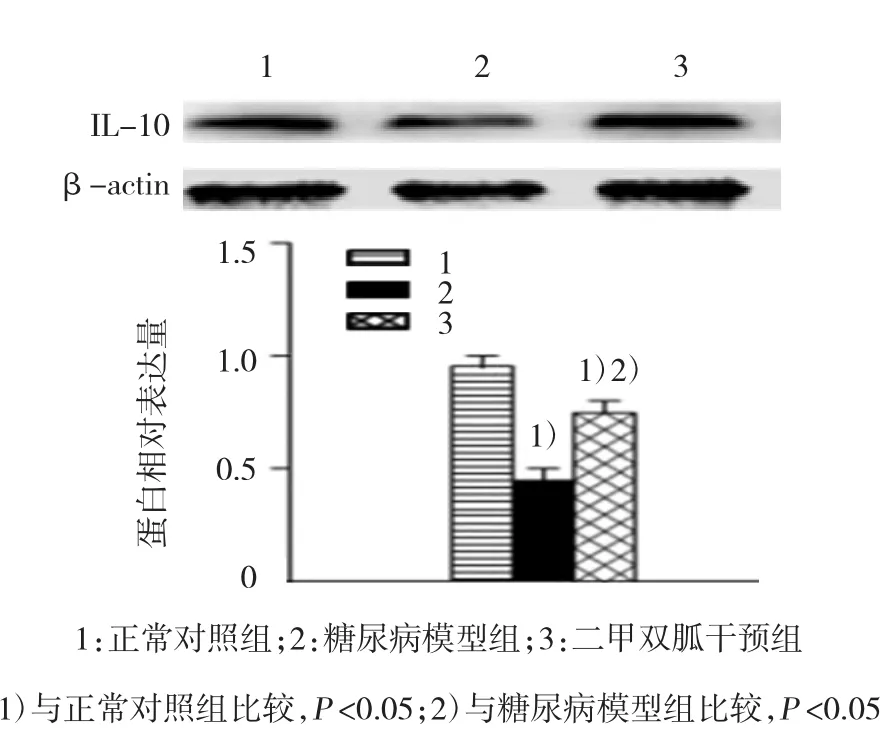
图3 各组大鼠肾脏抗炎因子I L-10的表达 (±s)
3 讨论
高血糖可引起蛋白质、脂类发生生理和生化特性的改变,最终形成糖基化终末产物[13],其可诱导单核趋化蛋白转化生长因子β1、结缔组织生长因子及血管内皮生长因子的产生,促使肾小球硬化[14-15];并且可促使血管ICAM-1与肾小管上皮细胞表达增多,导致白细胞从小管周围毛细血管内皮细胞迁移至肾脏间质,造成肾脏肥大,肾功能受损[16-17]。
二甲双胍作为一种经典降糖药,可有效改善糖尿病肾病患者的肾功能,这可能涉及多种机制。首先,该药可通过多种机制降低血糖,减少糖基化终末产物的产生[18];二甲双胍可减少谷胱甘肽过氧化物酶的表达,从而降低肾脏组织内的氧化应激[19];另外该药可降低血小板聚集和黏附,改善肾脏血管反应性及微循环[20]。但目前关于二甲双胍是否通过抗炎作用来实现对肾脏的保护作用尚少见报道。TNF-α、IL-1β及IL-6是临床上较为常用的炎症因子指标,常用来反应机体炎症反应的强弱;而IL-10为应用较为成熟的抗炎因子指标,用来反映机体的抗炎能力。因此本研究采用TNF-α、IL-1β、IL-6及IL-10来反映大鼠肾脏的炎症-抗炎反应状态。
本实验模型复制成功,并且发现糖尿病大鼠肾脏组织炎症细胞因子TNF-α、IL-1β及IL-6增加,抗炎症细胞因子IL-10减少。给予二甲双胍治疗后,血糖下降,肾脏肥大改善,肾脏炎症细胞因子与抗炎症细胞因子失平衡也得到改善。因此,笔者推测二甲双胍改善糖尿病肾病患者的肾功能是通过对肾脏的炎症细胞因子的调节来实现。未来笔者将进一步开展相关实验,一方面验证抗炎治疗是否对糖尿病肾病有直接的肾脏保护作用,另一方面将从细胞、基因水平进一步探究相关机制。
总之,本研究发现二甲双胍对糖尿病肾病大鼠的肾脏具有保护作用,其机制可能与抑制糖尿病大鼠肾脏炎症细胞因子表达有关。
[1]YAO Y,FOMISON-NURSE I C,HARRISON J C,et al.Chronic bilateral renal denervation attenuates renal injury in a transgenic rat model of diabetic nephropathy[J].American Journal of Physiology Renal Physiology,2014,307(3):F251-F262.
[2]HE Y,XU Z,ZHOU M,et al.Reversal of early diabetic nephropathy by islet transplantation under the kidney capsule in a rat model[J].2016,2016(4):1-12.
[3]VERAg,LÓPEZ-MIRANDA V,HERRADÓN E,et al.Characterization of cannabinoid-induced relief of neuropathic pain in rat models of type 1 and type 2 diabetes[J].Pharmacology Biochemistry Behavior,2012,102(2):335-343.
[4]HUANG L Y,TSUI D Y,WILLIAMS C M,et al.The furoxan nitric oxide donor,PRG150,evokes dose-dependent analgesia in a rat model of painful diabetic neuropathy(PDN)[J].Clinical Experimental Pharmacology Physiology,2015,42(9):921-929.
[5]肖雪娜,王莹,马彩娟,等.二甲双胍和阿卡波糖治疗早期糖尿病肾病疗效比较[J].中日友好医院学报,2012,12(2):86-89.
[6]陈淼,娄宁,陈福莲,等.二甲双胍对糖尿病肾病患者肾功能的影响[J].南京医科大学学报(自然科学版),2010,30(5):713-716.
[7]张永刚,任宁卫.二甲双胍联合益气补血法对2型糖尿病合并糖尿病肾病患者HGF、肌酐清除率及临床疗效影响[J].辽宁中医药大学学报,2016,18(8):211-213.
[8]YUE W,YANG C S,DIPAOLA R S,et al.Repurposing of metformin and aspirin by targeting AMPK-mTOR and inflammation for pancreatic cancer prevention and treatment[J].Cancer Prevention Research,2014,7(4):388-397.
[9]SAISHO Y.Metformin and Inflammation:its potential beyondglucose-lowering effect[J].Endocr Metab Immune Disord Drug Targets,2015,15(3):196-205.
[10]赵富利,亓民,刘辉.利拉鲁肽联合二甲双胍治疗2型糖尿病伴肥胖患者疗效及对微炎症状态的影响[J].中国现代医学杂志, 2015,25(15):43-46.
[11]CUI F,ZOU D,GAO Y,et al.Effect of tongxinluo on nephrin expression via inhibition of notch1/snail pathway in diabetic rats[J]. Evidence-based Complementary and Alternative Medicine,2015, 2015(7):1-11.
[12]BISHNOI M,BOSGRAAF C A,ABOOJ M,et al.Streptozotocin-induced early thermalhyperalgesia is independentofglycemic state of rats:role of transient receptor potential vanilloid 1(TRPV1)and inflammatory mediators[J].Molecular Pain, 2011,7(1):3278-3294.
[13]LI X,LI C,LI X,et al.Involvement of histone lysine methylation in p21gene expression in rat kidneyin vivoand rat mesan-gial cellsin vitrounder diabetic conditions[J].Journal of Diabetes Research,2016,2016(10):1-12.
[14]JIANG S,DU P,AN L,et al.Anti-diabetic effect of coptis chinensis polysaccharide in high-fat diet with STZ-induced diabetic mice[J].International Journal of Biological Macromolecules, 2013,55(3):118-122.
[15]LAMBA H S,BHARGAVA C S,THAKUR M,et al.α-glucosidase and aldose reductase inhibitory activity in vitro and antidiabetic activity in vivo of tribulus terrestris L (dunal)[J]. International Journal of Pharmacy Pharmaceutical Sciences, 2011,3(3):270-272.
[16]HUANGg,LV J,LI T,et al.Notoginsenoside R1 ameliorates podocyte injury in rats with diabetic nephropathy by activating the PI3K/Aktsignaling pathway[J].InternationalJournalof Molecular Medicine,2016,38(4):1179-1189.
[17]LOPEZPARRA V,MALLAVIA B,LOPEZFRANCO O,et al. Fcγ receptordeficiency attenuatesdiabetic nephropathy[J]. Journal of the American Society of Nephrology,2012,23(9):1518-1527.
[18]PERNICOVA I,KORBONITS M.Metformin-mode of action and clinical implications for diabetes and cancer[J].Nature Reviews Endocrinology,2014,10(3):143.
[19]施鹏,李婉湘.盐酸二甲双胍片对2型糖尿病神经病变患者氧化应激的作用[J].中国实用神经疾病杂志,2014(8):19-21.
[20]SOLINI A,ROSSI C,DURANTI E,et al.Saxagliptin prevents vascular remodeling and oxidative stress in db/db mice.Role of endothelial nitric oxide synthase uncoupling and cyclooxygenase[J]. Vascular Pharmacology,2015,76(666):62-71.
(童颖丹 编辑)
Protective effect of Metformin on Streptozotocin-induced nephropathy in diabetic rats
Yan Mei,San-tao Ou
(Department of Nephrology,the Affiliated Hospital of Southwest Medical University, Luzhou,Sichuan 646000,China)
Objective To observe the effectofMetformin on diabetic nephropathy induced by Streptozotocin in rats,and to explore its preventive and therapeutic effect on diabetic nephropathy.MethodsThirty-six healthy male 14-week-old Wistar rats were randomly divided into threegroups,i.e.normal controlgroup,diabeticgroup and Metformin interventiongroup.Streptozotocin was used to induce diabetic rat model. TNF-α,IL-1β,IL-6 and anti-inflammatory cytokine IL-10 in the renal tissues were detected by Western blot.MethodsThe levels of TNF-α,IL-6 and IL-1β in the renal tissues of the diabetic rats were significantly higher than those in the normal controls,while the IL-10 level was significantly lower than that in the controlgroup (P<0.05).After treatment with Metformin,the levels of TNF-α,IL-6 and IL-1β in the renal tissues decreased while the IL-10 level increased in the diabetic rats (P<0.05).ConclusionsMetformin can ameliorate diabetic nephropathy induced by Streptozotocin in rats by inhibiting the expression of inflammatory cytokines.
Metformin;diabetes;nephropathy;inflammatory cytokine
R587.1
A
2017-01-10
欧三桃,E-mail:422216756@qq.com
10.3969/j.issn.1005-8982.2017.20.001
1005-8982(2017)20-0001-05
