多功能净化柱-高效液相色谱法同时检测食用油中黄曲霉毒素和赭曲霉毒素A
2017-09-18,,,,
,,, ,
(1.新疆师范大学化学化工学院,新疆乌鲁木齐 830054;2.新疆合普联科技术检测研究院,新疆乌鲁木齐 831400;3.新疆医科大学药学院,新疆乌鲁木齐 830011)
多功能净化柱-高效液相色谱法同时检测食用油中黄曲霉毒素和赭曲霉毒素A
邢亚楠1,欧阳巧凤2,王绍坤2,杨斌2,周晓英3,*
(1.新疆师范大学化学化工学院,新疆乌鲁木齐 830054;2.新疆合普联科技术检测研究院,新疆乌鲁木齐 831400;3.新疆医科大学药学院,新疆乌鲁木齐 830011)
目的:研究并建立高效液相色谱法同时检测20批食用油中黄曲霉毒素B1、B2、G1、G2和赭曲霉毒素A的定量方法。方法:样品经涡旋、离心提取后,采用多功能净化柱对目标毒素净化富集,采用SHIMADZU Inertsil ODS-C18色谱柱(4.6 mm×150 mm,5 μm),FLD检测器,以甲醇-0.5%乙酸水为流动相进行梯度洗脱,进样量为10 μL,流速为0.8 mL/min,柱温为35 ℃,改变波长荧光检测并对方法学进行考察。结果:AFB1在0.25~40.6 ng/mL(r=0.9999),AFG1在0.5~40.4 ng/mL(r=0.9997),AFB2在0.06~10.06 ng/mL(r=0.9999),AFG2在0.06~10.08 ng/mL(r=0.9999),OTA在1.01~50.5 ng/mL(r=1.00)范围内呈良好线性关系,5种毒素的加标平均回收率为91.40%~109.36%。样品检测结果表明,20批食用油样品中有4批样品检测结果呈阳性,均受到黄曲霉毒素G1、G2的污染。结论:该方法准确、快速,能够广泛用于食用油中黄曲霉毒素B1、B2、G1、G2和赭曲霉毒素A的定量检测。
多功能净化柱,高效液相色谱,黄曲霉毒素,赭曲霉毒素A
真菌毒素(mycotoxin)是产毒真菌在适宜的环境条件下产生的有毒代谢产物,目前已知有300多种结构不同的真菌毒素[1]。黄曲霉毒素(Aflatoxins,AFT)是真菌黄曲霉(Aspergillusflavus)和寄生曲霉(Asperegillusparasiticus)所产生的毒性次生代谢产物[2],已分离出的黄曲霉毒素及其衍生物有20多种[3],其中黄曲霉毒素B1、B2、G1、G2(AFB1、AFB2、AFG1、AFG2)较为常见,AFT是迄今为止发现的毒性最强的一类化合物之一[4],且具有致癌性。早在1993年,AFB1被国际癌症研究机构(IARC)划定为I类致癌物[5];赭曲霉毒素(Ochratoxin,OT)是赭曲霉(Asperegillusochraceus)、纯绿青霉(Penicilliumviridicatum)和碳黑曲霉(Asperegilluscarbonarius)产生的有毒次级代谢产物[6],它包括7种结构类似的化合物,其中以赭曲霉毒素A(OTA)毒性最大,不仅有致癌、致畸和致突变作用,并且还具有肾毒性、肝毒性、免疫毒性等毒副作用。归为ⅡB类致癌物质[7]。AFT和OTA在自然界中污染频率较高污染范围较广,它们易存在于花生、棉籽、玉米、小麦和稻米等农作物中从而带来食品安全隐忧[8]。
鉴于AFT和OTA的危害,逐渐有国家对其制定了严格的限量标准和分析检测方法[9]。目前为止,用于检测AFT和OTA的方法主要有酶联免疫法(ELLSA)[10],它是一种用于快速筛查的定性方法,容易出现假阳性的结果需要进一步确证;液相色谱法(HPLC)[11],常用于化合物的分离与分析同样具有灵敏快速、高选择性等优点;液质联用法(LC-MS/MS)[12],是将色谱与质谱优势相结合的方法,具有高效快速,灵敏度高等优点但分析成本较高;考虑到经济与适用性,本实验选择HPLC法对AFB1、AFB2、AFG1、AFG2和OTA五种毒素进行分离与检测。
1 材料与方法
1.1材料与仪器
甲醇、乙腈 色谱纯,美国Sigma公司;氯化钠、冰醋酸 分析纯,天津盛森精细化工有限公司;黄曲霉毒素混合对照品:AFB1:2.03 μg/mL、AFG1:2.02 μg/mL、AFB2:0.503 μg/mL、AFG2:0.504 μg/mL 批号:L14311A,Romer Labs;赭曲霉毒素A对照品:OTA:10.01 μg/mL 批号:L13391B,Romer Labs;棉籽油10批、花生油5批、玉米油5批 随机购于市场。
LC-20A液相色谱系统配备RF-20A荧光检测器、Inertsil ODS-C18色谱柱(4.6 mm×150 mm,5 μm) 日本SHIMADZU公司;DC-12氮吹仪 上海安谱科学仪器有限公司;QL-866涡流混合器 海门市其林贝尔仪器制造有限公司;HC-3018R高速离心机 科大创新有限股份公司;XS105型万分之一电子天平 德国梅特勒-托利多仪器有限公司;milli-Q超纯水机 美国Millippore公司;MycoSep®226多功能净化柱(5 mL) Romer Labs。
1.2对照品溶液配制
精密吸取200 μL黄曲霉毒素混合对照品、50 μL赭曲霉毒素A对照品溶液分别于10 mL棕色容量瓶,用乙腈溶解并定容,配制成AFB1:40.6 ng/mL,AFG1:40.4 ng/mL,AFB2:10.0 ng/mL,AFG2:10.1 ng/mL,OTA:50.5 ng/mL的混合储备液,于-20 ℃保存。使用时用乙腈稀释成AFB1:20.3、10.1、5.07、1.02、0.510、0.255 ng/mL,AFG1:20.2、10.1、5.05、1.01、0.505、0.253 ng/mL,AFB2:5.03、2.51、1.26、0.251、0.126、0.0629 ng/mL,AFG2:5.04、2.52、1.26、0.252、0.126、0.0630 ng/mL,OTA:25.2、10.0、5.05、2.52、1.01 ng/mL的系列黄曲霉毒素和赭曲霉毒素A混合对照品溶液。
1.3样品提取、净化与富集
称取食用油样品(25±0.01) g于离心试管,加入5 g NaCl并加入提取液乙腈-水(84∶16,V/V)至100 mL,振荡,涡旋5 min,静置,准确吸取10 mL于15 mL离心管中,以10000 r/min离心10 min,取8 mL上清液至MycoSep®226萃取柱的玻璃套管中,将MycoSep®226萃取柱的红色橡胶头插入套管内,缓慢将萃取柱推入套管底部,使提取液通过固定相进入管中,取5 mL管中的净化液置于小试管中,在80 ℃条件下氮气吹至0.2 mL,用甲醇定容至1 mL,涡旋1 min,过0.45 μL有机滤膜,供HPLC检测。
1.4色谱条件
色谱柱为SHIMADZU Inertsil ODS-C18(4.6 mm×150 mm,5 μm);以0.5%乙酸为流动相A,甲醇为流动相B,按表1进行梯度洗脱,流速:0.8 mL/min,柱温:35 ℃,进样量:10 μL。检测器为荧光检测器(FLD)。

表1 梯度洗脱Table 1 The gradient elution program
注:λEx指荧光最大激发波长,λEm指荧光最大发射波长。
1.5数据处理
采用LC Solution软件进行分析,采用Origin 8.0软件绘制色谱图。
2 结果与讨论
2.1专属性
取黄曲霉毒素、赭曲霉毒素A混合对照品溶液、阴性食用油样品供试品溶液和加标阴性食用油样品供试品溶液(添加浓度为AFB1:3 ng/mL,AFG1:3 ng/mL,AFB2:0.8 ng/mL,AFG2:0.8 ng/mL,OTA:4 ng/mL)按1.4中的色谱条件进样检测,记录色谱图,如图1~图3所示。由图1可知,AFG2、AFG1、AFB2、AFB1、OTA的保留时间分别为7.6、9.1、10.6、13.1、25.0 min,各色谱峰的分离度均大于1.5。由图2、图3可看出,阴性样品中不存在明显干扰峰,且选用的MycoSep®226多功能净化柱能够针对两种毒素对样品进行净化且效果明显,表明在选定色谱条件下共存成分对AFB1、AFG1、AFB2、AFG2、OTA的测定没有干扰。
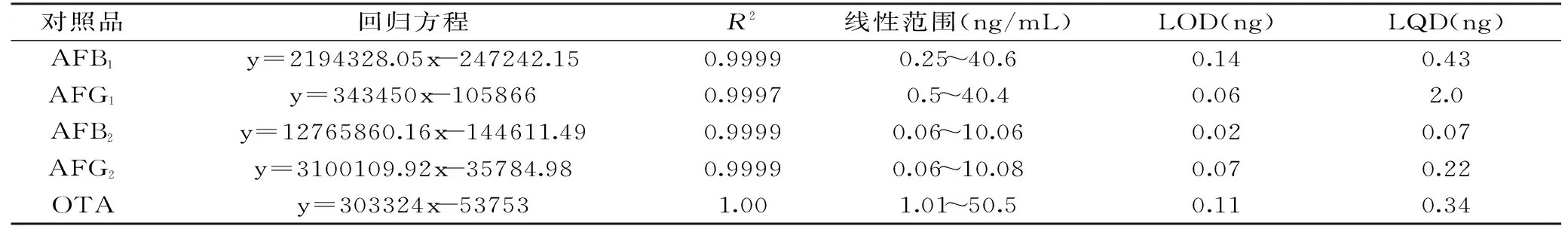
表2 线性、LOD和LQD实验结果Table 2 Results of linear,LOD and LQD
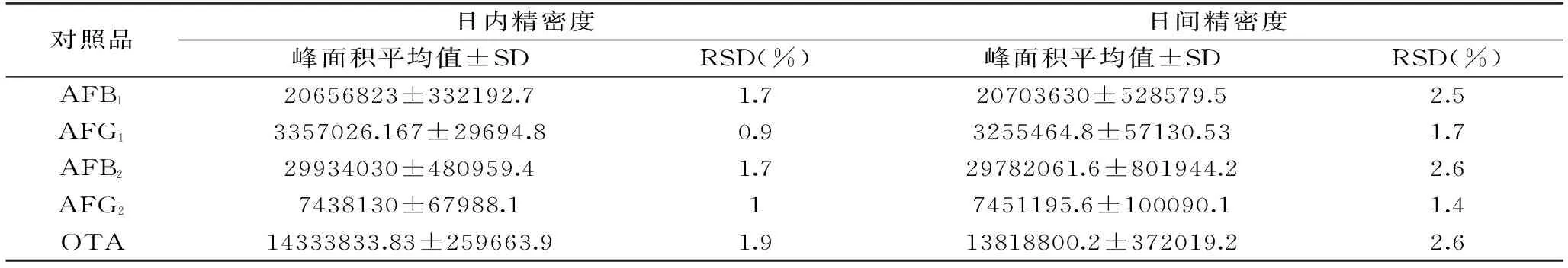
表3 日内与日间精密度实验结果Table 3 The results of intraday and daytime precision test

图1 AFT、OTA混合对照品溶液色谱图Fig.1 The chromatogram of AFT and OTA standard solution 注:1:AFG2,2:AFG1,3:AFB2,4:AFB1,5:OTA;图3同。
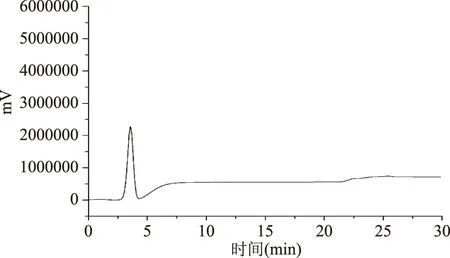
图2 经过净化的阴性样品色谱图Fig.2 The chromatogram of negative samples after purified
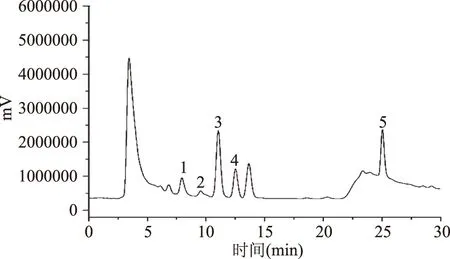
图3 经过净化的阴性加标样品色谱图Fig.3 The chromatogram of negative spiking samples after purified
2.2线性关系及检出限、定量限
取1.2中经稀释的AFB1、AFG1、AFB2、AFG2、OTA系列混合对照品溶液,按1.4中色谱条件进样检测。以浓度C为横坐标(x),以所对应的峰面积A为纵坐标(y),做回归曲线。
根据信噪比S/N=3和S/N=10确定方法检测限(LOD)和定量限(LQD),AFB1、AFG1、AFB2、AFG2、OTA的线性回归方程、变异系数、线性范围及检出限、定量限见表2。
结果表明,5种毒素的浓度与峰面积呈良好的线性关系,R2=0.999,LOD和LQD均低于国家标准GB/T 5009.23-2006[15]。
2.3精密度
取AFB1、AFG1、AFB2、AFG2、OTA的对照品溶液浓度分别为(AFB1:10.1 ng/mL,AFG1:10.1 ng/mL,AFB2:2.51 ng/mL,AFG2:2.52 ng/mL,OTA:10.0 ng/mL),按1.4中的色谱条件,分别在同一天内连续进样6次和在连续的5 d进样测定,记录峰面积见表3,结果显示,AFB1、AFG1、AFB2、AFG2、OTA日内与日间RSD=3.0%,表明仪器精密度良好,符合实际检测要求。
2.4稳定性与重复性
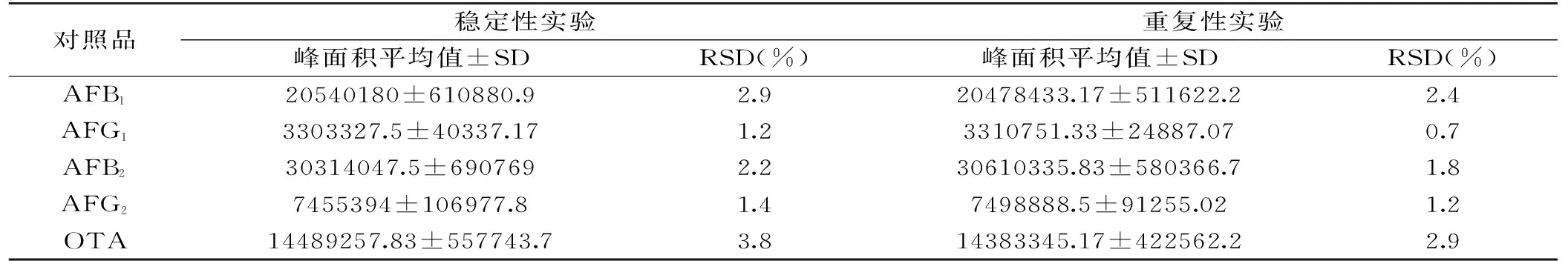
表4 稳定性与重复性实验结果Table 4 The results of stability and repeatability test
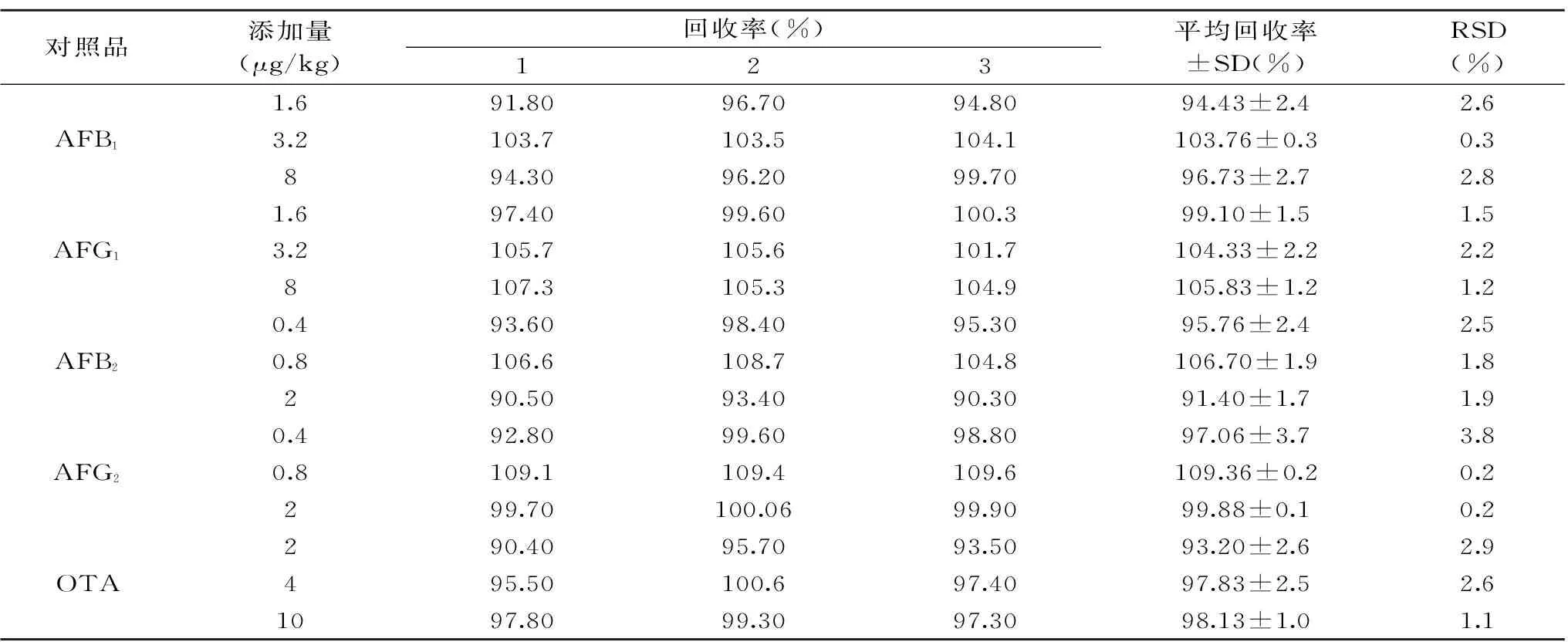
表5 回收率实验结果Table 5 The results of recovery test
称取(25±0.01) g食用油阴性样品,按AFB1、AFG1、AFB2、AFG2、OTA为10.1、10.1、2.5、2.5、50 μg/kg的添加水平添加混合对照品溶液,按1.3中方法制备供试品溶液,于配制后0、2、4、6、12、24 h分别进样,记录峰面积并计算RSD值(表4),结果显示RSD=4.0%,表明供试品溶液在24 h内稳定。
称取(25±0.01) g食用油阴性样品6份,按AFB1、AFG1、AFB2、AFG2、OTA为10.1、10.1、2.5、2.5、50 μg/kg的水平添加混合对照品溶液,按1.3中方法制备供试品溶液,分别进样测定,记录峰面积(表4)RSD=3.0%,结果表明本方法重复性良好。
2.5回收率
称取9份阴性食用油(25±0.01) g,分别置于100 mL具塞试管中,分别精密加入含量为AFB1:1.6、3.2、8 μg/kg,AFG1:1.6、3.2、8 μg/kg,AFB2:0.4、0.8、2 μg/kg,AFG2:0.4、0.8、2 μg/kg,OTA:2、4、10 μg/kg,3个浓度水平的的黄曲霉毒素和赭曲霉A毒素的混合对照溶液,每个浓度水平重复3次。按1.3方法制备供试品溶液,每个水平重复三次,回收率计算公式如下:回收率(%)=(加标样品测得浓度/加标浓度)×100,结果见表5,黄曲霉毒素的平均加样回收率为91.40%~109.36%,其RSD不高于3.8%,赭曲霉毒素A的平均加样回收率为93.2%~98.1%,RSD低于3%。表明该方法提取食用油中5种毒素损失较小,方法适用性较好。
2.6样品分析
称取食用油(25±0.01) g,按照1.3方法对20批食用油(棉籽油10批、玉米油、花生油各5批)进行提取、净化和富集,并应用1.4中的方法进行黄曲霉毒素和赭曲霉毒素A的检测,结果见表6。10批棉籽油中4批检测结果呈阳性,AFG2的污染水平在2.87~3.46 μg/kg之间,AFG1的污染水平在5.89~16.76 μg/kg之间。
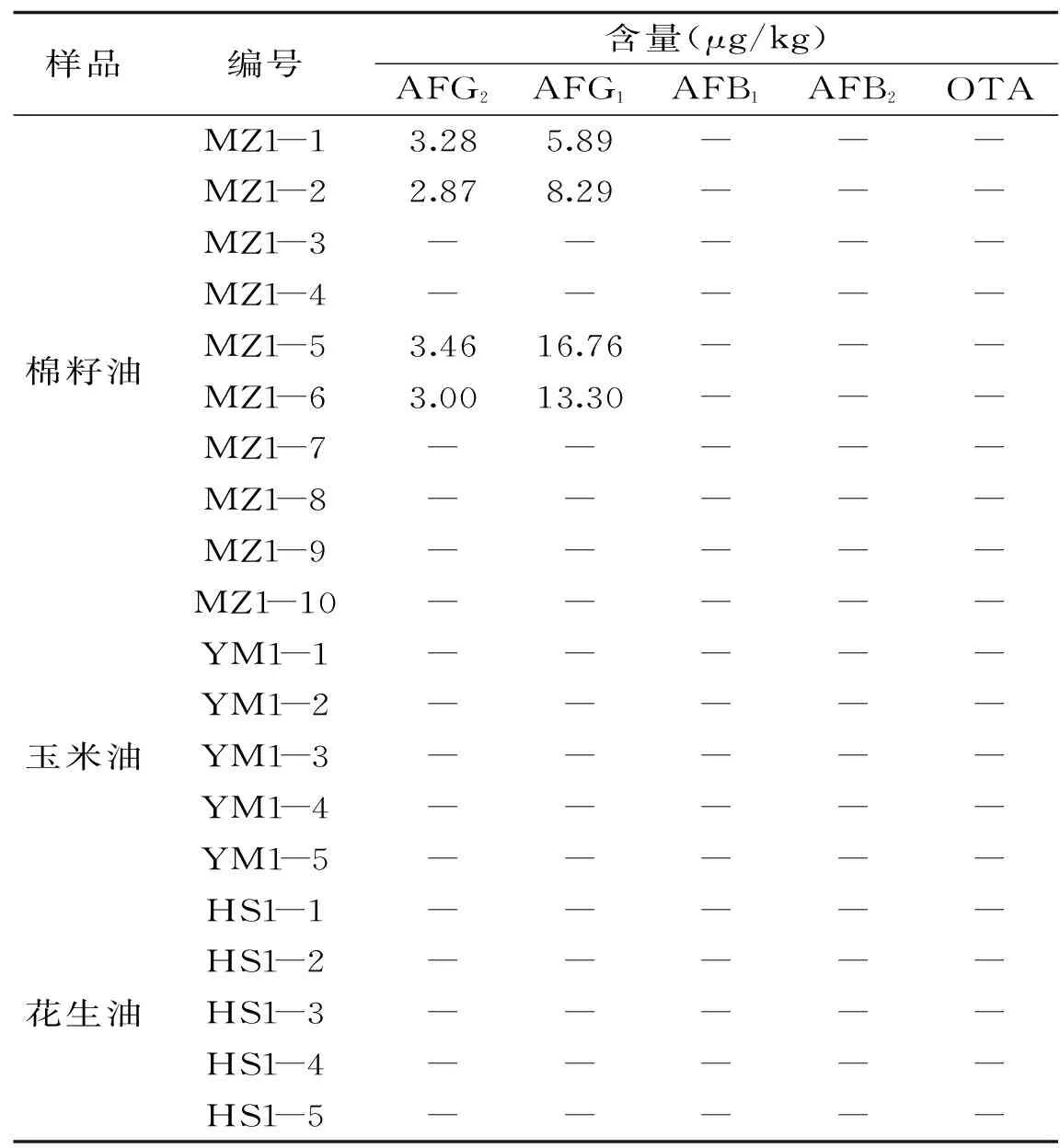
表6 样品分析检测结果Table 6 The results of sample analysis
注:-表示未检出。3结论
本研究建立了多功能净化柱-高效液相色谱法同时检测20批食用油样品中AFT和OTA含量的方法,结果表明,其中有4批棉籽油均受到毒素AFG2和AFG1的污染,且含量超过欧盟(EU)165/2010[16]中的限量标准:用于人类直接食用或作为配料的花生、油料种子、坚果、干制水果、谷物及其制品的黄曲霉毒素总含量不超过4 μg/kg。由于食用油的基质复杂,对于其中的真菌检测分析不易获得准确结果,本研究考察MycoSep®226多功能净化柱对样品基质的净化的情况,结果表明,该处理方法操作简单、快捷且能有效的富集目标毒素使之与基质成分分离,可广泛应于净化农作物、食品及中药材中的基质成分的净化,为HPLC的检测分析提供一定基础,对方法学考察的结果表明,该方法能够满足对样品灵敏、快速、高通量、低溶剂的检测要求,能够准确用于食用油中AFT和OTA的定量分析,在监控食用油中AFT和OTA的残留量方面具有较高的实用价值。为广泛应用于检测农作物、食品及中药材中AFT和OTA提供一定研究基础。
[1]陈丽星. 真菌毒素研究进展[J]. 河北工业科技,2006,23(2):124-126.
[2]Shrestha G R,Mridha A U. Detection and Quantitation of Aflatoxin for the Diagnosis of Aspergillus flavus[J]. Nepal Journal of Biotechnology,2015,3(1):6-9.
[3]Cao J L,Zhou S J,Kong W J,et al. Molecularly imprinted polymer-based solid phase clean-up for analysis of ochratoxin A in ginger and LC-MS/MS confirmation[J]. Food Control,2013,33(2):337-343.
[4]Lim C W,Yoshinari T,Layne J,et al. Multi-mycotoxin screening reveals separate occurrence of aflatoxins and ochratoxin a in asian rice[J]. Journal of Agricultural & Food Chemistry,2015,63(12):3104-3113.
[5]IARC(International Agency for Research on Cancer). Some Naturally Occurring Substances:Food Items and Constituents,Heterocyclic Aromatic Amines and My cotoxins[S]. World Health Organization,Lyon,1993,56.
[6]刘海波,刘建利,贾沙,等.ICA-HPLC检测枸杞中赭曲霉毒素A提取方法的比较[J].江苏农业科学,2016,44(7):347-349.
[7]侯建波,谢文,李杰,等.液相色谱-串联质谱法测定葡萄酒中赭曲霉毒素A、B的残留量[J].理化检验-化学分册,2015,51(9):1290-1293.
[8]杨建伯.真菌毒素与人类疾病[J].中国地方病学杂志,2002,21(4):314-317.
[9]张宇昊,杨琳,马良,等.真菌毒素同时检测方法研究进展[J].中国粮油学报,2011,26(6):123-128.
[10]Lou X,Zhu A,Wang H,et al. Direct and ultrasensitive optofluidic-based immunosensing assay of aflatoxin M1,in dairy products using organic solvent extraction[J]. Analytica Chimica Acta,2016,940(12):120-127.
[11]隋凯,李军,郑江,等.多功能柱净化-高效液相色谱法检测谷物中的玉米赤霉烯酮[J].分析实验室,2006,25(1):99-102.
[12]宫小明,任一平,董静,等.超高效液相色谱串联质谱法测定花生,粮油18种真菌毒素[J].分析测试学报,2011,30(1):6-12.
[13]Li F Q,Li Y W,Wang Y R,et al. Natural Occurrence of Aflatoxins in Chinese Peanut Butter and Sesame Paste[J]. Journal of Agricultural & Food Chemistry,2009,57(9):3519-3524.
[14]Ferracane R,Tafuri A,Logieco A,et al. Simultaneous determination of aflatoxin B1and ochratoxin A and their natural occurrence in Mediterranean virgin olive oil.[J]. Food Additives & Contaminants,2007,24(2):173-180.
[15]GB/T 5009.23-2006食品中黄曲霉毒素B1、B2、G1、G2的测定[S].北京:中国标准出版社,2006.
[16]EU.Commission Regulation(EC)No 165/2010[S]. 2010.
SimultaneousdeterminationofaflatoxinandochratoxinA
inedibleoilbymultifunctionalpurificationcolumnandhighperformanceliquidchromatography
XINGYa-nan1,OUYANGQiao-feng2,WANGShao-kun2,YANGBin2,ZHOUXiao-ying3,*
(1.College of Chemistry and Chemical Engineering,Xinjiang Normal University,Urumqi 830054,China;2.Xinjiang Hope Link Detection Technology Institute,Urumqi 831400,China;3.College of Pharmacy,Xingjiang Medical University,Urumqi 830011,China)
Objective:A quantitative method for simultaneous detection of aflatoxin B1,B2,G1,G2and ochratoxin A in 20 batches of edible oil was carried out by high performance liquid chromatography. Methods:After the sample was vortexed and centrifuged,the target toxin was purified by multifunctional purification column,using SHIMADZU Inertsil ODS-C18column(4.6 mm×150 mm,5 μm),FLD detector and methanol(A)/0.5% acetic acid water(B)by gradient elution,the injection volume was 10 μL,flow rate was 0.8 mL/min,column temperature at 35 ℃,then wavelength fluorescence was changed to detect aflatoxin B1,B2,G1,G2,ochratoxin A and study on methodology. Results:The linear ranges of AFB1,AFG1,AFB2,AFG2and OTA were 0.25~40.6 ng/mL(r=0.9999),0.5~40.4 ng/mL(r=0.9997),0.06~10.06 ng/mL(r=0.9999),0.06~10.08 ng/mL(r=0.9999)and 1.01~50.5 ng/mL(r=1.00). The average recovery rate of five mycotoxins was 91.40%~109.4%. The results showed that 4 batches of 20 samples of edible oil were positive and tested by aflatoxin G1and G2. Conclusion:The method is accurate and rapid,and can be widely used for the quantitative detection of aflatoxin B1,B2,G1,G2and ochratoxin A in edible oil.
multifunction cleanup column;high performance liguid chromatography;aflatoxin;ochratoxin A
2017-01-10
邢亚楠(1992-),女,硕士研究生,研究方向:天然产物的分离与分析,E-mail:xingyanan26@qq.com。
*通讯作者:周晓英(1968-),女,硕士,教授,研究方向:中药质量标准,E-mail:zhouxiaoying4@163.com。
新疆省高校企业联合基金(20161001)。
TS207.3
:A
:1002-0306(2017)16-0242-05
10.13386/j.issn1002-0306.2017.16.046
