脱盐咸鸭蛋清肽-亚铁螯合物的制备及表征
2017-09-18,,,
, ,,
(华中农业大学食品科学技术学院,环境食品学教育部重点实验室,湖北武汉 430070)
脱盐咸鸭蛋清肽-亚铁螯合物的制备及表征
李博,侯焘,陈恩民,何慧*
(华中农业大学食品科学技术学院,环境食品学教育部重点实验室,湖北武汉 430070)
本文以脱盐咸鸭蛋清肽为原料,FeCl2·4H2O为铁源,以亚铁的螯合率和螯合物的得率为跟踪指标,对鸭蛋清肽-亚铁螯合物的制备条件进行优化;并采用红外光谱、动态光散射仪、荧光光谱、圆二色谱手段,对肽-亚铁螯合物进行了结构表征。单因素及正交实验结果表明,鸭蛋清肽-亚铁螯合物的最佳螯合反应条件:抗坏血酸(VC)与亚铁盐的质量比为0.2∶1,鸭蛋清肽溶液的浓度为4%,肽与亚铁盐的质量比为3∶1,pH 5.5,反应温度为40 ℃,反应时间为40 min,乙醇的添加量为反应液体积的7倍,在此条件下亚铁的螯合率为65.15%,螯合物得率为44.46%。红外光谱显示Fe2+与肽的氨基端与羧基端相结合;荧光光谱表明随着Fe2+的增加,荧光吸收带从3822 nm显著下降为3124.44 nm(p<0.05);激光粒度仪显示肽与肽-亚铁螯合物的半径分别为(144.23±5.86) nm和(453.66±8.74) nm;圆二色谱显示肽中α螺旋、β折叠的含量为28.66%±1.54%、10.02%±1.04%,而肽-亚铁螯合物中α螺旋、β折叠的含量为16.10%±1.96%、27.33%±1.08%,两者均发生显著变化(p<0.05)。从结构层面证实了肽-亚铁螯合物的形成。
鸭蛋清肽,亚铁盐,螯合物,螯合率,表征
咸鸭蛋清作为蛋品加工的副产品,其质量在咸鸭蛋中约占54%,因含盐量高达7%~10%,蛋清蛋白粉中盐含量甚至高达35%,极大程度地限制了其应用范围,这不仅造成了良好蛋白质资源的浪费,其排放也易污染环境[1]。目前,将富含蛋白质的食品工业下脚料进行酶解利用是一种趋势[2],因此,将咸鸭蛋清进行脱盐进而获取鸭蛋清蛋白,再进行酶解改性,不仅提高下脚料的附加值,同时可以减少环境污染,获得良好的经济效益与社会效益。咸鸭蛋清肽具有多种生理活性,易于被人体吸收,具有良好的补钙[3-4]、降血压[5]等多种功效,以此为基础,利用鸭蛋清肽制备肽-亚铁螯合物,可以强化鸭蛋清肽补铁的效果。
铁是生物体必需的微量元素,铁元素的缺乏会导致贫血。普通的无机铁和有机酸铁吸收率低,且口感较差,而肽-亚铁螯合物是一种新型的生物态铁,可直接被肠黏膜细胞吸收,吸收率远较无机铁高,并且安全,无消化道刺激,是理想的补铁剂[6]。目前,已有一些关于肽-亚铁螯合物的报道,如鹰嘴豆蛋白肽-亚铁螯合物[7]、乌鸡低聚肽-亚铁螯合物[6]、血红蛋白肽-亚铁螯合物[8]、米糠蛋白肽-亚铁螯合物[9]、鳕鱼皮胶原蛋白肽-亚铁螯合物[10]等。但有关于鸭蛋清肽-亚铁螯合物的研究未见报道。
本研究通过正交实验对鸭蛋清肽-亚铁螯合物的制备条件进行优化,采用红外光谱、荧光光谱、动态光散射仪、圆二色谱对螯合物和肽进行表征,以期为开发一种新型的生物补铁剂提供科学依据。
1 材料与方法
1.1材料与仪器
咸鸭蛋清 购于湖北神丹健康食品有限公司,蛋白含量约为10%,盐含量约7%;氯化亚铁、抗坏血酸、盐酸羟胺、邻菲啰啉、乙醇(95%)等 所用试剂均为国产分析纯。
DF-101S集热式恒温加热磁力搅拌器 巩义市予华仪器有限责任公司;PB-10Sartoius标准型pH计 德国赛多利斯股份公司;TDL-5A台式低速离心机 上海菲恰尔分析仪器有限公司;UV-1750紫外可见分光光度计 日本Shimadza公司;AL204型电子天平 梅特勒-托利多(上海)仪器有限公司;RF-5031荧光分光光度计 日本岛津公司;JASCO-810型圆二色谱仪 日本Jaco公司;LS-609型激光粒度仪 珠海欧美克仪器公司;471FT-IR红外光谱仪 美国Nicolet公司。
1.2实验方法
1.2.1 肽-亚铁螯合物的制备工艺 鸭蛋清蛋白→加入适量的蒸馏水→沸水浴45 min→冷却后放入水浴锅中→pH调到7、温度调至50 ℃→加中性蛋白酶进行水解→NaOH保持pH在最适的条件→沸水灭酶10 min→离心(3800 r/min,15 min)→取上清→旋蒸→冷冻干燥→脱盐咸鸭蛋清肽[5]
脱盐咸鸭蛋清肽→加入抗氧化剂VC→调pH→加入亚铁盐→恒温螯合→离心(4000 r/min,10 min)取上清液→加入适量的乙醇醇沉→离心(10000 r/min,15 min)取沉淀→乙醇洗涤沉淀多次→烘干得到肽-亚铁螯合物[11]
1.2.2 肽-亚铁螯合物的指标测定 采用硫酸亚铁铵配制10 μg/mL铁离子标准溶液,吸取铁离子标准溶液0、2.0、4.0、6.0、8.0、10.0 mL,10%的盐酸羟胺2.5 mL、0.12%邻菲罗啉5 mL、然后加入pH=5醋酸-醋酸钠的缓冲液5 mL,用水稀释至刻度,以不加铁的试剂作为空白溶液,在510 nm波长处测定吸光度[12]。绘制的标准曲线为y=0.2013x+0.0007(R2=0.9992)。
样品测定:准确称取0.02 g的样品置于100 mL烧杯中,加入2 mL浓盐酸,待样品完全溶解后,用蒸馏水定容至100 mL容量瓶中。准确吸取5 mL样品液于50 mL容量瓶中,按照标准曲线的操作步骤测定吸光度。
亚铁离子含量(mg/kg)=CV0/mV1
式中:C为标准曲线上查得样品试液相应的亚铁含量(μg);m为样品的质量(g);V1为测定时所取样品试液的体积(mL);V0为样品处理后的定容体积(mL)。
亚铁螯合率(%)=m′/M×100
式中:m′为螯合物中亚铁的含量(mg);M为加入反应体系中亚铁的总量(mg)。
肽-亚铁螯合物得率(%)=W0/W1×100
式中:W0为小分子肽-亚铁螯合物总量(mg);W1为小分子肽与亚铁盐的总质量(mg)。
1.2.3 肽-亚铁螯合物的制备工艺
1.2.3.1 VC与亚铁盐的质量比对螯合反应中亚铁离子的影响 固定肽的浓度为4%,肽与亚铁盐质量比2∶1,pH为5,温度为40 ℃,反应时间40 min,乙醇的体积倍数为5,选用VC与亚铁盐的质量比(0.1∶1、0.15∶1、0.2∶1、0.25∶1、0.3∶1);将螯合反应液离心后的沉淀干燥,比较沉淀的质量。
1.2.3.2 单因素实验设计 固定VC与亚铁盐的质量比为0.2∶1,pH为5,温度为40 ℃,反应时间40 min,肽与亚铁盐质量比为2∶1,乙醇的体积倍数为5,选用肽的浓度为2%、3%、4%、5%、6%;
固定VC与亚铁盐的质量比为0.2∶1,肽的浓度为4%,pH为5,温度为40 ℃,反应时间40 min,乙醇的体积倍数为5,选用肽与亚铁盐质量比为1∶1、2∶1、3∶1、4∶1、5∶1;
固定VC与亚铁盐的质量比为0.2∶1,肽与亚铁盐质量比为3∶1,pH为5,温度为40 ℃,反应时间40 min,肽的浓度为4%,乙醇的体积倍数为5,选用pH为3、4、5、6、7;
固定VC与亚铁盐的质量比为0.2∶1,肽与亚铁盐质量比为3∶1,pH为6,反应时间40 min,肽的浓度为4%,乙醇的体积倍数为5,选用温度为20、30、40、50、60 ℃;
固定VC与亚铁盐的质量比为0.2∶1,肽与亚铁盐质量比为3∶1,pH为6,温度为40 ℃,肽的浓度为4%,乙醇的体积倍数为5,选用反应的时间为20、30、40、50、60 min;
固定VC与亚铁盐的质量比为0.2∶1,肽与亚铁盐质量比为3∶1,pH为6,温度为40 ℃,肽的浓度为4%,反应的时间40 min,选用乙醇的体积倍数(乙醇是离心后上清液体积的倍数)为4、5、6、7、8。按上述顺序进行单因素实验,选择优化后的结果逐一进行单因素实验,以螯合反应中亚铁的螯合率和螯合物得率为衡量指标。
1.2.3.3 正交实验 在上述单因素实验的基础上,反应时间、温度、乙醇的体积倍数按照单因素的结果确定,以pH、肽与亚铁盐的质量比、肽的浓度为实验因素,以亚铁螯合率和螯合物得率为测试指标,通过正交实验筛选出肽-亚铁螯合物制备的最佳工艺参数。正交实验因素和水平见表1。
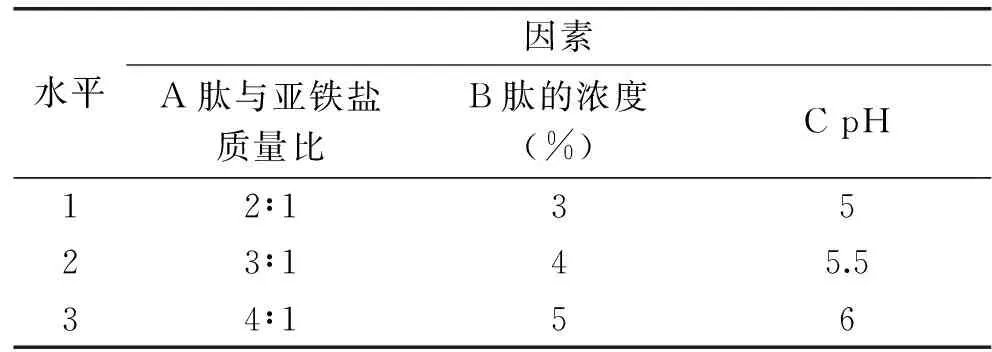
表1 正交实验因素与水平Table 1 Factors and levels in orthogonal test
1.2.4 肽与肽-亚铁螯合物的红外光谱分析 将肽-亚铁螯合物与肽样品各5 mg,放入玛瑙研钵中,加入干燥的500 mg纯KBr,混合研磨均匀,光谱范围为4000~400 cm-1,扫描信号累加次数为32次,分辨率为4 cm-1,利用红外光谱仪进行定性分析,得到光谱图。
1.2.5 肽与肽-亚铁螯合物的粒径分析 将肽-亚铁螯合物与肽分别用蒸馏水(RI=1.330)溶解,得到1 mg/mL的溶液。测试条件为比色杯尺寸为1 cm的聚苯乙烯池,测量温度为25 ℃,温度平衡时间为2 min。
1.2.6 肽与肽-亚铁螯合物的荧光光谱分析 将肽用醋酸-醋酸钠(pH=5)的缓冲液溶解得到1 mg/mL的溶液,加入不同质量的FeCl2,使FeCl2的浓度分别为2、4、6、8、10 mmol/L,常温静置20 min后进行实验。测试条件为激发波长280 nm,发射波长290~500 nm,激发与发射狭缝的宽度均为5 nm,温度为25 ℃。
1.2.7 肽与肽-亚铁螯合物的圆二色谱分析 将肽-亚铁螯合物与肽分别溶解得到1 mg/mL的溶液。测试条件设置波长范围为190~260 nm,池厚为0.1 cm,温度25 ℃,谱带宽度为1.0 cm,扫描速率20 nm/min,扫描3次,累加得到CD谱图。
1.3数据处理
实验中每个处理重复三次,采用SPSS 18.0软件进行数据的显著性分析,应用Origin 8.5软件绘图。
2 结果与分析
2.1肽-亚铁螯合物的制备条件
2.1.1 维生素C对螯合反应的影响 由图1可知,添加维生素C(VC)是为了防止Fe2+氧化成Fe3+。当VC与亚铁盐质量比从0.1∶1增大到0.2∶1时,Fe(OH)3沉淀呈下降趋势,VC与亚铁盐质量比为0.2∶1时,沉淀的质量下降到最低点,继续增加VC的质量,沉淀的质量上升。加入VC过少,Fe2+容易氧化成Fe3+,并生成Fe(OH)3沉淀,造成螯合物不纯(含有肽与Fe3+生成的螯合物),并且肽与Fe3+形成的螯合物中的Fe3+不是补铁的活性形式;加入VC过多,虽能有效防止Fe2+的氧化,但反应体系中还有多余的VC,VC具有一定的螯合能力,同样造成螯合物不纯(含有VC与Fe2+生成的螯合物),并且还会影响对肽与亚铁螯合能力的准确评估。所以选择VC为亚铁盐质量的0.2倍。
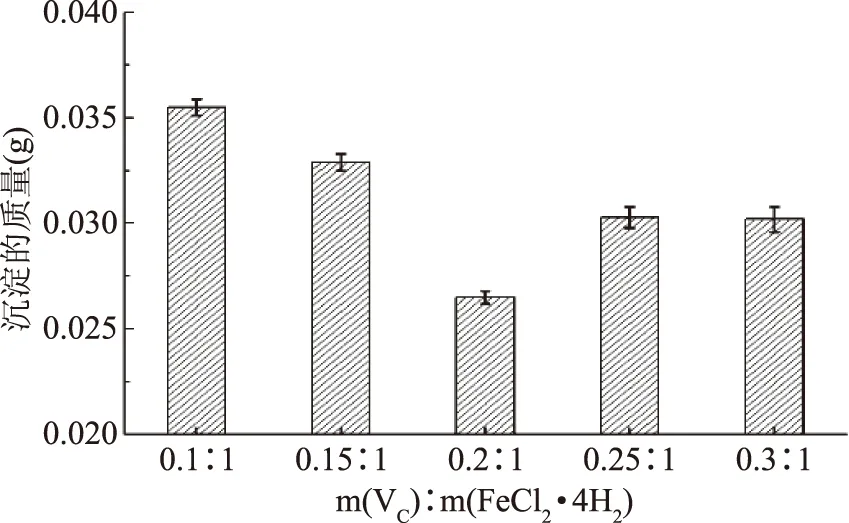
图1 VC加入量对螯合反应的影响Fig.1 Effect of the amount of ascorbic acid on chelating reaction
2.1.2 肽的浓度对螯合反应的影响 由图2可知,当肽的浓度由2%升到4%时,亚铁螯合率与螯合物的得率呈上升趋势,4%时达到最大,继续增加肽的浓度时,亚铁螯合率与螯合物的得率均下降。当肽与亚铁盐质量比一定时,肽浓度较低时,溶液中肽及亚铁的浓度都很低,两者之间由于热运动引起的相互碰撞也少,所以螯合程度低[13],随着肽浓度的逐渐增大,螯合物的产量提高;但是当肽及亚铁浓度过大时,会产生大量的螯合物,而大量产物存在时,在一定程度上会使反应逆向进行,使螯合率降低。故选择合适的肽浓度为4%。
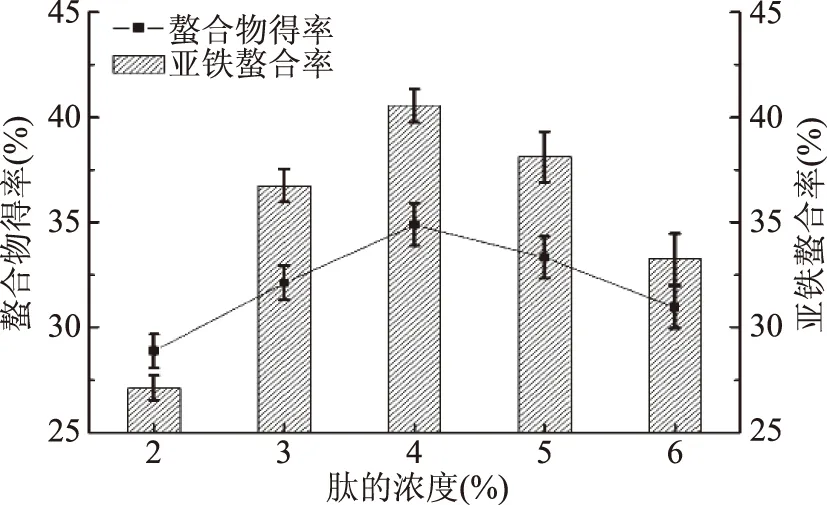
图2 肽的浓度对螯合反应的影响Fig.2 Effect of concentration of the peptide on chelating reaction
2.1.3 肽与亚铁盐质量比对螯合反应的影响 由图3可知,当质量比从1∶1升到时3∶1,亚铁螯合率和螯合物的得率呈上升趋势;从3∶1到5∶1时,亚铁螯合率和螯合物的得率下降。可能因为当向肽溶液中加入亚铁盐时溶液过少时,螯合反应后还剩下部分多肽,造成肽的利用率不高,螯合物的得率不高;当向肽液中加入亚铁盐过多时,螯合反应虽能充分利用多肽,但由于Fe2+过多时,肽的螯合能力已达到饱和,因而其螯合物的得率和螯合率均降低。因此,选择肽与亚铁盐质量比为3∶1。
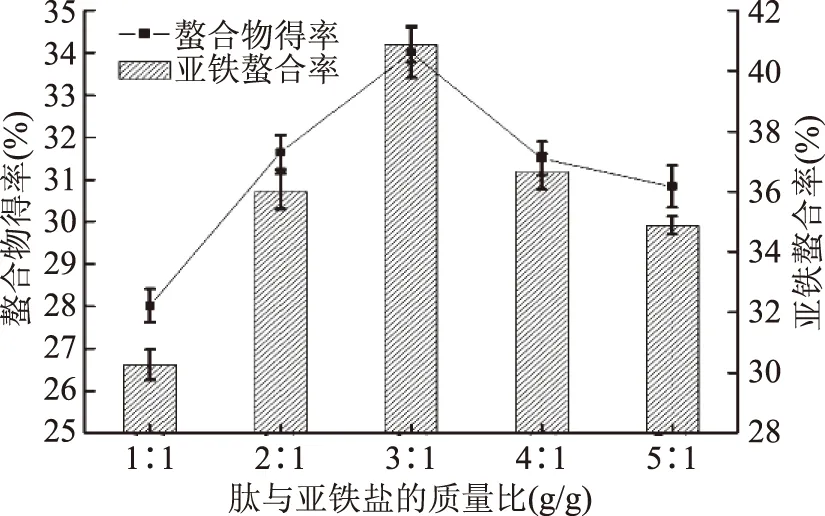
图3 肽与亚铁盐的质量比对螯合反应的影响Fig.3 Effect of the mass ratio of peptide to ferrous salt on chelating reaction
2.1.4 pH对螯合反应的影响 由图4可知,pH在3~7范围内,先随着pH的增大,螯合率呈上升趋势,当pH达到6时,螯合率和螯合物得率均达到最高;继续增大pH,螯合率和螯合物得率则均呈下降趋势。在pH较低的酸性条件下,反应体系中存在较多H+,不利于配位原子的释出;当pH逐渐增大时,反应体系中OH-增多,体系会有Fe(OH)2生成,Fe(OH)2也极易氧化成Fe(OH)3,因此选择反应体系的pH为6。
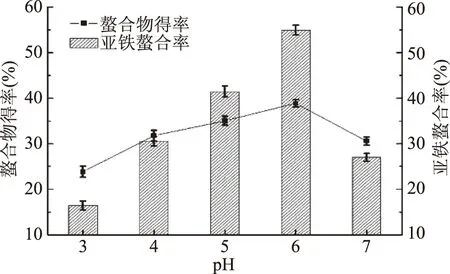
图4 pH对螯合反应的影响Fig.4 Effect of pH on chelating reaction
2.1.5 温度对螯合反应的影响 如图5所示,当温度从20 ℃逐步升温时,螯合率和螯合物得率先提高;当温度达到40 ℃时,螯合率和螯合物得率均达最高;若温度再升高时,螯合率和螯合物得率均呈现降低的趋势。因为反应体系中如果温度过低,则会减缓肽与Fe2+的反应活力,降低螯合率和螯合物得率;当反应温度过高时,Fe2+则容易被氧化成Fe3+,同样降低螯合率和螯合物的得率[13]。故选40 ℃作为螯合反应最适温度。
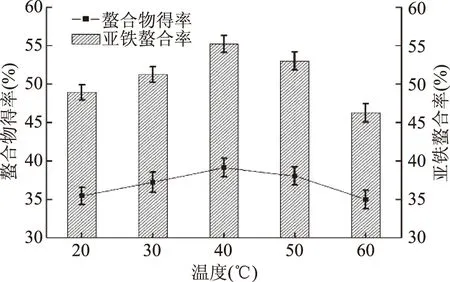
图5 温度对螯合反应的影响Fig.5 Effect of temperature on chelating reaction
2.1.6 时间对螯合反应的影响 由图6可知,螯合时间从20 min延长到40 min,螯合率和螯合物得率均呈上升趋势,在40 min时螯合率和螯合物得率均最高,继续延长螯合时间,螯合率和螯合物得率反而降低,说明在40 min时螯合反应程度达到最高。由于金属离子螯合是一个能快速完成的反应,故不需用过长的时间[14]。故选40 min作为螯合反应的最适时间。
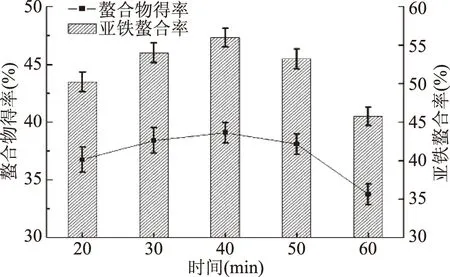
图6 时间对螯合反应的影响Fig.6 Effect of time on chelating reaction
2.1.7 乙醇对螯合反应的影响 由图7可知,当乙醇体积分数由4倍增加到7倍时,螯合率与得率均先增大,乙醇体积分数为7倍时达到最大,继续增大,螯合率和螯合物得率反而降低。这主要是因为当乙醇添加量过少时,沉淀不够充分;而当乙醇加入量过多时,相当于溶剂增多,有可能使难溶物达不到其溶度积而部分溶解,导致螯合率与螯合物的得率均下降[15]。因此适宜的乙醇体积倍数为反应液体积的7倍。

图7 乙醇的体积倍数对螯合反应的影响Fig.7 Effect of volume fraction of ethanol on chelating reaction
2.2肽-亚铁螯合物工艺条件的优化
采用L9(34)正交实验方法,通过极差分析结果表2可以看出,影响螯合反应中亚铁螯合率的3个因素主次顺序为C、A、B,最优组合为A2B2C2。影响螯合反应中螯合物得率的最优组合为A2B2C2,正好与亚铁的螯合率的指标条件吻合。得到的最佳工艺条件为肽与亚铁盐的质量比是3∶1,pH为5.5,反应时间为40 min,反应温度为40 ℃,肽的浓度为4%,在此工艺条件下进行验证实验,所得亚铁的螯合率65.15%,螯合物得率为44.46%。
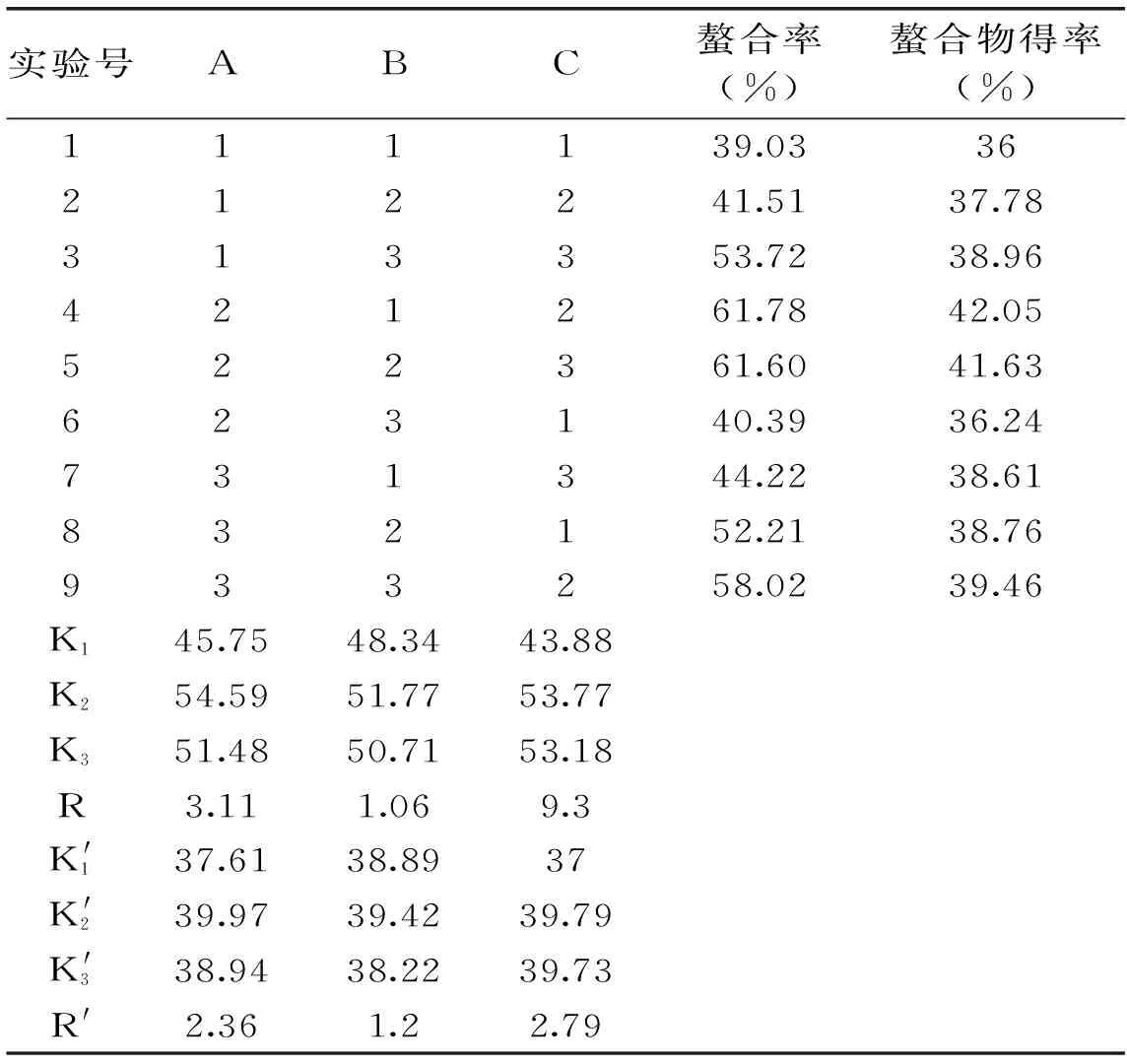
表2 正交实验结果Table 2 The result of the orthogonal experiment
2.3肽与肽-亚铁螯合物红光光谱分析
红外光谱特征吸收峰的改变可以反映金属离子与肽中有机配位体相互作用[16]。如图8所示,高频区的宽峰为羟基(-OH)和氨基(-NH)的伸缩振动峰在此处的叠加,与肽的图谱相比,当肽与Fe2+发生螯合反应后,吸收峰的位置由3397.98 cm-1移动至3377.20 cm-1,移动了约20个波数,表明当羟基氧和氨基氮参与配位后,相当于O-H键、N-H键有一定程度的弱化,即键力常数减小,而红外峰的吸收频率与键力常数的根号成正比,故该峰向低波数大幅移动;酰胺I带即C=O的伸缩振动峰也从1662.28 cm-1移动至1651.42 cm-1,移动了约11个波数;-COO-的反对称伸缩振动峰从1548.76 cm-1移动到1546.85 cm-1,其对称伸缩振动峰从1414.23 cm-1移动到1405.98 cm-1移动了约9个波数;同理,当羧基氧参与配位时,相当于羧基上的碳氧键有一定程度的弱化,故吸收峰移向低频,以上结果表明螯合之后,肽的结构发生了明显变化。
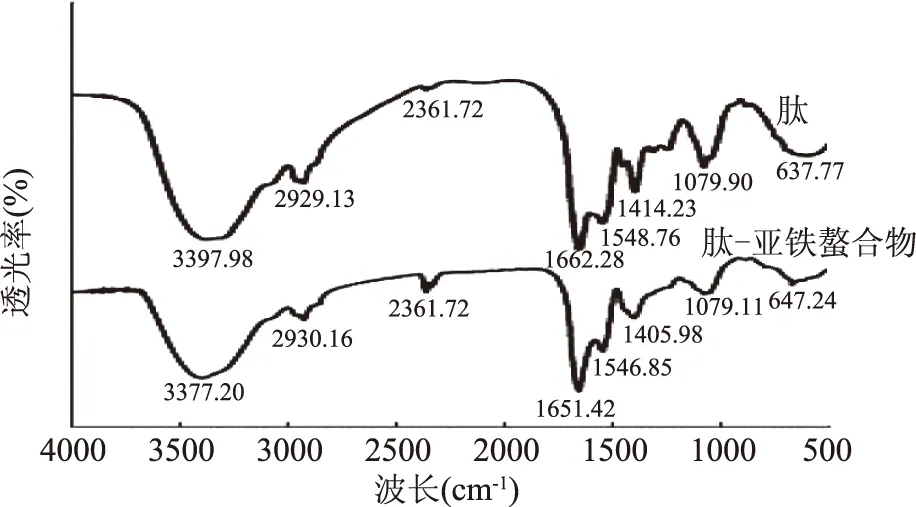
图8 肽与肽-亚铁螯合物的红外光谱图Fig.8 Infrared spectrum of peptide and peptide-ferrous chelate
2.4肽与肽-亚铁螯合物粒径分析
肽与肽-亚铁螯合物粒径的分布如图9所示,肽与肽-亚铁螯合物的半径分别为(144.23±5.86) nm和(453.66±8.74) nm,肽-亚铁螯合物粒径显著增加(p<0.01),肽与亚铁相互作用使粒径的分布更加集中,并且信号得到加强,说明螯合反应不仅存在于分子内相互作用,还存在于分子间。图9说明亚铁离子能使肽聚集、折叠形成肽-亚铁螯合物[17]。
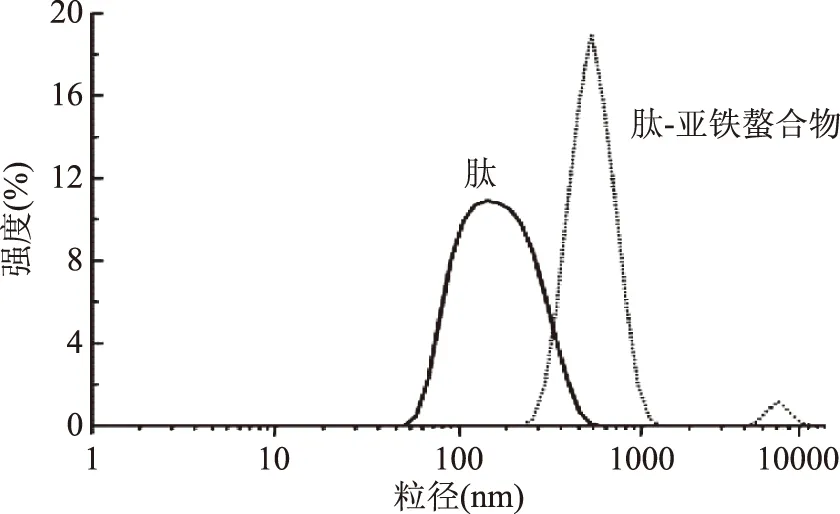
图9 肽与肽-亚铁螯合物的粒径分布图Fig.9 Particle size distributions of peptide and peptide-ferrous chelate
2.5肽与肽-亚铁螯合物荧光光谱分析
肽含有的芳香族氨基酸苯丙氨酸、色氨酸和酪氨酸,可以产生内源性荧光,肽与亚铁发生螯合反应后,故荧光强度的降低可以反映肽-亚铁螯合物在形成过程中发生了肽的折叠[18],如图10所示,随着FeCl2含量的不断增加,荧光吸收带从3822 nm显著下降为3124.44 nm(p<0.05),当FeCl2的浓度达到8 mmol/L时,随浓度增加荧光强度的下降幅度变小,已无显著变化,可能由肽与Fe2+结合导致了配位键的生成,随着Fe2+含量的增加,肽没有多余的位点与之结合,故肽参与的螯合反应不再增强,其荧光减弱程度也不再增强。图10也表明在螯合反应过程中,肽结构发生了折叠和聚集,其特征结构的变化与肽-钙螯合物类似[19]。
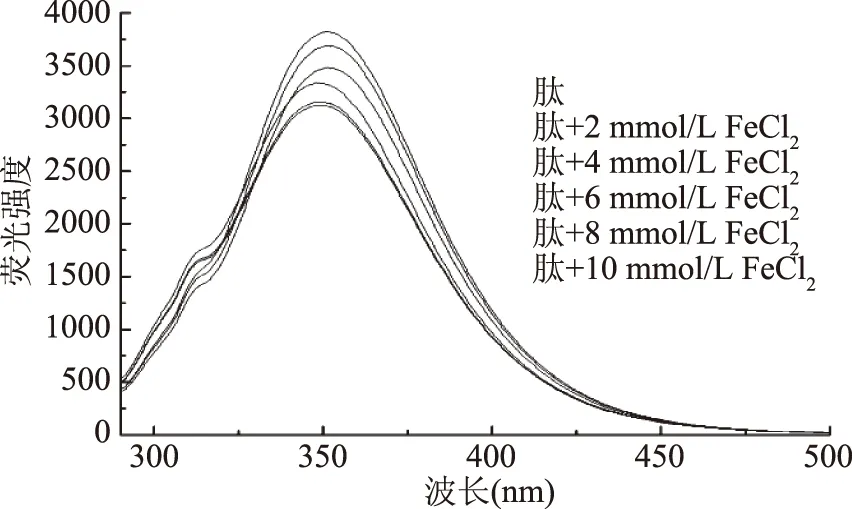
图10 肽与不同浓度的FeCl2的荧光光谱图Fig.10 Fluorescence spectrum of peptide with different Fe2+ concentrations
2.6肽与肽-亚铁螯合物圆二色谱分析
圆二色谱可以检测蛋白质二级结构与三级结构的变化,198 nm附近的正峰和218 nm附近的负峰是典型的β折叠结构形成的吸收峰,208 nm附近的负峰则是α螺旋形成的[20]。如图11所示,肽在209 nm处有一个极强的负峰,而形成螯合物后,负峰红移至217 nm,而且伴随着摩尔椭圆率的增大;这是形成二级结构的特征,说明α螺旋转变为β折叠。如图12所示,α螺旋、β折叠、β转角、无规卷曲均发生变化,其中肽中α螺旋、β折叠的含量为28.66%±1.54%、10.02%±1.04%,而肽-亚铁螯合物中α螺旋、β折叠的含量为16.10%±1.96%、27.33%±1.08%。表明α螺旋、β折叠的含量发生显著(p<0.05)变化,肽与亚铁螯合后使得其二级结构发现了显著改变,由于α螺旋是一种紧密的结构,而β折叠是一种较伸展的结构,由肽-亚铁螯合物粒径相较于肽有了大幅提高佐证了这一点,生成螯合物后β转角、无规卷曲没有显著变化。
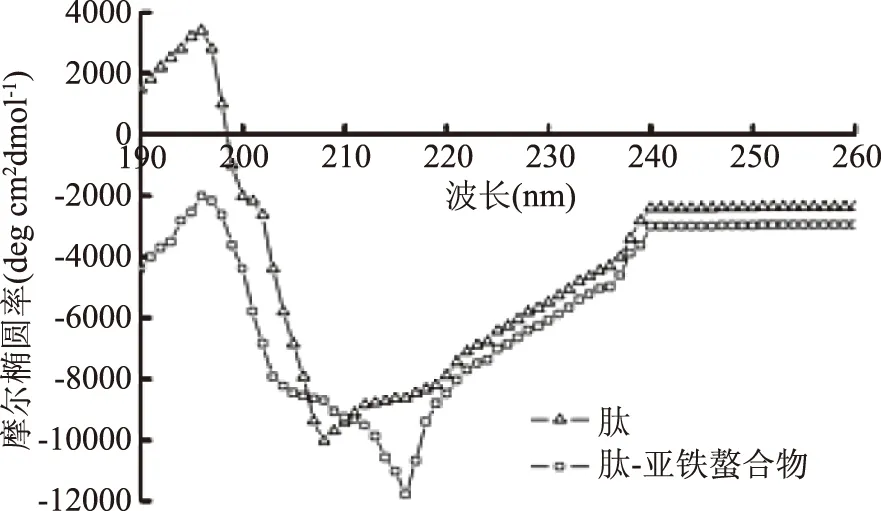
图11 肽与肽-亚铁螯合物的圆二色谱图Fig.11 Circular dichroism spectrum of peptide and peptide-ferrous chelate
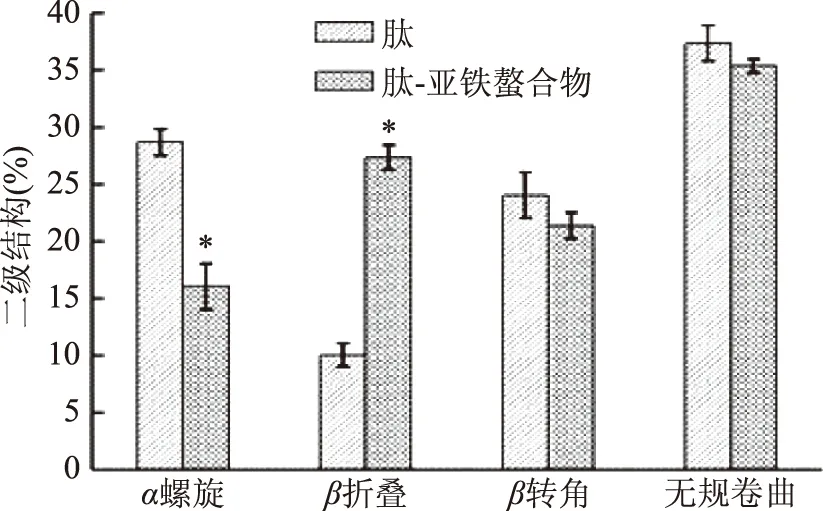
图12 肽与肽-亚铁螯合物的二级结构Fig.12 The percentage of secondary structure of peptide and peptide-ferrous chelate注:*表示螯合物与肽相比具有显著差异(p<0.05)。
3 结论
本研究对脱盐咸鸭蛋清肽-亚铁螯合物的制备条件进行了研究,通过正交实验优化了制备条件,即抗坏血酸与亚铁盐的质量比为0.2∶1,鸭蛋清肽溶液的浓度为4%,肽与亚铁盐的质量比为3∶1,pH为5.5,反应时间为40 min,反应温度为40 ℃,乙醇的添加量为反应液体积的7倍,在此条件下亚铁的螯合率为65.15%,螯合物得率为44.46%。红外光谱显示Fe2+与肽的氨基端与羧基端相结合;荧光光谱表明螯合以后荧光猝灭导致荧光强度的降低;激光粒度仪表明螯合以后半径增大、圆二色谱说明螯合以后二级结构发生变化,故从结构的层面证实了肽-亚铁螯合物的形成。
[1]冯朝波.咸鸭蛋清的资源化研究[D].广州:华南农业大学,2008.
[2]Liaset B,Lied E,Espe M. Enzymatic hydrolysis of by-products from the fish-filleting industry:chemical characterization and nutritional evaluation[J]. Journal of the Science of Food and Agriculture,2000,80(5):581-589.
[3]Hou T,Wang C,Hui H,et al. Desalted duck egg white peptides promotion of calcium uptake and structure characterization[J]. Journal of Agricultural and Food Chemistry,2015:290-296.
[4]Zhao N N,Hu J,He H,et al. Effects of desalted duck egg white peptides and their products on calcium absorption in rats[J]. Journal of Functional Foods,2014:234-242.
[5]胡君.鸭蛋清ACE抑制肽的制备及结构鉴定[D].武汉:华中农业大学,2016.
[6]刘文颖,谷瑞增,林峰,等.乌鸡低聚肽铁配合物的稳定性研究[J].食品与发酵工业,2014,40(10):322.
[7]Cristina T F,Tyijuin M A,Naliar J V. Iron-chelating activity of chickpea protein hydrolysate peptides[J]. Food Chemistry,2012:1585-1588.
[8]郑烔.血红蛋白多肤鳌合铁的制备及其抗贫血功能研究[D].重庆:西南大学,2008.
[9]Foong L C,Mustapha U I,Maznah I. Iron-binding capacity of defatted rice bran hydrolysate and bioavailability of iron in Caco 2 Cells[J]. Journal of Agricultural and Food Chemistry,2015,63:9029-9036.
[10]蔡冰娜,陈忻,潘剑宇,等.响应面法优化鳕鱼皮胶原蛋白肽螯合铁工艺[J].食品科学,2012,30(5):48-52.
[11]刘永,叶娴,韦寿莲.罗非鱼鳞胶原蛋白肽铁螯合物制备工艺的优化[J].精细化工,2013,30(2):761-765.
[12]杨华,赵薇,林顺毅,等.大豆多肽亚铁螯合物的螯合条件优化[J].湖北农业科技,2015,54(9):2198-2204.
[13]赵静.猪血红蛋白铁螯合肽的制备及性质研究[D].长春:吉林大学,2016.
[14]黄赛博,林慧敏,邓尚贵.响应面法优化带鱼蛋白多肽螯合亚铁制备工艺[J].食品工业科技,2016,37(4):266-270.
[15]赵宁宁.脱盐咸鸭蛋清促钙吸收肽的制备、修饰及增加骨密度作用研究[D].武汉:华中农业大学,2014.
[16]Nara M,Morii H,Tanokura M. Coordination to divalent cations by calcium-binding proteins studied by FTIR spectroscopy[J]. Biochim Biophys Acta Biomembr,2013,1828:2319-2327.
[17]Zhao L N,Huang Q M,Huang S L,et al. Novel peptide with a specific calcium-binding capacity from whey protein hydrolysate and the possible chelating mode[J]. Journal of Agricultural and Food Chemistry,2014,62:10274-10282.
[18]Lin J P,Cai X X,Tang M R,et al. Preparation and evaluation of the chelating nanocomposite fabricated with marine algaeSchizochytriumsp. protein hydrolysate and calcium[J].Journal of Agricultural and Food Chemistry,2015,63:9704-9714.
[19]Hou T,Liu W W,He H,et al. Desalted duck egg white peptides promote calcium uptake by counteracting the adverse effects of phytic acid[J]. Food Chemistry,2016,219:428-435.
[20]黄海.鲤鱼卵钙离子结合活性肽制备及其钙结合机制的研究[D].青岛:中国海洋大学,2014.
Preparationandcharacterizationofdesaltedduckeggwhitepeptide-ferrouschelate
LIBo,HOUTao,CHENGEn-min,HEHui*
(College of Food Science and Technology,Huazhong Agricultural University,Key Laboratory of Environmental Food Science of Ministry of Education,Wuhan 430070,China)
In this paper,desalted duck egg white peptides and FeCl2·4H2O was used as the raw material.Using chelating rate of ferrous and the yield of chelate as trace indexs,the preparation conditions of duck egg peptides-ferrous chelate were optimized,and the structure of peptides-ferrous chelate was characterized by IR,dynamic light scattering,fluorescence spectroscopy and circular dichroism. The results of single factor and orthogonal test showed that the optimal chelating reaction condition of duck egg white peptides-ferrous chelate was as follows:the mass ratio of VCto ferrous salt was 0.2∶1,the concentration of duck egg peptides was 4%,the ratio of peptides to ferrous salt was 3∶1,the pH value was 5.5,the temperature was 40 ℃,the reaction time was 40 min,and the amount of ethanol was 7 times of the volume of the reaction solution. Under these conditions,the chelating rate of ferrous was 65.15%,and the yield of the chelate was 44.46%.The Infrared spectrum showed that Fe2+binds to the amino terminus and the carboxyl terminal of peptide.The fluorescence spectrum showed that the fluorescence absorption band decreased from 3822 nm to 3124.44 nm with the increase of Fe2+(p<0.05).The laser particle size analyzer showed that the radius of peptide and peptide-ferrous chelate was(144.23±5.86) nm and(453.66±8.74) nm respectively.The circular dichroism showed that the content ofα-helix in the peptide was 28.66%±1.54% and 10.02%±1.04%,while the content ofα-helix andβ-sheet in peptide-ferrous chelate was 16.10%±1.96% and 27.33%±1.08%,both of which had changed significantly(p<0.05).The formation of peptides-ferrous chelate was confirmed from the structural.
duck egg white peptides;ferrous salt;chelate;chelating rate;characterization
2017-02-23
李博(1993-),男,硕士研究生,研究方向:食品化学,E-mail:1520615283@qq.com。
*通讯作者:何慧(1960-),女,博士,教授,研究方向:食品化学,E-mail:hehui@mail.hzau.edu.cn。
TS253.1
:B
:1002-0306(2017)16-0172-06
10.13386/j.issn1002-0306.2017.16.032
