ARTP诱变选育高产海藻糖菌株及酶促反应条件优化
2017-09-18,,,,
,,,,
(江南大学生物工程学院,工业生物技术教育部重点实验室,江苏无锡 214122)
ARTP诱变选育高产海藻糖菌株及酶促反应条件优化
田成福,张伟国,徐建中,刘冬冬,史仲平*
(江南大学生物工程学院,工业生物技术教育部重点实验室,江苏无锡 214122)
以实验室保藏的节杆菌属菌株Arthrobactersp. SH为出发菌株,经常压室温等离子体(atmospheric and room temperature plasma,ARTP)诱变选育后,筛选到一株以淀粉为原料TreY-TreZ途径生产海藻糖的高产突变菌株Arthrobactersp. SH-52。该突变菌株酶催化能力达到129.6 U/mL,比出发菌株提高了46.1%。对菌株Arthrobactersp. SH-52的酶促反应条件进行优化,结果表明,酶促反应最适温度45 ℃,最适反应时间30 h,最适初始pH 6.5,最适底物为浓度20%的淀粉液化液(DE值为11.9)。经酶促反应优化后,采用未经纯化的粗酶液进行催化,转化率达到37.6%。实验结果表明ARTP诱变是选育高酶活海藻糖生产菌的有效方法,研究结果对工业化生产海藻糖具有一定的借鉴价值。
海藻糖,常压室温等离子体诱变,TreY-TreZ途径,淀粉液化液
自然界中的海藻糖多是由两个葡萄糖残基经α-1,1糖苷键构成的非还原性二糖,广泛存在于低等植物、藻类、细菌、真菌、昆虫等生物体内[1]。海藻糖不但能够作为一些生物体的能源物质,还是一种重要的应激代谢产物。研究表明海藻糖无论在生物体内还是体外均可以保护生物细胞及活性大分子,使其免受高温、干旱、冷冻、高渗等环境下的破坏[2-3]。因此,海藻糖在分子生物学、医药、食品、化妆品等领域有着广泛的应用前景。
现已研究发现,海藻糖在生物体内有多种合成途径[4],其中麦芽寡糖基海藻糖途径(TreY-TreZ途径)以廉价的淀粉为原料,利用麦芽寡糖基海藻糖合成酶(Maltooligosyl trehalose synthase,MTSase,TreY基因编码)和麦芽寡糖基海藻糖水解酶(Maltooligosyl trehalose hydrolase,MTHase,TreZ基因编码)的协同作用,将一定链长的直链淀粉转化为海藻糖。该途径具有特异性较高,快速温和等优点,是工业化生产海藻糖的重要方法之一[5-6]。目前国内酶法生产海藻糖的转化率较低,成本较高,限制了海藻糖的广泛应用,因此获得高MTSase和MTHase酶活力的菌株是酶法生产海藻糖的关键。ARTP诱变是近几年发展起来的新型诱变技术,它具有对操作者安全、环境友好、操作简便、突变快速、突变率高、获得的突变体性状稳定等特点,目前已经应用到各类微生物育种过程中[7]。
本研究对实验室保藏的Arthrobactersp. SH进行常压室温等离子体诱变,筛选得到一株菌体生长良好的高MTSase和MTHase酶活力的菌株,并对诱变菌株的酶促反应条件进行探究。研究结果可望为通过选育高产海藻糖菌株,实现利用酶法工业化生产海藻糖提供参考依据。
1 材料与方法
1.1材料与仪器
出发菌株(Arthrobactersp. SH) 本实验室保藏的节杆菌;耐高温α-淀粉酶(40000 U/mL)、普鲁兰酶(1000 ASPU/mL)、糖化酶(10000 U/mL) 均购自江苏锐阳生物科技有限公司;可溶性淀粉、酵母膏、蛋白胨 均购自国药集团化学试剂有限公司;氯化钠、MgSO4·7H2O、Na2HPO4·12H2O、KH2PO4均为国产分析纯;葡萄糖(食品级,纯度92%) 购自山东西王集团;平板完全培养基(g/L) 牛肉膏10,蛋白胨10,葡萄糖(食品级)5,氯化钠5,MgSO4·7H2O 0.5,琼脂20,pH 6.8,0.1 MPa 灭菌20 min;种子培养基(g/L) 牛肉膏3,蛋白胨10,葡萄糖(食品级)5,MgSO4·7H2O 0.5,pH 7.0,0.1 MPa 灭菌20 min;产酶培养基(g/L) 葡萄糖(食品级)30,蛋白胨10,酵母浸膏2,Na2HPO4·12H2O 0. 6,KH2PO41,MgSO4·7H2O 0.5,pH 6.8,90 kPa 灭菌15 min。
HYL-B全温摇瓶柜 太仓市强乐实验有限责任公司;SHA-B恒温水浴振荡器 常州国华企业;ARTP-III型常压室温等离子体生物诱变系统 北京思清源生物科技有限公司;ST16型台式离心机 美国赛默飞世尔科技公司;超声波破碎仪 美国SONICS公司;721N型可见分光光度计 上海仪电分析仪器有限公司。
1.2实验方法
1.2.1 菌种的活化与培养 将菌株接种于平板完全培养基上进行活化,置于30 ℃恒温培养箱中培养40 h左右;将活化后的菌株接种于种子培养基,250 mL三角瓶装液量30 mL,在摇瓶柜中30 ℃ 100 r/min培养14~18 h;培养好的种子培养基以2%的接种量接种于产酶培养基,50 mL产酶培养基装在500 mL三角瓶中,在摇瓶柜中30 ℃ 100 r/min 培养40 h。
1.2.2 ARTP诱变时间的确定 取处于对数生长期的菌体,用无菌生理盐水洗涤并重悬,制成菌悬液,控制菌体OD600在0.5~0.6。吸取10 μL菌悬液,均匀涂于ARTP系统的载片上,启动ARTP诱变系统,进行酒精消毒,紫外灭菌。设置仪器的功率为100 W,气流量为10 SLM,处理时间分别设置为0、10、20、30、40、50 s。处理完毕后用无菌生理盐水对载片上的菌体进行洗脱,适当稀释后分别涂布于平板培养基中,用黑布包裹放于28 ℃恒温培养箱中培养30~40 h,以未诱变的培养皿为对照,统计菌落数,计算致死率,并确定最佳诱变时间。
1.2.3 诱变菌株的筛选方法 菌株经诱变后从中挑选菌落出现较早,形态大小各异,长势旺盛的单菌落进行产酶培养,毎个单菌落设置3个平行,分别测定各诱变菌株的菌体浓度以及菌株的酶催化能力。从中筛选酶催化能力高的菌株,并以此为出发菌株进行下一轮诱变筛选。
1.2.4 分析检测方法
1.2.4.1 菌体浓度(OD600)测定 产酶培养结束后,将培养液稀释20倍,在600 nm处测定吸光度。
1.2.4.2 致死率计算 致死率(%)=100×(对照组活菌数-诱变组活菌数)/对照组活菌数。
1.2.4.3 转化率计算 海藻糖转化率(%)=反应体系中海藻糖质量浓度/反应体系中淀粉质量浓度×100。
1.2.4.4 海藻糖定性分析 采用薄层层析法,参照文献[8]。
1.2.4.5 海藻糖定量分析 采用DNS法,参照文献[9]。
1.2.5 酶催化能力测定 菌株产酶培养结束后,用pH6.5 25 mmol/L的磷酸缓冲液离心收集菌体并洗涤一次,重悬菌体后保持各实验组菌体浓度一致,加入1 mg/mL溶菌酶37 ℃水浴处理1 h。经超声波法300 W下工作1 s间歇2 s,破碎8 min后离心得粗酶液上清。取4 mL粗酶液,等体积加入150 U/g(淀粉)普鲁兰酶处理过的20%淀粉液化液,45 ℃水浴振荡反应30 h,沸水浴10 min终止反应后加入1000 U/g(淀粉)糖化酶水解残余的麦芽糊精,水解24 h后沸水浴终止反应,离心取上清,采用DNS法测定海藻糖的量。一个酶活单位定义为每小时合成1 mg海藻糖所需酶的量[10],计算产酶培养结束后单位体积培养液的酶活。
1.2.6 粗酶液制备海藻糖的工艺优化 采用控制变量法,进行单因素实验,分别考察反应温度、反应时间、初始pH、淀粉液化液的浓度、DE值对粗酶液催化反应的影响。
1.2.6.1 海藻糖合成途径的初步验证 分别配制浓度为20%的葡萄糖、麦芽糖、麦芽三糖、麦芽五糖、淀粉液化液作为反应底物。分别取4 mL底物等体积加入250 U/mL的粗酶液,在初始pH6.5,45 ℃下水浴振荡反应30 h。反应结束经糖化后采用薄层层析法定性检测产物生成。
1.2.6.2 温度对粗酶液催化反应的影响 设置5个实验组,取4 mL浓度20%,DE值11.9的淀粉液化液,等体积加入250 U/mL的粗酶液。分别在35、40、45、50、55 ℃下水浴振荡反应,反应时间为30 h,反应初始pH6.5。反应结束经糖化后测定各组海藻糖产量,计算转化率。
1.2.6.3 初始pH对粗酶液催化反应的影响 产酶培养结束后,配制相同浓度(25 mmol/L)不同pH(5.5、6.0、6.5、7.0、7.5)的磷酸缓冲溶液,在相同条件下分别对菌体洗涤、重悬(重悬后保持各组菌浓度一致)、破碎,得到不同pH的粗酶液。取4 mL粗酶液,等体积加入相应pH,浓度20%,DE值11.9的淀粉液化液,在45 ℃下水浴振荡反应30 h。反应结束经糖化后测定各组海藻糖产量,计算转化率。
1.2.6.4 淀粉液化液DE值对粗酶液催化反应的影响 在淀粉液化液制备过程中设置五组,淀粉浓度均为20%,通过添加不同浓度的耐高温α-淀粉酶,改变各组淀粉的液化程度,灭活耐高温α-淀粉酶后测定各组的DE值,分别得到DE值为7.3、11.9、18.4、27.8、42.7的淀粉液化液。取4 mL淀粉液化液,等体积加入250 U/mL的粗酶液,在初始pH 6.5,45 ℃下水浴振荡反应30 h。反应结束经糖化后测定各组海藻糖产量,计算转化率。
1.2.6.5 反应时间与底物浓度对粗酶液催化反应的影响 在4 mL 250 U/mL粗酶液中分别等体积加入浓度为10%、20%、30%的淀粉液化液(DE值均为11.9),在初始pH6.5,45 ℃下水浴振荡反应60 h,反应前20 h每隔5 h取样,后面毎隔10 h取样。反应结束经糖化后测定各组海藻糖的量并计算转化率。
1.2.7 数据处理 所有实验每组对照均至少重复三次,实验结果以“平均值±标准偏差”的形式表示。利用SPSS 19.0软件对数据进行单因素方差分析,并用Origin 8.5软件对数据作图分析。
2 结果与讨论
2.1 ARTP诱变致死曲线
按照1.2.2的处理方法对菌株SH进行ARTP诱变,以时间为变量,得到菌株的诱变致死曲线(图1)。根据之前的报道[11],采用ARTP诱变系统的致死率在90%左右时菌体的正突变率较高。从图1中可以看出,处理时间为40 s和50 s时,致死率分别为92.3%和97.3%,且经单因素方差分析二者致死率差异不显著(p>0.05),其他处理时间致死率差异显著(p<0.05)。因此,综合正突变率和致死率,本实验的诱变处理时间在40 s和50 s时均可,诱变后的菌株均能进行培养筛选。
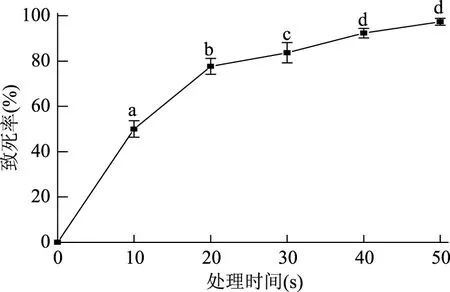
图1 等离子体处理Arthrobacter sp. SH的致死率曲线Fig.1 The lethal rate of Arthrobacter sp.SH treated by ARTP注:图中相同字母表示差异不显著(p>0.05),不同字母表示差异显著(p<0.05)。
2.2诱变菌株的筛选
从诱变后的菌株中选择大小形态各异的单菌落,进行产酶培养并进行酶转化实验,采用薄层层析法初筛。实验结果显示,与出发菌株相比,有22株菌株的酶催化能力得到提高。对其中的9株表现较好的诱变菌株做进一步定量分析,结果发现,在相同产酶条件及酶转化条件下,菌株5-2的产酶能力最强,且生物量也有明显提高,诱变菌株酶催化能力达到129.6 U/mL,相较于原始菌株的88.7 U/mL,菌株催化能力提高了46.1%(表1)。同时对各诱变菌株的菌体浓度与酶催化能力分别进行单因素方差分析,分析结果表明,各诱变菌株的菌体浓度及酶催化能力差异显著(p<0.05)),诱变筛选结果具有统计学意义。由此可见ARTP诱变对提高菌体酶活效果显著,并将诱变菌株5-2命名为Arthrobactersp. SH-52。

表1 菌株的诱变筛选Table 1 The screening result of Arthrobacter sp. SH
注:同列相同字母表示差异不显著(p>0.05),不同字母表示差异显著(p<0.05)。
2.3诱变菌株SH-52粗酶液酶法制备海藻糖的工艺优化
2.3.1 海藻糖合成途径的初步验证 分别以不同底物进行粗酶液反应,反应结束后采用薄层层析法定性检测,结果如表2所示。从表2中可以看出,当以葡萄糖、麦芽糖为底物时没有检测到海藻糖生成,以麦芽五糖、淀粉液化液为底物时检测到有大量海藻糖生成,此外,以麦芽三糖为底物时也没有检测到生成海藻糖,由此可初步验证该酶促反应是以麦芽寡糖基海藻糖途径(TreY-TreZ途径)催化麦芽寡糖合成海藻糖,且麦芽寡糖的聚合度至少应该在三以上。

表2 海藻糖合成途径的初步验证Table 2 Preliminary validation of trehalose synthesis pathway
注:“-”表示无海藻糖生成;“+”表示有海藻糖生成。
2.3.2 温度对粗酶液催化反应的影响 结果如图2所示,当反应温度为45 ℃时,海藻糖转化率达到最高,为34.5%。前人报道的节杆菌属菌株双酶反应的最适反应温度多在40 ℃,嗜酸热古菌的反应温度虽然很高(反应温度可达75 ℃)但存在菌体培养困难,酶活较低的缺点[12]。诱变菌株SH-52的最适反应温度较高,一方面可以加快酶促反应速率,缩短反应时间,另一方面较高的温度可以降低微生物污染的发生几率,保持一个较好的酶促反应环境。这在海藻糖的实际生产制备中具有重要意义。
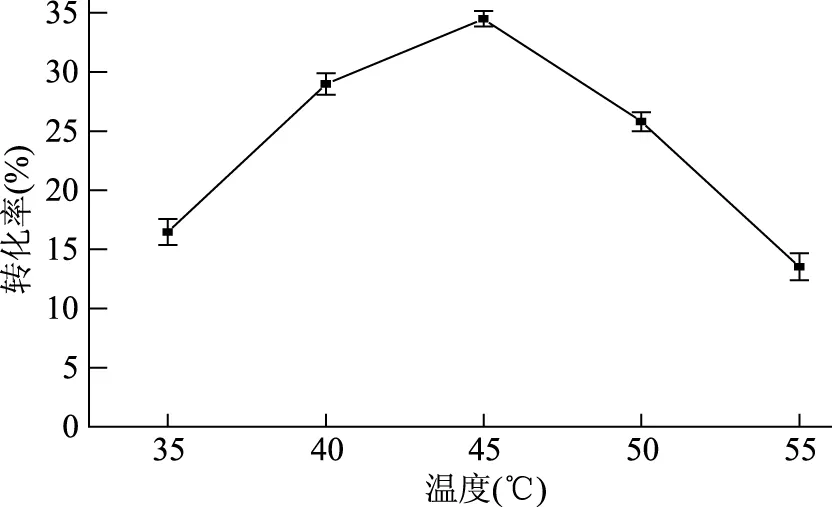
图2 反应温度对转化率的影响Fig.2 Effect of reaction temperature on conversion rate
2.3.3 初始pH对粗酶液催化反应的影响 pH能够改变酶的构象,引起酶蛋白的活性中心结构改变,进而改变酶活力,由图3结果可知,粗酶液反应的最适pH范围在6.0~7.0之间,当初始pH为6.5时,转化率最高,达到33.4%,因此选择粗酶液反应的初始pH为6.5。日本学者报道了节杆菌Arthrobactersp.Q36中双酶反应中的酶学性质[13-14],其中MTSase的最适pH7.0,最适温度40 ℃;MTHase的最适pH6.5,最适温度45 ℃。本文以含有MTSase和MTHase的粗酶液为研究对象,其最适pH与文献报道的结果相似。
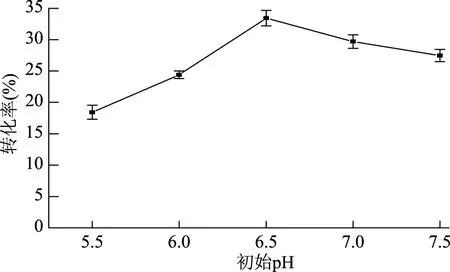
图3 反应初始pH对转化率的影响Fig.3 Effect of initial pH on conversion rate
2.3.4 淀粉液化液DE值对粗酶液催化反应的影响 淀粉液化液的DE值决定了反应底物的组成成分,是影响海藻糖转化率的关键因素,在酶量充足的情况下,淀粉液化液中适合酶反应的麦芽寡糖的含量将直接决定粗酶液反应的转化率[15-16]。制备不同DE值的淀粉液化液为底物进行催化,结果如图4所示,当DE值为11.9时,底物转化率达到最高,为37.6%,当DE增加到18.4时,转化率为36.1%,仍能保持较高的转化率,由此表明,聚合度在一定范围内的麦芽寡糖均可作为酶的最适底物。DE值过低,淀粉液化液中麦芽寡糖聚合度偏大,支链麦芽寡糖偏多,不适宜粗酶液反应;当DE值过高,聚合度偏小,反应副产物增多,同样导致转化率降低。因此选择DE值为11.9的淀粉液化液做为粗酶液反应的最适底物。
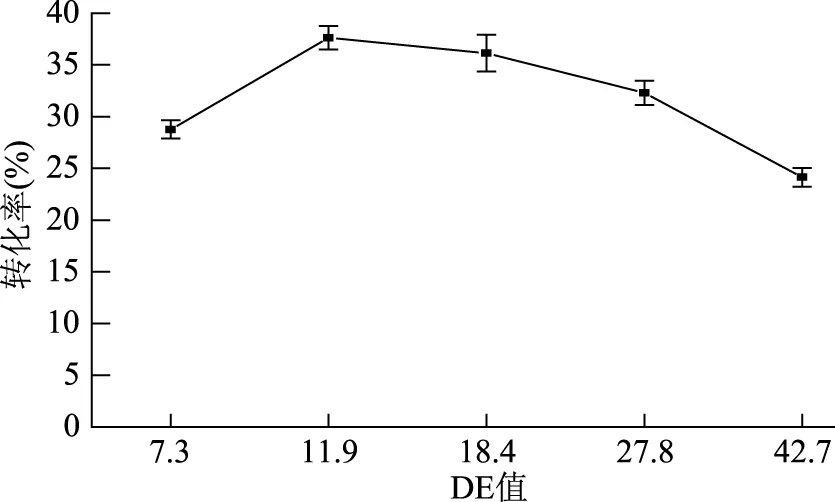
图4 DE值对粗酶液催化反应的影响Fig.4 Effect of DE value on conversion rate
2.3.5 反应时间与底物浓度对粗酶液催化反应的影响 从图5中可以看出,随着反应的进行海藻糖转化率不断增加,三种浓度的底物均能够在30 h左右达到最高转化率。而且以浓度10%、20%的淀粉液化液为底物进行转化时转化率较为接近,当淀粉液化液浓度达到30%时转化率降低很多,这可能是由于淀粉液化液中适宜酶反应的底物所占比例是一定的,浓度为10%、20%的淀粉液化液中适宜酶反应的底物均能够利用完毕,二者转化率接近,当淀粉液化液浓度达到30%时,反应体系中的酶量不足成为酶促反应的限制因素,此外由于淀粉液化液浓度过高,粘度过大,不利于酶分子的自由扩散,反应中产物、副产物浓度增加,反应体系环境恶化,阻碍了反应的进行,降低了底物利用率[17]。综合考虑底物利用率及生产周期,选择浓度为20%的淀粉液化液作为反应的最适底物,粗酶液反应时间为30 h。
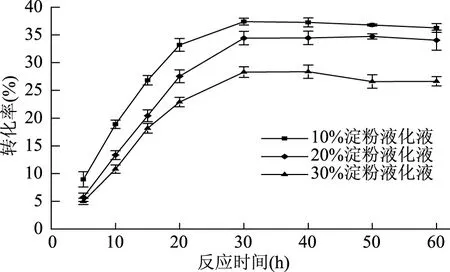
图5 反应时间与底物浓度对转化率的影响Fig.5 Effect of reaction time and substrate concentration on conversion rate
3 结论
工业化酶法生产海藻糖主要是通过TreY-TreZ途径作用于淀粉来实现,是最有优势的海藻糖生产方法,我国是淀粉生产大国,以淀粉为原料生产海藻糖具有重要意义。本研究采用常压室温等离子体(ARTP)诱变系统筛选得到一株以TreY-TreZ途径生产海藻糖的突变菌株Arthrobactersp. HS-52,其生物量与粗酶液转化能力均优于原始菌株,摇瓶培养酶活达到129.6 U/mL,比出发菌株提高了46.1%。对海藻糖生物合成途径进行了验证,初步确定该酶促反应是通过麦芽寡糖基海藻糖途径(TreY-TreZ途径)催化麦芽寡糖合成海藻糖,且麦芽寡糖的聚合度至少在三以上。确定了诱变菌株粗酶液催化制备海藻糖的最佳工艺条件:反应温度45 ℃,初始pH6.5,反应底物是浓度20%的淀粉液化液(DE值11.9),反应时间30 h。以浓度20%的淀粉液化液为底物,等体积加入未经浓缩、纯化的粗酶液进行催化,转化率达到37.6%。本文对工业化酶法生产海藻糖具有一定的借鉴意义。
[1]Feofilova E P,Usov A I,Mysyakina I S,et al. Trehalose:chemical structure,biological functions,and practical application[J]. Microbiology,2014,83(3):184-194.
[2]Richards A B,Krakowka S,Dexter L B,et al. Trehalose:a review of properties,history of use and human tolerance,and results of multiple safety studies[J]. Food and Chemical Toxicology,2002,40:871-898.
[3]Naozumi T,Navzer D S,Mitsuhiro S. Trehalose:Current use and future applications[J]. Journal of Pharmaceutical Sciences. 2011,100(6):2020-2053.
[4]宋晓丽,石东升,温佳文,等. 海藻糖的生物合成途径及其生物学功能[J]. 食品与发酵业,2013,39(8):167-171.
[5]陈炜,何秉旺. 酶法合成海藻糖研究的新进展[J]. 微生物学通报,1998,25(3):164-166.
[6]Schiraldi C,Dilernia I,Derosa M. Trehalose production:exploiting novel approaches[J]. Trends in Biotechnology,2002,20(10):420-425.
[7]张雪,张晓菲,王立言,等. 常压室温等离子体生物诱变育种及其应用研究进展[J]. 化工学报,2014,65(7):2676-2684.
[8]刘传斌,云战友,鲁济青,等.海藻糖的分析方法[J]. 食品与发酵工业,1998,24(5):40-43.
[9]王蕾,郑璞. DNS法定量测定海藻糖的研究[J]. 食品科技,2004,29(2):82-84.
[10]Maruta K,Nakada T,Kubota M,et al. Formation of trehalose from maltooligosaccharides by a novel enzymatic system[J]. Bioscience,Biotechnology,and Biochemistry,1995,59(10):1829-1834.
[11]张欣. 生物酶法合成海藻糖工艺的改进研究[D]. 北京:北京化工大学,2006.
[12]Tetsuya N,Shoji L,Hiroto C,et al. Purification and characterization of thermostable maltooligosyl trehalose trehalohydrolase from the thermoacidophilic archaebacterium Sulfolobus acidocaldarius[J]. Bioscience,Biotechnology and Biochemistry,1996,60(2):267-270.
[13]Nakada T,Maruta K,Tsusaki K,et al. Purification and properties of a novel enzyme,maltooligosyl trehalose synthase,fromArthrobactersp. Q36[J]. Bioscience,Biotechnology,and Biochemistry,1995,59(12):2210-2214.
[14]Nakada T,Maruta K,Mitsuzumi H,et al. Purification and characterization of a novel enzyme,maltooligosyl trehalose trehalohydrolase fromArthrobactersp. Q36[J]. Bioscience,Biotechnology,and Biochemistry,1995,59(12):2215-2218.
[15]陈晓斌,林建平,金志华,等. 硫矿硫化叶菌MTSase和MTHase基因的克隆与表达[J]. 微生物学通报,2006,33(5):54-59.
[16]王成君. 黄色短杆菌催化糊精合成海藻糖的研究[D]. 杭州:浙江大学,2005.
[17]赖承兴,葛宇,袁勤生. 海藻糖的MTSase及MTHase酶促合成条件的研究[J]. 中国医药工业杂志,2003,34(9):11-13.
Breedingofthetrehalosehigh-yieldingstrainbyARTPandtheoptimizationofenzymaticreactionconditions
TIANCheng-fu,ZHANGWei-guo,XUJian-zhong,LIUDong-dong,SHIZhong-ping*
(The Key Laboratory of Industrial Biotechnology,Ministry of Education,School of Biotechnology,Jiangnan University,Wuxi 214122,China)
A genetic stability trehalose high-yielding strainArthrobactersp. SH-52 was obtained from the original strain ofArthrobactersp. SH,which was mutated by atmospheric and room temperature plasmas(ARTP). The catalysis ability ofArthrobactersp. SH-52 reached 129.6 U/mL,which was 46.1% higher than that of the original strain. The enzymatic reaction conditions of SH-52 were optimized,and the results were as follows:reaction temperature 45 ℃,reaction time 30 h,pH6.5,and DE value 11.9 of 20% starch hydrolysate. Under the optimum reaction conditions,the conversion rate reached 37.6% by crude enzyme. The results showed that ARTP mutagenesis technology was an effective method for breeding high-activity trehalose-producing bacteria,and the results could be used for industrial production of trehalose.
trehalose;atmospheric and room temperature plasma(ARTP);TreY-TreZ pathway;starch hydrolysate
2017-02-13
田成福(1990-),男,硕士研究生,研究方向:工业微生物菌种选育及优化,E-mail:tianchengfu@126.com。
*通讯作者:史仲平(1962-),男,博士,教授,研究方向:发酵工学,E-mail:zpshi@jiangnan.edu.cn。
江苏省自然科学基金-青年基金(BK20150149)。
TS245.9
:A
:1002-0306(2017)16-0126-05
10.13386/j.issn1002-0306.2017.16.024
