双菌株联合固态发酵冷榨核桃粕提高产品纳豆激酶活性的研究
2017-09-18,,,,,
,,, ,,
(西北农林科技大学食品科学与工程学院,陕西杨凌 712100)
双菌株联合固态发酵冷榨核桃粕提高产品纳豆激酶活性的研究
王瑞珍,蔡天娇,徐亚飞,任璐,雷宏杰*,徐怀德*
(西北农林科技大学食品科学与工程学院,陕西杨凌 712100)
为提高纳豆芽孢杆菌单菌发酵品的纳豆激酶(nattokinase,NK)活性并减少产品的不良氨味,采用戴尔凯氏有孢圆酵母、植物乳杆菌分别与纳豆芽孢杆菌联合固态发酵核桃粕。结果表明:纳豆芽孢杆菌与戴尔凯氏有孢圆酵母在接种量3%、菌种配比2∶1、发酵温度34 ℃、发酵时间60 h的条件下得到的核桃粕发酵品NK活性达2040.82 U/g,提高了70.42%,挥发性盐基氮含量为64.18 mg/100 g,降低了84.37%;纳豆芽孢杆菌与植物乳杆菌在接种量9%、菌种配比1.5∶1、发酵温度42 ℃、发酵时间60 h的条件下得到的发酵品NK活性为1966.02 U/g,提高了64.18%,挥发性盐基氮含量为62.68 mg/100 g,降低了84.74%。混合菌种发酵品的氨味显著减少,改善了传统发酵品的风味。
核桃粕,纳豆芽孢杆菌,戴尔凯氏有孢圆酵母,植物乳杆菌,固态发酵,纳豆激酶
核桃(JuglansregiaL.)属胡桃科(Juglandaceae)核桃属(JuglansL.)植物。我国是世界第一大核桃生产国[1],栽培面积8000多万亩,产量达300多万吨[2]。核桃仁营养丰富,脂肪含量高达60%以上[3],蛋白质含量约为14%~18%,氨基酸种类齐全[4];冷榨核桃油的核桃粕蛋白达30%~40%[5],残油12%~14%[6],水分5%~7%,是优质的植物蛋白资源,适用于加工各种食品和保健品。
纳豆芽孢杆菌(Bacillussubtilsnatto)是食品用益生菌[7-8],发酵过程中可产生纳豆激酶(nattokinase,NK)、蛋白酶、脂肪酶、淀粉酶等多种酶系[9]。纳豆激酶具有纤溶活性强、可口服、副作用小、作用时间长[10]等特点,成为较为理想的保健及抗血栓药物[11]。以大豆、豆粕、菜籽粕或马铃薯渣为原料的有关纳豆芽孢杆菌固态发酵产NK的研究已有报道[12-15],牛丽亚等[16]采用嗜酸乳杆菌和纳豆芽孢杆菌联合发酵豆粕,提高了豆粕营养价值,使蛋白酶活力达2240.9 U/g。刘丽莉[17]用蜡样芽胞杆菌、植物乳杆菌和嗜热链球菌混合发酵牛骨粉,蛋白酶的活力提高,胶原多肽的质量浓度达3.62 mg/mL。孙军德等[18]采用沼泽红假单胞菌和纳豆芽孢杆菌混合固态发酵淀粉豆,NK活性提高53.74%的同时氨味明显降低。王常苏等[19]用纳豆芽孢杆菌与毛霉混合固态发酵黄豆,NK活性提高88.11%,并改善了纳豆的口感。核桃粕成本低、安全,也可以发酵生产富含纳豆激酶产品,高瑞雄等[20]用纳豆芽孢杆菌固态发酵冷榨核桃粕,NK活性达到1522 U/g,发酵品有氨味,可以采用混合菌种发酵核桃粕进一步提高NK活性和产品品质,减少氨味,但相关研究未见报道。
为此,本论文以冷榨核桃粕为原料,采用戴尔凯氏有孢圆酵母、植物乳杆菌分别与纳豆芽孢杆菌联合固态发酵提高NK活性,为核桃粕的综合利用和新产品开发提供理论依据。
1 材料与方法
1.1材料与仪器
冷榨核桃粕 河北绿岭庄园食品有限公司,粗蛋白31.70%,粗脂肪9.86%,水分7.63%;纳豆芽孢杆菌(CICC 10023) 中国工业菌种保藏中心;白葡萄酒酵母RW、红葡萄酒酵母SY 安琪酵母股份有限公司;保加利亚乳杆菌(Yo-Mix 300LYo 50 Dcu) 由CHR HANSEN公司提供;戴尔凯氏有孢圆酵母(WKZ1-2)、植物乳杆菌(20261)、嗜热链球菌(1.1855) 本实验室保藏菌种;尿激酶(5000 U) 购于美国ADM公司;凝血酶(1000 U)、牛纤维蛋白原 购自Sigma公司;其他试剂 国产分析纯。
YXQ-LS-50G立式压力蒸汽灭菌器 上海博迅实业有限公司;SPH-2102C立式双层恒温培养振荡器 上海世平实验设备有限公司;SW-CJ-2D型(实用垂直新颖)双人净化工作台 苏州净化设备有限公司;HC-3018R高速冷冻离心机 安徽中科中佳科学仪器有限公司。
1.2培养基
纳豆芽孢杆菌的斜面、液体培养基 均为牛肉膏蛋白胨培养基[20]。
白葡萄酒酵母RW、红葡萄酒酵母SY、戴尔凯氏有孢圆酵母的斜面培养基YPD:酵母膏10 g/L、蛋白胨20 g/L、葡萄糖20 g/L,调pH 6.5,加20 g/L琼脂得斜面培养基。
白葡萄酒酵母RW、红葡萄酒酵母SY、戴尔凯氏有孢圆酵母的液体种子培养基YPD:酵母膏10 g/L、蛋白胨20 g/L、葡萄糖20 g/L,调pH 6.5。
嗜热链球菌、保加利亚乳杆菌、植物乳杆菌的斜面、液体培养基均为MRS培养基[16]。
1.3实验方法
1.3.1 种子液制备 分别配制液体培养基和斜面培养基,将保藏的菌种转接到斜面培养基,34 ℃培养24 h使菌种活化。取活化菌种两环接入装有25 mL液体培养基的100 mL三角瓶中,置于恒温培养振荡器中培养(34 ℃,150 r/min),本实验选取纳豆芽孢杆菌、植物乳杆菌、嗜热链球菌、保加利亚乳杆菌均培养12 h的种子液,戴尔凯氏有孢圆酵母、白葡萄酒酵母RW、红葡萄酒酵母SY均培养16 h的种子液。
1.3.2 原料预处理 将冷榨核桃粕过20目筛网。分别称取核桃粕10 g、氯化钠0.15 g和葡萄糖0.1 g于100 mL锥形瓶中,加15 mL蒸馏水,调pH为7.0±0.2,于室温下浸泡2 h,121 ℃高压灭菌锅湿热灭菌20 min,冷却后接入种子液,并于恒温振荡器中37 ℃恒温发酵,转速150 r/min。接种发酵48 h后,于4 ℃冰箱后熟24 h。
1.3.3 NK活性测定方法 采用琼脂糖-纤维蛋白平板法[20]。
1.3.4 挥发性盐基氮含量测定 采用半微量定氮法,参照GB T5009.44-2003。
1.3.5 菌种优化 在菌种比例1∶1,接种量9%,发酵温度为37 ℃,发酵时间48 h的发酵条件下,对嗜热链球菌、保加利亚乳杆菌、植物乳杆菌、戴尔凯氏有孢圆酵母、白葡萄酒酵母RW、红葡萄酒酵母SY分别与纳豆芽孢杆菌混合发酵,以NK活性为指标,优选适合发酵的菌种。
1.3.6 单因素实验 选择戴尔凯氏有孢圆酵母、植物乳杆菌分别与纳豆芽孢杆菌混合发酵的方法,以NK活性为指标,分析接种量、菌种配比、葡萄糖添加量、发酵温度及发酵时间对发酵品中的NK活性影响。
接种量分别设定为3%、5%、7%、9%、11%的种子液,其中菌种配比(纳豆芽孢杆菌:戴尔凯氏有孢圆酵母、纳豆芽孢杆菌∶植物乳杆菌)为1.5∶1,葡萄糖添加量为0.5%,发酵温度37 ℃,发酵时间48 h;
菌种配比(纳豆芽孢杆菌:戴尔凯氏有孢圆酵母、纳豆芽孢杆菌:植物乳杆菌)分别设定为1∶2、1∶1.5、1∶1、1.5∶1、2∶1,其中接种量为9%,葡萄糖添加量为0.5%,发酵温度为37 ℃,发酵时间为48 h;
葡萄糖添加量分别设定为0%、0.5%、1.0%、1.5%、2%,其中接种量为9%,菌种配比为1∶1,发酵温度为37 ℃,发酵时间为48 h;
发酵温度分别设定为28、31、34、37、42 ℃,其中接种量为9%,菌种配比为1∶1,葡萄糖添加量为1%,发酵时间为48 h;
发酵时间分别设定为12、24、36、48、60 h,其中接种量为9%,菌种配比为1∶1,葡萄糖添加量为1%,发酵温度为37 ℃。
1.3.7 正交实验 根据单因素实验结果,以NK活性为指标,采用纳豆芽孢杆菌分别与戴尔凯氏有孢圆酵母、植物乳杆菌混合发酵,固定葡萄糖添加量为1.0%。以接种量、菌种配比、发酵温度及发酵时间为影响因素按L16(45)正交表进行实验,确定最优发酵条件。纳豆芽孢杆菌分别与戴尔凯氏有孢圆酵母、植物乳杆菌混合发酵正交实验的各因素水平分别见表1、表2。
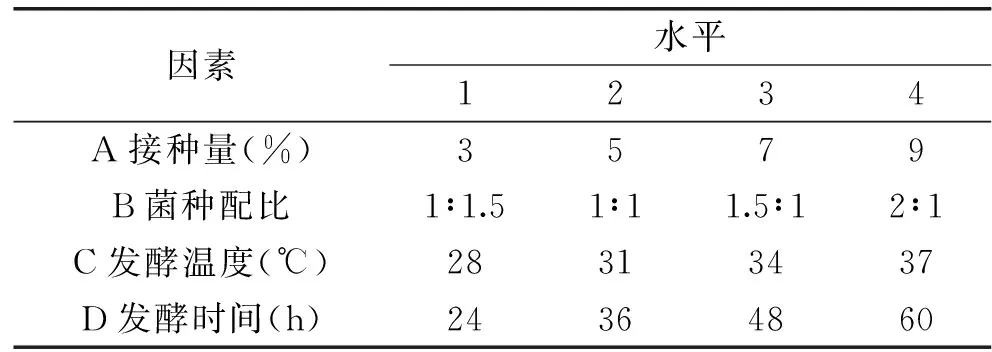
表1 纳豆芽孢杆菌与戴尔凯氏有孢圆酵母混合发酵正交设计因素水平表Table 1 Factors and levels of orthogonal design of fermentation by the mixed strains ofBacillus subtils natto and Torlaspora delbrueckii
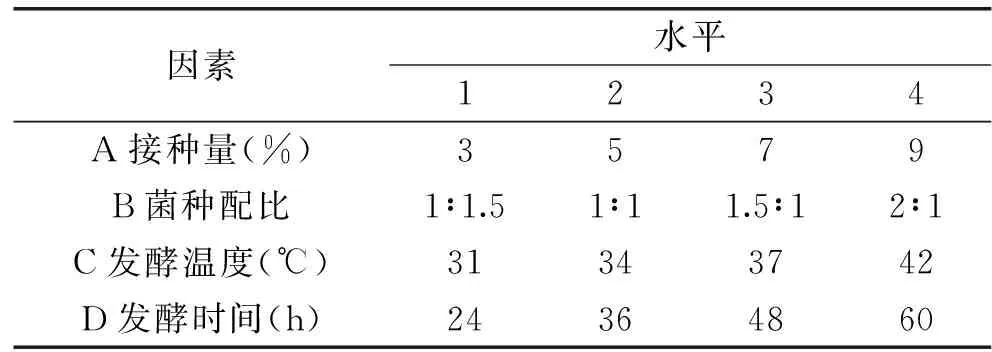
表2 纳豆芽孢杆菌与植物乳杆菌混合发酵正交实验因素水平表Table 2 Factors and levels of orthogonal experiment of fermentation by the mixed strains ofBacillus subtils natto and Lactobacillus plantarum
1.4数据处理
利用Minitab 16.0数据处理软件进行分析,并通过Tukey法检验数据间差异的显著性(p<0.05),每个实验3次重复,结果取平均值。
2 结果与分析
2.1不同乳酸菌与纳豆芽孢杆菌混合发酵核桃粕对纳豆激酶活性的影响
由图1可以看出,不同菌种混合发酵对纳豆激酶活性的影响存在显著性差异。其中,纳豆芽孢杆菌与植物乳杆菌混合发酵纳豆激酶活性最高,酶活达1524.47 U/g。因此,本实验选择植物乳杆菌与纳豆芽孢杆菌混合进行发酵条件的优化。
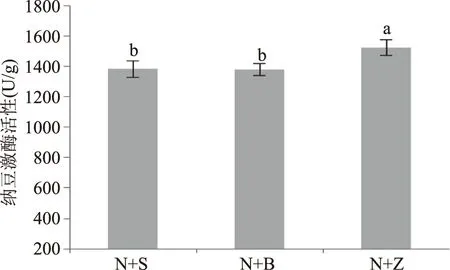
图1 不同乳酸菌与纳豆芽孢杆菌混合发酵对纳豆激酶活性的影响Fig.1 Effect of fermentation by the mixed strains of different Lactic acid bacteria and Bacillus subtils natto on nattokinase activity注:不同小写字母表示差异显著(p<0.05)。N-纳豆芽孢杆菌,S-嗜热链球菌,B-保加利亚乳杆菌,Z-植物乳杆菌。
2.2不同酵母菌与纳豆芽孢杆菌混合发酵核桃粕对纳豆激酶活性的影响
由图2可知,纳豆芽孢杆菌与戴尔凯氏有孢圆酵母混合发酵纳豆激酶活性最高,活性为1386.54 U/g,故本实验选择戴尔凯氏有孢圆酵母与纳豆芽孢杆菌混合进行发酵条件的优化。
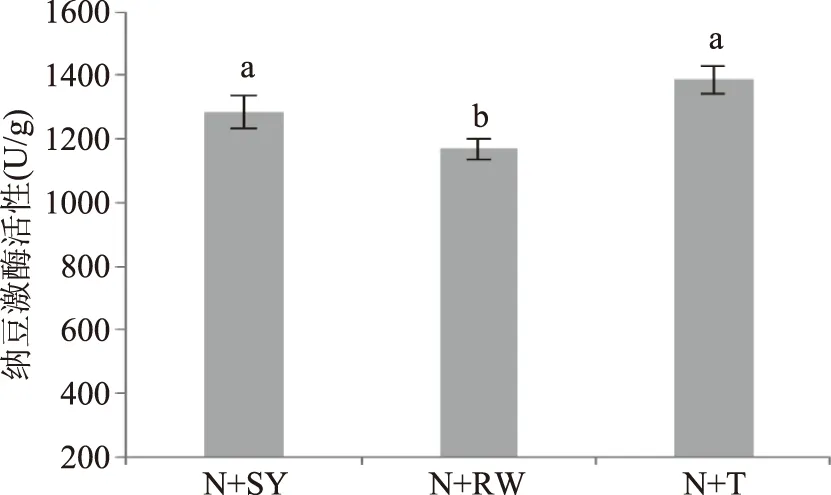
图2 不同酵母菌与纳豆芽孢杆菌混合发酵对纳豆激酶活性的影响Fig.2 Effect of fermentation by the mixed strains of different Saccharomycetes and Bacillus subtils natto on nattokinase activity注:不同小写字母表示差异显著(p<0.05)。N-纳豆芽孢杆菌,SY-红葡萄酒酵母,RW-白葡萄酒酵母,T-戴尔凯氏有孢圆酵母。
2.3固态发酵核桃粕产纳豆激酶的单因素实验结果
2.3.1 接种量对纳豆激酶活性的影响 由图3可知,不同接种量对发酵品的NK活性产生不同的影响,NK活性随接种量的增加呈先升高后降低的趋势。当纳豆芽孢杆菌与戴尔凯氏有孢圆酵母混合发酵的接种量为5%的菌种种子液时,NK活性达到最大值,为1733.00 U/g。当纳豆芽孢杆菌与植物乳杆菌混合发酵的接种量为7%的菌种种子液时,NK活性达到最大值,为1755.84 U/g。当接种量太小时,随着接种量的增加,纳豆芽孢杆菌密度逐渐增加[21],产生的纳豆激酶量也随之增加。当接种量太大时,菌体细胞的生长繁殖消耗了过多的底物营养物质,产生大量的代谢废物[22],加快菌体细胞衰老,导致产酶量降低,NK活性下降。
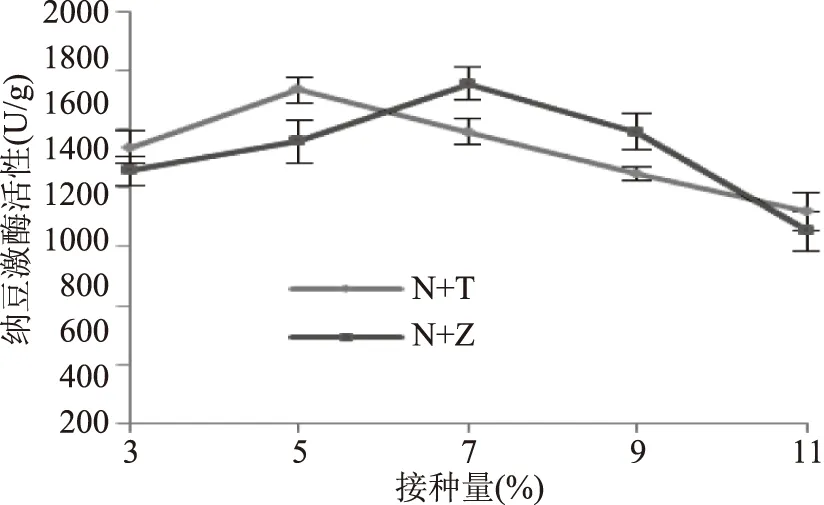
图3 接种量对纳豆激酶活性的影响Fig.3 Effect of inoculation amount on nattokinase activity
2.3.2 菌种配比对纳豆激酶活性的影响 图4显示了菌种配比(纳豆芽孢杆菌:戴尔凯氏有孢圆酵母、纳豆芽孢杆菌:植物乳杆菌)对NK活性的影响。
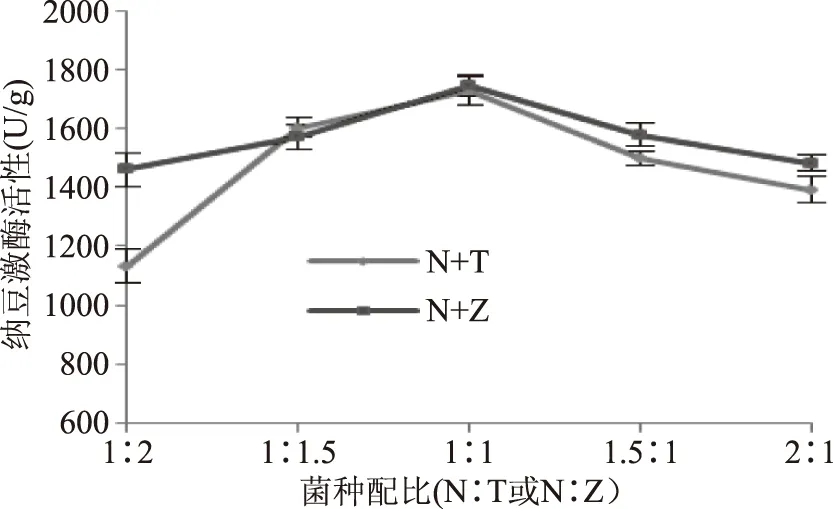
图4 菌种配比对纳豆激酶活性的影响Fig.4 Effect of proportion of inoculums on nattokinase activity
结果表明,NK活性随菌种比例的增加呈先升高后降低的趋势,适宜的纳豆芽孢杆菌和植物乳杆菌比例范围(1∶1.5~1.5∶1)对NK的合成具有促进作用。当纳豆芽孢杆菌与戴尔凯氏有孢圆酵母的比例为1∶1时,NK活性达到最大值,约为1725.76 U/g。当纳豆芽孢杆菌与植物乳杆菌的比例为1∶1时,是适合NK合成的最佳接种比例,NK活性达到最大值,约为1745.71 U/g。菌种比例太大太小都不利于NK活性的提高,过多接种纳豆芽孢杆菌或植物乳杆菌及戴尔凯氏有孢圆酵母可能会使得菌种间协同作用不但不能发挥,反而由于两菌种对营养物质的竞争[23],抑制了NK的生成。
2.3.3 葡萄糖添加量对纳豆激酶活性的影响 结果表明,葡萄糖添加量为1.0%时,戴尔凯氏有孢圆酵母、植物乳杆菌分别与纳豆芽孢杆菌混合发酵,NK活性均达到最大值,分别为1689.35、1678.22 U/g。葡萄糖过高过低都不利于NK活性的提高。葡萄糖是单糖,微生物易利用,无水解等过程,是一种速效碳源[22],可以在发酵过程中提供大量碳源,以维持其持续增长,NK活性提高。而葡萄糖添加量过多,发酵基质中碳氮比例增大,对菌种繁殖不利[23],从而导致NK活力下降。当葡萄糖添加量分别为0.5%、1.0%和1.5%时,NK活性之间均无显著性差异(p>0.05)。因此,本实验选择1.0%的葡萄糖添加量。
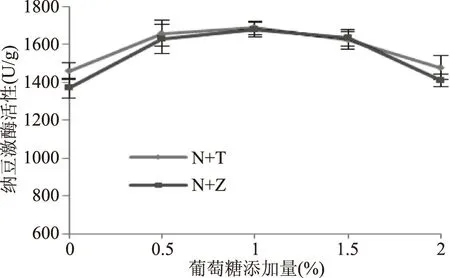
图5 葡萄糖添加量对纳豆激酶活性的影响Fig.5 Effect of glucose content on nattokinase activity
2.3.4 发酵温度对纳豆激酶活性的影响 结果表明,NK活性随发酵温度的升高呈先升高后降低的趋势。纳豆芽孢杆菌与戴尔凯氏有孢圆酵母混合发酵在发酵温度为34 ℃的条件下,NK活性达到最大值,约为1721.72 U/g,表明纳豆芽孢杆菌在该温度条件下能较好的生长繁殖,且其代谢产生的NK具有较高的活性。而纳豆芽孢杆菌与植物乳杆菌混合发酵在发酵温度为37 ℃的条件下,NK活性达到最大值,约1721.66 U/g。温度过低时,微生物的生长速率慢,代谢产物生成的速度降低[24],导致NK活性低;但温度过高时,会引起微生物菌体的过早衰老死亡及NK耐热性差[25],从而使NK活性下降。
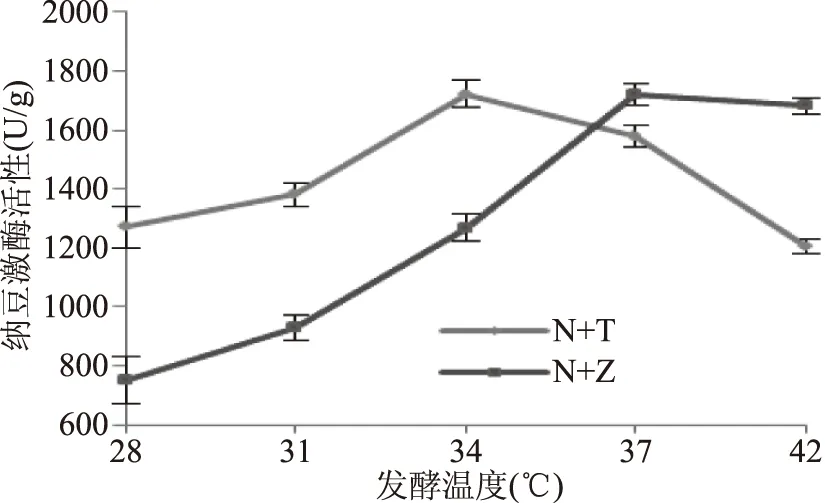
图6 发酵温度对纳豆激酶活性的影响Fig.6 Effect of fermentation temperature on nattokinase activity
2.3.5 发酵时间对纳豆激酶活性的影响 由图7可知,NK活力随发酵时间的增加呈先升高后降低的趋势。当纳豆芽孢杆菌与戴尔凯氏有孢圆酵母混合发酵在发酵时间为48 h的条件下,NK活性达到最大值,约为1716.15 U/g。当纳豆芽孢杆菌与植物乳杆菌混合发酵在发酵时间为48 h的条件下,NK活性达到最大值,约为1702.72 U/g。在48 h之前,菌种随着发酵时间的延长而迅速生长繁殖,产生并积累NK,使得酶活性增加。在48 h之后,随着发酵时间的延长,菌种进入衰亡期,NK活性降低,这是由于菌种代谢或核桃粕内物质转化产生酶抑制性物质,或是NK进一步转化或降解为其他物质,还可能是由于发酵时间过长而导致有害产物的积累[26],从而使得NK活性降低。
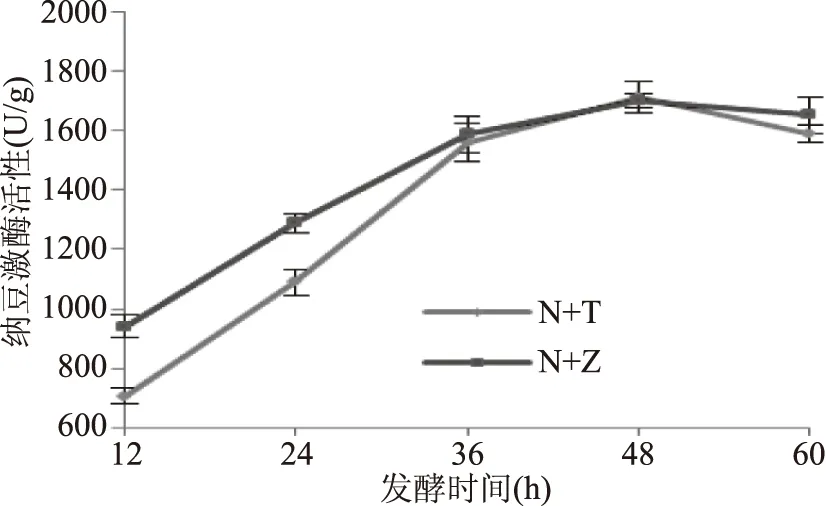
图7 发酵时间对纳豆激酶活性的影响Fig.7 Effect of fermentation time on nattokinase activity
2.4正交实验设计结果
2.4.1 纳豆芽孢杆菌与戴尔凯氏有孢圆酵母混合发酵正交实验结果 根据单因素实验结果,以NK活性为指标做正交分析,纳豆芽孢杆菌与戴尔凯氏有孢圆酵母混合发酵核桃粕的实验结果见表3。
由表3可以看出,对于纳豆芽孢杆菌与戴尔凯氏有孢圆酵母混合发酵,NK活力最高是1927.48 U/g。四因素对NK活性的影响主次顺序为:C发酵温度>A接种量>D发酵时间>B菌种配比,即发酵温度对NK活性影响最大,为决定性因素,其次为接种量、发酵时间,而菌种配比的影响最小。
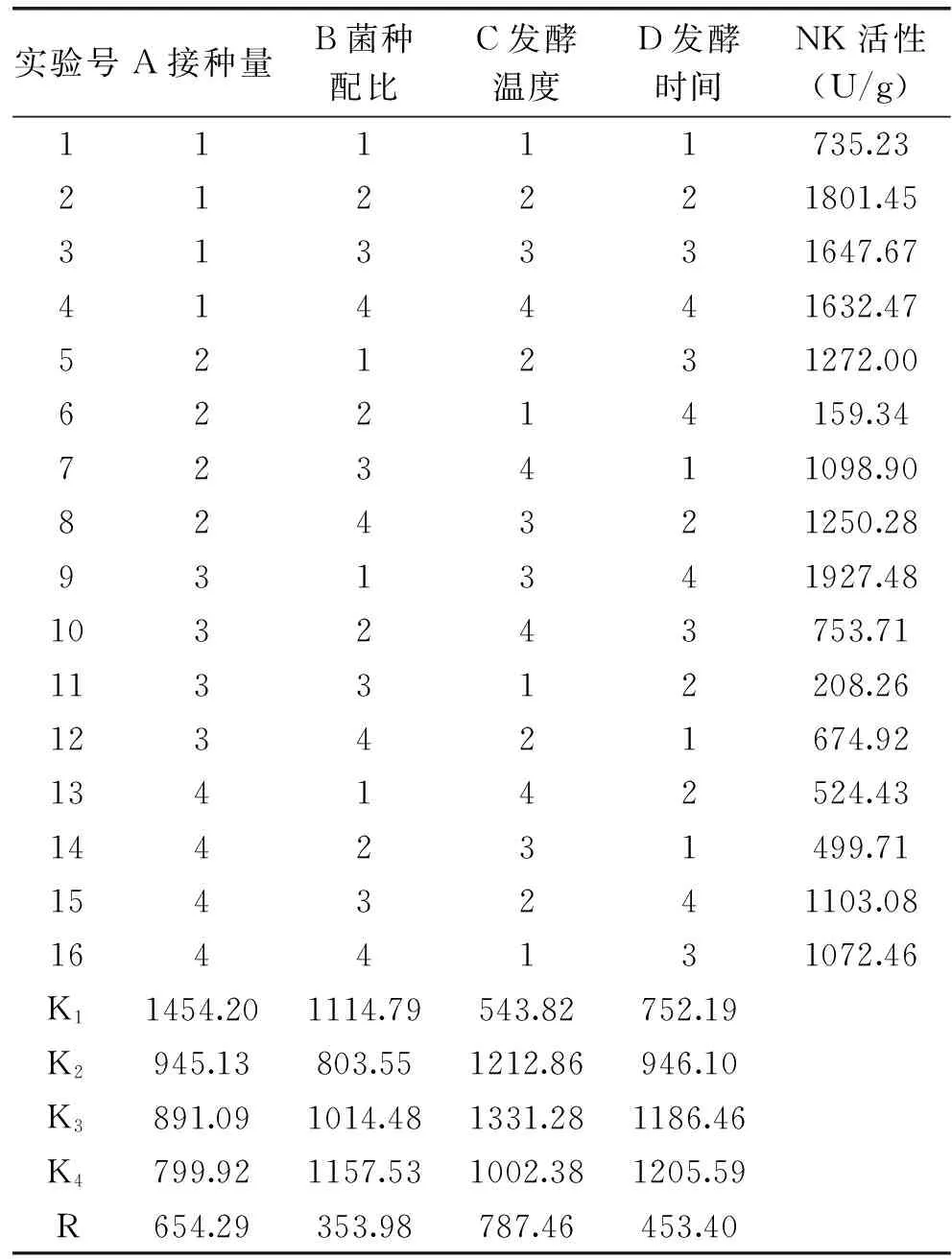
表3 正交优化实验设计和结果Table 3 Experimental design and results for orthogonal analysis
纳豆芽孢杆菌与戴尔凯氏有孢圆酵母混合发酵的理论最优组合为A1B4C3D4,即接种量3%,菌种配比为2∶1,34 ℃下发酵60 h,进行三次验证实验,测得NK活性为2040.82 U/g,与正交实验中NK活性(最高为1927.48 U/g)相比有所提高,提高了5.88%。
纳豆芽孢杆菌单菌发酵核桃粕,NK活性为1197.51U/g,挥发性盐基氮含量为410.72 mg/100 g。相比于纳豆芽孢杆菌单菌发酵品,戴尔凯氏有孢圆酵母与纳豆芽孢杆菌混合发酵产品NK活性显著提高(p<0.01),提高了70.42%,挥发性盐基氮含量为64.18 mg/100 g,降低了84.37%。戴尔凯氏有孢圆酵母与纳豆芽孢杆菌混合发酵效果优良。孙军德[18]采用纳豆芽孢杆菌与沼泽假单胞菌混合发酵,挥发性盐基氮含量降低了79.81%,王帆等[27]用乳酸菌、葡萄球菌和酵母菌混合发酵鱼肉香肠,挥发性盐基氮含量降低了80.91%,氨味明显减轻。其原因是戴尔凯氏有孢圆酵母在发酵过程中与纳豆芽孢杆菌竞争营养物质,减弱了核桃粕中蛋白质的分解速度[14],因而减少挥发性盐基氮的生成;戴尔凯氏有孢圆酵母在发酵过程中分解培养基中的糖类,产生醇香味[28],戴尔凯氏有孢圆酵母与纳豆芽孢杆菌混合发酵品氨味减少,提高适口性。
2.4.2 纳豆芽孢杆菌与植物乳杆菌混合发酵正交实验结果 根据单因素实验结果,以NK活性为指标做正交分析,纳豆芽孢杆菌与植物乳杆菌混合发酵核桃粕的实验结果见表4。
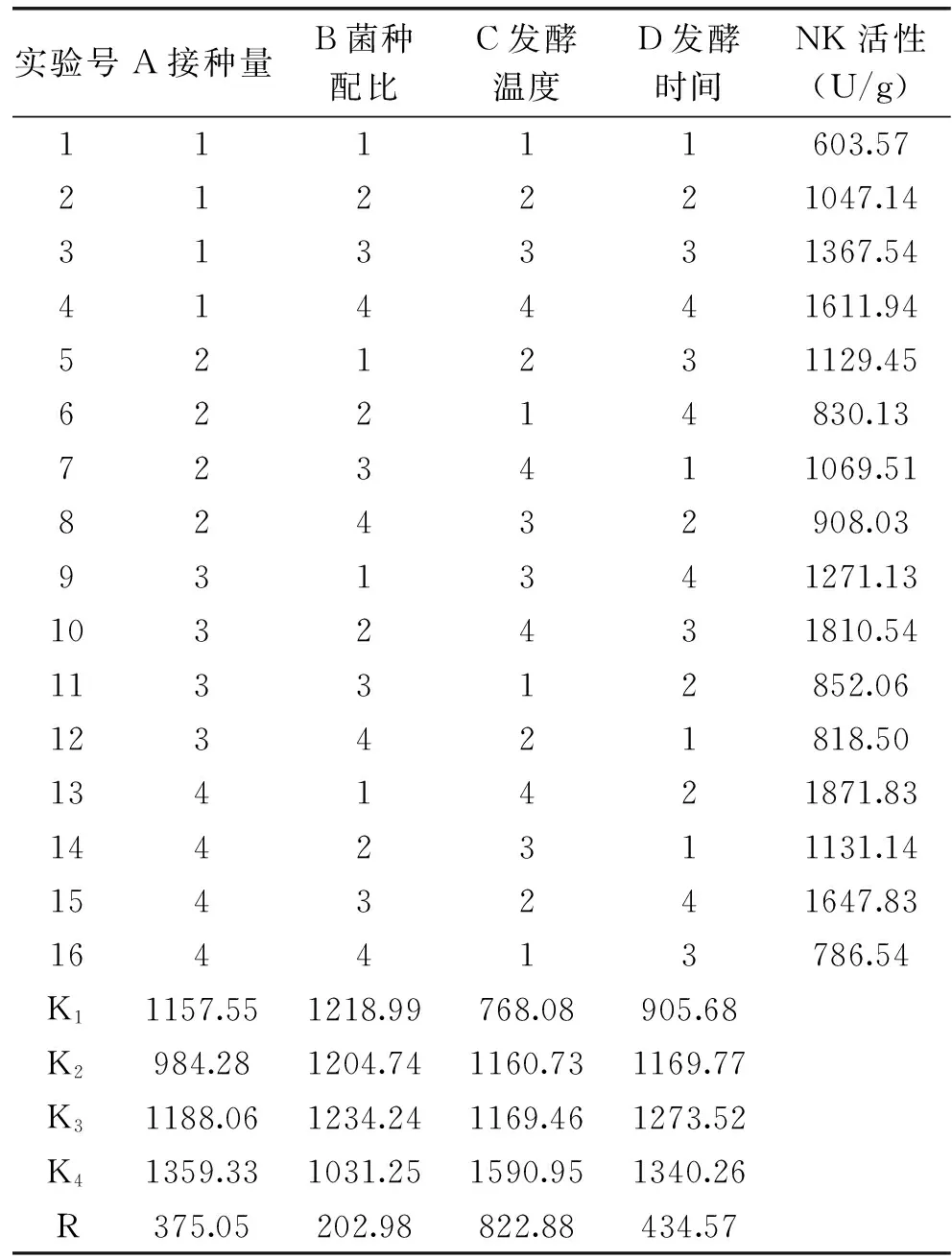
表4 正交实验结果与分析Table 4 Results and analysis for orthogonal experiment
由正交实验结果可以看出,对于纳豆芽孢杆菌与植物乳杆菌混合发酵,NK活性最高是1871.83 U/g。四因素对NK活性的影响主次顺序为:C发酵温度>D发酵时间>A接种量>B菌种比例。即发酵温度对NK活性影响最大,为决定性因素,其次为发酵时间、接种量,而菌种配比的影响最小。
纳豆芽孢杆菌与植物乳杆菌混合发酵的理论最优组合为A4B3C4D4,即接种量9%,菌种配比为1.5∶1,42 ℃下发酵60 h,进行三次验证实验,测得NK活性为1966.02 U/g,高于其他16组,所得到的正交实验结果合理。
相比于NK活性和挥发性盐基氮含量分别为1197.51U/g、410.72 mg/100 g的纳豆芽孢杆菌单菌发酵品,纳豆芽孢杆菌与植物乳杆菌混合发酵产品的NK活性显著提高(p<0.01),提高了64.18%,挥发性盐基氮含量为62.68 mg/100 g,降低了84.74%,显著减轻了产品的氨味。植物乳杆菌在发酵过程中产生的乳酸与氨及胺类等碱性物质发生中和反应,降低了挥发性盐基氮的含量[29]。此外,植物乳杆菌可降解精氨酸、组氨酸、天门冬氨酸等产生杂醇和在发酵过程中产生有机酸,两者又可进行酯化反应缩水生成酯类物质[29],对产品的整体香气起到柔和作用。混合菌种发酵氨味减少,改善了传统发酵品的风味。
3 结论
单因素和正交实验结果表明,纳豆芽孢杆菌与戴尔凯氏有孢圆酵母混合菌种发酵冷榨核桃粕的最佳条件为:接种量3%,菌种配比2∶1,发酵时间60 h,发酵温度34 ℃。而纳豆芽孢杆菌与植物乳杆菌混合菌种发酵冷榨核桃粕的最优条件为:接种量9%、菌种比例为1.5∶1、发酵温度42 ℃、发酵时间60 h。与纳豆芽孢杆菌单菌发酵品相比,混合菌种发酵均可显著提高NK活性(p<0.01),降低挥发性盐基氮含量(p<0.01),从而有效减轻发酵品的不良氨味。因此,本研究为混合菌种发酵提高核桃粕发酵品的品质提供了理论依据和方法指导。
[1]JEAN-PIERRE S,ZORA LEA U,DAVLET M,et al. Thinning effects on walnut stem and crown diameter growth and fruiting in the walnut-fruit forests of Kyrgyzstan[J]. Journal of Mountain Science,2016,13(9):1558-1566.
[2]潘学军,张文娥,李琴琴,等. 核桃感官和营养品质的主成分及聚类分析[J]. 食品科学,2013,34(8):195-198.
[3]张文涛,徐华,蒋林惠,等. 核桃仁氧化酸败及其延缓措施研究进展[J]. 食品科学,2012,33(3):272-276.
[4]李婷. 核桃粕蛋白提取工艺研究[D]. 乌鲁木齐:新疆农业大学,2015:7-12.
[5]金子纯,张润光,韩军岐,等.核桃饼粕蛋白质及其开发利用[J]. 食品与发酵工业,2016,42(6):265-269.
[6]李志红,徐怀德,郭盼,等. 冷榨核桃油饼单宁脱除技术研究[J]. 中国食品学报,2015,15(1):150-156.
[7]AOYAMA M,NAKACHI K,KOBAMOTO N O H,et al. Soybean-milk-coagulating activity ofBacilluspumilusderives from a serine proteinase[J]. Applied Microbiology & Biotechnology,2000,53(4):390-395.
[8]TUAN T Q,AI L T T,HIEP D M,et al. Purification and characterization of recombinant nattokinase fromBacillussubtilis[J]. Journal of Controlled Release,2015,37(1se):1-6.
[9]李妍,吴庆红,陈义伦,等. 一株纳豆芽孢杆菌的产酶条件优化[J]. 食品科学,2013,34(3):179-183.
[10]董超,李楠,程辉彩,等. 纳豆激酶发酵条件的优化[J]. 食品科学,2009,30(1):151-154.
[11]Yan L I,Qing-Hong W U,Chen Y L,et al. Optimization of Fermentation Conditions for Nattokinase Production byBacillussubtilisnatto[J]. Food Science,2013,34(3):179-183.
[12]张琳,王凯,庞丰平,等. 纳豆激酶的液体发酵条件优化[J]. 基因组学与应用生物学,2016(2):373-377.
[13]杨学娟.纳豆芽孢杆菌固体发酵低温豆粕的功能活性及机制研究[D].镇江:江苏大学,2013:18.
[14]肖萌,王远亮. 双低菜籽粕混菌固态发酵条件的优化[J]. 西北农林科技大学学报:自然科学版,2015(9):1-8.
[15]杜磊,凡复,周博. 豆渣马铃薯渣固态发酵改善纤维适口性的研究[J]. 食品工业,2016(3):59-63.
[16]牛丽亚,黄占旺,赵鹏. 纳豆芽孢杆菌和嗜酸乳杆菌混合发酵过程中营养物质变化的研究[J]. 粮食与饲料工业,2009,2009(4):36-37.
[17]刘丽莉,梁严予,尹光俊,等. 混合菌种发酵牛骨粉制备血管紧张素转换酶抑制肽[J]. 河南科技大学学报:自然科学版,2017,38(1).
[18]孙军德,陈思,杨璐,等. 双菌株混合发酵纳豆的条件优化[J]. 沈阳农业大学学报,2016,47(1):35-40.
[19]王常苏,孙晓彤,金健,等. 混合多菌种固态发酵产纳豆激酶的研究[J]. 武汉轻工大学学报,2013,32(3):5-9.
[20]高瑞雄. 纳豆芽孢杆菌发酵核桃粕的研究[D]. 杨凌:西北农林科技大学,2016:21-33.
[21]胡伶俐,李军,张云峰,等.纳豆激酶液体发酵条件的优化[J].化学与生物工程,2011,28(1):42-45.
[22]LEE B H,Lai Y S,Wu S C. Antioxidation,angiotensin converting enzyme inhibition activity,nattokinase,and antihypertension ofBacillussubtilis,(natto)-fermented pigeon pea[J]. Journal of Food & Drug Analysis,2015,23(4):750-757.
[23]张杰,葛武鹏,陈瑛,等. 纳豆激酶高产菌株的选育及固态发酵技术[J]. 食品科学,2016,37(3):151-156.
[24]Hui Min Zhou,Hong Xing Zhang,Yuan Hong Xie,et al. Optimization of Liquid Fermentation Conditions and Encapsulation for Nattokinase Production[J]. Advanced Materials Research,2013(781-784):1403-1409.
[25]王文秀,于佳,李钐,等. 不同条件对纳豆菌发酵蛤蜊产物中游离氨基酸态氮含量及纳豆激酶活性的影响[J]. 食品科学,2015,36(9):113-116.
[26]JHAN J K,Chang W F,Wang P M,et al. Production of fermented red beans with multiple bioactivities using co-cultures ofBacillussubtilis,andLactobacillusdelbrueckiisubsp.bulgaricus[J]. Lebensmittel-Wissenschaft und-Technologie,2015,63(2):1281-1287.
[27]王帆,迟明旭,韩德权,等.混合菌种联合发酵对鱼肉香肠品质的影响[J].食品工业科技,2015,36(7):182-186.
[28]王星晨,胡凯,陶永胜. 葡萄汁有孢汉逊酵母和酿酒酵母的混合酒精发酵动力学[J]. 食品科学,2016,37(3):103-108.
[29]裘迪红,欧昌荣,苏秀榕,等. 植物乳杆菌发酵草鱼肉挥发性成分的变化规律[J]. 食品科学,2015,36(20):174-180.
Studyofimprovingnattokinaseactivitythroughsolid-statefermentationofcold-pressingwalnutdregsbycompoundstrains
WANGRui-zhen,CAITian-jiao,XUYa-fei,RENLu,LEIHong-jie*,XUHuai-de*
(College of Food Science and Engineering,Northwest A&F University,Yangling 712100,China)
To improve nattokinase(NK)activity of fermentation products byBacillussubtilsnattoand reduce the ammonia smell,solid-state fermentation of walnut dregs by the mixed strains ofBacillussubtilsnattoandTorlasporadelbrueckii(BacillussubtilsnattoandLactobacillusplantarum)was investigated. Results showed that the optimum technological parameters of fermentation by the mixed strains ofBacillussubtilsnattoandTorlasporadelbrueckiiwere as follows:inoculation amount of 3%,proportion of inoculums of 2∶1,fermentation temperature of 34 ℃,fermentation time of 60 h. In this fermentation conditions,the NK activity was 2040.82 U/g,increasing by 70.42%. The content of volatile base nitrogen was 64.18 mg/100 g,decreasing by 84.37%. In addition,the optimum technological parameters of fermentation by the mixed strains ofBacillussubtilsnattoandLactobacillusplantarumwere as follows:inoculation amount of 9%,proportion of inoculums of 1.5∶1,fermentation temperature of 42 ℃,fermentation time of 60 h. In these fermentation conditions,the NK activity was 1966.02 U/g,increasing by 64.18%. The content of volatile base nitrogen was 62.68 mg/100 g,decreasing by 84.74%. The mixed strains fermentation could decrease the ammonia smells significantly,improve the flavor of traditional fermentation products.
walnut dregs;Bacillussubtilsnatto;Torlasporadelbrueckii;Lactobacillusplantarum;solid-state fermentation;nattokinase
2017-01-05
王瑞珍(1991-),女,硕士研究生,研究方向:果蔬贮藏与加工,E-mail:wrz1003420723@sina.com。
*通讯作者:雷宏杰(1984-),男,博士,讲师,研究方向:果蔬加工与食品生物技术,E-mail:leihongjie000@163.com。 徐怀德(1964-),男,大学本科,教授,研究方向:果品蔬菜贮藏与加工和天然产物提取,E-mail:xuhuaide@aliyun.com。
陕西省科技统筹创新工程计划项目(2016KTCQ02-22)。
TS201.3
:A
:1002-0306(2017)16-0112-06
10.13386/j.issn1002-0306.2017.16.022
