CEUS评价大鼠肝泡状棘球蚴病灶血流灌注的动态演变
2017-09-18曾红春王颖鑫王俊华刘文亚
曾红春,王颖鑫,王俊华,韩 伟,刘文亚
(1.新疆医科大学第一附属医院超声诊断科,2.新疆包虫病基础医学重点实验室,3.影像中心,新疆 乌鲁木齐 830011)
CEUS评价大鼠肝泡状棘球蚴病灶血流灌注的动态演变
曾红春1,王颖鑫1,王俊华2,韩 伟1,刘文亚3*
(1.新疆医科大学第一附属医院超声诊断科,2.新疆包虫病基础医学重点实验室,3.影像中心,新疆 乌鲁木齐 830011)
目的探讨CEUS评价不同时期大鼠肝泡状棘球蚴病(HAE)血流灌注的价值。方法采用CEUS观察70只成功感染HAE的大鼠在接种后不同时期(9、28、50周)的血流灌注特征,并与病理结果对照。结果接种9周时55个(55/70,78.57%)病灶表现为高回声,15个(15/70,21.43%)病灶表现为混合性回声,病理表现为乳白色单/多囊泡样结构。随接种时间的延长(28、50周),病灶最大径逐渐增大,病灶内部实性成分及钙化灶逐渐增多,部分病灶可出现液化坏死。镜下病灶周边纤维组织逐渐增厚,周边见微血管聚集区。接种9周时CEUS显示病灶呈环状强化及分隔样强化,28周及50周时呈环状强化或伴细线样强化及无强化。CEUS后病灶边缘增强带最大宽度与病灶最大径比值随接种时间延长而逐渐减小(P=0.02)。结论接种后不同时期大鼠HAE病灶的超声征象渐趋复杂,坏死区及钙化灶增加,CEUS可显示不同时期病灶周边及内部的血流灌注特征。
泡状棘球蚴;肝;超声检查
常规影像学方法(超声、CT及MRI等)对肝泡状棘球蚴病(hepatic alveolar echinococcosis, HAE)的诊断有重要价值,但均不能准确评价病灶活性状态[1]。FDG-PET可通过病灶摄取FDG的情况,反映HAE病灶周围的炎性反应而间接评价虫体的活性状态[2-3],但PET设备昂贵,普及率差,不适合作为常规检查方法。故本研究利用CEUS可直观定量评价病灶微血供情况[4-6]的优势,通过评价大鼠HAE的微血流灌注情况,观察接种后不同时期HAE病灶血流灌注的演变规律。
1 材料与方法
1.1实验动物 SD大鼠70只(由新疆医科大学动物实验中心提供),雌雄不限,清洁级,体质量(220±20)g,鼠龄8~10周。种鼠为经腹腔感染泡状棘球蚴的长爪沙鼠2只(由新疆医科大学第一附属医院动物实验科学部提供),体质量65 g。本研究经新疆医科大学第一附属医院伦理委员会审查通过(审批号:IACUC20150423-06)。
1.2模型制备 处死种鼠,剖腹取出泡状棘球蚴组织,除去坏死组织,剩余组织称重、剪碎、研磨、过筛,制成匀浆;生理盐水反复冲洗沉淀3次、过滤;剩余组织加生理盐水,配制成浓度为20%的混悬液(20 000个原头节/ml),加入适量青霉素和链霉素注射液(药物浓度为250 U/ml)。将SD大鼠麻醉,开腹直视下选较厚的肝叶,注射器针头斜行刺入肝实质约1 cm,注入20%原头节混悬液0.2 ml,纱布压迫止血,丝线逐层缝合关闭腹腔。
1.3CEUS检查 采用Siemens Sequia 512超声仪,高频探头,频率8~15 MHz,选用CPS模式,机械指数为0.08~0.11。70只成功感染HAE的大鼠于接种后第9周、28周、50周分别进行常规超声及CEUS检查。大鼠麻醉后备皮,充分暴露上腹部,取仰卧位或左侧卧位,先行常规超声、CDFI检查,详细记录病灶部位、大小、形态、边界、内部回声以及有无血流信号等。造影剂为声诺维(SonoVue),使用前注入5 ml 生理盐水,摇匀,配置成混悬液,留置备用。经大鼠尾静脉注入混悬液0.5 ml,随即用1 ml生理盐水进行冲管,观察持续2 min以上。观察并记录CEUS增强模式,留取较为清晰的图像储存于超声工作站。
1.4CEUS评价 注射造影剂后2~20 s为动脉期,肝动脉显影,肝组织为低回声;21~40 s为门静脉期,门静脉开始显影,肝实质回声均匀性增强;41 s后为延迟期,肝实质回声均匀性减低。观察造影增强模式,选择动脉期病灶周边环状增强带最宽处测量其最大径,即病灶增强的范围;同时测量病灶最大径,均测量3次取平均值。计算增强带与病灶最大径的比值。
1.5病理检查 接种后9、28、50周CEUS检查结束后,随机抽取10只大鼠进行病理检查。剖腹取出大鼠肝脏,观察病灶的形态,测量病灶大小。对所取肝组织常规石蜡包埋、切片(厚5 μm),进行HE染色、Masson染色,观察病灶的炎性反应、微血管和纤维组织。
1.6统计学分析 采用SPSS 21.0统计分析软件,不同时期病灶最大径、增强带最大径、增强带与病灶最大径的比值均不符合正态分布和方差齐性,以中位数表示,组间比较采用Kruskal-WallisH检验,P<0.05为差异有统计学意义。两两比较采用Wilcoxon秩和检验,根据比较次数调整检验水准,P<0.017为差异有统计学意义。
2 结果
2.1大鼠HAE不同时期CEUS特征及病理基础
2.1.1接种9周 接种9周时(n=70),病灶最大径中位数5.86 mm,55个(55/70,78.57%)病灶表现为高回声,包括点状高回声(1型;10/70,14.29%)、簇状细小高回声(2型;21/70,30.00%)、灶状高回声(3型;24/70,34.29%);15个病灶(4型;15/70,21.43%)表现为肝内混合性回声(无回声伴高回声分隔)。8个(8/70,11.43%)最大径≥7 mm的4型病灶内可见钙化灶。
55个(55/70,78.57%;图1A)病灶CEUS表现为动脉期环状强化,门静脉期廓清(图1B),见于直径<3 mm的病灶;15个(15/70,21.43%)表现为动脉期环状强化伴分隔强化,类似“调色碟样”改变,静脉期开始廓清,见于直径≥3 mm的病灶。病理表现为米黄色或乳白色单/多囊泡样结构,HE染色病灶周边可见红染纤维结构,内呈空泡样改变,与肝组织交界区可见微血管聚集(图1C)。Masson染色可清晰显示病灶周边蓝染纤维结构(图1D)。
2.1.2接种28周 接种28周时(n=56),病灶最大径中位数8.40 mm,34个(34/56,60.71%)病灶表现为高回声;22个(22/56,39.29%)病灶表现为混合性回声,病灶内部实性高回声成分较9周时增多。11个病灶(11/56,19.64%)内部及边缘可见数量不等的钙化灶。34个(34/56,60.71%)病灶CEUS表现为动脉期环状强化,22个(22/56,39.29%)表现为内部伴线样增强,门静脉期持续强化,延迟相廓清(图2A、2B)。大体病理见病灶外观呈不规则石灰色或米黄色,类似“树根样”盘置于肝内,剖面呈多房状改变,其间夹杂少量黏液,HE染色可见红染纤维组织与不规则液性区域交织分布,病灶边缘处可见微血管及炎性细胞(图2C)。Masson染色可显示蓝染纤维结构和液性无染色区(图2D)。
2.1.3接种50周 接种50周时(n=45),病灶最大径中位数10.20 mm,25个(25/45,55.56%)病灶表现为高回声;20个(20/45,44.44%)病灶表现为高回声、极低回声及无回声区混合分布。17个(17/45,37.78%)病灶内部及周边可见钙化灶。38个(38/45,84.44%)病灶动脉期周边呈不规则环状强化,门静脉期持续强化,延迟相廓清(图3A、3B);7个(7/45,15.56%)病灶周边及内部造影全程均未见强化。大体病理见病灶外观呈石灰色或米黄色,外形不规则;剖面以火山石样结构为主,夹杂少量黏液。HE染色病灶周边呈厚壁红染纤维结构,病灶与肝组织交界处见微血管伴炎性细胞(图3C)。Masson染色可清晰显示病灶周边蓝染纤维结构(图3D)。
2.2病灶周边增强带与病灶最大径之比在接种不同时期的变化 随着病程进展,病灶最大径逐渐增大,病灶周边增强带与最大径的比值逐渐减小,总体差异均有统计学意义(P均<0.05)。接种50周时病灶周围增强带与最大径比值均小于28周和9周病灶(P均<0.01)。接种后不同时期病灶周围增强带最大径差异无统计学意义(P=0.17)。见表1。
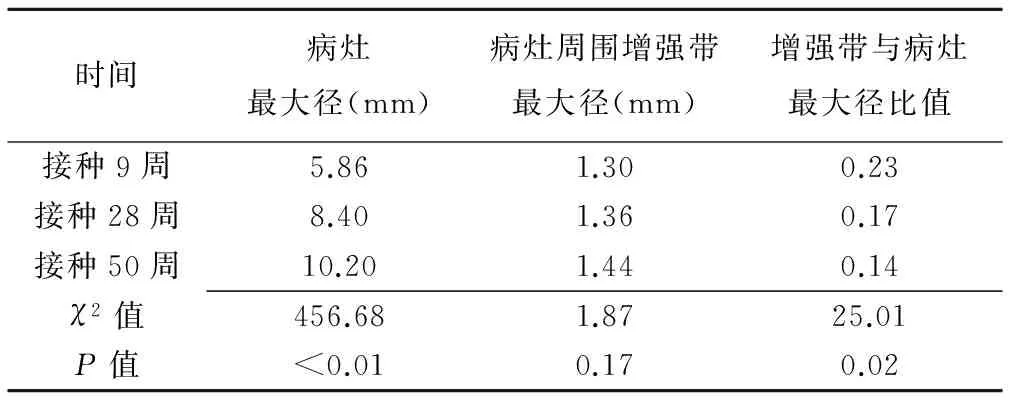
表1 不同接种时间病灶最大径、病灶周围增强带最大径及两者比值比较(中位数)

图1 接种9周时大鼠HAE病灶CEUS及病理图 A.动脉期病灶呈环状强化(箭); B.门静脉期廓清(箭); C.病理图(HE,×100)示病灶边壁(箭)见多个芽生子囊(箭头); D.病理图(Masson,×100)示边壁呈蓝染纤维结构(箭) 图2 接种28周时大鼠HAE病灶CEUS及病理图 A.动脉期病灶内呈分隔样强化(箭); B.门静脉期持续强化(箭); C.病理图(HE,×40)示病灶周边纤维组织; D.病理图(Masson,×20)边壁呈蓝染纤维结构(箭) 图3 接种50周时大鼠HAE病灶CEUS及病理图 A.动脉期病灶呈环状强化(箭); B.门静脉期病灶持续强化(箭); C.病理图(HE,×40)示病灶周边纤维组织; D.病理图(Masson,×20)示边壁呈蓝染纤维结构(箭)
3 讨论
HAE病灶不同时期血管化及纤维化状态的交替出现,构成了该病进展的基本病理改变,血管化贯穿整个病程。因此,HAE病灶周边及内部血管的多少决定病灶的活性状态。CT灌注、MR扩散加权成像、CEUS研究[7-9]均表明HAE与肝组织交界处存在富含微血管的区域,但血管化状态在HAE进展中的演变规律,以及与病灶活性状态的关系,仍有待进一步研究。
本研究发现接种9周时大鼠HAE的增强方式主要有2种,最大径<3 mm的病灶,增强模式主要为动脉期环状增强,静脉期逐渐消退;最大径≥3 mm的病灶,增强模式主要为动脉周边环状增强伴内部分隔强化,静脉期开始消退。由于本研究采用纯血池显像造影剂,因此,HAE病灶增强区域与病理显示的病灶周边有丰富微血管增殖的炎性反应区一致。造影过程中无增强的区域为囊泡样结构[10-11],且早期大鼠HAE在病理上既可表现为单囊泡也可表现为多囊泡样结构。
本研究发现随接种时间的延长,在接种不同时期大鼠HAE病灶周边环状增强区的宽度差异无统计学意义(P=0.17)。由于病灶体积逐渐增大,但病灶周边的微血管富集区并未随病灶体积增大而增宽,因此病灶周边增强带与病灶最大径的比值逐渐减小。接种后50周显著小于接种后9周和28周,提示相对于病灶体积的增大,病灶周边的滋养血管不能充分满足其生长需求,加之病灶边缘小囊泡释放囊液刺激周围组织,导致纤维组织增生,病灶呈相对乏血供状态。本研究发现CEUS后病灶内部未见强化或仅可见分隔样强化,提示HAE病灶内部为乏血供状态。既往研究[12-13]通过CT灌注成像、DWI及PET/CT检查亦有类似发现。
接种早期HAE病灶动脉期呈环状增强,门静脉期呈低增强,提示病灶血供主要来源于肝动脉。随病程进展,病灶周围动脉血管截断,门静脉逐渐参与供血,因此,中晚期病灶出现门静脉期持续强化的特征。HAE病灶内部钙化灶被视为与肝内其他病变鉴别的特异性影像学表现,并可用来评价对HAE病灶的药物治疗效果[14]。本研究中随着接种时间延长,病灶内部钙化灶逐渐增多,提示HAE病灶伴钙化或液化坏死多预示病灶处于较晚期[15]。
本研究的不足:目前该类研究仅限于动物实验阶段,采用CEUS评价HAE病灶生物学活性的临床价值,仍有待通过大量临床研究验证;由于HAE的演变及活性状态过程复杂,期间是否有除新生血管化因素外其他机制的参与仍有待进一步研究。
总之,本研究对成功感染HAE后不同时期的大鼠进行CEUS,结果表明随病程进展,病灶边缘增强带与病灶最大径的比值逐渐减小,提示病灶血供逐渐减少。因此,采用CEUS可动态反映HAE病灶的血流灌注情况。
(致谢:本文英文摘要承蒙美国国家癌症研究所 弗雷德里克国家实验室图像分析及可视化研究项目组负责人刘雁翎博士修改润色,特此表示由衷的感谢!)
[1] Liu W, Delabrousse É, Blagosklonov O, et al. Innovation in hepatic alveolar echinococcosis imaging: Best use of old tools, and necessary evaluation of new ones. Parasite, 2014,21:74.
[2] Caoduro C, Porot C, Vuitton DA, et al. The role of delayed18F-FDG PET imaging in the follow-up of patients with alveolar echinococcosis. J Nucl Med, 2013,54(3):358-363.
[3] Porot C, Knapp J, Wang J, et al. Development of a specific tracer for metabolic imaging of alveolar echinococcosis: A preclinical study. Conf Proc IEEE Eng Med Biol Soc, 2014,2014:5587-5590.
[4] Wang W, Chen LD, Lu MD, et al. Contrast-enhanced ultrasound features of histologically proven focal nodular hyperplasia: Diagnostic performance compared with contrast-enhanced CT. Eur Radiol, 2013,23(9):2546-2554.
[5] Qu P, Yu X, Liang P, et al. Contrast-enhanced ultrasound in the characterization of hepatocellular carcinomas treated by ablation: Comparison with contrast-enhanced magnetic resonance imaging. Ultrasound Med Biol, 2013,39(9):1571-1579.
[6] Westwood M, Joore M, Grutters J, et al. Contrast-enhanced ultrasound using SonoVue©(sulphur hexafluoride microbubbles) compared with contrast-enhanced computed tomography and contrast-enhanced magnetic resonance imaging for the characterisation of focal liver lesions and detection of liver metastases: A systematic review and cost-effectiveness analysis. Health Technol Assess, 2013,17(16):1-243.
[7] 董甜甜,聂芳,魏佳琪,等.实时超声造影诊断肝泡状棘球蚴病.中国医学影像技术,2015,31(6):872-875.
[8] 李舍,樊海宁,马淑梅,等.不同类型肝泡型包虫病的病灶边缘区CEUS参数分析.中国医学影像技术,2017,33(4):550-553.
[9] Zeng H, Wang J, Xie W, et al. Assessment of early hepatic echinococcus multilocularis Infection in rats with real-time contrast-enhanced ultrasonography. Ultrasound Med Biol, 2012,38(11):1982-1988.
[10] 曾红春,王静,刘文亚,等.大鼠肝泡状棘球蚴病模型早期超声造影表现与病理对照分析.新疆医科大学学报,2015,38(3):310-313.
[11] 曾红春,郭莉,肖虎,等.MRI-DWI在早期大鼠肝泡状棘球蚴病模型中的应用价值.新疆医科大学学报,2015,38(10):1203-1206,1212.
[12] 姚冰,王海涛,刘文亚,等.肝泡状棘球蚴边缘区域CT灌注成像与组织病理对照研究.中国医学计算机成像杂志,2010,16(3):215-220.
[13] 王静,蒋奕,刘文亚,等.能谱CT碘图与18F-FDG PET评价肝泡球蚴病生物活性的对比研究.中国医学计算机成像杂志,2015,21(4):375-378.
[14] Crouzet J, Grenouillet F, Delabrousse E, et al. Personalized management of patients with inoperable alveolar echinococcosis undergoing treatment with albendazole: Usefulness of positron-emission-tomography combined with serological and computed tomography follow-up. Clin Microbiol Infect, 2010, 16(6):788-791.
[15] 曾红春,王颖鑫,王俊华,等.大鼠感染肝泡状棘球蚴不同时期超声动态演变与病理对照研究.中国医学影像学杂志,2016,24(5):325-328.
CEUSindynamiclyassessingbloodperfusionofhepaticalveolarechinococcosisinrats
ZENGHongchun1,WANGYingxin1,WANGJunhua2,HANWei1,LIUWenya3*
(1.DepartmentofUltrasonography, 2.XinjiangKeyLaboratoryofBasedMedicineandHydatid, 3.ImagingCenter,theFirstAffiliatedHospitalofXinjiangMedicalUniversity,Urumqi830011,China)
ObjectiveTo evaluate the value of CEUS in dynamicly assessing the blood perfusion of hepatic alveolar echinococcosis (HAE) in rats.MethodsThe experimentally induced secondary HAE in totally 70 rats were studied at different time periods (9th week, 28th week, and 50th week) with CEUS, and compared to pathology results.ResultsAt the 9th week, 55 HAE lesions (55/70, 78.57%) presented hyperechoic and the rest of 15 HAE lesions (15/70, 21.43%) presented mixed echogenicity. The single or multiple vesicular structures were found as pathological feature. At later stages (28th week and 50th week), the size of lesions increased compared to 9th week with more solid structures and the calcifications found in HAE lesions. Microscopically, the fibrous tissues surrounding the lesions gradually thickened and the microvascular accumulation were visible around the lesions. The HAE lesions at the 9th week showed the ring enhancement and central septa enhancement in CEUS. The HAE lesions at the 28th week and 50th week showed combinations of no enhancement, ring enhancement, and central septa enhancement in CEUS. The ratio of edge enhancement to maximum diameter of lesions decreased with the progression (P=0.02).ConclusionThe ultrasonographic features in HAE lesions become more complicated with increasing calcifications and enlarged necrosis areas with the progression. The CEUS can reveal the dynamics of blood perfusion of HAE lesions at different stages.
Alveolar echinococcosis; Liver; Ultrasonography
国家自然科学基金(81460267)。
曾红春(1977—),女,山东菏泽人,博士,主任医师、副教授。研究方向:腹部及浅表器官的超声诊断。
E-mail: zenghongchun1168@126.com
刘文亚,新疆医科大学第一附属医院影像中心,830011。E-mail: dr_ykdxlwy@163.com
2017-03-17 [
] 2017-07-09
10.13929/j.1672-8475.201703026
R383.3; R445.1
A
1672-8475(2017)09-0566-05
