烟粉虱MED隐种气味结合蛋白基因BtabOBP2和BtabOBP4的cDNA克隆及原核表达
2017-09-16谢红艳万鲁长黄春燕刘国霞JeanFranoisPicimbon宫志远
谢红艳,万鲁长,黄春燕,刘国霞,Jean-François Picimbon,宫志远*
(1. 山东省农业科学院农业资源与环境研究所,农业部废弃物基质化利用重点实验室,山东省农业面源污染防控重点实验室,济南 250100;2.山东省农业科学院生物技术研究中心,济南 250100)
烟粉虱MED隐种气味结合蛋白基因BtabOBP2和BtabOBP4的cDNA克隆及原核表达
谢红艳1,万鲁长1,黄春燕1,刘国霞2,Jean-François Picimbon2,宫志远1*
(1. 山东省农业科学院农业资源与环境研究所,农业部废弃物基质化利用重点实验室,山东省农业面源污染防控重点实验室,济南 250100;2.山东省农业科学院生物技术研究中心,济南 250100)
采用RT-PCR和RACE技术成功克隆烟粉虱Bemisiatabaci(Gennadius)气味结合蛋白(odorant binding protein, OBP)基因BtabOBP2和BtabOBP4的cDNA全长。BtabOBP2(GenBank 登录号:AIS71883)和BtabOBP4(GenBank 登录号:AIS71884)的cDNA序列全长分别为1107 bp和874 bp,完整开放阅读框(ORF)分别为744 bp和429 bp,分别编码247和142氨基酸,BtabOBP4有6个保守的半胱氨酸,属于典型OBP,而BtabOBP2除了具有典型OBP的6个半胱氨酸,增加了3个保守的半胱氨酸,属于Plus-C OBP。将得到的BtabOBP2和BtabOBP4重组到原核表达载体pET30a(+),转化入BL21(DE3)大肠杆菌感受态细胞,用IPTG诱导融合蛋白表达。采用亲和层析和凝胶过滤层析纯化融合蛋白,并进行Western blot 分析。结果显示,BtabOBP2和BtabOBP4融合蛋白在大肠杆菌中均有可溶性表达,Western blot 结果证实所表达的融合蛋白确实为目的蛋白。BtabOBP2融合蛋白在SDS-PAGE中的表观分子量比预测的分子量大了6.53 kDa,用重组肠激酶切掉6×His标签后,目的蛋白的表观分子量与预测分子量相近,偏差降低,说明6×His标签是造成融合蛋白表观分子量偏差的原因。本研究明确了烟粉虱气味结合蛋白基因BtabOBP2和BtabOBP4的核苷酸、氨基酸序列特征,并成功进行了原核表达和纯化,为进一步研究这两个OBP基因的分子结构和功能奠定了基础。
烟粉虱;气味结合蛋白;基因克隆;原核表达;纯化
昆虫灵敏的嗅觉是其生存与繁衍的关键,在昆虫觅食、寻找配偶、交配、产卵、躲避捕食者等行为中发挥重要作用(Larssonetal., 2004)。昆虫对化学信号的感受主要通过嗅觉感受器内的可溶性蛋白结合并运输外界疏水性的气味分子通过淋巴液到达嗅觉神经树突膜上的嗅觉受体,将化学信号转化为神经电信号并传向中枢神经系统,引起昆虫的行为反应。参与昆虫嗅觉识别的相关功能蛋白包括气味结合蛋白(odorant binding proteins, OBPs)、化学感受蛋白(chemosensory proteins, CSPs)、嗅觉受体(olfactory receptors, ORs)、气味降解酶(odorant degrading enzymes, ODEs)和感觉神经元膜蛋白(sensory neuron membrane proteins, SNMPs)等(Vogtetal., 1985, 2009; Wanneretal., 2004),其中气味结合蛋白是昆虫专一性识别外界气味物质的关键作用因素(Vogt and Riddiford, 1981)。昆虫OBPs是一类水溶性小分子量酸性蛋白,其典型特征是在二级序列中存在6个保守的半胱氨酸,分别交叉形成3个二硫键以对蛋白的三维结构起支撑作用(Pelosietal., 2006)。昆虫中第一个OBP是1981年在多音天蚕Antheraeapolyphemus触角中被发现,此后多种OBPs在双翅目、膜翅目、直翅目、同翅目等昆虫中陆续被鉴定(Pelosi and Maida, 1995; Zhangetal., 2009; Zhouetal., 2010)。
烟粉虱Bemisiatabaci(Gennadius)属于半翅目Hemiptera粉虱科Aleyrodidae,是一种世界性重要农业害虫,其寄主范围广,通过直接刺吸植物汁液、分泌蜜露诱发霉污病、传播植物病毒等方式危害植物(Jones, 2003; De Barroetal., 2011)。烟粉虱是一个至少由36个隐种组成的物种复合体(Huetal., 2011;刘银泉和刘树生,2012),其中MED (Mediterranean)隐种(同“Q型烟粉虱”)和MEAM1 (Middle East-Asia Minor 1)隐种(同“B型烟粉虱”)入侵性最强、危害最大,MED隐种在中国大部分地区已经取代MEAM1隐种成为优势种(Panetal., 2011; Leeetal., 2013)。烟粉虱主要依靠化学防治,使其已对多种化学杀虫药剂产生了不同程度的抗药性,而且大量使用化学药剂还加剧了环境污染和对非靶标生物的杀伤作用,急需开发更为有效的无公害防治技术。通过干扰靶标昆虫的嗅觉识别来对其进行有效控制的技术在许多害虫的防治中已经得到应用(Lealetal., 2003; Sunetal., 2011)。烟粉虱对不同寄主植物上的取食和产卵有明显的选择性(林克剑等,2008;张永军等,2003),这种寄主选择性与不同寄主植物挥发物质差异密切相关。研究表明,1,8-桉树脑对烟粉虱MEAM1隐种有显著吸引作用(曹凤琴等,2008),野生番茄中的姜烯、姜黄烯、p-伞化烃和α-松油烯对烟粉虱MED隐种有趋避行为(Bleekeretal., 2009)。气味结合蛋白OBPs在烟粉虱对寄主植物挥发性物质的识别结合过程中具有重要作用,是设计嗅觉引诱剂的良好靶标。目前,烟粉虱OBPs相关的报道较少。王然等(2016)克隆了烟粉虱MED隐种的气味结合蛋白基因OBP8,原核表达重组蛋白,并分析了其与植物挥发物的结合特性。张岚(2011)从转录组数据中预测了烟粉虱的4条OBPs序列,多为序列片段,且未做试验验证。本研究根据已报道的烟粉虱OBP基因序列片段信息设计引物,采用RT-PCR和RACE技术对烟粉虱OBP2和OBP4基因的cDNA全长序列进行了克隆和分析,并构建表达载体,进行了原核表达和蛋白纯化,为进一步研究OBPs的结构和生理功能奠定基础。
1 材料与方法
1.1 供试昆虫
烟粉虱最初从山东寿光和济南田间的茄子上采集,基于线粒体细胞色素氧化酶I基因(mitochondrial cytochrome oxidase I,mtCOI)鉴定生物型后(Chuetal., 2011),在人工气候箱内以棉花GossypiumhirsutumL.(品种:鲁棉研21)为寄主进行饲养。饲养条件:温度26℃,相对湿度60%-80%,光周期16L ∶8D。
1.2 主要试剂
SMARTer RACE cDNA Amplification Kit购自Clontech公司;RevertAid First Strand cDNA Synthesis Kit、预染蛋白Marker 10-170 kDa(26616)购自Fermentas公司;pEASY-T1 Cloning Kit、Trans1-T1感受态细胞均购自北京全式金生物技术有限公司;LA Taq DNA聚合酶、T4 DNA ligase、限制性内切酶BamHI 和XhoI、Trizol、DL2000 DNA Marker、Kanamycin、X-Gal、IPTG等均购自Takara公司;所用引物由Invitrogen公司合成;表达载体pET30a(+)为本实验室保存。DNA胶回收试剂盒、HRP-DAB底物显色试剂盒购自北京天根生物科技有限公司;Pierce BCA 蛋白定量分析试剂盒购自Thermo公司。
1.3 烟粉虱OBPs基因的克隆
取60头烟粉虱MED隐种成虫,用Trizol法提取总RNA,并用DNaseⅠ除去残留的基因组DNA,经Eppendorf核酸蛋白测定仪检测RNA的质量和浓度,使用RevertAid First Strand cDNA Synthesis Kit合成cDNA第一链。同时按照SMARTer RACE cDNA Amplification Kit 操作手册,合成3′和5′ RACE-ready cDNA 第一链。根据GenBank中的烟粉虱OBP基因序列片段(登录号分别为:JN088199和JN088200)设计并合成引物(表1)。
3′和5′ RACE PCR 反应条件均为:94℃变性3 min,接着进行35个循环,循环条件为94℃ 30 s,65℃ 30 s,72℃ 1 min,最后72℃延伸10 min。扩增产物用1.2%琼脂糖凝胶电泳检测,用DNA凝胶回收试剂盒回收纯化,测定浓度。纯化后的片段与pEasy T1载体连接,再转化到Trans1-T1大肠杆菌感受态细胞中,然后涂布在含有Kanamycine/X-gal/IPTG的LB平板上,37℃培养16 h。挑取白色单菌落进行PCR验证。挑选阳性克隆送往山东省农业科学院生物技术研究中心进行测序。序列测定采用测序仪ABIPRISMTM3730XL Sequencer(Perkin Elmer)进行,反应试剂为BigDye 3.1 Terminator Cycle Sequencing Ready Reaction Kit(Perkin Elmer)。将RACE获得的序列进行拼接,得到目的基因的全长cDNA序列,用在线ORF Finder software(http://www.ncbi.nlm. nih.gov/gorf/gorf.html)分析开放阅读框,设计特异性引物(表1)验证基因。
1.4 序列分析
利用在线Expasy对序列进行翻译(http://web.expasy.org/translate/),并预测蛋白质的分子量、等电点等理化性质(http://web.expasy.org/protparam/)。运用在线工具SignalP 4.1 (http://www.cbs.dtu.dk/services/SignalP/)预测其信号肽,通过NCBI中的BLAST进行氨基酸序列的同源搜索和比对。用DNAMAN软件进行序列比对,采用MEGA 5.0通过Neighbor-Joining法构建系统发育树。
1.5 原核表达
根据烟粉虱BtabOBP2和BtabOBP4成熟肽(不含信号肽)的编码序列设计一对特异性引物(表1),为了便于将目的基因克隆到表达载体上,上游引物引入BamHI(GGATCC)酶切位点,下游引物引入Xho I(CTCGAG)酶切位点。以反转录合成的cDNA为模板,PCR 反应条件: 94℃预变性3 min; 94℃变性30 s, 61℃退火30 s, 72℃延伸1 min, 35 个循环; 最后72℃延伸10 min。扩增产物经1.2%琼脂糖凝胶电泳检测。目的片段回收、纯化后,连接到pEASY-T1 载体,再转化Trans1-T1感受态细胞,菌落PCR和双酶切鉴定阳性克隆,将正确的菌液测序,测序正确后提取质粒。将重组质粒经BamHI,XhoI双酶切后,回收目的片段,与经同样双酶切的原核表达载体pET30a(+)相连接,转化大肠杆菌BL21(DE3)感受态细胞,挑取酶切和测序鉴定正确的单克隆于5 mL LB中(含50 μg/mL Kanamycine)37℃培养过夜,次日以1 ∶100的比例转接到新鲜的LB液体培养基中,继续培养至OD600=0.6,加入不同终浓度的IPTG(0.5,1.0,1.5,2.0 mmol/L),诱导温度37℃,转速180 r/min,加入IPTG时作为取样的0时间点,分别在诱导的2和5 h取样。8000 r/min离心10 min收集菌体,用15% SDS-PAGE电泳分析目的蛋白的表达情况。
为检查融合蛋白的可溶性,向诱导后收集的大肠杆菌菌体中加裂解液(50 mmol/L NaH2PO4,300 mmol/L NaCl,10 mmol/L 咪唑, pH 8.0),于冰上超声破碎后,12000 r/min离心10 min收集上清和沉淀,进行SDS-PAGE检测。

表 1 试验中所用引物Table 1 Primers used in this study
注:下划线表示酶切位点。Note: The restriction site is underlined.
1.6 融合蛋白纯化
以优化的诱导条件大量诱导表达,离心收集菌体,加裂解液超声破碎,12000 r/min离心10 min,将含融合蛋白的上清液泵入Ni-NTA亲和柱,用含不同浓度咪唑(20,25,30,100,250和500 mmol/L)的洗脱缓冲液进行梯度洗脱,分部收集。SDS-PAGE电泳检测收集的蛋白样品,将含目的蛋白的组分合并,用3 kDa的超滤管(Millipore)浓缩后,用AKTA purifier UPC-900(GE 公司)进行凝胶过滤层析(层析柱为Superdex 75 10/300 GL),进一步去除杂蛋白,并将含咪唑的洗脱缓冲液置换成50 mmol/L Tris-HCl(pH 8.0)。SDS-PAGE电泳检测分部收集的蛋白样品,将含融合蛋白的组分合并,超滤浓缩。用Pierce BCA 蛋白定量分析试剂盒测定蛋白浓度,按比例加入重组肠激酶,切除融合蛋白位于氨基末端的6×His标签,酶切后的蛋白再次过亲和层析柱。纯化后的目的蛋白经超滤浓缩,测定浓度后,-70℃保存,备用。
1.7 Western Blot 鉴定
融合蛋白经15% SDS-PAGE电泳进行分离,然后经半干式转膜仪将蛋白从胶转印至硝酸纤维素膜上。用封闭液(TBST+5%脱脂奶粉)封闭过夜,TBST洗膜后,加入鼠anti-His 单克隆抗体(用含有0.5%脱脂奶粉的TBST溶液按1 ∶1200的比例稀释),室温反应2 h,用TBST洗膜3次,每次10 min。然后加入TBST(含0.5%脱脂奶粉)稀释的羊抗鼠IgG-HRP(1 ∶3000),室温反应2 h,用TBST再洗膜3次,每次10 min。用HRP-DAB底物显色试剂盒鉴定表达产物。
2 结果与分析
2.1 烟粉虱BtabOBP2和BtabOBP4基因的cDNA克隆与序列分析
本研究设计特异性引物采用RACE技术,获得了烟粉虱2个OBP基因的全长cDNA序列,分别命名为BtabOBP2和BtabOBP4,并提交至GenBank数据库,登录号分别为AIS71883和AIS71884。BtabOBP2和BtabOBP4的cDNA全长分别为1107 bp和874 bp,5′端分别有111 bp和81 bp的非编码区,3′端有252 bp和364 bp的非编码区,且都有poly A尾。完整开放阅读框长度分别为744 bp和429 bp,编码247个氨基酸和 142个氨基酸。由在线软件SignalP 预测,2个OBP基因的N末端分别有22个氨基酸和19个氨基酸长度的信号肽(图1),BtabOBP2和BtabOBP4成熟蛋白的理论分子量分别为25.03 kDa和13.79 kDa,预测的等电点分别为8.21和8.72。利用DNAMAN软件对BtabOBPs和其它昆虫同源序列进行氨基酸序列比对(图2),结果显示, BtabOBP4氨基酸序列中有6个保守的半胱氨酸残基,属于典型OBP。BtabOBP2与BtabOBP4同源性很低(8.50%),BtabOBP2氨基酸序列中有14个半胱氨酸残基,其中9个是保守的,除了具有典型OBP的6个保守的半胱氨酸,增加了3个半胱氨酸,属于Plus-C OBP。用MEGA 5.0 通过Neighbor-Joining法构建烟粉虱OBPs与其它昆虫OBPs系统进化树(图3),bootstrap值为1000。从进化树上可以看出,BtabOBP2和BtabOBP4分别在两个大的分支上,但都与同翅目稻飞虱OBPs的进化关系较近。
A

B

图1 烟粉虱BtabOBP2 (A)和BtabOBP4 (B)的核苷酸及氨基酸序列
注:下划线部分为信号肽,方框为保守的半胱氨酸。Note: Underlined is signal peptide, and square frame is conserved cysteines.

图2 烟粉虱BtabOBP2和BtabOBP4与其它昆虫OBPs氨基酸序列比对Fig.2 Amino acid sequence alignment of BtabOBP2 and BtabOBP4 from Bemisia tabaci with OBPs from other insects注:蓝色阴影表示50%以上同源性,黑色阴影表示100%同源性,OBPs来源及GenBank登录号如下。Note: The blue shadow indicates > 50% identity, black shadow indicates 100% identity. The origin of OBPs and their GenBank accession numbers were as follows: BtabOBPs, 烟粉虱 Bemisia tabaci (BtabOBP2: AIS71883; BtabOBP4: AIS71884); ApisOBPs, 豌豆蚜 Acyrthosiphon pisum (ApisOBP6: NP_001153532.1; ApisOBP8: NP_001153534.1); AlinOBPs, 苜蓿盲蝽 Adelphocoris lineolatus (AlinOBP7: ACZ58085.1; AlinOBP12: ACZ58083.1); AalbOBP4, 白纹伊蚊 Aedes albopictus (AFC60566.1); AgosOBPs, 棉蚜 Aphis gossypii (AgosOBP6: AGE97636.1; AgosOBP8: AGE97638.1); AlucOBPs, 绿盲蝽 Apolygus lucorum (AlucOBP1: ADD84665.1; AlucOBP5: AEA07663.1; AlucOBP6: AEA07664.1); CquiOBP, 致倦库蚊 Culex quinquefasciatus (XP_001843376.1); DcitOBP, 柑橘木虱 Diaphorina citri (ABG81983.1); DmojOBP, 果蝇 Drosophila mojavensis (XP_001998267.1); LstrOBP3, 灰飞虱 Laodelphax striatella (AEQ19909.1); LlinOBP21, 美国牧草盲蝽 Lygus lineolaris (AHF71051.1); MperOBP, 桃蚜 Myzus persicae (ACI30682.1); NlugOBP1, 褐飞虱 Nilaparvata lugens (ACI30679.1); RproOBP6, 长红锥蝽 Rhodnius prolixus (CAX63265.1); SaveOBP8, 麦长管蚜 Sitobion avenae (ACX32010.2); SfurOBP7, 白背飞虱 Sogatella furcifera (AHB59659.1); TcasOBP, 赤拟谷盗 Tribolium castaneum (XP_972220.1).
2.2 烟粉虱BtabOBP2和BtabOBP4重组蛋白的表达、纯化和鉴定
SDS-PAGE电泳结果显示,BtabOBP4融合蛋白在19 kDa左右有特异性蛋白条带,和预期的一致。BtabOBP2融合蛋白在37 kDa左右有特异性蛋白条带,比预期的30.47 kDa的分子量大6.53 kDa,偏差达21%。未插入目的基因的空质粒和未经IPTG诱导的pET30a-BtabOBP2和pET30a-BtabOBP4转BL21(DE3)的菌液在相应的位置都没有产生特异性条带(图4)。BtabOBP2和BtabOBP4融合蛋白在上清和包涵体中都有表达(图4),且在上清中表达量较高。
用Ni-NTA亲和层析柱纯化上清中的融合蛋白,再用凝胶过滤层析柱进一步纯化、脱盐后,超滤管浓缩。以鼠anti-His单克隆抗体为一抗,以辣根过氧化物酶标记的羊抗鼠IgG为二抗进行Western blot 分析,BtabOBP2和 BtabOBP4融合蛋白在相应的位置都有单一非弥散性免疫反应带(图4-B),表明所表达的融合蛋白确实为目的蛋白。为验证BtabOBP2融合蛋白在SDS-PAGE中的表观分子量偏大与6×His标签有关,用重组牛肠激酶切去6×His标签,再进行SDS-PAGE电泳检测,结果切掉His标签的BtabOBP2在SDS-PAGE中的表观分子量为24 kDa左右,比推导的理论分子量25.68 kDa小了1.68 kD,偏差降低至6.5%(图4-A,泳道7)。
2.3 诱导表达条件的筛选
为使BtabOBP2和BtabOBP4大量可溶性表达,我们对融合蛋白诱导表达的条件进行了筛选,发现IPTG浓度对目的蛋白的诱导表达影响不大。BtabOBP4在37℃下诱导5 h的表达量略少于诱导2 h的表达量,而诱导时间对BtabOBP2的表达影响不明显。筛选出的最佳诱导条件为:温度为37℃,诱导时间为2 h,诱导转速为180 rpm,IPTG浓度:BtabOBP2为2 mmol/L,BtabOBP4为1 mmol/L。
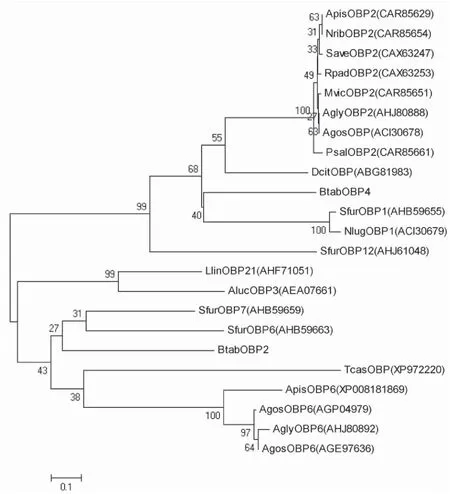
图3 烟粉虱BtabOBP2和BtabOBP4与其它昆虫气味结合蛋白的系统发育树Fig.3 Phylogenetic tree of BtabOBP2 and BtabOBP4 of Bemisia tabaci and OBPs from other different insect species注:OBPs来源。Note: Origin species of OBPs: NribOBP2, 莴苣衲长管蚜 Nasonovia ribisnigri; RpadOBP2, 禾谷缢管蚜 Rhopalosiphum padi; MvicOBP2, 巢菜修尾蚜 Megoura viciae; AglyOBP2和AglyOBP6, 大豆蚜 Aphis glycines; PsalOBP2, 柳粉毛蚜 Pterocomma salicis;其它同图2,others same to Fig.2。

图4 pET30a-BtabOBP2和pET30a-BtabOBP4融合蛋白的诱导表达、纯化(A)及其Western blot(B)Fig.4 Expression, purification (A)and Western blot (B)of the recombinant proteins pET30a-BtabOBP2 and pET30a-BtabOBP4注:A: M, 蛋白标准分子量; 1, 空载体经诱导的BL21(DE3)菌体; 2-8, 分别为未经IPTG诱导的pET30a-BtabOBP2和pET30a-BtabOBP4的菌体; 3-9, 分别为经IPTG诱导的pET30a-BtabOBP2和pET30a-BtabOBP4的菌体; 4-10, 分别为纯化后的pET30a-BtabOBP2和pET30a-BtabOBP4; 5-11, 分别为pET30a-BtabOBP2和pET30a-BtabOBP4经超声破碎后的上清; 6-12, 分别为pET30a-BtabOBP2和pET30a-BtabOBP4经超声破碎后的沉淀; 7, 肠激酶切掉6×His标签后的pET30a-BtabOBP2; B:1-2, 分别为带6×His标签的pET30a-BtabOBP2和pET30a-BtabOBP4的Western印记杂交。Note: A: M, Protein molecular weight marker; 1, Induced BL21(DE3)bacteria within pET30a(+)vector; 2-8, Expressed product of pET30a-BtabOBP2 and pET30a-BtabOBP4 without IPTG induction, respectively; 3-9, Expressed product of pET30a-BtabOBP2 and pET30a-BtabOBP4 with IPTG induction; 4-10, Purified pET30a-BtabOBP2 and pET30a-BtabOBP4 protein; 5-11, Supernatant of pET30a-BtabOBP2 and pET30a-BtabOBP4 after sonication; 6-12, Pellet of pET30a-BtabOBP2 and pET30a-BtabOBP4 after sonication; 7, pET30a-BtabOBP2 with 6×His tag excised by enterokinase. B: 1-2, 6×His Western blot of pET30a-BtabOBP2 and pET30a-BtabOBP4.
3 结论与讨论
昆虫中OBPs按照保守半胱氨酸的数量和位置分为5种类型:典型OBP、Plus-C OBP、Dimer OBP、Minus-C OBP及非典型OBP。目前已有属于8个目的40种昆虫的OBP得到了分离和克隆(Pelosietal., 2006)。本研究利用RACE技术,成功获得了烟粉虱气味结合蛋白BtabOBP2和BtabOBP4的cDNA全长,其中BtabOBP4有6个保守的的半胱氨酸,符合C1-X15-39-C2-X3-C3-X21-44-C4-X7-12-C5-X8-C6的结构特点(X代表每个半胱氨酸之间间隔的氨基酸残基数),并且第2个和第3个半胱氨酸之间有3个氨基酸,第5个和第6个半胱氨酸之间有8个氨基酸, BtabOBP4属于典型OBP。BtabOBP2氨基酸序列中有14个半胱氨酸残基,与其它昆虫同源序列的氨基酸序列比对结果显示,其中9个是保守的,除了具有典型OBP的6个半胱氨酸C1-C6,增加了3个半胱氨酸,在C4和C5之间增加了C4a,在C6后面紧挨着一个脯氨酸P,后面有两个半胱氨酸C6a和C6b,在C5和C6之间仍然有8个氨基酸,C4a和C5之间有9个氨基酸,BtabOBP2属于Plus-C OBP。大多数昆虫目之间的 OBPs 氨基酸序列同源性很低,甚至在昆虫属之间的同源性低于20% (Zhouetal., 2010)。黑腹果蝇Drosophilamelanogaster中有51个OBP基因,其中39个典型OBP的氨基酸序列同源性仅为10%-15% (Graham and Davies, 2002)。本研究中,BtabOBP2与BtabOBP4的同源性非常低,为8.50%。
重组蛋白异源表达,获得与天然OBPs一致的活性重组OBPs,进行体外的配体结合实验是目前普遍用于研究OBPs功能的方法。本研究构建表达载体, 对BtabOBP2和BtabOBP4进行了原核表达。本研究在37℃下对IPTG浓度和诱导时间进行了诱导表达条件的筛选和优化。发现BtabOBP2和BtabOBP4都有可溶性表达,IPTG终浓度对蛋白表达量影响较少,BtabOBP4随着诱导时间的延长,蛋白表达量越少,可能与表达过程中对宿主细胞产生毒性作用有关(Vassilevskietal., 2008)。
本研究中,原核表达的BtabOBP4融合蛋白在SDS-PAGE中的表观分子量为19 kDa左右,与计算出的理论分子量19.23 kDa相符。而BtabOBP2融合蛋白在SDS-PAGE中的表观分子量为37 kDa左右,与软件推导的理论分子量30.47 kDa相差6.53 kDa,偏差达21%,这可能是由于6×His标签造成的偏差(唐威华等,2000)。许多研究者发现His-tag融合蛋白在SDS-PAGE中表现出的分子量大于其应有的分子量(Harwood, 1994; Niu and Guiltinan, 1994; DeMaria and Brewer, 1996; Kim and Chung, 1997)。唐威华等(2000)研究一个水稻蛋白P73与His-tag融合表达时(P73-His),发现该融合蛋白在SDS-PAGE中的表观分子量约为33 kDa,与计算出的理论分子量19.1 kDa相差很大。然后对其进行C末端氨基酸顺序测定、电喷雾质谱分析,结果证实其实际分子量与理论值一致。P73-His融合蛋白经酶切去除包括His-tag在内的载体蛋白后,其在SDS-PAGE中表观分子量的偏差大大降低,证实His-tag是造成P73-His融合蛋白表观分子量偏大的原因之一,推测可能是由于组氨酸是碱性氨基酸,带有正电荷,而His-tag中含有连续6个组氨酸,带有较强的正电荷,降低了蛋白在SDS-PAGE中的泳动速率,导致了表观分子量的变大。本研究中,与pET30a(+)空载体和诱导前相比,BtabOBP2融合蛋白在37 kDa处有明显较粗的条带,且Western blot 分析表明该位置的带确实是融合His-tag的目的蛋白。用肠激酶切除His-tag后,BtabOBP2蛋白在SDS-PAGE中的表观分子量为24 kDa左右,与推导的理论分子量相差1.68 kDa,偏差由21%降低至6.5%。因此BtabOBP2融合蛋白在SDS-PAGE中的表观分子量偏差是His-tag造成的。而SDS-PAGE中表观分子量偏差的原因除了His-tag作用之外,还与蛋白本身有关(唐威华等,2000),BtabOBP4与BtabOBP2属于不同类型的OBPs,BtabOBP4融合蛋白在SDS-PAGE中的表观分子量与推导的理论分子量相符。本研究对烟粉虱BtabOBP2和BtabOBP4基因的克隆和原核表达,为其结构和功能研究奠定了基础,对了解烟粉虱的嗅觉机制具有重要意义。
References)
Bleeker PM, Diergaarde PJ, Ament K,etal. The role of specific tomato volatiles in tomato-whitefly interaction [J].PlantPhysiology, 2009, 151 (2): 925-935.
Cao FQ, Liu WX, Fan ZN,etal. Behavioural responses ofBemisiatabaciB-biotype to three host plants and their volatiles [J].ActaEntomologicaSinica, 2008, 51 (8): 830-838. [曹凤勤,刘万学,范中南,等. B型烟粉虱对三种寄主植物及其挥发物的行为反应[J]. 昆虫学报, 2008, 51 (8): 830-838]
Chu D, Gao CS, De Barro P,etal. Investigation of the genetic diversity of an invasive whitefly in China using both mitochondrial and nuclear DNA markers [J].BulletinofEntomologicalResearch, 2011, 101 (4): 467-475.
De Barro PJ, Liu SS, Boykin LM,etal.Bemisiatabaci: A statement of species status [J].AnnualReviewofEntomology, 2011, 56 (1): 1-19.
DeMaria CT, Brewer G. AUF1 binding affinity to AU-rich elements correlates with rapid mRNA degradation [J].JournalofBiologyChemical, 1996, 271 (21): 12179-12184.
Graham LA, Davies PL. The odorant-binding proteins ofDrosophilamelanogaster: Annotation and characterization of a divergent gene family [J].Gene, 2002, 292 (1-2): 43-55.
Harwood A. Methods in Molecular Biology[M]. Vol. 58. Totowa: NJ Humana Press. 1994, 491-510.
Jones DR. Plant viruses transmitted by whiteflies [J].EuropeanJournalofPlantPathology, 2003, 109 (3): 195-219.
Hu J, De Barro P, Zhao H,etal. An extensive field survey combined with a phylogenetic analysis reveals rapid and widespread invasion of two alien whiteflies in China [J].PLoSONE, 2011, 6 (1): e16061.
Kim SY, Chung HJ, Thomas TL. Isolation of a novel class of bZIP transcription factors that interact with ABA-responsive and embryo-specification elements in the Dc3 promoter using a modified yeast one-hybrid system [J].ThePlantJournal, 1997, 11 (6): 1237-1251.
Larsson MC, Domingos AI, Jones WD,etal.Or83bencodes a broadly expressed odorant receptor essential forDrosophilaolfaction [J].Neuron, 2004, 43(5): 703-714.
Leal WS, Barbosa RMR, Xu W,etal. Reverse and conventional chemical ecology approaches for the development of oviposition attractants forCulexmosquitoes [J].PLoSONE, 2003, 3 (8): e3045.
Lee W,Park J, Lee GS,etal. Taxonomic status of theBemisiatabacicomplex(Hemiptera: Aleyrodidae)and reassessment of the number of its constituent species [J].PLoSONE, 2013, 8 (5): e63817.
Lin KJ, Wu KM, Zhang YJ,etal. The feeding and oviposition behaviors ofBemisiatabaci(Gennadius)biotype B on five host plants [J].ActaPhytophylacicaSinica, 2008, 35 (3): 199-204. [林克剑,吴孔明,张永军,等. B型烟粉虱成虫对五种寄主植物的取食和产卵行为[J]. 植物保护学报, 2008, 35 (3): 199-204]
Liu YQ, Liu SS. Species status ofBemisiatabacicomplex and their distributions in China [J].JournalofBiosafety, 2012, 21 (4): 247-255. [刘银泉, 刘树生. 烟粉虱的分类地位及在中国的分布[J]. 生物安全学报, 2012, 21 (4): 247-255]
Niu XP, Guiltinan MJ. DNA binding specificity of the wheat bZIP protein EmBP-1[J].NucleicAcidsResearch, 1994, 22 (23): 4969-4978.
Pan HP, Chu D, Ge DQ,etal. Further spread of and domination byBemisiatabaci(Hemiptera: Aleyrodidae)biotype Q on field crops in China [J].JournalofEconomicEntomology, 2011, 104 (3): 978-985.
Pelosi P, Maida R. Odorant-binding proteins in insects[J].ComparativeBiochemistryandPhysiology, 1995, 111B (3): 503-514.
Pelosi P, Zhou JJ, Ban LP,etal. Soluble proteins in insect chemical communication [J].CellularandMolecularLifeSciences, 2006, 63 (14): 1658-1676.
Sun YF, Qiao HL, Ling Y,etal. New analogues of (E)-β-farnesene with insecticidal activity and binding affinity to aphid odorant-binding proteins [J].JournalofAgriculturalandFoodChemistry, 2011, 59 (6): 2456-2461.
Tang WH, Zhang JL, Wang ZY,etal. The cause of deviation made in determining the molecular weight of His-tag fusion proteins by SDS-PAGE [J].ActaPhytophysiologicaSinica, 2000, 26(1): 64-68. [唐威华,张景六,王宗阳,等. SDS-PAGE 法测定His-tag 重组蛋白分子量产生偏差的原因[J]. 植物病理学报, 2000, 26 (1): 64-68]
Vassilevski AA, Kozlov SA, Grishin EV. Antimicrobial peptide precursor structures suggest effective production strategies[J].RecentPatentsonInflammation&AllergyDrugDiscovery, 2008, 2 (1): 58-63.
Vogt RG, Miller NE, Litvack R,etal. The insect SNMP gene family [J].InsectBiochemistryandMolecularBiology, 2009, 39 (7): 448-456.
Vogt RG, Riddiford LM. Pheromone binding and inactivation by moth antennae[J].Nature, 1981, 293 (5827): 161-163.
Vogt RG, Riddiford LM, Prestwich GD. Kinetic properties of a sex pheromone-degrading enzyme: The sensillar esterase ofAntheraeapolyphemus[J].ProceedingsoftheNationalAcademyofSciencesoftheUnitedStatesofAmerica, 1985, 82 (24): 8827-8831.
Wang R, Zhang XM, Li FQ,etal. Cloning and prokaryotic expression of odorant binding protein OBP8 in MED cryptic speciesBemisiatabaciand the binding characteristics with plant volatiles [J].JournalofPlantProtection, 2016, 43 (1): 32-39. [王然, 张晓曼, 李峰奇, 等. 烟粉虱MED隐种气味结合蛋白OBP8 的克隆、原核表达及与植物挥发物的结合特性[J]. 植物保护学报, 2016, 43 (1): 32-39]
Wanner KW, Willis LG, Theilmann DAetal. Analysis of the insect OS-D-Like gene family [J].JournalofChemicalEcology, 2004, 30 (5): 889-911.
Zhang L. Gene Prediction and Sequence Analysis of Insect Odorant Binding Protein,Chemosensory Protein and Ryanoding Receptor in Eight Transcriptome Data [D]. Nanjing: Nanjing Agricultural University, 2011.[张岚. 八种昆虫转录组数据中OBP、CSP 和RyR 基因预测及序列分析[D]. 南京: 南京农业大学, 2011]
Zhou JJ, Vieira FG, He XL,etal. Genome annotation and comparative analyses of the odorant binding proteins and chemosensory proteins in the pea aphidAcyrthosiphonpisum[J].InsectMolecularBiology, 2010, 19 (Suppl. 2): 113-122.
Zhang SA, Zhang YJ, Su HH,etal. Identification and expression pattern of putative odorant-binding proteins and chemosensory proteins in antennae of theMicroplitismediator(Hymenoptera: Braconidae)[J].ChemicalSenses, 2009, 34 (6): 503-512.
Zhang YJ, Liang GM, Ni YX,etal. Selection of the adult ofBemisiatabaci(Gennadius)to different host plants [J].PlantProtection, 2003, 29 (2): 20-22. [张永军,梁革梅,倪云霞,等. 烟粉虱成虫对不同寄主植物的选择性[J]. 植物保护, 2003, 29 (2): 20-22]
cDNAcloningandprokaryoticexpressionofodorantbindingproteingenesBtabOBP2andBtabOBP4fromtheBemisiatabaciMEDcrypticspecies
XIE Hong-Yan1, WAN Lu-Zhang1, HUANG Chun-Yan1, LIU Guo-Xia2, Jean-François Picimbon2, GONG Zhi-Yuan1*
(1. Key Laboratory of Wastes Matrix Utilization, Ministry of Agriculture, Shandong Provincial Key Laboratory of Agricultural Non-Point Source Pollution Control and Prevention, Institute of Agricultural Resources and Environment, Shandong Academy of Agricultural Sciences, Jinan 250100, China; 2. Biotechnology Research Center, Shandong Academy of Agricultural Sciences, Jinan 250100, China)
The full-length cDNAs of two odorant binding protein genesBtabOBP2 andBtabOBP4 fromBemisiatabaci(Gennadius)were cloned by using reverse transcription-polymerase chain reaction (RT-PCR)and rapid amplification of cDNA ends (RACE). The full-length cDNA sequences ofBtabOBP2 (GenBank accession No. AIS71883)andBtabOBP4 (GenBank accession No. AIS71884)are 1107 bp and 874 bp, which contain 744 bp and 429 bp open reading frame encoding 247 and 142 amino-acid residues, respectively. The deduced amino acid sequence of BtabOBP4 contains six typical conservative cysteine residues, which are the hallmark of typical OBPs. Besides the six typical conservative cysteines, BtabOBP2 contains 3 more conservative ones and BtabOBP2 belongs to Plus-C OBP.BtabOBP2 andBtabOBP4 were then constructed into the pET30a(+)/BL21(DE3)prokaryotic expression vector and expressed with the induction of IPTG. The recombinant proteins were purified by affinity chromatography and gel filtration chromatography and analyzed by western blot. The results showed that recombinant proteins of BtabOBP2 and BtabOBP4 were expressed as soluble form inEscherichiacoli. The results of western blot confirmed that the expressed recombinant proteins were the target proteins. The molecular weight of BtabOBP2 recombinant protein in SDS-polyacrylamide gel electrophoresis was 6.53 kDa higher than that of the value calculated from its amino acid sequence deduced from the encoding cDNA. After a 43 amino acid peptide including the 6×His tag in N-terminal was excised from the recombinant protein by digestion with the recombinant enterokinase, the deviation of molecular weight of this protein determined by SDS-PAGE was reduced, which indicated that the 6×His tag caused the deviation of the molecular weight. In this study, the sequence characteristics of nucleotides and amino acids ofBtabOBP2 andBtabOBP4 were clarified. BtabOBP2 and BtabOBP4 recombinant proteins were successfully expressed and purified, which lay the foundations for studying the molecular structures and functions of BtabOBP2 and BtabOBP4.
Bemisiatabaci; odorant binding protein (OBP); gene cloning; prokaryotic expression; purification
山东省农业科学院青年科研基金(2015YQN36);山东省博士后创新项目专项资金(201203025);山东省农业科学院农业科技创新工程(CXGC2017A01)山东省现代农业产业技术体系食用菌创新团队建设项目(SDAIT-07-01)
谢红艳,女,1980年生,山东淄博人,博士,助理研究员,研究方向为昆虫生化与分子生物学,E-mail:hyxieswan@163.com
*通讯作者 Author for correspondence,E-mail: sdgzy2656@126.com
Received:2016-08-26;接受日期 Accepted:2016-10-25
Q963;S433.39
:A
1674-0858(2017)04-0752-10
谢红艳,万鲁长,黄春燕,等.烟粉虱MED隐种气味结合蛋白基因BtabOBP2和BtabOBP4的cDNA克隆及原核表达[J].环境昆虫学报,2017,39(4):752-761.
