土荆芥醇提物对MCF-7细胞增殖的影响
2017-09-15朱晓换张杜宇钟守慧任秋蓉王亚男
朱晓换, 张杜宇, 钟守慧, 任秋蓉, 王亚男*
(1. 四川师范大学 细胞生物学研究室, 四川 成都 610101; 2. 四川大学 生命科学学院, 四川 成都 610064)
土荆芥醇提物对MCF-7细胞增殖的影响
朱晓换1, 张杜宇2, 钟守慧1, 任秋蓉1, 王亚男1*
(1. 四川师范大学 细胞生物学研究室, 四川 成都 610101; 2. 四川大学 生命科学学院, 四川 成都 610064)
为研究土荆芥醇提物对人乳腺癌MCF-7细胞增殖的抑制作用及其相关机制,采用MTT法检测细胞增殖抑制率,Hochest染色观察细胞核的形态变化,分光光度计法检测抗氧化酶相对活性和丙二醛相对含量.结果表明:土荆芥醇提物对MCF-7细胞增殖具有显著的抑制作用,且具有时间和浓度效应(P<0.01),作用12、24、48 h后,其IC50值分别是3.85、3.70和3.28 mg/mL;形态学观察显示,细胞核出现凋亡小体、染色质凝集、呈边缘化分布等典型的凋亡特征;随土荆芥醇提物浓度增大,超氧化物歧化酶和过氧化氢酶相对活性先升高后降低,丙二醛相对含量先升高,而后保持恒定,在质量浓度3.50 mg/mL时三者均达到最高值.结论:土荆芥醇取物抑制MCF-7细胞增殖是通过扰乱细胞抗氧化系统,诱导细胞氧化损伤,最终导致细胞凋亡.
土荆芥; 醇提物; MCF-7细胞; 细胞凋亡; 氧化损伤
土荆芥(ChenopodiumambrosioidesL.) 又名红泽蓝、臭草等,属于藜科藜属,为一年或多年生芳香性草本植物,原产于热带美洲,目前在我国广泛分布[1].土荆芥的药用价值始载于《生草药性备要》,具有除湿、止痛、通经等功效,用于治疗皮肤湿疹、蛇虫咬伤、闭经等症[2].近年来一些研究表明土荆芥提取物具有明显的抗肿瘤作用,如土荆芥挥发油具有阻滞细胞周期、破坏细胞结构等毒性效应,抑制了人乳腺癌MCF-7细胞的增殖[3],导致人肝癌SMMC-7721细胞发生Caspase依赖性凋亡[4].许多药用植物的醇提物也具有抗肿瘤功效,目前有关土荆芥醇提物的抗肿瘤效应的报道不一致,F. R. F. Nascimento等[5]研究表明土荆芥叶醇提物通过抑制腹腔内艾氏固体瘤和腹水瘤的形成,显著提高了荷瘤小鼠存活率;而M. J. Ruffa等[6]研究显示土荆芥醇提物对人肝癌HepG2细胞增殖没有抑制作用,导致这一结果的原因可能是不同产地的土荆芥中含有的次生代谢物质不同.MCF-7细胞是从1名69岁的白人女性患者组织样品中分离得到的乳腺癌细胞株,常用于研究肿瘤的发生机制.
土荆芥在四川省广泛分布,具有较大的开发潜力.本研究以MCF-7细胞为受试细胞,以产自四川省成都市的土荆芥为材料,通过MTT法评价其醇提物对MCF-7细胞增殖的影响,为土荆芥资源的开发利用提供一定的理论依据.
1 材料与方法
1.1 受试细胞 人乳腺癌MCF-7细胞由四川大学华西医院生物治疗国家重点实验室提供.
1.2 供试植株 实验所用植株采集于四川省成都市郊区,经四川师范大学生命科学学院马丹炜教授鉴定确认为藜科藜属土荆芥ChenopodiumambrosioidesL..
1.3 实验试剂 RPMI-1640培养基、胰蛋白酶、新生牛血清(成都哈里生物工程有限公司);噻唑蓝(MTT, Biosharp 生物公司);Hoechst 33258(碧云天生物技术研究所,型号:C1011);二甲基亚砜(DMSO, Amresco生化公司);超氧化物歧化酶(SOD)WST-1 法测定试剂盒、过氧化氢酶(CAT)测定试剂盒、丙二醛(MDA)试剂盒(南京建成生物工程研究所).
1.4 实验仪器 Spectra MaxMZ多功能细胞分析仪(美国Molecular Devices 公司);DM300型荧光显微镜(德国Leica公司) ;粉碎机SF-200(泰州市博精制药机械有限公司);真空干燥机(北京博医康实验仪器有限公司);旋转蒸发仪RE-52CS(上海雅荣生化仪器设备有限公司);循环水式多用真空泵SHB-Ⅲ(郑州长城科工贸有限公司).
1.5 实验方法
1.5.1 细胞培养 人乳腺癌MCF-7细胞培养于体积分数10%的新生牛血清、体积分数1%的青霉素(质量浓度100 U/mL)和链霉素(质量浓度100 μg/mL)组成的RPMI-1640培养液中,并置于37 ℃、体积分数5%CO2饱和湿度培养箱内.
实验中所用的细胞均于前一天更换新鲜培养液,且处于对数生长期,每一实验均重复3次.
1.5.2 土荆芥醇提物的提取 土荆芥植株于阴凉处晾干,制成干粉,20目筛子过筛,称取15 g放入锥形瓶中,按3∶40比例加入体积分数50%的乙醇溶液,超声波提取30 min,重复3次,收集滤液,用旋转蒸发仪在40 ℃恒温下浓缩,用真空冷冻干燥机冷冻干燥成粉末,即土荆芥醇提物[7].
土荆芥醇提取物得率=
提取物质量/土荆芥粉末质量×100%.
不同浓度的土荆芥醇提物是将其冻干粉用体积分数25%的乙醇配制而成.
1.5.3 MTT法检测细胞增殖抑制率 人乳腺癌MCF-7细胞经胰蛋白酶消化离心后,以每孔100 μL,密度1×105个/mL接种于96孔板中.细胞贴壁后,更换200 μL质量浓度分别为 2.50、3.00、3.50、4.00、4.50、5.00 mg/mL土荆芥醇提物的新鲜培养液,各浓度设置5个重复,以体积分数25%的乙醇为溶剂对照,并设空白对照、阴性对照.
置于培养箱中培养24 h后,避光加入20 μL质量浓度5 mg/mL MTT溶液,作用4 h,吸去上清,加入150 μL二甲基亚砜.在波长490 nm处,用多功能细胞分析仪检测吸光度(A)值,按以下公式计算细胞增殖抑制率:

1.5.4 Hochest染色观察细胞核形态 将对数期的人乳腺癌MCF-7细胞以每孔2 mL,密度5×104个/mL接种于放有盖玻片的六孔板中,置于CO2培养箱中培养.细胞贴壁后,更换2 mL质量浓度分别为2.50、3.50、5.00 mg/mL土荆芥醇提物的新鲜培养液,以体积分数25%的乙醇为溶剂对照,并设空白对照、阴性对照.
药物作用24 h后,加入500 μL 固定液在4 ℃下作用10 min, PBS清洗2次,加入500 μL Hoechst 33258 染色液染色5 min,PBS清洗2次,取10 μL PBS缓冲液于洁净载玻片上,将长有细胞的盖玻片缓慢盖于载玻片上,立即在暗室内荧光显微镜下观察并拍照.
1.5.5 抗氧化酶活性和丙二醛(MDA)含量的测定将对数期的人乳腺癌MCF-7细胞以每瓶3 mL,密度3×105个/mL接种于50 mL培养瓶中,置于CO2培养箱中培养.细胞贴壁后,更换3 mL质量浓度分别为2.50、3.50、4.50、5.00 mg/mL土荆芥醇提物的新鲜培养液,以体积分数25%的乙醇为溶剂对照,并设空白对照、阴性对照.
药物作用24 h后,按试剂盒说明书操作,分别测定细胞中超氧化物歧化酶(SOD)、过氧化氢酶(CAT)活性和MDA含量.

2 结果与分析
2.1 土荆芥醇提物得率 15 g土荆芥粉末经超声波提取法得到1.529 g提取物,提取率为10.19%.
2.2 土荆芥醇提物抑制MCF-7细胞增殖 土荆芥醇提物对MCF-7细胞的MTT实验结果见图1.
由图1可知土荆芥醇提物可显著抑制MCF-7细胞的生长,且具有时间和浓度效应(P<0.01).当土荆芥醇提物质量浓度达到5.00 mg/mL,其对MCF-7细胞抑制率接近 80%,表明绝大部分MCF-7细胞已死亡.
应用Microsoft Excel 2010作回归方程,土荆芥醇提物对MCF-7细胞作用时间为12、24和48 h 时,其半致死质量浓度IC50值分别为3.85、3.70、3.28 mg/mL.
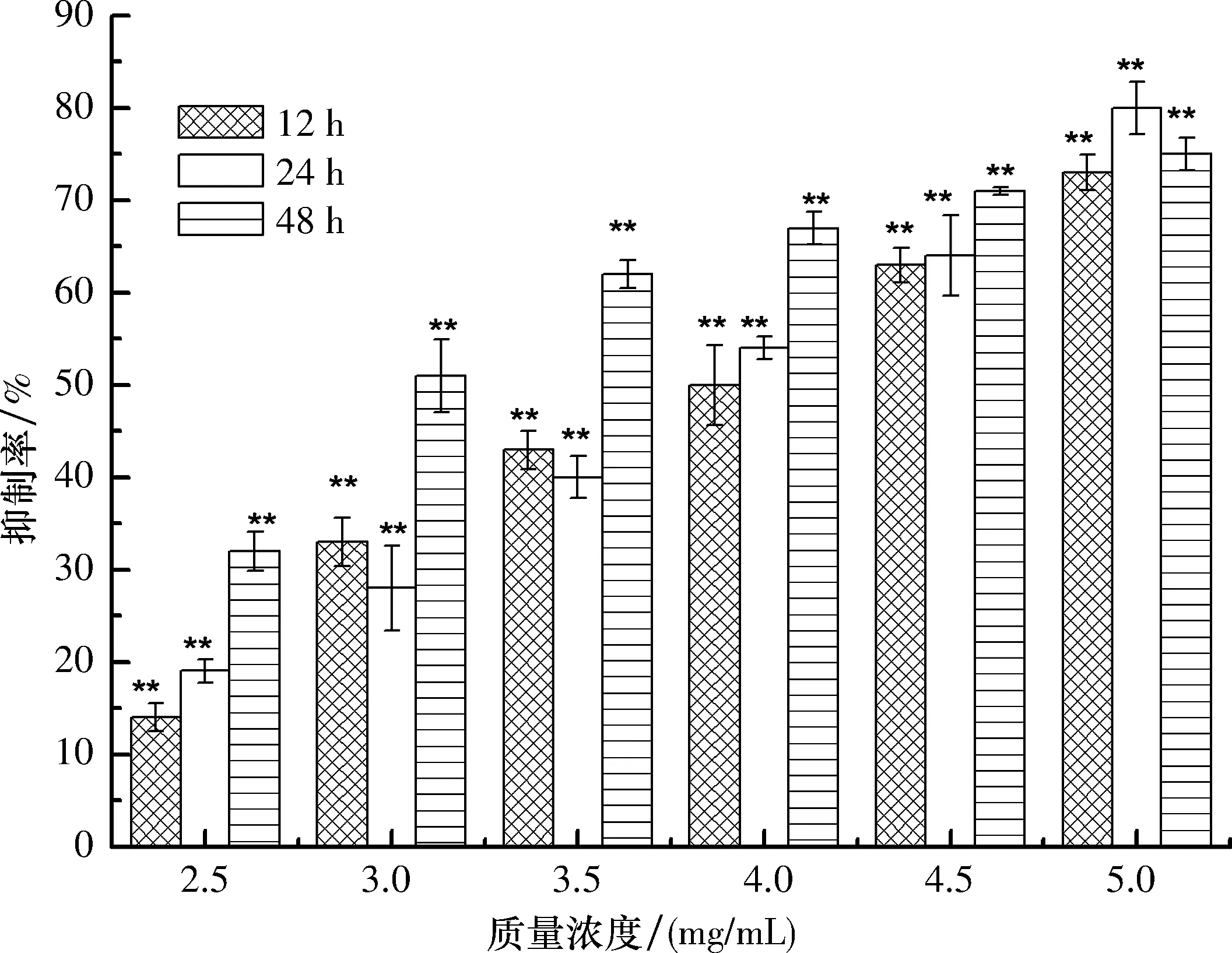
**:P<0.01
2.3 土荆芥醇提物诱导MCF-7细胞凋亡 土荆芥醇提物作用MCF-7细胞24 h后,经Hochest 33258染色,荧光显微镜下观察细胞核形态,结果见图2.对照组中细胞核染色均匀,呈正常的蓝色(图2A).土荆芥醇提物处理组细胞中染色质凝集,呈边缘化,或呈碎块状致密浓染,细胞核周围出现凋亡小体,表现出典型的凋亡特征(图2B、C和D箭头所示).随着处理浓度的增大,凋亡小体的数目逐渐增多(图2C),呈碎块状致密浓染的细胞核越来越多(图2D).

A、B、C、D土荆芥醇提物质量浓度分别为0、2.50、3.50、5.00 mg/mL
2.4 土荆芥醇提物诱导MCF-7细胞氧化损伤 不同剂量的土荆芥醇提物作用MCF-7细胞24 h后,对SOD、CAT相对活性和MDA相对含量的影响见图3.
土荆芥醇提物可激活SOD、CAT活性,随处理剂量升高,细胞中SOD、CAT相对活性均增高(P<0.01),在质量浓度3.50 mg/mL时达到最高值,分别为124.95%、22.39%.随处理剂量的增加,MDA含量逐渐升高后趋于稳定(P<0.01),在3.50 mg/mL时达到最高值,为74.74%.结果表明,土荆芥醇提物干扰 MCF-7 细胞的抗氧化系统,诱导细胞发生氧化损伤.

图3 土荆芥醇提物对抗氧化酶相对活性和MDA相对含量的影响
3 讨论
许多药用植物的醇提物具有广泛的抗肿瘤效应.文献[8]发现阿魏菇醇提物能显著抑制人食管癌Eca109细胞、人宫颈癌HeLa细胞、鼠黑色素瘤B16F10细胞和人乳腺癌MCF-7细胞的增殖.颜晰等[9]研究表明,连翘根醇提物通过JAK/STAT和ERK信号转导通路,启动线粒体内源途径诱导食管癌TE-13细胞凋亡.文献[10]发现土荆芥叶醇提物可增强小鼠体内巨噬细胞活性,提高机体免疫力,推测这可能是其具有抗肿瘤效应的原因之一.文献[5]将质量分数5 mg/kg土荆芥叶醇提物注射到植入固体瘤或腹水瘤的小鼠体内,一定时间后测定固体瘤的生长状况或腹水的体积和癌细胞数目,证明土荆芥叶醇提物能有效抑制Ehrlich固体瘤和腹水瘤的形成,从而提高荷瘤小鼠的存活率.本研究采用的土荆芥醇提物是用体积分数50%的乙醇从土荆芥全株制成的干粉中提取、浓缩、冷冻、干燥所得[7],其主要成分为黄酮类物质.本研究结果表明该醇提物显著抑制了MCF-7细胞的增殖,处理24 h时,其IC50值为3.70 mg/mL,明显低于土荆芥挥发油对MCF-7细胞的IC50值(9.45 μg/mL)[11],表明土荆芥醇提物的细胞毒性远低于其挥发油的,其原因可能是由于醇提物和挥发油的有效成分差异较大造成的.
植物的次生代谢物质具有明显的细胞毒性,当受到这些次生代谢物质作用时,细胞内会产生过量的过氧化氢(H2O2)、超氧阴离子(O2-)等活性氧(ROS)[12],导致质膜脂质过氧化生成的MDA,破坏蛋白质和核酸的结构[13],引起氧化损伤,导致细胞生长受阻.氧化损伤与细胞凋亡之间存在一定的关系.文献[14]发现,人工半合成的4种大黄素蒽醌衍生物诱导细胞内 ROS增加,线粒体膜电位降低,从而抑制人口腔鳞癌KB细胞及其多药耐药株KBv200细胞生长,这一结果显示大黄素蒽醌衍生物可能通过线粒体途径诱导肿瘤细胞凋亡.化疗药物如长春新碱和顺铂同样也是通过诱导氧化应激,引起肿瘤细胞凋亡[15].本研究结果表明,在土荆芥醇提物作用下,细胞的SOD和CAT相对活性先升高后下降,MDA相对含量升高,表明土荆芥醇提物引起了MCF-7细胞出现氧化应激,Hochest染色结果显示细胞染色质固缩且呈边缘化、出现凋亡小体等明显的凋亡特征.由此可见,土荆芥醇提物抑制MCF-7细胞增殖是通过诱导细胞氧化损伤,从而导致细胞凋亡.
致谢 2016大学生创新创业训练计划项目和四川师范大学开放实验项目对本文给予了资助,谨致谢意.
[1] 徐海根,强胜. 中国外来入侵物种编目[M] . 北京:中国环境科学出版社,2004.
[2] 中国药科大学. 中药辞海[M]. 第一卷. 北京:中国医药科技出版社,1993:232.
[3] 吴佳靓. 土荆芥挥发油及其主要成分对人乳腺癌细胞(MCF-7)的体外抗肿瘤活性[D]. 成都:四川师范大学,2014.
[4] 王亚男,朱晓换,马慧,等. 土荆芥挥发油诱导人肝癌SMMC-7721细胞Caspase依赖性凋亡[J]. 中药材,2016,39(5):1124-1128.
[5] NASCIMENTO F R F, CRUZ G V B, PEREIRA P V S, et al. Ascitic and solid ehrlich tumor inhibition byChenopodiumambrosioidesL. treatment[J]. Life Sciences,2006,78(22):2650-2653.
[6] RUFFA M J, FERRARO G , WAGNER M L, et al. Cytotoxic effect of Argentine medicinal plant extracts on human hepatocellular carcinoma cell line[J]. Ethnopharmacology,2002,79(3):335-339.
[7] 冯霞,赵欣. 不同容器发酵水豆豉乙醇提取物的抗氧化效果比较[J]. 现代食品科技,2016,32(7):1-8.
[8] 王为兰,陈开旭,刘军,等. 阿魏菇醇提物抗肿瘤功效及三萜类成分的提取[J]. 生物技术通报,2016(7):206-216.
[9] 颜晰. 连翘根醇提物抗肿瘤及免疫调节作用的实验研究[D]. 石家庄:河北医科大学,2012.
[10] CRUZ G V B, PEREIRA P V S, PATRICIO F J, et al. Increase of cellular recruitment, phagocytosis ability and nitric oxide production induced by hydroalcoholic extract fromChenopodiumambrosioidesleaves[J]. J Ethnopharmacology,2007,111(1):148-154.
[11] WU J L, MA D W, Wang Y N, et al. Cytotoxicity of essential oil ofChenopodiumambrosioidesL against human breast cancer MCF-7 cells[J]. Tropical J Pharmaceutical Research December,2013,12(6):929-933.
[12] PAN J, SHE M, XU Z X, et al. Farnesyl transferase inhibitors induce DNA damage via reactive oxygen species in human cancer cells[J]. Cancer Research,2005,65(9):3671-3681.
[13] OWEN R W, GIACOSA A, HULL W E, et al. Olive-oil consumption and health:the possible role of antioxidants[J]. Lancet Oncol,2000,1(2):107-112.
[14] 丁岩,梁永钜,陆豫,等. 大黄素蒽醌衍生物介导KB及KBv200细胞氧化损伤的研究[J]. 中草药,2004,11:63-66.
[15] GORRINI C, HARRIS I S, MAK T W. Modulation of oxidative stress as an anticancer strategy[J]. Nature Reviews Drug Discovery,2013,12(12):931-947.
(编辑 陶志宁)
The Effects of Ethanol Extract fromChenopodiumambrosioideson MCF-7 Cell Proliferation
ZHU Xiaohuan1, ZHANG Duyu2, ZHONG Shouhui1, REN Qiurong1, WANG Yanan1
(1.CellBiologyLaboratory,SichuanNormalUniversity,Chengdu610101,Sichuan; 2.CollegeofLifeScience,SichuanUniversity,Chengdu610064,Sichuan)
To investigate the effects of ethanol extract fromChenopodiumambrosioideson proliferation inhibition of human breast cancer cells MCF-7 and its relative mechanism, MTT assay, Hochest staining and Spectrophotometer method were applied to evaluate the ratio of cell proliferation inhibition, to visualize morphological changes of the nucleus, and the relative activities of cellular superoxide dismutase, catalase and relative content of malondialdehyde inC.ambrosioidesethanol extract treated MCF-7 cells. The results showed that the treatment of ethanol extract fromC.ambrosioidesresulted in the inhibition of MCF-7 cell proliferation in a dose- and time-dependent manner, and its IC50values were 3.85 mg/mL, 3.70 mg/mL, 3.28 mg/mL for 12 h, 24 h, 48 h, respectively. Morphological visualization revealed typical morphologic changes of apoptosis such as the emergence of apoptotic bodies, condensed chromatin and marginalization. With the increasing of the concentration of ethanol extract, relative activities of antioxidant enzymes, superoxide dismutase and catalase, were increased first and then decreased, the relative content of malondialdehyde was increased first and then kept constantly, the highest enzyme activities and MDA content were observed when the concentration of the ethanol extract increased to 3.50 mg/mL. Our results suggested that ethanol extract fromC.ambrosioidesinhibited the proliferation of MCF-7 cells through disrupting cell antioxidant system, inducing cell oxidative damage, and leading to apoptosis.
Chenopodiumambrosioides; ethanol extract; MCF-7 cells; apoptosis; oxidative damage
2016-06-30
四川省教育厅自然科学重点项目(16ZA0056)
R282
A
1001-8395(2017)04-0531-05
10.3969/j.issn.1001-8395.2017.04.017
*通信作者简介:王亚男(1973—),女,副教授,主要从事细胞生物学和细胞毒理学的研究,E-mail:273218760@qq.com
