曲妥珠单抗并紫杉醇新辅助化疗在HER2阳性晚期局部乳腺癌治疗中的应用研究
2017-09-15权利丰
权利丰
自贡市第一人民医院 肿瘤科(自贡 643000)
·论著·
曲妥珠单抗并紫杉醇新辅助化疗在HER2阳性晚期局部乳腺癌治疗中的应用研究
权利丰
自贡市第一人民医院 肿瘤科(自贡 643000)
目的探讨曲妥珠单抗并紫杉醇新辅助化疗治疗人表皮生长因子受体2(HER2)阳性晚期局部乳腺癌(HER2 positive late local breast cancer,HER2-PLLBC)的临床疗效。方法选取2012年1月至2013年12月自贡市第一人民医院收治的HER2-PLLBC女性患者78例,按照随机数字表法分为试验组(n=39)和对照组(n=39),对照组行曲妥珠单抗治疗,试验组行曲妥珠单抗并多西紫杉醇治疗。比较治疗前后两组血清癌胚抗原(CEA)、糖类抗原153(CA153)、C角蛋白19片段抗原21-1(CYFRA21-1)水平;血清白介素-6(IL-6)、白介素-8(IL-8)及肿瘤坏死因子-α(TNF-α)水平;观察两组患者肿瘤复发情况及不良反应发生率。结果治疗后,两组患者血清CEA、CA153、CYFRA21-1及IL-6、IL-8、TNF-α水平均降低,试验组血清CEA、CA153、CYFRA21-1及IL-6、IL-8、TNF-α水平均低于对照组,差异有统计学意义(P<0.05);试验组的客观有效率58.97%(23/39)、临床获益率84.62%(33/39)均大于对照组的客观有效率30.77%(12/39)、临床获益率64.10%(25/39);复发率10.26%(4/39)小于对照组的28.21%(11/39),差异有统计学意义(P<0.05)。治疗期间,试验组不良反应发生率与对照组比较,差异无统计学意义(P>0.05)。结论曲妥珠单抗并紫杉醇新辅助化疗治疗HER2-PLLBC疗效显著,复发率低,安全可靠。
曲妥珠单抗;紫杉醇;新辅助化疗;HER2阳性晚期局部乳腺癌;疗效
近年来,随着治疗技术的不断提高,乳腺癌(breast cancer,BC)患者的死亡率逐渐降低,但晚期BC患者生存时间仍远低于早期BC经手术治疗患者[1]。究其原因,主要是由于晚期BC患者确诊时癌细胞已广泛转移,多数患者已丧失最佳手术治疗时期[2]。研究[3]表明,在所有晚期BC患者中,约20%~30%存在人表皮生长因子受体2(human epidermal growth factor receptor2,HER2)基因过度表达。研究[4]证明,BC细胞的强侵袭性和不良预后与HER2基因过度表达密切相关,故需将HER2作为重要靶点对HER2阳性晚期BC患者进行治疗。自贡市第一人民医院于2012年1月至2013年12月将曲妥珠单抗并紫杉醇新辅助化疗应用于HER2阳性晚期局部BC(HER2positive late local breast cancer,HER2-PLLBC)患者的临床治疗,效果较为满意,现报道如下。
1 资料与方法
1.1临床资料
选取2012年1月至2013年12月自贡市第一人民医院收治的HER2-PLLBC女性患者78例,年龄33~71(52.33±5.49)岁;病理分型:浸润性导管癌59例(75.64%),浸润性小叶癌19例(24.36%);TNM分期:Ⅲa期31例(39.74%),Ⅲb期26例(33.33%),Ⅳ期21例(26.92%);部位:左侧40例(51.28%),右侧 38例(48.72%)。纳入标准:免疫组化和(或)FISH检测判定为HER2基因扩增,经组织病理学及影像学诊断为HER2-PLLBC患者;预期生存>90 d患者;肝肾功能正常患者;KPS评分>70分患者;左室射血分数≥55%患者;知情同意患者。排除标准:存在其他癌症患者;有曲妥珠单抗治疗史患者;早期BC患者;依从性差患者;骨髓功能不全或严重出血性疾病患者;化疗不耐受患者。将上述78例患者按照随机数字表法分为试验组(n=39)和对照组(n=39),两组患者基线资料比较,差异无统计学意义(P>0.05)(表1),具有可比性。
1.2方法
1.2.1 对照组 行曲妥珠单抗治疗。曲妥珠单抗(生产企业:美国Genentech Inc.;批准文号:国药准字:J00100122;规格:440 mg/20 mL/瓶)首次剂量8 mg/kg静滴,时间<90 min,然后按照每3周6 mg/kg静滴,时间<90 min。连续治疗8~50周。
1.2.2 试验组 给予曲妥珠单抗并多西紫杉醇治疗。多西紫杉醇(生产企业:法国Rhone-Poulenc Rorer S.A.;批准文号:X20010340;规格:20 mg/0.5 mL/支)75 mg/m2静滴,时间<60 min,每化疗周期第1天。21 d为1周期,共治疗4周期。曲妥珠单抗治疗同对照组。
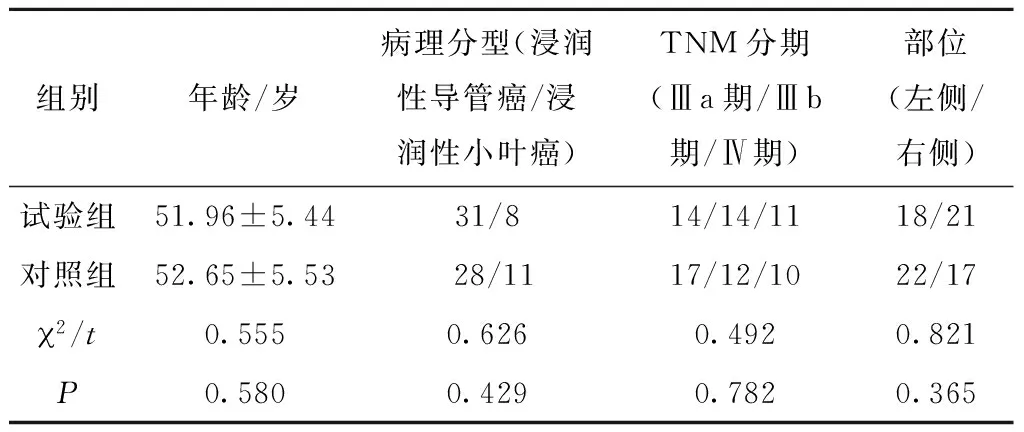
表1 两组患者基线资料比较(n=39)
1.3观察指标
观察治疗前、治疗完成后第3个月两组血清癌胚抗原(CEA)、糖类抗原153(CA153)、C角蛋白19片段抗原21-1(CYFRA21-1)水平,血清白介素-6(IL-6)、白介素-8(IL-8)及肿瘤坏死因子-α(TNF-α)水平;观察随访期间肿瘤复发情况及不良反应发生率。CEA、CA153、CYFRA21-1以化学发光法检测,IL-6、IL-8、TNF-α以酶联免疫法检测,检测严格按照各指标相关试剂盒操作步骤操作。治疗期间不良反应依据CTCAE 3.0毒性评价标准进行评价。两组患者均随访2年。
1.4疗效评价标准
疗效评价标准依据RECIST 1.0实体瘤评价标准制定。完全缓解(CR):BC病灶基本或完全消失,血清肿瘤标志物回归至正常水平,且维持时间≥1月;部分缓解(PR):BC病灶最长径之和降低≥30%,且病灶无扩大或无新生病灶,血清肿瘤标志物水平降低≥65%,且维持时间≥1月;稳定(SD):BC病灶最长径之和降低
1.5统计学方法
2 结果
2.1治疗前后两组血清CEA、CA153、CYFRA21-1水平比较
治疗前,两组血清CEA、CA153、CYFRA21-1水平比较,差异均无统计学意义(P>0.05);治疗后,两组血清CEA、CA153、CYFRA21-1水平均降低,较治疗前比较,差异有统计学意义(P<0.05);治疗后,试验组血清CEA、CA153、CYFRA21-1水平低于对照组,差异有统计学意义(P<0.05)(表2)。
2.2治疗前后两组血清IL-6、IL-8、TNF-α水平比较
治疗前,两组血清IL-6、IL-8、TNF-α水平比较,差异均无统计学意义(P>0.05);治疗后,两组血清IL-6、IL-8、TNF-α水平均降低,较治疗前比较,差异有统计学意义(P<0.05);治疗后,试验组血清IL-6、IL-8、TNF-α水平低于对照组,差异有统计学意义(P<0.05)(表3)。
2.3两组临床疗效比较
试验组客观有效率(58.97%)、临床获益率(84.62%)均大于对照组客观有效率(30.77%)、临床获益率(64.10%),差异有统计学意义(P<0.05);随访期间,试验组复发率(10.26%)小于对照组(28.21%),差异有统计学意义(P<0.05)(表4)。
2.4两组治疗期间不良反应比较
治疗期间,试验组各不良反应发生率与对照组比较,差异无统计学意义(P>0.05)(表5)。
表2 治疗前后两组血清CEA、CA153、CYFRA21-1水平比较
注:与治疗后比较,aP<0.05
表3 两组治疗前后血清IL-6、IL-8、TNF-α水平比较
注:与治疗后比较,aP<0.05
表4 两组临床疗效比较[n(%),n=39]
表5 两组治疗期间不良反应比较[n(%),n=39]
3 讨论
HER2为原癌基因的一种,可发挥酪氨酸激酶受体功能。HER2基因扩增可促进肿瘤细胞表面过度表达HER2蛋白,活化HER2受体,提高肿瘤细胞下游信号通道活动,促进肿瘤细胞的增殖及转移[5]。研究[6-7]证明,HER2基因表达程度越高,肿瘤的恶性程度越高,其治疗后转移率及复发率也越高。此外,HER2阳性癌细胞增殖指数高,病灶负荷大,组织学分级相对较差,淋巴结极易转移,故临床治疗常存在较大困难。研究[8]证明,单纯内分泌治疗或化疗难以为HER2-PLLBC提供确切稳定的疗效,且治疗后极易发生转移。曲妥珠单抗为IgG1型抗体,能够和HER2受体相结合,抑制HER2受体正常作用的发挥[9]。研究[10-11]表明,曲妥珠单抗的抗原结合部位可与HER2受体胞外域相结合,抑制形成HER2异源与同源二聚体,影响下游信号通道及细胞生长。曲妥珠单抗可经其Fc段和抗原提呈细胞、NK细胞以及免疫效应细胞的相关受体相结合,提高肿瘤相关特异性B淋巴细胞活性,促进机体生成肿瘤相关抗体,从而有效杀灭肿瘤细胞。
临床研究[12]证明,尽管曲妥珠单抗治疗HER2阳性晚期肿瘤患者疗效较为显著,但部分HER2阳性晚期肿瘤患者对曲妥珠单抗存在耐药性。研究[13]证明,部分HER2阳性BC患者无进展生存期与HER2蛋白的表达相关,与接受曲妥珠单抗治疗无明显相关。由于曲妥珠单抗治疗部分HER2-PLLBC患者有效,故临床常以曲妥珠单抗并化疗方案治疗HER2-PLLBC,使曲妥珠单抗抑制HER2的作用得到有效发挥[14]。心脏毒性是曲妥珠单抗典型的毒副作用[15],研究[16]发现,曲妥珠单抗可抑制激活心肌细胞HER2蛋白的信号传导,诱导心肌细胞凋亡,但该机制具有可逆性,停止使用曲妥珠单抗即可恢复至正常状态。此外,曲妥珠单抗导致的心脏毒性和临床使用的剂量无关,经对症治疗患者心脏毒性均可缓解。为避免发生严重的心脏毒性,治疗期间要加强患者心功能检测,给予血管紧张素转换酶保护心功能,必要时给予对症治疗。
综上所述,本研究两组患者经治疗后,血清肿瘤标志物及炎性因子水平均明显降低,且试验组血清肿瘤标志物及炎性因子水平低于对照组,试验组客观有效率、临床获益率均大于对照组,复发率小于对照组,与上述研究较为一致。此外,试验组治疗期间不良反应发生率低于对照组,提示曲妥珠单抗并紫杉醇治疗HER2-PLLBC较单纯曲妥珠单抗更具优势。
[1]Gatta L B, Incardona P, Cadei M,etal. Simultaneous fluorescence immunophenotyping and Her-2/neu genotyping (FICTION) in breast carcinoma candidates to target therapy[J]. Appl Immunohistochem Mol Morphol, 2012, 20(4): 413-420.
[2]李娜妮, 刘健, 吴凡, 等. 拉帕替尼联合白蛋白结合型紫杉醇治疗曲妥珠单抗治疗失败的HER2阳性乳腺癌的临床观察[J]. 中华内分泌外科杂志, 2016, 10(5): 369-373.
[3]刘世伟, 徐玲, 张虹, 等. HER2阳性乳腺癌新辅助治疗病理完全缓解预测因素分析[J]. 中华外科杂志, 2016, 54(2): 94-98.
[4]Curigliano G, Goldhirsch A. Dual HER2 inhibition and pathological complete response in early breast cancer: increasing success of treatment by improving patient selection[J]. Ann Oncol, 2017, 28(3): 441-443.
[5]Lipton A, Goodman L, Leitzel K,etal. HER3, p95HER2, and HER2 protein expression levels define multiple subtypes of HER2-positive metastatic breast cancer[J]. Breast Cancer Res Treat, 2013, 141(1): 43-53.
[6]李凡周, 孙刚, 董朝, 等. HER-2阳性小乳腺癌的研究进展[J]. 中国妇幼保健, 2016, 31(1): 219-221.
[7]黄志恒, 王先明. 曲妥珠单抗联合多西紫杉醇新辅助化疗Her-2/neu高表达局部晚期乳腺癌的疗效观察[J]. 中国肿瘤临床与康复, 2010, 17(5): 433-435.
[8]Aitelhaj M, Lkhoyaali S, Rais G,etal. First line chemotherapy plus trastuzumab in metastatic breast cancer HER2 positive-Observational institutional study[J]. Pan Afr Med J, 2016, 24: 324.
[9]Rugo H S, Barve A, Waller C F,etal. Effect of a Proposed Trastuzumab Biosimilar Compared With Trastuzumab on Overall Response Rate in Patients With ERBB2 (HER2)-Positive Metastatic Breast Cancer: A Randomized Clinical Trial[J]. JAMA, 2017, 317(1): 37-47.
[10] 徐金明, 黎可, 陈轩, 等. 曲妥珠单抗对HER2阳性乳腺癌患者术后辅助治疗的临床观察[J]. 重庆医学, 2013, 42(9): 1025-1026.
[11] 周春鹤, 李惠艳, 车德海, 等. 曲妥珠单抗辅助或新辅助治疗HER2阳性转移性乳腺癌的临床结果[J]. 现代生物医学进展, 2016, 16(32): 6332-6335,6363.
[12] 刘丹, 刘彦君, 施明. 曲妥珠单抗的耐药机制及其逆转策略[J]. 中国肿瘤生物治疗杂志, 2016, 23(4): 453-467.
[13] Santa-Maria C A, Nye L, Mutonga M B,etal. Management of Metastatic HER2-Positive Breast Cancer: Where Are We and Where Do We Go From Here[J]. Oncology (Williston Park), 2016, 30(2): 148-155.
[14] 张丹丹, 程文, 刘莹, 等. 超声心动图评价赫塞汀对乳腺癌患者心脏毒性[J]. 现代肿瘤医学, 2013, 21(8): 1862-1865.
[15] 朱方清, 杜凤彩, 陈剑. 曲妥珠单抗在HER2阳性乳腺癌治疗中的心脏毒性及防治[J]. 癌症进展, 2016, 14(1): 40-42.
[16] 黄平, 刘雅娟, 陈占红, 等. 曲妥珠单抗治疗晚期乳腺癌患者的心脏毒性研究[J]. 中国临床药理学杂志, 2017, 33(9): 778-781.
TheAppliedResearchofTrastuzumabCombinedwithTaxolNeoadjuvantChemotherapyinTreatingHER2PositiveLocalLateBreastCancer
QuanLifeng.
DepartmentofOncology,ZigongFirstPeople′sHospital,Zigong643000,China
ObjectiveTo study the clinical efficacy of trastuzumab combined with taxol neoadjuvant chemotherapy in treating HER2positive locally late breast cancer (HER2-PLLBC).MethodsA total of78female patients with HER2-PLLBC treated in Zigong First People′s Hospital from January of2012to December of2013were selected and divided into the experiment group (n=39) and the control group (n=39) according to the random number table. The control group was treated with trastuzumab, while the experiment group was treated with trastuzumab combined with docetaxel. The two groups were compared between before and after treatment in the levels of serum carcino embryonic antigens (CEA), carbohydrate Antigen153(CA153), cytokeratin19fragmentantigen21-1(CYFRA21-1), interleukin-6(IL-6), IL-8(IL-8) and tumor necrosis factor-α (TNF-α) respectively. The recurrence and adverse reaction of the two groups were also observed and recorded.ResultsThe levels of CEA, CA153, CYFRA21-1, IL-6, IL-8and TNF-α in both groups were reduced after treatment and those in the experiment group were significantly lower than those in the control group (P<0.05). The objective response rate and clinical benefit rate in the experiment group were58.97% and84.62% respectively and higher than those in the control group which were30.77% and64.10% respectively. The recurrence rate in the experiment group was10.26% and significantly lower than that in the control group which was28.21% (P<0.05). During the treatment period, the difference in the incidence of adverse reactions between the experiment group and control group was not statistically significant (P>0.05).ConclusionTrastuzumab combined with taxol neoadjuvant chemotherapy has significant curative effect with safety, reliability and low recurrence rate in treating HER2-PLLBC.
Trastuzumab; Paclitaxel; Neoadjuvant chemotherapy; HER2positive locally late breast cancer; Curative effect
http://kns.cnki.net/kcms/detail/51.1705.R.20170901.0924.010.html
10.3969/j.issn.1674-2257.2017.04.026
R737.9
A