聚肌苷酸-聚胞苷酸对人髓核细胞基质金属蛋白酶-1、13表达的影响*
2017-09-15夏新宇
夏新宇,胡 松,刘 阳,邹 强,常 山
1.成都医学院 基础医学院(成都 610500);2.成都医学院 科研实验中心(成都 610500);3.成都医学院第一附属医院 骨科(成都 610500)
·论著·
聚肌苷酸-聚胞苷酸对人髓核细胞基质金属蛋白酶-1、13表达的影响*
夏新宇1,胡 松2,刘 阳2,邹 强2,常 山3△
1.成都医学院 基础医学院(成都 610500);2.成都医学院 科研实验中心(成都 610500);3.成都医学院第一附属医院 骨科(成都 610500)
目的探究聚肌苷酸-聚胞苷酸[polyinosinic-polycytidylic acid,Poly(I:C)]对人髓核细胞(nucleus pulposus cells,NPC)基质金属蛋白酶(matrix metalloproteinases,MMPs)-1、13表达的影响。方法取人椎间盘组织,采用酶消化法分离并体外培养NPC。不同时间不同剂量的Poly(I:C)刺激NPC,利用qPCR和Western blot方法检测MMP-1、13的mRNA和蛋白质表达情况;siRNA分别沉默TLR-3、RIG-1和MDA-5后,Poly(I:C)刺激NPC,qPCR检测MMP-1、13的mRNA表达情况。结果分离培养的NPC 5~6 d后,贴壁生长;Poly(I:C)刺激NPC后,MMP-1、13的mRNA和蛋白质表达水平明显升高,差异有统计学意义(P<0.05);siRNA沉默TLR-3后,MMP-1、13的mRNA 表达水平受到明显抑制,差异有统计学意义(P<0.05);siRNA沉默RIG-1和MDA-5后,MMP-1、13的mRNA 表达水平不受影响(P>0.05)。结论Poly(I:C)通过TLR-3受体途径促进NPC表达MMP-1、13。
髓核细胞;Poly (I:C);基质金属蛋白酶-1、13;Toll样受体3
椎间盘退变(intervertebral disc degeneration ,IVDD)作为生活中常见的疾病,拥有较高的发病率及复发率,如引起颈腰腿痛发生的主要原因便是IVDD[1]。IVDD是一个由多因素共同作用的复杂过程,其中,椎间盘髓核的主要组成物质-细胞外基质(extracellular matrix ,ECM)成分的改变与IVDD密切相关。基质金属蛋白酶(matrix metalloproteinases,MMPs)作为金属蛋白酶,参与多数基质成分的降解,包括糖蛋白类和蛋白聚糖类,特别是胶原蛋白类,其表达和分解平衡的失调是引起ECM改变的主要原因[2]。IVDD时,MMPs的表达与活性增高,引起ECM降解,髓核水分及弹性丧失,最终导致椎间盘生物学活性改变,而MMP-1、2、3、13在维持椎间盘ECM平衡的作用尤为重要[3-6]。既往研究[7]报道,IVDD患者体内发现双链DNA病毒(dsDNA),提示病毒感染可能是影响IVDD的一个重要因素。人工合成类病毒聚肌苷酸-聚胞苷酸[polyinosinic-polycytidylic acid,Poly(I:C) ],作为一种病毒类似物,在研究病毒感染过程中被广泛应用[8]。Poly(I:C)可以诱导多种细胞MMPs表达增高,而在椎间盘中,Poly(I:C)是否引起MMPs改变,目前还未有文献报道。因此,本研究通过Poly(I:C)来模拟病毒感染人髓核细胞(nucleus pulposus cells,NPC),以研究病毒感染对MMP-1、13表达的影响。
1 材料与方法
1.1实验材料
1.1.1 组织来源 来自椎间盘摘除或置换术患者的髓核组织(成都医学院第一附属医院脊柱外科),在无菌条件下进行原代NPC分离。
1.1.2 试剂 DMEM基础培养基(Hyclone,美国),FBS胎牛血清(Gibco,美国),II型胶原酶(Gibco,美国),胰蛋白酶(Sigma-Aldrich,美国),RNAiso Plus(Takara,日本),PrimeScriptRRT reagent Kit with gDNA Eraser(Takara,日本),UPL probe(Roche,瑞士),Mastermix FastStart Universal Probe(Roche,瑞士),Poly (I:C)(Invivogen,美国),MMP-1、13单克隆抗体(R&D)。

表1 qPCR 引物信息
1.2方法
1.2.1 人NPC的分离培养 获取新鲜椎间盘组织(成都医学院附属第一医院脊柱外科,均获得病人同意),将组织剪碎成体积1 mm3,利用胰蛋白酶、II型胶原酶相结合的方法,从椎间盘组织中分离、培养NPC。使用含DMEM+10%FBS完全培养基,在CO2细胞培养箱中孵育培养。每天定时观察细胞生长状况,每隔3 d换液,待细胞生长融合至80%时,用胰蛋白酶消化传代培养。
1.2.2 分组 实验根据检测内容不同,共分3组(剂量效应、时间效应、受体通路),设立实验组与对照组,各组间重复检测3次。剂量效应:分别以50、100 μg/mL 剂量Poly(I:C)刺激NPC 24 h为实验组,Poly(I:C)未刺激NPC为对照组;时间效应:50 μg/mL剂量Poly(I:C)刺激NPC 24、48 h为实验组,Poly(I:C)未刺激NPC为对照组;受体通路:siRNA沉默TOLL样受体3(TOLL like receptor 3,TLR-3)、黑色素分化相关基因蛋白5(melanoma differentiation-associated gene 5 ,MDA-5)和细胞内维甲酸诱导基因蛋白1(retinoic acid-inducible gene 1,RIG-1)表达后,Poly(I:C)刺激NPC为实验组,以Poly(I:C)直接刺激NPC为对照组。
1.2.3 siRNA转染方法 根据LipofectamineTM2000试剂说明,将TLR-3(s235)、MDA-5(s34500)及RIG-1(s223616)siRNA转染至NPC中,分别沉默TLR-3、MDA-5和RIG-1 3种受体基因,抑制其表达。细胞于37 ℃,CO2培养箱中,培养48 h,完成转染过程。
1.2.4 RNA提取及qPCR检测MMP-1、13 mRNA的表达 采用Trizol试剂提取NPC总RNA,依据PrimeScriptRRT reagent Kit with gDNA Eraser说明书,进行RT-PCR逆转录cDNA。以GAPDH为内参,通过CFX96TMReal time System 进行扩增。PCR仪程序设定反应条件为:起始95 ℃、10 min;然后95 ℃、10 S和60 ℃、30 S反复40个循环;最后40 ℃、30 S。所有qPCR均设置3个复孔,实验均重复3次(表1)。
1.2.5 Western blot检测MMP-1、13的蛋白质表达 提取NPC总蛋白,使用BCA试剂盒对所提蛋白含量进行测定,计算蛋白浓度,以GAPDH作为实验内参。采用SDS-PAGE电泳法,对所提蛋白进行电泳及转膜,将含有蛋白质的PVDF膜用5%脱脂牛奶,37 ℃封闭1 h或4 ℃封闭8 h。封闭后,加一抗抗体,4 ℃孵育过夜,最后加入二抗,室温孵育1 h。抗体孵育完成后,加入显色液,化学发光成像仪曝光成像。
1.3统计学方法
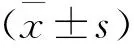
2 结果
2.1NPC原代培养
酶消化法分离后的NPC,原代培养5~6 d后贴壁生长,显微镜下观察呈长梭型或不规则形状(图1)。
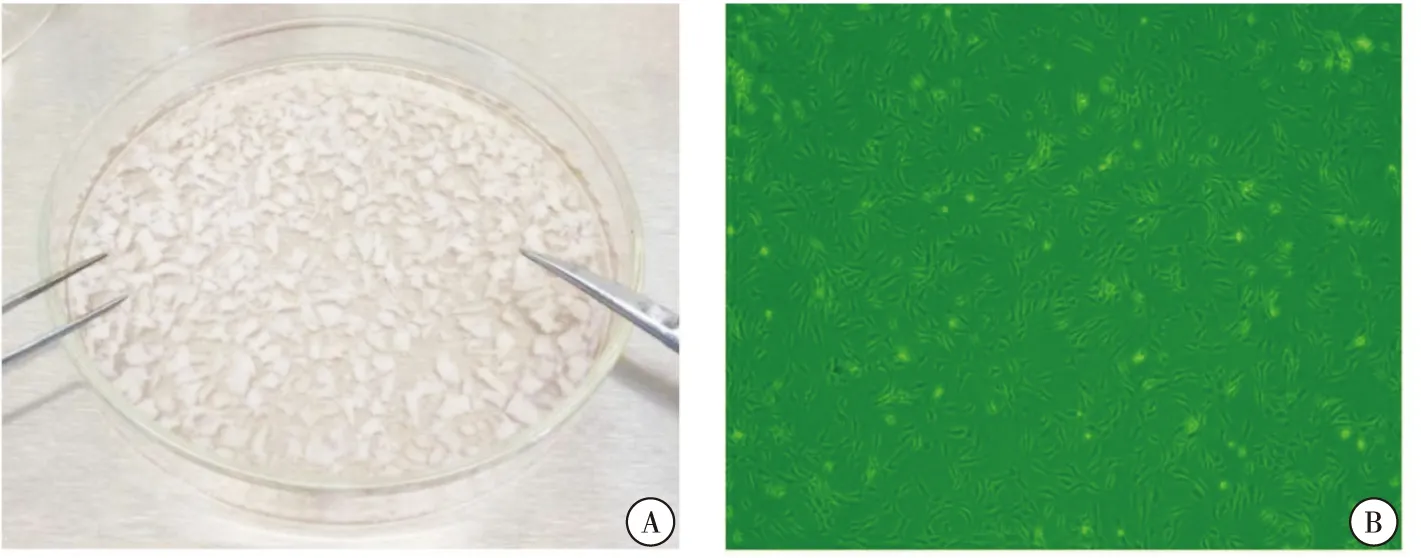
图1 NPC原代培养 注:A.剪碎的新鲜髓核组织;B.培养5~6 d贴壁生长的原代NPC(×4)
2.2Poly(I:C)刺激人NPC后MMP-1、13mRNA和蛋白质的表达
实验组50、100 μg/mL剂量的Poly(I:C)分别处理NPC 24、48 h后,MMP-1、13的mRNA表达量比对照组明显升高,差异有统计学意义(P<0.05)(图2 A、B)。Western blot检测Poly(I:C)刺激NPC后MMP-1、13的蛋白质表达,实验组50、100 μg/mL剂量的Poly(I:C)分别刺激NPC 24、48 h后,MMP-1、13蛋白质的表达量刺激组与未刺激对照组之间相比明显升高,差异有统计学意义(P<0.05)(图2 C、D)。

图2 Poly(I:C)刺激NPC后MMP-1、13的mRNA和蛋白质表达结果
注:A.qPCR检测50 μg/mL剂量Poly(I:C)刺激NPC不同时间MMP-1、13的mRNA表达;B.qPCR检测不同剂量Poly(I:C)刺激NPC 24 h后MMP-1、13的mRNA表达;C、D.Western blot检测Poly(I:C)刺激NPC后MMP-1、13的蛋白质表达;以未刺激为对照组,与对照组比较,*P<0.05
2.3Poly(I:C)诱导TLR-3、MDA-5、RIG-1基因沉默后的NPC表达MMP-1、13情况
实验组siRNA沉默TLR-3表达, Poly(I:C)刺激NPC 24 h后,MMP-1、13的mRNA表达量与对照组Poly(I:C)直接刺激NPC相比,表达量明显降低,差异有统计学意义(P<0.05);实验组siRNA沉默MDA-5表达,Poly(I:C)刺激NPC 24 h后,MMP-1、13的mRNA表达量与对照组Poly(I:C)直接刺激NPC相比,差异无统计学意义(P>0.05);实验组siRNA沉默RIG-1表达,Poly(I:C)刺激NPC 24 h后,MMP-1、13的mRNA表达量与对照组Poly(I:C)直接刺激NPC相比,差异无统计学意义(P>0.05)(图3)。
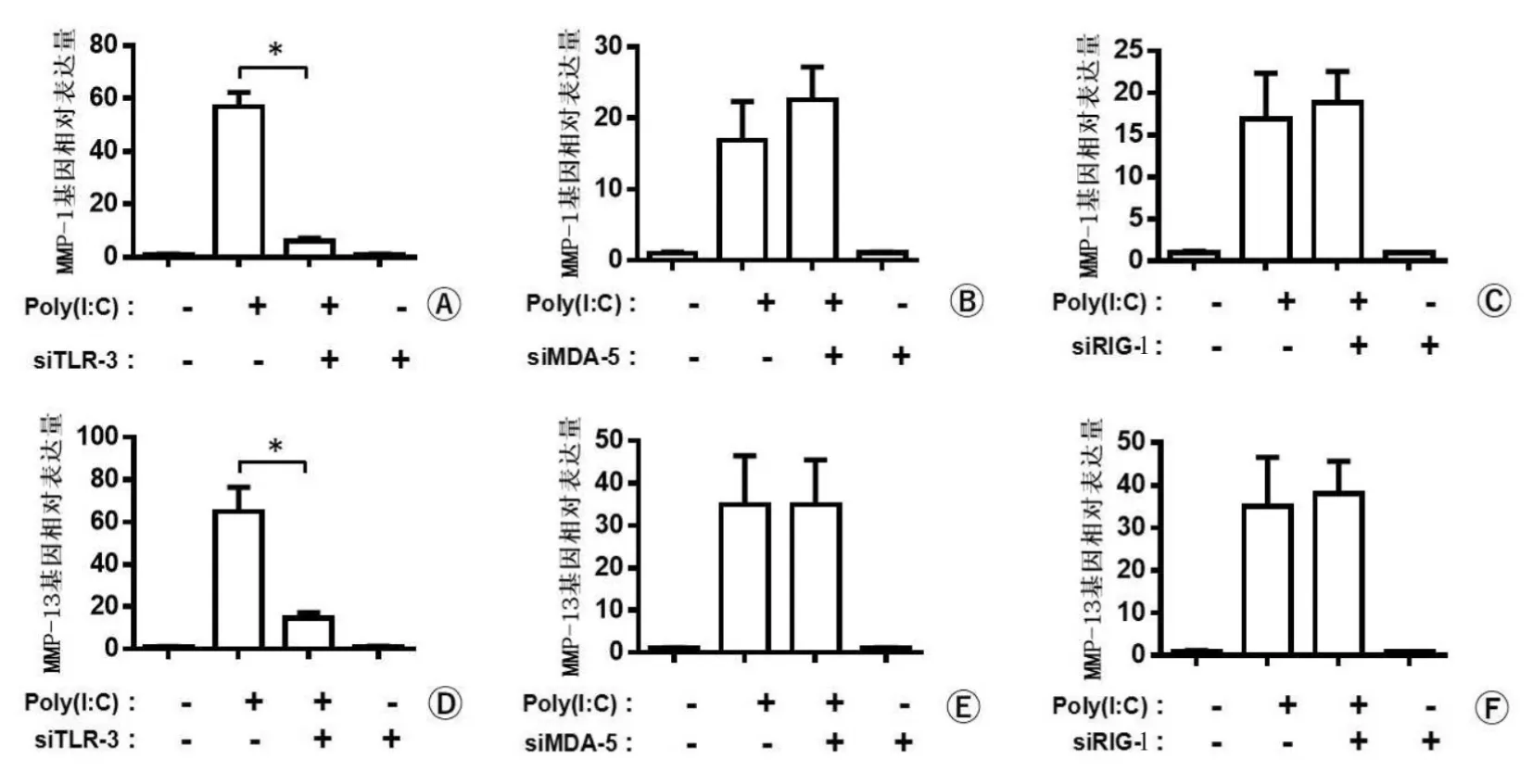
图3 siRNA沉默TLR-3、MDA-5、RIG-1基因表达后MMP-1、13的mRNA表达结果
注:A、D. siRNA沉默TLR-3后Poly(I:C)刺激NPC表达MMP-1、13,以Poly(I:C)直接刺激为对照组;B、E. siRNA沉默MDA-5后Poly(I:C)刺激NPC表达MMP-1、13,以Poly(I:C)直接刺激为对照组;C、F. siRNA沉默RIG-1后Poly(I:C)刺激NPC表达MMP-1、13,以Poly(I:C)直接刺激为对照组;与对照组比较,*P<0.05
3 讨论
IVDD的发生是一个极其复杂的过程,引起IVDD的具体机制目前还未清楚,目前有研究[9]认为,正常椎间盘组织中ECM成份的合成和分解处于动态平衡状态,当平衡打破,ECM成分改变时,则会引起IVDD的发生。MMPs作为ECM中主要含有的一类酶,其合成和分泌的失常是引起ECM成分改变的主要原因[10]。MMPs共分6类,含有20多个家族成员,而不同类MMPs的具体生物学作用不同,同一类型的MMPs在不同类型细胞中的表达量也不同。MMP-1、13属于间质胶原酶,其主要作用为水解纤维胶原,当ECM中MMP-1、13表达升高时,纤维胶原降解,最终引起IVDD发生。既往研究[11-12]表明,IVDD中均检测到MMP-1、13的表达量较正常椎间盘组织升高,因此,本实验通过研究影响MMP-1、13表达升高的因素,探究引起IVDD发生的原因。
不同类型细胞中,Poly(I:C)可以诱导多种MMPs的表达,如皮肤成纤维细胞中Poly(I:C)可通过IRF-3诱导MMP-1、2、3的表达[13];肺成纤维细胞中Poly(I:C)促进MMP-1、2、9的表达[14];软骨细胞中Poly(I:C)可诱导MMP-13的表达升高[15]。而在NPC中,Poly(I:C)是否可以调节MMP-1、13的表达,目前还未有研究报道。因此,本实验通过qPCR和Western blot方法,检测Poly(I:C)刺激NPC后,MMP-1、13的mRNA和蛋白质表达情况,结果显示:不同剂量的Poly(I:C)刺激不同时间,MMP-1、13的mRNA和蛋白质的表达水平均明显升高(P<0.05)。由此表明,病毒感染人体后,可以诱导NPC合成和分泌MMP-1、13,为进一步研究病毒在IVDD发生过程中所起的作用提供依据。
Poly(I:C)作为配体作用于细胞的过程中,主要与TLR-3相结合发挥作用,而在某些类型细胞中,Poly(I:C)也可被MDA-5和RIG-1这两种受体识别[16],进而发挥作用。因此,Poly(I:C)诱导NPC产生MMP-1、13的过程中,既可能依赖TLR-3途径发挥作用,也可能与MDA-5和RIG-1两种受体相结合发挥作用。为探明IVDD过程中,Poly(I:C)诱导NPC表达MMP-1、13依赖何种途径,实验采用基因沉默方法,分别使用TLR-3、MDA-5和RIG-1对应的siRNA沉默3种受体表达后,检测Poly(I:C)刺激NPC后MMP-1、13的mRNA表达,结果显示:沉默TLR-3表达后,Poly(I:C)刺激NPC后MMP-1、13的mRNA表达量相比对照组明显降低(P<0.05);而沉默MDA-5和RIG-1表达后,Poly(I:C)刺激NPC后MMP-1、13的mRNA表达量相比对照组,差异无统计学意义(P>0.05)。因此,Poly(I:C)诱导NPC表达MMP-1、13过程依赖于TLR-3途径,而非MDA-5和RIG-1两种途径。由此说明,在人NPC中,Poly(I:C)主要依赖与TLR-3相结合诱导MMP-1、13两种金属蛋白酶表达,TLR-3在病毒感染机体引起IVDD的过程中发挥着重要作用。
综上所述,IVDD的发生可能与机体感染病毒有关(病毒感染可能是诱发IVDD的因素之一)。Poly(I:C)作用于NPC通过TLR-3受体途径,引起MMP-1、13的表达量改变,进而引起ECM平衡改变,最终导致IVDD发生。因此,深入研究病毒感染对IVDD发生的影响,对探讨引起IVDD的因素具有一定意义。同时,也为IVDD的研究提供了新方向,给临床治疗IVDD提供了新思路。由于IVDD中MMPs表达升高往往伴随炎症因子的表达上调,因此,进一步研究方向将是Poly(I:C)诱导NPC表达MMP-1、13是否依赖其他细胞因子的产生,何种因子参与了这个过程。
[1]Peng B, Hao J, Hou S,etal. Possible pathogenesis of painful intervertebral disc degeneration[J]. Spine, 2006, 31(5): 560-566.
[2]Hamacher S, Matern S, Roeb E. Extracellular matrix -- from basic research to clinical significance. An overview with special consideration of matrix metalloproteinases[J]. Dtsch Med Wochenschr, 2004, 129(38): 1976-1980.
[3]Roberts S, Caterson B, Menage J,etal. Matrix metalloproteinases and aggrecanase: their role in disorders of the human intervertebral disc[J]. Spine, 2000, 25(23): 3005-3013.
[4]Murphy G, Hembry R M, Hughes C E,etal. Role and regulation of metalloproteinases in connective tissue turnover[J]. Biochem Soc Trans, 1990, 18(5): 812-815.
[5]Pockert A J, Richardson S M, Le Maitre C L,etal. Modified expression of the ADAMTS enzymes and tissue inhibitor of metalloproteinases 3 during human intervertebral disc degeneration[J].Arthritis Rheum,2009,60(2):482-491.
[6]Liu J, Roughley P J, Mort J S. Identification of human intervertebral disc stromelysin and its involvement in matrix degradation[J]. J Orthop Res, 1991, 9(4): 568-575.
[7]Alpantaki K, Katonis P, Hadjipavlou A G,etal. Herpes virus infection can cause intervertebral disc degeneration: a causal relationship[J]. J Bone Joint Surg Br, 2011, 93(9): 1253-1258.
[8]Fang F, Ooka K, Sun X,etal. A synthetic TLR3 ligand mitigates profibrotic fibroblast responses by inducing autocrine IFN signaling[J]. J Immunol, 2013, 191(6): 2956-2966.
[9]Boos N, Weissbach S, Rohrbach H,etal. Classification of age-related changes in lumbar intervertebral discs: 2002 Volvo Award in basic science[J]. Spine, 2002, 27(23): 2631-2644.
[10] Hamacher S, Matern S, Roeb E. Extracellular matrix -- from basic research to clinical significance. An overview with special consideration of matrix metalloproteinases[J]. Dtsch Med Wochenschr, 2004, 129(38): 1976-1980.
[11] Roberts S, Caterson B, Menage J,etal. Matrix metalloproteinases and aggrecanase: their role in disorders of the human intervertebral disc[J]. Spine, 2000, 25(23): 3005-3013.
[12] Anderson D G, Izzo M W, Hall D J,etal. Comparative gene expression profiling of normal and degenerative discs: analysis of a rabbit annular laceration model[J]. Spine, 2002, 27(12): 1291-1296.
[13] Yao C, Lee D H, Oh J H,etal. Poly(I:C) induces expressions of MMP-1, -2, and -3 through various signaling pathways including IRF3 in human skin fibroblasts[J]. J Dermatol Sci, 2015, 80(1): 54-60.
[14] Ichikawa T, Sugiura H, Koarai A,etal. TLR3 activation augments matrix metalloproteinase production through reactive nitrogen species generation in human lung fibroblasts[J]. J Immunol, 2014, 192(11): 4977-4988.
[15] Radwan M, Gavriilidis C, Robinson J H,etal. Matrix metalloproteinase 13 expression in response to double-stranded RNA in human chondrocytes[J]. Arthritis Rheum, 2013, 65(5): 1290-1301.
[16] Kalali B N, Köllisch G, Mages J,etal. Double-stranded RNA induces an antiviral defense status in epidermal keratinocytes through TLR3-, PKR-, and MDA5/RIG-I-mediated differential signaling[J]. J Immunol, 2008, 181(4): 2694-2704.
TheEffectofPoly(I:C)ontheExpressionofMMP-1andMMP-13inHumanNucleusPulposusCells
XiaXinyu1,HuSong2,LiuYang2,ZouQiang2,ChangShan3△.
1.SchoolofBasicMedicalSciences,ChengduMedicalCollege,Chengdu610500,China;2.CenterforScientificResearch,ChengduMedicalCollege,Chengdu610500,China;3.DepartmentofOrthopedics,TheFirstAffiliatedHospitalofChengduMedicalCollege,Chengdu610500,China
ObjectiveTo explore the effect of polyinosinic-polycytidylic acid (Poly (I:C)) on the expression of matrix metalloproteinases (MMP)-1and MMP-13in human nucleus pulposus cells (NPC).MethodsThe human nucleus pulposus cells were isolated by enzyme digestion from the human disc tissue and cultured in vitro. The human nucleus pulposus cells were treated with Poly (I:C) with different dosages at different time and then the mRNA and protein expression levels of MMP-1and MMP-13were detected by qPCR and Western blot. TLR3, RIG-I and MDA-5were inhibited by siRNAs respectively and then the mRNA expression level of MMP-1and MMP-13in the human nucleus pulposus cells were detected by qPCR.ResultsThe human nucleus pulposus cells grew with adherence after being cultured in vitro after5to6days. Poly(I:C) significantly increased the mRNA and protein expression levels of MMP-1and MMP-13in the human nucleus pulposus cells (P<0.05). The expression level of MMP-1and MMP-13significantly decreased in the cells transfected with TLR-3siRNA (P<0.05), while there were no significant differences among the expression levels of MMP-1and MMP-13in the cells transfected with RIG-1siRNA and MDA-5siRNA respectively.ConclusionPoly (I:C) upregulated the expression of MMP-1and MMP-13in human nucleus pulposus cells via TLR3mediated mechanism.
Nucleus pulposus cells; Poly (I:C); MMP-1and MMP-13; TLR-3
http://kns.cnki.net/kcms/detail/51.1705.R.20170707.0948.006.html
10.3969/j.issn.1674-2257.2017.04.014
四川省教育厅科研项目(No:14ZA0225)
:常山,E-mail:sayufeng@163.com
R363
A
△