晚期膝骨关节炎患者外周血中趋化因子表达谱的特征分析*
2017-09-15谢庆云符培亮李晓华钱齐荣
谢庆云,符培亮,陈 宜,王 波,李晓华,钱齐荣△
1 第二军医大学长征医院 关节外科(上海 200003);2 解放军成都军区总医院 骨科(成都 610083)
·论著·
晚期膝骨关节炎患者外周血中趋化因子表达谱的特征分析*
谢庆云1, 2,符培亮1,陈 宜1,王 波1,李晓华1,钱齐荣1△
1 第二军医大学长征医院 关节外科(上海 200003);2 解放军成都军区总医院 骨科(成都 610083)
目的探讨行关节置换术的晚期膝骨关节炎(osteoarthritis,OA)患者外周血中趋化因子谱的特征及变化,了解其慢性炎症状态。方法选取2016年1—7月在第二军医大学长征医院住院的行关节置换术的晚期膝OA患者共20例,设为OA组,同期选取本院体检中心健康体检者共20例为正常对照组,通过流式液相多重蛋白定量技术,检测两组血浆中趋化因子表达谱水平。结果OA组和正常对照组血浆中,IL-8(CXCL8)、IP-10(CXCL10)、Eotaxin(CCL11)、MCP-1(CCL2)的浓度差异无统计学意义(P>0.05);OA组血浆中,TARC(CCL17)和RANTES(CCL5)的浓度明显低于正常对照组(P<0.05)。结论晚期膝OA患者外周血中趋化因子的产生趋于平稳甚至逐渐降低,而炎症反应可能更多的局限于关节局部。
骨关节炎;趋化因子;炎症;关节置换术;流式液相多重蛋白定量技术
骨关节炎(osteoarthritis,OA)是一种慢性的肌肉骨骼系统疾病,主要影响滑膜关节的结构和功能,是全球主要致残性疾病之一[1]。OA的主要特征为软骨退变,关节软骨的逐渐丢失,造成关节破坏。目前认为,慢性炎症在OA的关节软骨破坏中发挥了重要作用[2]。趋化因子能够趋化促炎细胞到达关节局部,维持或加重炎症反应,阐明趋化因子表达谱的特征性改变,尤其是参与炎症和免疫紊乱的趋化因子,对于更深层次理解疾病的状态非常重要。本研究将通过流式液相多重蛋白定量技术(cytometric bead assay,CBA),分析晚期膝OA患者及正常对照组血浆中趋化因子谱的特征性变化,旨在探讨趋化因子在OA疾病诊断和治疗中的应用价值,为进一步阐明OA发病机制,探寻疾病诊断和判断疗效的生物学标记物提供参考依据。
1 资料与方法
1.1临床资料
选取2016年1—7月在第二军医大学长征医院住院的晚期膝OA患者,共20例,均符合1995年美国风湿病学会OA的诊断标准,诊断为原发性膝OA,有关节置换手术指征,并行全膝关节置换。排除标准:除外合并其他可能影响炎症指标的疾病,如感染、肿瘤、创伤等;同时,除外合并有其他风湿性疾病。记录患者相关临床资料,包括:病程、体质量指数(BMI)、视觉模拟评分法(visual analogue scale/score,VAS)、膝关节Kellgren-Lawrence(K-L)分级等。正常对照组为同期本院体检中心健康体检者,共20例。由于OA的发病率随着年龄的增加明显增高,故正常对照组年龄选取在24~45岁,并行膝关节平片以除外膝OA。两组性别、BMI构成上,差异无统计学意义(P>0.05)。使用EDTA管采集外周静脉血2 mL,离心后吸取上清,保存于-80 ℃待用。所有研究对象均行知情告知,并签署知情同意书(表1)。
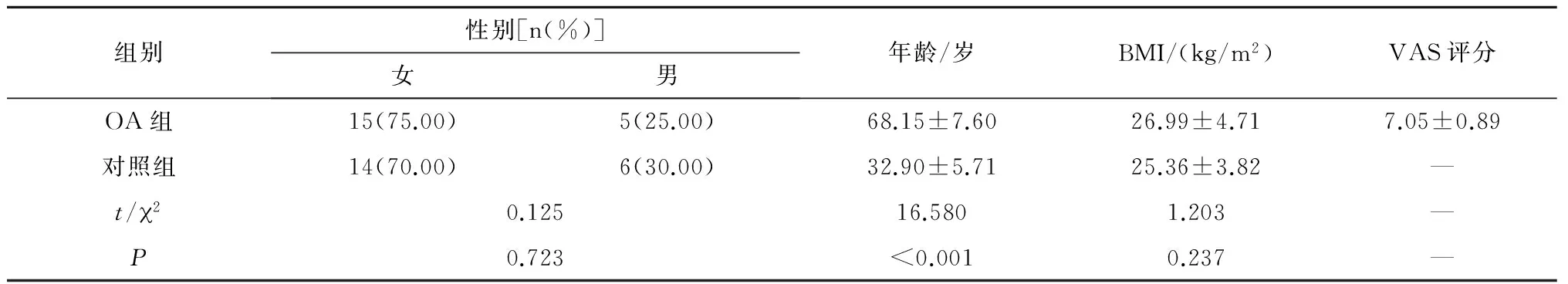
表1 两组基本特征比较(n=20)
1.2方法
使用LEGENDplexTMHuman Proinflammatory Chemokine Panel试剂盒(美国Biolegend公司),通过流式细胞仪,检测OA组及对照组血浆中多种趋化因子浓度。检测的趋化因子包括:IL-8(CXCL8)、IP-10(CXCL10)、Eotaxin(CCL11)、TARC(CCL17)、MCP-1(CCL2)和RANTES(CCL5)。具体操作步骤如下:1)制备标准品:按照1∶4稀释倍数,分别制备标准品C7~C1, Assay buffer作为标准品C0 (0 pg/mL)。2)样本稀释:血浆样本使用Assay buffer稀释两倍,血浆样本不稀释会导致结果不准确。3)用前所有试剂室温平衡,标准品应设置复孔。4)在96孔U底板中加入反应体系:标准曲线孔中,加入25 μL Matrix B;样本孔中加入25 μL Assay buffer;标准曲线孔中加入25 μL对应的标准品;样本孔中加入25 μL稀释后的血浆样本;所有孔中均加入25 μL混合微球和25 μL检测抗体。注意加入微球的过程中,需间断地摇晃微球,以避免微球沉降到瓶底。5)用铝箔将96孔板覆盖以避光,96孔板放置于摇板器上室温摇板,600 r,2 h。6)每孔中加入25 μLSA-PE。7)用铝箔将96孔板覆盖以避光,将96孔板放置于摇板器上室温摇板,600 r ,30 min。8)将96孔板离心,1 000 g,2 229 r/min,离心半径15.4 cm,5 min。9)用排枪尽可能吸去上清,注意不要吸走微球。10)每孔中加入200 μLWash buffer,摇板1 min以重悬微球。96孔板离心,1 000 g,2 229 r/min,离心半径15.4 cm,5 min,移去上清。11)每孔中加入200 μLWash buffer,用移液枪吹打重悬微球。流式细胞仪BD FACSCaliburTM(dual laser)上机,FL 2(575 nm)和FL 4(660 nm)通道采集荧光信号。
1.3统计学方法
2 结果
2.1流式细胞仪读取微球信息
BD FACSCaliburTM流式细胞仪FL 2(575 nm)和FL 4(660 nm)通道分别检测PE、APC荧光染料强度。根据微球大小和自身携带的APC荧光强度,可将微球分为6种类型,用以标记单个样本中的6种趋化因子。而每种特定类型微球的PE荧光强度则代表了相对应趋化因子的浓度(图1)。

图1 流式细胞仪检测血浆中趋化因子的浓度
注:A. 根据APC荧光强度可将微球分为6群,分别对应6种不同的趋化因子;B. 特定微球所结合的PE荧光强度代表了所对应趋化因子的浓度
2.2趋化因子标准曲线的多参数拟合
输入标准品的流式检测数据,使用LEGENDplexTMData Analysis Software进行标准曲线的多参数拟合。由此可见,所检测的6个趋化因子标准曲线变异范围为0.16%~2.80%,相关性R2=0.998~1.000。标准曲线拟合良好,可用于检测样本趋化因子浓度的计算(图2)。
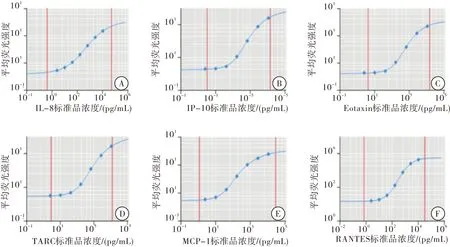
图2 多参数拟合趋化因子的标准曲线
注:A. IL-8(CXCL8)标准曲线;B. IP-10(CXCL10)标准曲线;C. Eotaxin(CCL11)标准曲线;D. TARC(CCL17)标准曲线;E. MCP-1(CCL2)标准曲线; F. RANTES(CCL5)标准曲线
2.3两组血浆中趋化因子的浓度
通过流式细胞仪检测APC和PE染料的荧光强度,对微球进行分群,并按照拟合的标准曲线,计算出每个样品中多重趋化因子的浓度。可以看出,OA组和正常对照组血浆中,IL-8(CXCL8)、IP-10(CXCL10)、Eotaxin(CCL11)、MCP-1(CCL2)的浓度差异无统计学意义(P>0.05);OA组血浆中TARC(CCL17)和RANTES(CCL5)的浓度明显低于正常对照组(P<0.05)(图3)。
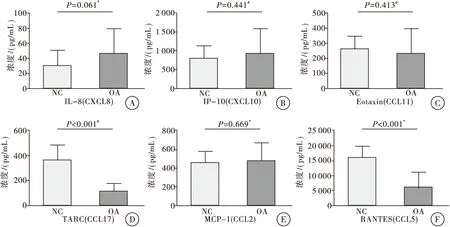
图3 OA组和正常对照组血浆中趋化因子的浓度
注:A. 两组血浆中IL-8(CXCL8)含量的比较;B. 两组血浆中IP-10(CXCL10)含量的比较;C. 两组血浆中Eotaxin(CCL11)含量的比较;D. 两组血浆中TARC(CCL17)含量的比较;E. 两组血浆中MCP-1(CCL2)含量的比较; F. 两组血浆中RANTES(CCL5)含量的比较;*表示两样本t检验;#表示采用Welch′st检验
3 讨论
OA是一种常见的以关节软骨退变为主要改变的疾病,全球70岁以上人群的发病率约为40%[3]。目前,尚无有效方法可以延缓或逆转病程,对晚期OA唯一有效的治疗方法为关节置换手术[4]。OA的发病机制尚不清楚,认为与应力刺激、年龄、遗传、炎症、肥胖、损伤及环境因素等相关[5]。因此,进一步阐明 OA 的发病机制,并探寻更加有效的治疗方法显得尤为重要。近年来,炎症在OA发病和疾病进程中的作用日益受到关注。有研究[6]认为,炎症因子网络失衡在OA的发病中具有重要作用,慢性非感染性炎症是OA全身及局部内环境的主要特征。
趋化因子是一类能使细胞发生趋化运动的小分子细胞因子,根据其N-端半胱氨酸的数量和位置,可分为CC、CXC、C和CX3C趋化因子[7]。趋化因子在免疫监视、器官发育、血管生成和免疫反应等多种生物学过程中发挥重要作用[8]。趋化因子的表达谱,尤其是参与炎症和免疫紊乱的趋化因子,对于更深层次的理解疾病的状态是非常重要的,而此前研究[9]多数是关注炎症细胞因子在OA发病机制中的作用,发现IL-1β、IL-6、IL-17、TNF-α等炎症细胞因子在早期OA患者的外周血及关节局部明显升高,诱导了关节软骨基质的破坏以及破骨细胞的分化。相比而言,关于趋化因子在OA发病及病程中的研究相对较少。
有学者[10]比较了关节置换的膝OA患者和膝关节创伤患者血清和关节液中的趋化因子水平,发现两组血清中CXCL8、CCL5的浓度差异无统计学意义(P>0.05),而晚期膝OA患者关节液中CCL5水平高于膝关节创伤组。Hampel等[11]检测了OA患者和RA患者关节液中趋化因子,发现OA患者关节液中Eotaxin、hGROα、IL-8、IL-10、MCP-1、MCP-2、MIG、RANTES和TARC水平均明显低于RA患者。另1项研究[12]入组了161例行玻璃酸钠关节腔注射的OA患者(K-L分级:2~4级),通过ELISA检测发现,OA患者血清中MCP-1(CCL2)浓度高于正常对照组,但与K-L分级、疼痛评分均缺乏相关性。早期膝OA患者血浆中CXCL2浓度较正常对照组明显升高,且与膝关节K-L分级具有相关性[13]。目前,尚缺乏晚期膝OA患者循环中趋化因子表达谱特征变化的研究报道。
本研究中,采用CBA分析了晚期膝OA患者及正常对照组血浆中趋化因子谱的变化特征。CBA是近年来发展起来的一种多重蛋白定量检测技术,与传统的ELISA方法相比较,具有更高的检测敏感性和更广泛的检测范围,能够同时对多个趋化因子进行定量测定[14]。结果显示,晚期膝OA组和正常对照组血浆中,IL-8(CXCL8)、IP-10(CXCL10)、Eotaxin(CCL11)和MCP-1(CCL2)的浓度差异无统计学意义(P>0.05);而晚期膝OA患者血浆中TARC(CCL17)和RANTES(CCL5)浓度较正常对照组明显降低(P<0.05)。本研究部分结果与已有的文献报道不完全一致,分析结果不一致的原因可能包括:其他研究大多纳入的是早期OA病例,而本研究中均为行关节置换术的晚期膝OA患者,K-L分级3~4级,不同研究之间OA病例组的入选标准不同造成了结果差异;不同检测方法对于异质性抗体检出的效率不同。TARC(CCL17)和RANTES(CCL5)作为CC趋化因子家族成员,主要生物学功能是将单核细胞和T细胞吸引、趋化至炎症部位[15]。由此推测:早期OA患者全身慢性炎症状态更加明显,晚期膝OA患者循环中趋化因子的产生趋于平稳甚至逐渐降低,而炎症反应可能更多局限于关节局部。
本研究的局限性包括:首先,样本含量较小,还需要进一步通过更大样本量的研究加以证实;其次,由于正常对照组关节液很难获取,本研究没有比较晚期膝OA患者和正常对照组关节液中的趋化因子,无法证实关节局部趋化因子谱的特征性改变。总之,还需要进行更加深入的研究,进一步阐明趋化因子在OA疾病发生、发展中的作用及机制,从整体上研究细胞因子之间的相互作用,探寻疾病的血清生物学标记物,同时,开发简单、准确的多指标联合检测方法,为疾病的诊断、治疗和预后评估提供更为可靠的依据。
[1]Hoy D G, Smith E, Cross M,etal.Reflecting on the global burden of musculoskeletal conditions: lessons learnt from the global burden of disease 2010 study and the next steps forward[J]. Ann Rheum Dis, 2015, 74(1): 4-7.
[2]de Lange-Brokaar B J, Ioan-Facsinay A, van Osch G J,etal. Synovial inflammation, immune cells and their cytokines in osteoarthritis: a review[J]. Osteoarthr Cartil, 2012, 20(12): 1484-1499.
[3]Dieppe P A, Lohmander L S. Pathogenesis and management of pain in osteoarthritis[J]. Lancet, 2005, 365(9463):965-973.
[4]Bomer N, den Hollander W, Ramos Y F,etal. Underlying molecular mechanisms of DIO2 susceptibility in symptomatic osteoarthritis[J]. Ann Rheum Dis, 2015, 74(8): 1571-1579.
[5]Ramos Y F, Bos S D, Lakenberg N,etal. Genes expressed in blood link osteoarthritis with apoptotic pathways[J]. Ann Rheum Dis,2014, 73(10):1844-1853.
[6]Mendel O I, Luchihina L V, Mendel W. Aging and osteoarthritis.chronic nonspecific inflammation as a link between aging and osteoarthritis(Review)[J].Adv Gerontol, 2015, 28(2):274-283.
[7]Zlotnik A, Yoshie O. The chemokine superfamily revisited[J]. Immunity, 2012, 36(5):705-716.
[8]Stein J V, Nombela-Arrieta C. Chemokine control of lymphocyte trafficking: a general overview[J]. Immunology, 2005, 116(1):1-12.
[9]Benito M J, Veale D J, FitzGerald O,etal. Synovial tissue inflammation in early and late osteoarthritis[J]. Ann Rheum Dis, 2005, 64(9):1263-1267.
[10] Pierzchala A W, Kusz D J, Hajduk G. CXCL8 and CCL5 expression in synovial fluid and blood serum in patients with osteoarthritis of the knee[J]. Arch Immunol Ther Exp(Warsz), 2011, 59(2):151-155.
[11] Hampel U, Sesselmann S, Iserovich P,etal. Chemokine and cytokine levels in osteoarthritis and rheumatoid arthritis synovial fluid[J]. J Immunol Methods, 2013, 396(1/2):134-139.
[12] Li L, Jiang B E. Serum and synovial fluid chemokine ligand 2/monocyte chemoattractant protein 1 concentrations correlates with symptomatic severity in patients with knee osteoarthritis[J]. Ann Clin Biochem,2015, 52(Pt 2):276-282.
[13] He W, Wang M, Wang Y,etal. Plasma and Synovial Fluid CXCL12 Levels Are Correlated With Disease Severity in Patients With Knee Osteoarthritis[J]. J Arthroplasty, 2016, 31(2): 373-377.
[14] Tsuchida A I, Beekhuizen M, 't Hart M C,etal. Cytokine profiles in the joint depend on pathology, but are different between synovial fluid, cartilage tissue and cultured chondrocytes[J]. Arthritis Res Ther, 2014, 16(5): 441.
[15] Deshmane S L, Kremlev S, Amini S,etal. Monocyte chemoattractant protein-1 (MCP-1): an overview[J]. J Interferon Cytokine Res, 2009, 29(6):313-326.
TheCharacteristicAnalysisoftheExpressionProfileofChemokinesinthePeripheralBloodofPatientswithAdvancedKneeOsteoarthritis
XieQingyun1,2,FuPeiliang1,ChenYi1,WangBo1,LiXiaohua1,QianQirong1△.
1.DepartmentofJointSurgery,ChangzhengHospitalofTheSecondMilitaryMedicalUniversity,Shanghai200003,China;2.DepartmentofOrthopaedics,GeneralHospitalofChengduMilitaryRegion,Chengdu610083,China
ObjectiveTo investigate the characteristics of chemokines in the peripheral blood of patients with advanced knee osteoarthritis (OA) treated with arthroplasty and understand the state of patients′ chronic inflammation.MethodsThe twenty patients with advanced knee OA treated with arthroplasty in Changzheng Hospital of The Second Military Medical University from January to July of2016were selected into the OA group, while the other twenty healthy controls were selected from those undergoing the medical examination in Medical Examination Centre of the hospital over the corresponding period. The cytometric bead array method was used to measure the expression profile of chemokines in the plasma of the two groups.ResultsThere were no significant differences between the OA group and the control group in the levels of IL-8(CXCL8), IP-10(CXCL10), Eotaxin (CCL11) and MCP-1(CCL2) (P>0.05). The concentrations of TARC (CCL17) and RANTES (CCL5) were significantly lower in the plasma of the OA group than in that of the control group (P<0.05).ConclusionThe production of chemokines in the patients with advanced knee OA tend to be stable and even decreased and the inflammatory reaction may be more limited to the joint.
Osteoarthritis; Chemokine; Inflammation; Arthroplasty; Cytometric bead array
http://kns.cnki.net/kcms/detail/51.1705.R.20170511.1641.002.html
10.3969/j.issn.1674-2257.2017.04.013
四川省科技厅重点研发项目(No:2017SZ0128);四川省卫生厅基金项目(No:130320;No:130322)
:钱齐荣,E-mail:qianqr@163.com
R684.3
A
△