BD926对骨髓源性未成熟树突状细胞增殖及吞噬作用的影响*
2017-09-15苏志伟段佳毅王衍堂
苏志伟,杨 苗,杨 凯,徐 灿,彭 旭,段佳毅,冷 潇,,王衍堂,△
1. 成都医学院 生物医学系(成都 610500);2. 成都医学院基础医学院 免疫教研室(成都 610500)
·论著·
BD926对骨髓源性未成熟树突状细胞增殖及吞噬作用的影响*
苏志伟1,杨 苗2,杨 凯1,徐 灿1,彭 旭1,段佳毅1,冷 潇1,2,王衍堂1,2△
1. 成都医学院 生物医学系(成都 610500);2. 成都医学院基础医学院 免疫教研室(成都 610500)
目的研究苯并噻唑类衍生物BD926对小鼠骨髓源性未成熟树突状细胞(immature dendritic cells, imDCs)增殖及吞噬作用的影响。方法分离小鼠骨髓源性单核细胞诱导imDCs,借助PE/Annexin V凋亡检测试剂盒、CFSE细胞增殖试剂盒以及FITC-葡聚糖,应用流式细胞术检测BD926对imDCs在粒细胞-巨噬细胞集落刺激因子(granulocyte macrophage colony stimulating factor,GM-CSF)刺激下的细胞存活、细胞增殖以及吞噬作用的影响。结果与PBS组相比,25 、5 、1 μM 的BD926处理imDCs后,其细胞增殖水平降低,差异有统计学意义(P<0.05);高、中、低3个剂量组BD926处理后,imDCs与PBS组相比,细胞存活差异无统计学意义 (P>0.05);高、中、低3个剂量组BD926处理后,imDCs与PBS组相比,吞噬作用差异无统计学意义 (P>0.05)。结论BD926在体外可明显抑制GM-CSF刺激的imDCs增殖作用,对imDCs的细胞存活和吞噬作用则无明显影响。
苯并噻唑类衍生物;未成熟树突状细胞;细胞增殖;吞噬作用;凋亡
树突状细胞(dendritic cells, DCs) 起源于骨髓多功能造血干细胞(multiple hematopoietic stem cell, MHSCs),是机体内最强大的专职抗原递呈细胞(antigen presenting cells, APC),能高效激活幼稚T细胞,在诱导T细胞介导的免疫应答以及T细胞相关的免疫耐受过程中存在极为重要的作用[1]。DCs作为连接天然免疫和获得性免疫的桥梁,近期研究[2]提示,其在自身免疫性疾病发病中的作用愈发重要。DCs摄取自身抗原,经加工后呈递并激活外周幼稚T细胞,其分泌的细胞因子如IL-6、IL-12、IL-23和TGF-β等亦是诱导Th1和Th17细胞分化的关键要素[3-4]。DCs的细胞表面分子表型、成熟度和细胞因子功能的异质性是免疫反应和免疫耐受实现动态平衡的重要因素。成熟DCs(mature dendritic cells, mDCs)表达高丰度的共刺激分子,分泌大量T细胞活化相关的细胞因子(如IL-6、IL-12、IL-18、IL-23等),选择性激活并诱导各亚型T细胞分化,进而产生免疫反应。未成熟树突状细胞(immature dendritic cells, imDCs)表达低水平的MHC分子以及CD40、CD80和CD86等共刺激分子,但具有较强的吞噬、迁移能力以及增殖特性[5]。
苯并噻唑类衍生物是一类芳香族杂环化合物,既往研究主要集中于肿瘤[6-7]与细菌感染[8],但其免疫抑制活性相关的研究尚未见报道。本研究合成筛选出一组苯并噻唑衍生物,可明显抑制小鼠和人的T细胞增殖。其中,以BD750活性最高,该化合物通过抑制IL-2诱导的STAT5磷酸化在2μM浓度下,即可有效抑制T细胞增殖[9]。尽管BD750在体外具有较好的免疫抑制活性,但其体内免疫抑制作用一般,其原因可能是BD750难溶于水,吸收缓慢,达不到有效的血药浓度。通过对BD750进行化学修饰等结构改造,合成其新的水溶性衍生物BD926,发现BD926亦能明显抑制T细胞增殖,且相关分子机制与BD750相似,亦是作用于STAT5磷酸化信号通路[10]。而过去研究[11-12]已证实,粒细胞-巨噬细胞集落刺激因子(granulocyte-macrophage colony stimulating factor,GM-CSF)通过诱导STAT5活化,在单核细胞、巨噬细胞以及DCs等髓系免疫细胞的增殖、活化和成熟方面存在关键作用。因此,本研究拟观察BD926处理的小鼠骨髓源性的imDCs,在GM-CSF刺激后,其存活、增殖和吞噬相关的细胞功能是否发生改变。探讨BD926是否因其对STAT5磷酸化的抑制作用,干扰小鼠骨髓来源imDCs在GM-CSF刺激后的细胞活动,从而为水溶性苯并噻唑类衍生物BD926在后续动物体内干预自身免疫性疾病发病提供更为丰富的体外实验数据。
1 材料与方法
1.1实验材料
1.1.1 实验动物 6~8周龄雄性SPF级C57BL/6小鼠(北京维通利华),饲养于成都医学院科研实验中心SPF动物房。实验动物使用许可证号:SYXK(川)2015-196,室温20 ~ 26 ℃,相对湿度40%~70%,光暗周期(12 h/12 h)。
1.1.2 主要实验试剂 rmGM-CSF购买于美国Peprotech公司;LPS购买于美国Sigma公司;FITC-Dextran(40 000 MW)购买于美国Sigma公司;PE Annexin V Apoptosis Detection Kit I购买于美国BD Pharmingen公司;CellTrace CFSE Cell Proliferation Kit购买于美国Invitrogen公司。
1.2实验方法
1.2.1 小鼠骨髓源性imDCs纯化分离及受试药物
取雄性C57BL/6小鼠(6~8周龄),行颈椎脱臼,处死后,放入75%酒精,浸泡消毒3 min。无菌条件下,分离股骨,放入冰浴中的无血清RPMI-1640培养基中。70% 酒精浸泡消毒2 min, 预冷的无血清RPMI-1640培养基洗涤2次。剪掉股骨末端骨骺,借助1 mL注射器,吸取PBS缓冲液对骨髓腔反复冲洗,收集冲洗后的细胞悬液,40 μm孔径细胞筛网(美国BD Falcon)过滤。离心(300 g/min, 5 min),弃上清,加入红细胞裂解液去除红细胞,PBS洗涤,离心(300 g/min, 5 min),收集细胞。细胞计数,调整细胞密度(1×106个/mL),并重悬于RPMI-1640培养基(10%胎牛血清)中,接种至100 mm平皿,加入rmGM-CSF 20 ng/mL,5%CO2孵箱,37 ℃培养。细胞培养24 h换液,吸弃含未贴壁细胞及细胞碎片的培养液。加入新的RPMI-1640完全培养基,吹打收集轻微黏附贴壁细胞,调整细胞密度(1×106个/mL),重新接种于24孔细胞培养板,培养条件同前。
本实验的受试药物苯并噻唑类衍生物BD926 [sodium 2-(benzo[d]thiazol-2-yl)-4,5,6,7-tetrahydro-2H-indazol-3-olate, C14H12N3NaOS, MW: 293.3],是在之前已报道的小分子化合物BD750 [2-(2-benzothiazoleyl)-4,5,6,7-tetrahydro-2H-indazol-3-ol, C14H13N3OS, MW: 271.3]的结构基础上进行化学修饰优化后得到的水溶性衍生物(图1)[9]。
1.2.2 剂量设计 本研究设5个实验组,每组设2复孔,剂量设计如下所示(表1)。
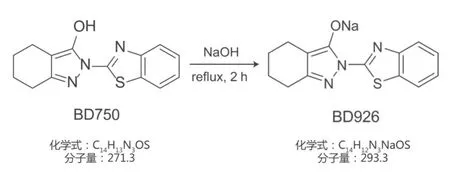
图1 水溶性苯并噻唑类衍生物BD926的合成
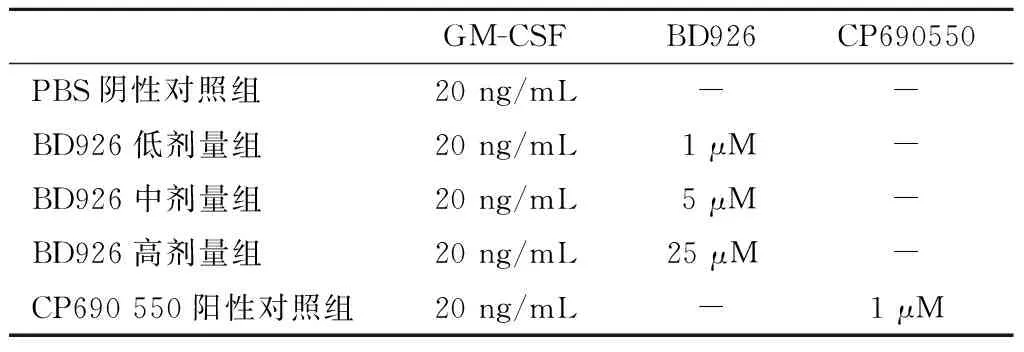
GM-CSFBD926CP690550PBS阴性对照组20ng/mL--BD926低剂量组20ng/mL1μM-BD926中剂量组20ng/mL5μM-BD926高剂量组20ng/mL25μM-CP690550阳性对照组20ng/mL-1μM
1.2.3 流式细胞术检测BD926对imDCs细胞存活的影响 在细胞培养第2天,重新接种于24孔培养板的imDCs(细胞密度1×106个/mL),在加入20 ng/mL的GM-CSF以及实验设计的各剂量组药物后,继续培养48 h。培养结束后,按PE/Annexin V凋亡检测试剂盒说明书进行染色,应用BD公司Accuri C6分析型流式细胞进行检测。
1.2.4 流式细胞术检测BD926对imDCs细胞增殖的影响 在细胞培养第2天,自100 mm平皿收集的轻微黏附贴壁细胞。细胞计数,调整细胞密度(1×106个/mL)。加入CFSE溶液(2 M),孵育10 min(37 ℃),每2 min吹打混匀;加入含5% 胎牛血清的PBS缓冲液(预冷)中止染色,离心(300 g/min, 5 min),收集细胞,PBS缓冲液重复洗涤两次。调节细胞密度为1×106个/mL,接种于24孔培养板的imDCs,加入20 ng/mL的GM-CSF以及实验设计的各剂量组药物后,继续培养48 h。培养结束后,收集细胞,PBS洗涤后上机检测。
1.2.5 流式细胞术检测BD926对imDCs细胞吞噬作用的影响 在细胞培养第2天,接种于24孔培养板的imDCs(细胞密度1×106个/mL),在加入20 ng/mL的GM-CSF以及实验设计的各剂量组药物后,继续培养48 h。收集细胞并调整细胞密度至1×106个/mL,重新接种于24孔培养板。加入FITC-Dextran终浓度为1 mg/mL,37 ℃,孵育60 min,预冷PBS洗涤2次后,上机检测imDCs对抗原的摄取能力。
1.3统计学方法
2 结果
2.1BD926对imDCs细胞存活的影响
BD926高、中、低3个剂量组干预后的imDCs在培养48 h后,其细胞存活率与PBS阴性对照组相比,差异无统计学意义(P>0.05);细胞凋亡率(Annexin V阳性细胞比率)与PBS阴性对照组相比,差异无统计学意义(P>0.05)(图2)。
2.2BD926对imDCs细胞增殖的影响
BD926高、中、低3个剂量组干预后的imDCs在培养48 h后,其细胞增殖与PBS阴性对照组相比,增殖指数降低,差异有统计学意义(P<0.05);且BD926对GM-CSF诱导的imDCs细胞增殖的抑制作用存在一定剂量依赖关系。此外,1 μM CP690 550对imDCs的细胞增殖亦有抑制作用,差异有统计学意义(P<0.05)(图3)。
2.3BD926对imDCs吞噬作用的影响
BD926高、中、低3个剂量组干预后的imDCs,对Dextran的摄取能力与PBS阴性对照组相比,差异无统计学意义(P>0.05);此外,1 μM CP690 550干预后的imDCs对Dextran的摄取能力与PBS阴性对照组相比,差异无统计学意义(P>0.05)(图3)。
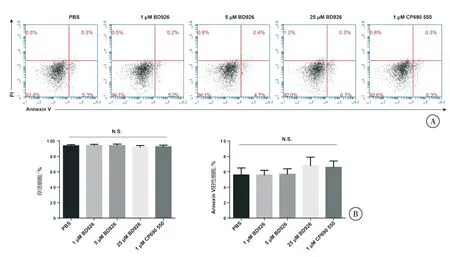
图2 BD926对骨髓源性imDCs细胞活性的影响注:A. PI/Annexin V双染后,流式细胞术检测imDCs凋亡率;B. 定量分析存活细胞及Annexin V阳性细胞比率
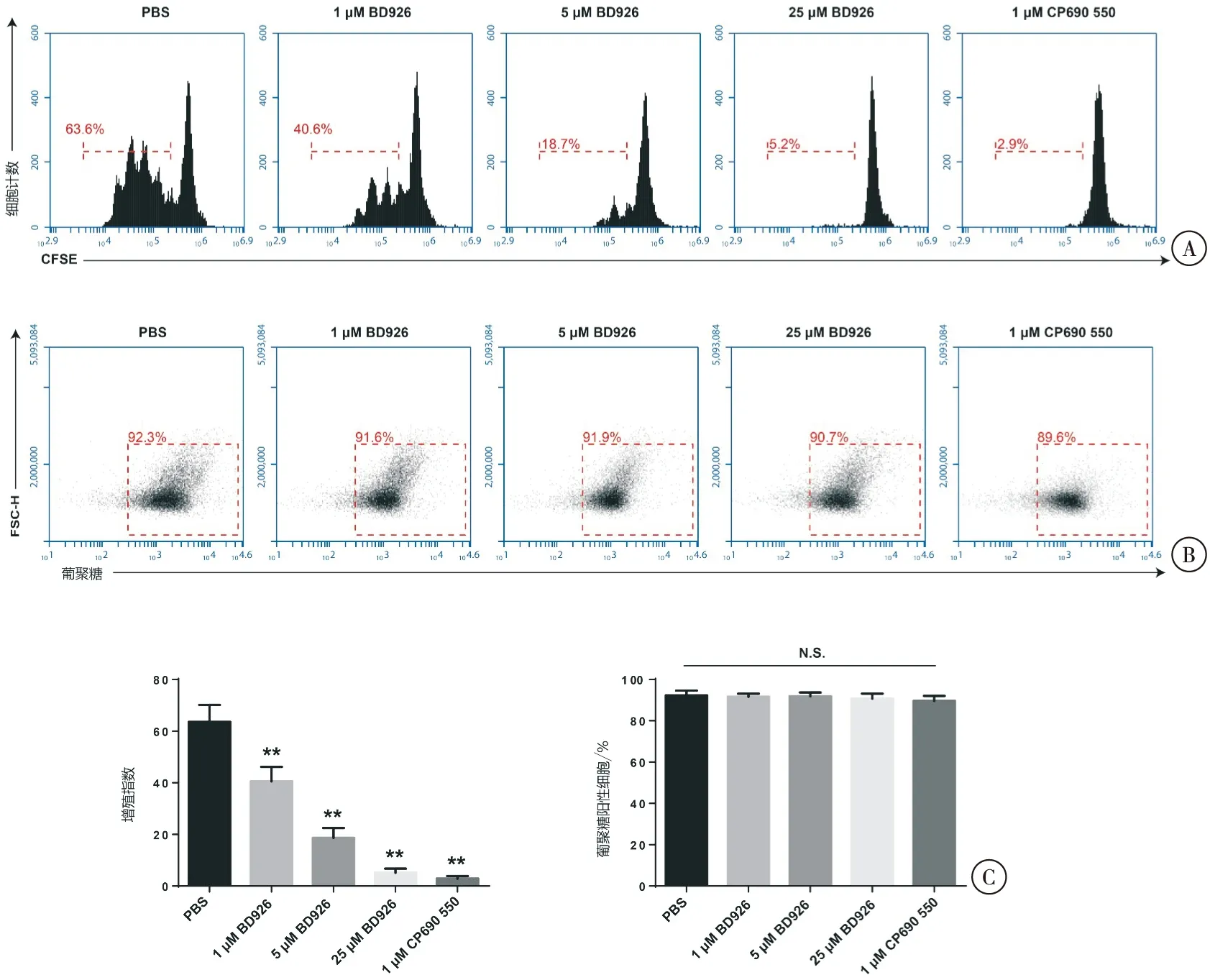
图3 BD926对骨髓源性imDCs细胞增殖及吞噬作用的影响
注:A. CFSE标记后,流式细胞术检测imDCs增殖率;B. 流式细胞术检测imDCs对Dextran的吞噬作用;C. 定量分析细胞增殖指数及Dextran阳性细胞比率;与PBS阴性对照组比较,**P<0.05
3 讨论
具有免疫抑制活性的小分子化合物在移植免疫和自身免疫等领域的临床用药中显现其日益重要的地位。2012年,美国食品药品管理局(FDA)批准辉瑞公司开发的Jak抑制剂CP690 550用于治疗甲氨喋呤疗效不佳或不耐受的中至重度活动性类风湿关节炎(RA)成人患者。本研究小组筛选出新型苯并噻唑类衍生物BD750,其化学结构与当前进入临床阶段的小分子免疫抑制剂如CP690 550、雷帕霉素、环孢霉素A及FK506等存在明显差异,表明BD750是一种全新的免疫抑制剂[13]。在体外实验研究中,进一步明确BD750通过阻断STAT5信号通路完全抑制T细胞增殖[9]。而其经过化学修饰结构改造后得到的水溶性衍生物BD926,也表现相似的体外活性以及分子机制[10]。因此,BD926具有成为新型STAT5信号通路抑制剂的潜力,其作为先导化合物,通过将来持续的优化改造,有望成为应用于对抗移植排异以及自身免疫性疾病的免疫抑制药物。在后续的体内实验中,将着重研究苯并噻唑类衍生物BD926对不同的自身免疫疾病动物模型的发病及疾病活动的干预作用。由于STAT5信号通路广泛存在于机体不同的细胞类型,具有重要的生理学意义[6]。因此,BD926进入机体后,对T细胞以外的其他细胞,尤其是其他免疫细胞的细胞功能的影响也非常值得关注。
在本研究中,探讨了苯并噻唑类衍生物BD926对骨髓源性imDCs增殖及吞噬作用的影响,结果显示,1 μM BD926在体外即可明显抑制骨髓源性imDCs在GM-CSF刺激后的细胞增殖作用,而在25 μM的药物作用浓度下能基本实现对imDCs增殖的完全抑制。但高、中、低3个剂量组的BD926对imDCs的存活和吞噬作用则无明显影响。imDCs因其增殖能力、吞噬功能、趋化作用、细胞形态以及活化分子和共刺激因子等细胞表面标记的表达方面与mDCs均存在明显差异。但imDCs在吞噬摄取外来或自身抗原并加工呈递活化幼稚T细胞,以及在受到抗原刺激后分化成熟并分泌大量的炎性细胞因子在T细胞相关反应中,存在不可或缺的作用,是连接固有免疫与获得性免疫之间的重要桥梁[14]。近期研究[15]发现,imDCs因其与mDCs在成熟度和功能上的差异,在诱导机体免疫耐受等方面亦存在不可或缺的作用 。因此,BD926对imDCs细胞扩增、存活和吞噬方面的影响,在药物调节机体的免疫反应过程中亦不容忽视。本研究为水溶性苯并噻唑类衍生物BD926在后续动物体内干预自身免疫性疾病发病提供更为坚实和丰富的体外实验数据。
[1]Minton K. Dendritic cells: Choosing the right presentation[J]. Nat Rev Immunol, 2011, 11(12): 804.
[2]Ganguly D, Haak S, Sisirak V,etal. The role of dendritic cells in autoimmunity[J]. Nat Rev Immunol, 2013, 13(8): 566-577.
[3]Reis e Sousa C. Dendritic cells in a mature age[J]. Nat Rev Immunol, 2006, 6(6): 476-483.
[4]Mohammad M G, Hassanpour M, Tsai V W,etal. Dendritic cells and multiple sclerosis: disease, tolerance and therapy[J]. Int J Mol Sci, 2012, 14(1): 547-562.
[5]Ardavín C. Origin, precursors and differentiation of mouse dendritic cells[J]. Nat Rev Immunol, 2003, 3(7): 582-590.
[6]Wang Z, Shi X H, Wang J,etal. Synthesis, structure-activity relationships and preliminary antitumor evaluation of benzothiazole-2-thiol derivatives as novel apoptosis inducers[J]. Bioorg Med Chem Lett, 2011, 21(4): 1097-1101.
[7]Chakraborty M, Jin K J, Glover S A,etal. Characterization of the 4-(benzothiazol-2-yl)phenylnitrenium ion from a putative metabolite of a model antitumor drug[J]. J Org Chem, 2010, 75(15): 5296-5304.
[8]Aridoss G, Amirthaganesan S, Jeong Y T. Synthesis, crystal and antibacterial studies of diversely functionalized tetrahydropyridin-4-ol[J]. Bioorg Med Chem Lett, 2010, 20(7): 2242-2249.
[9]Liu Y, Yang T, Li H,etal. BD750, a benzothiazole derivative, inhibits T cell proliferation by affecting the JAK3/STAT5 signalling pathway[J]. Br J Pharmacol, 2013, 168(3): 632-643.
[10] Liu Y, Lai Y, Li H,etal. A novel water-soluble benzothiazole derivative BD926 inhibits human activated T cell proliferation by down-regulating the STAT5 activation[J]. Eur J Pharmacol, 2015, 761: 36-43.
[11] Litherland S A, Xie T X, Grebe K M,etal. Signal transduction activator of transcription 5 (STAT5) dysfunction in autoimmune monocytes and macrophages[J]. J Autoimmun, 2005, 24(4): 297-310.
[12] Lehtonen A, Matikainen S, Miettinen M,etal. Granulocyte-macrophage colony-stimulating factor (GM-CSF)-induced STAT5 activation and target-gene expression during human monocyte/macrophage differentiation[J]. J Leukoc Biol, 2002, 71(3): 511-519.
[13] Ghoreschi K, Gadina M. Jakpot! New small molecules in autoimmune and inflammatory diseases[J]. Exp Dermatol, 2014, 23(1): 7-11.
[14] Villarino A V, Kanno Y, Ferdinand J R,etal. Mechanisms of Jak/STAT signaling in immunity and disease[J]. J Immunol, 2015, 194(1): 21-27.
[15] Zhou Y, Leng X, Luo S,etal. Tolerogenic Dendritic Cells Generated with Tofacitinib Ameliorate Experimental Autoimmune Encephalomyelitis through Modulation of Th17/Treg Balance[J]. Journal of Immunology Research, 2016, 2016:1-13.
TheEffectofBD926ontheProliferationandPhagocytosisofMurineBoneMarrow-DerivedImmatureDendriticCells
SuZhiwei1,YangMiao2,YangKai1,XuCan1,PengXu1,DuanJiayi1,LengXiao1, 2,WangYantang1, 2△.
1.SchoolofBiomedicalSciences,ChengduMedicalCollege,Chengdu610083,China;2.DepartmentofImmunology,SchoolofBasicMedicalSciencesofChengduMedicalCollege,Chengdu610083,China
ObjectiveTo study the effect of the Benzothiazole derivative BD926on the proliferation and phagocytosis of murine bone marrow-derived immature dendritic cells (imDCs).MethodsImDCs were isolated and induced from murine bone marrow-derived mononuclear cells. The flow cytometry (FCM) was used to detect the effect of BD926on the cell survival, proliferation and phagocytosis of imDCs upon the stimulation of GM-CSF with the help of PE/Annexin V Apoptosis Detection Kit, CellTrace CFSE Cell Proliferation Kit and FITC-dextran.ResultsCompared with the PBS group, the cell proliferation of imDCs treated by BD926of25μM,5μM and1μM respectively were significantly reduced in a concentration-dependent manner (P<0.05), while the survival and phagocytosis of imDCs treated by BD926of the high, medium and low dosage respectively were not statistically different from those of imDCs in the PBS group (P>0.05).ConclusionThe Benzothiazole derivative BD926can suppress the proliferation of imDCs stimulated by GM-CSF in vitro, and it has no obvious effect on the survival and phagocytosis of imDCs.
Benzothiazole derivative; Immature dendritic cells; cell proliferation; Phagocytosis; Apoptosis
http://kns.cnki.net/kcms/detail/51.1705.R.20170901.1059.014.html
10.3969/j.issn.1674-2257.2017.04.011
国家自然科学基金资助项目(No: 81202363);国家级大学生创新创业训练计划项目(No:201513705005);发育与再生四川省重点实验室研究基金(No:SYS16-002)
:王衍堂,E-mail: yt-wang@hotmail.com
R392.5
A
△