运动对大鼠骨骼肌细胞凋亡及钙离子含量的影响
2017-09-15王海生王志勇蒋欢欢
王海生,王志勇,蒋欢欢
(1.河北北方学院公共体育部,河北张家口 075000;2.河北北方学院附属第二医院药剂科,河北张家口 075000)
运动对大鼠骨骼肌细胞凋亡及钙离子含量的影响
王海生1,王志勇1,蒋欢欢2
(1.河北北方学院公共体育部,河北张家口 075000;2.河北北方学院附属第二医院药剂科,河北张家口 075000)
探讨运动对大鼠骨骼肌细胞凋亡及钙离子含量的影响。将大鼠分为对照组、一般运动组和强运动组,对照组大鼠正常活动,一般运动组大鼠跑台速度为18 m/min,强运动组大鼠跑台速度为25 m/min,一般运动组和强运动组大鼠均运动至力竭。分别检测大鼠比目鱼肌和胫骨前肌细胞凋亡情况,大鼠血清和大鼠后肢组织匀浆上清中超氧化物歧化酶(SOD)活性、丙二醛(MDA)含量和钙离子水平,大鼠肌肉组织中Bax、Bcl-2表达水平。结果发现,一般运动组大鼠比目鱼肌中细胞凋亡率和SOD活性均明显高于对照组,差异极显著(P<0.01)。强运动组大鼠比目鱼肌中的SOD活性明显低于一般运动组,差异极显著(P<0.01)。试验组大鼠血清中MDA水平均明显低于对照组,差异极显著(P<0.01)。一般运动组大鼠胫骨前肌和比目鱼肌中MDA水平均明显高于对照组和强运动组,差异极显著(P<0.01)。一般运动组大鼠比目鱼肌中钙离子水平和Bax表达水平明显高于对照组,差异显著(P<0.05)。一般运动组大鼠比目鱼肌中Bcl-2表达水平明显低于对照组,差异极显著(P<0.01)。表明一般运动比高强度运动更易导致比目鱼肌细胞凋亡,作用机制可能与钙离子浓度、氧自由基水平、Bax、Bcl-2有关。
运动;细胞凋亡;比目鱼肌;胫骨前肌
细胞凋亡(apoptosis)是一种正常情况下的细胞程序性死亡,是机体维持内环境稳定的重要方式。骨骼肌细胞凋亡在骨骼肌正常发育、生长过程中具有重要作用[1]。有研究表明,运动可造成骨骼肌细胞的凋亡[2],发现小鼠的肌肉细胞经过自发齿轮运动后出现凋亡[3]。纯种马在经过长期的跑台训练后,TUNEL检测发现,肌细胞出现凋亡[4]。骨骼肌细胞凋亡情况与运动强度、运动时间和运动方式有关。
细胞凋亡途径有多种,其中线粒体途径是目前研究最多的[5]。比目鱼肌和胫骨前肌分别是大鼠典型的运动慢肌和快肌。研究表明,慢肌中含有的线粒体比快肌中更多[6]。为了明确不同运动强度对慢肌和快肌中骨骼肌细胞凋亡的影响,本研究以大鼠为模型,分别经过不同的运动强度训练后,检测大鼠胫骨前肌和比目鱼肌中的细胞凋亡及钙离子含量变化情况,以期为进一步研究运动对骨骼肌细胞凋亡的影响奠定基础。
1 材料与方法
1.1 材料
1.1.1 实验动物 36只成年SD雄性大鼠,体重200 g~220 g,2月龄,购自河北省实验动物中心。
1.1.2 主要仪器及试剂 紫外分光光度计,美国Thermo公司产品;BCA蛋白浓度检测试剂盒,美国Sigma公司产品;SOD活性检测试剂盒,上海纪宁实业有限公司产品;组织蛋白含量测定试剂盒,南京建成生物科技有限公司产品;钙离子含量检测试剂盒,浙江爱康生物科技有限公司产品;Bcl-2单克隆抗体、Bax单克隆抗体、GAPDH单克隆抗体、辣根过氧化物标记的二抗,美国CTS公司产品。
1.2 方法
1.2.1 分组 36只成年雄性大鼠随机分为3组,每组12只。分别为对照组(1组)、一般运动组(2组)、强运动组(3组)。所有实验动物饲养温度为22℃~23℃,每天光照时间为7:00~19:00。一般运动组跑台速度为18 m/min,强运动组跑台速度为25 m/min,两组大鼠运动至力竭后停止。对照组大鼠正常活动不运动。一般运动组和强运动组在试验开始前1周均进行适应性训练,每天运动10 min,跑台速度为10 m/min。实验跑台坡度均为0°。
1.2.2 标本制作 各组大鼠运动后立即断颈处死,同时取颈部血液3 mL,在室温下静置60 min 后,4 000 r/min离心15 min,吸取血清上清至新的EP管,放置于4℃备用。取后肢比目鱼肌和胫骨前肌,其中右后肢部分用于制作石蜡切片和Western blot。左后肢部分用来制作组织匀浆和组织蛋白含量测定。组织匀浆和石蜡切片均按照常规方法操作制备[7]。
1.2.3 细胞凋亡检测 取制作厚度为5 μm的石蜡切片,放置于二甲苯中脱蜡,水化后,放在8.5 g/L的氯化钠溶液中浸泡5 min,PBS洗涤后用40 g/L的多聚甲醛固定,固定时间为10 min。PBS洗涤后,按照每片100 μL加入浓度为20 μg/mL的Proteinase K处理组织20 min。PBS洗涤后,用40 g/L多聚甲醛固定5 min,PBS洗涤,加入100 μL平衡液,放置于湿盒中孵育12 min。加入100 μL的TUNEL混合液,在37℃避光湿盒中反应60 min。用H2O2封闭POD,PBS洗涤后,加入体积为100 μL的Streptavidin标记的HRP(500倍稀释)反应3 min。PBS洗涤,加100 μL的DAB溶液,孵育反应10 min,用苏木素复染,二甲苯透明后封片。观察细胞凋亡情况。每组大鼠随机选择8组切片,显微镜下随机选择2个视野观察凋亡细胞数目,计算细胞凋亡率。
1.2.4 SOD水平检测 各组大鼠断颈处死后,取血清和组织匀浆,按照SOD检测试剂盒说明书检测SOD水平。组织蛋白含量水平按照组织蛋白测定试剂盒说明书检测肌肉组织中的蛋白含量。待测样品中含有SOD时,亚硝酸盐形成减少,待测管的吸光度会低于对照管的吸光度,计算SOD水平。
1.2.5 MDA水平检测 运用硫代巴比妥酸法检测组织匀浆和血清中的MDA水平。硫代巴比妥酸可以与MDA反应生成红色物质,分光光度计检测532 nm处的吸光度。操作步骤按照MDA检测试剂盒说明书操作。计算MDA含量。
1.2.6 钙离子水平检测 采用比色法检测组织匀浆中的钙离子浓度。取200 μL的浓度为100 g/L的组织匀浆液,10 000 r/min离心10 min后,弃上清液,加入冰预冷的生理盐水重悬后,分光光度计测定570 nm的吸光度,计算钙离子浓度。
1.2.7 Bcl-2、Bax蛋白表达水平检测 分别取大鼠肌肉组织,剪碎后放置于研钵中,加入液氮充分研磨。取40 mg的组织加入200 μL的细胞裂解液,放置于冰上裂解30 min。12 000 r/min、4℃离心15 min,转移蛋白上清至新的EP管中。取蛋白样品按照BCA蛋白浓度检测试剂盒说明书检测提取的蛋白浓度。取蛋白样品与Loading buffer充分混合后,100℃煮沸5 min。SDS-PAGE蛋白电泳初始电压为80 V,最终电压为120 V,每孔加入变性蛋白样品为50 μL。按照常规方法将蛋白转印至PVDF膜上,转膜电压为90 V。取出PVDF膜,经50 g/L脱脂奶粉封闭后,依次与一抗(400倍稀释)、二抗(1 000倍稀释)孵育反应后,在暗室中显影,定影。以GAPDH为参照,分析蛋白表达水平。

2 结果
2.1 细胞凋亡结果
TUNEL法检测各组大鼠胫骨前肌和比目鱼肌细胞凋亡显示,一般运动组大鼠比目鱼肌中细胞凋亡率明显高于对照组,差异极显著(P<0.01);强运动组大鼠胫骨前肌和比目鱼肌中细胞凋亡率均明显高于对照组,差异极显著(P<0.01);强运动组大鼠比目鱼肌中细胞凋亡率明显低于一般运动组,差异显著(P<0.05)(表1)。

表1 运动对大鼠骨骼肌细胞凋亡的影响
注:**P<0.01 vs 对照组;#P<0.05 vs 一般运动组。
Note:**P<0.01 vs control group;#P<0.05 vs general exercise group.
2.2 SOD活性检测结果
各组大鼠血清和肌肉SOD水平检测结果显示,一般运动组和强运动组大鼠血清中的SOD活性均明显低于对照组,差异极显著(P<0.01)。一般运动组大鼠比目鱼肌中SOD活性明显高于对照组,差异极显著(P<0.01);强运动组大鼠比目鱼肌中的SOD活性明显低于一般运动组,差异极显著(P<0.01)(图1)。
2.3 MDA水平检测结果
各组大鼠血清和肌肉MDA水平检测结果显示,一般运动组和强运动组大鼠血清中MDA水平均明显低于对照组,差异极显著(P<0.01)。一般运动组大鼠胫骨前肌和比目鱼肌中MDA水平均明显高于对照组,差异极显著(P<0.01);强运动组大鼠胫骨前肌中MDA水平明显高于对照组,差异显著(P<0.05);强运动组大鼠比目鱼肌中MDA水平明显高于对照组,差异极显著(P<0.01)(图2)。
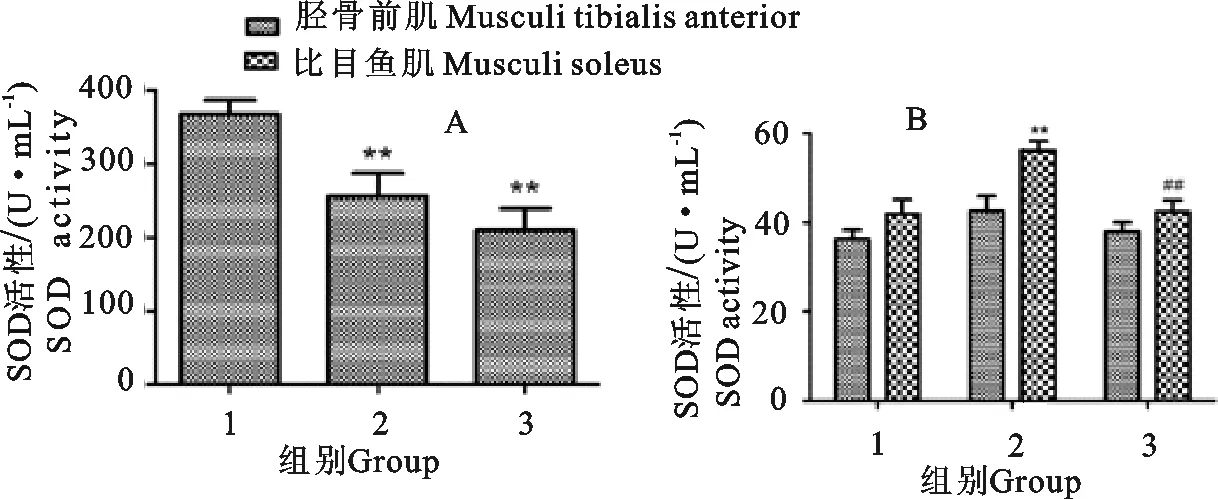
A.大鼠血清中SOD活性;B.大鼠肌肉组织匀浆上清中的SOD活性;1.对照组;2.一般运动组;3.强运动组;**P<0.01 vs 对照组;##P<0.01 vs 一般运动组
A.SOD activity in serum of rats;B.SOD activity in the supernatant of rat muscle tissue;1.Control group;2.General exercise group;3.Strong exercise group;**P<0.01 vs control group;##P<0.01 vs general exercise group
图1运动对大鼠血清及肌肉组织中SOD活性的影响
Fig.1 Effect of exercise on the activity of SOD in serum and muscle tissue of rats
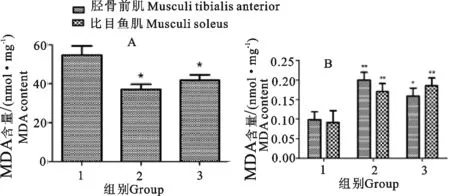
A.大鼠血清中MDA水平;B.大鼠肌肉组织匀浆上清中的MDA水平;1.对照组;2.一般运动组;3.强运动组;*P<0.05 vs 对照组;**P<0.01 vs 一般运动组
A.MDA level in serum of rats;B.MDA level in the supernatant of rat muscle tissue;1.Control group;2.General exercise group;3.Strong exercise group;*P<0.05 vs control group;**P<0.01 vs general movement group
图2运动对大鼠血清及肌肉组织中MDA水平的影响
Fig.2 Effect of exercise on the level of MDA in serum and muscle tissue of rats
2.4 钙离子水平检测结果
各组大鼠肌肉组织钙离子水平检测结果显示,一般运动组大鼠比目鱼肌中钙离子水平明显高于对照组,差异显著(P<0.05);强运动组大鼠比目鱼肌中钙离子水平明显低于对照组,差异显著(P<0.05)(图3)。
2.5 Bcl-2、Bax表达结果
Western blot检测各组大鼠比目鱼肌和胫骨前肌组织中Bcl-2、Bax表达水平。结果显示,强运动组大鼠胫骨前肌和比目鱼肌中Bax蛋白表达水平明显高于对照组,差异极显著(P<0.01)。强运动组大鼠胫骨前肌中Bcl-2蛋白表达水平明显低于对照组,差异极显著(P<0.01)。强运动组大鼠比目鱼肌中Bcl-2蛋白表达水平明显低于对照组,差异显著(P<0.05)。一般运动组大鼠比目鱼肌中Bax表达水平明显高于对照组,差异极显著(P<0.01);一般运动组大鼠比目鱼肌中Bcl-2表达水平明显低于对照组,差异极显著(P<0.01)(图4)。
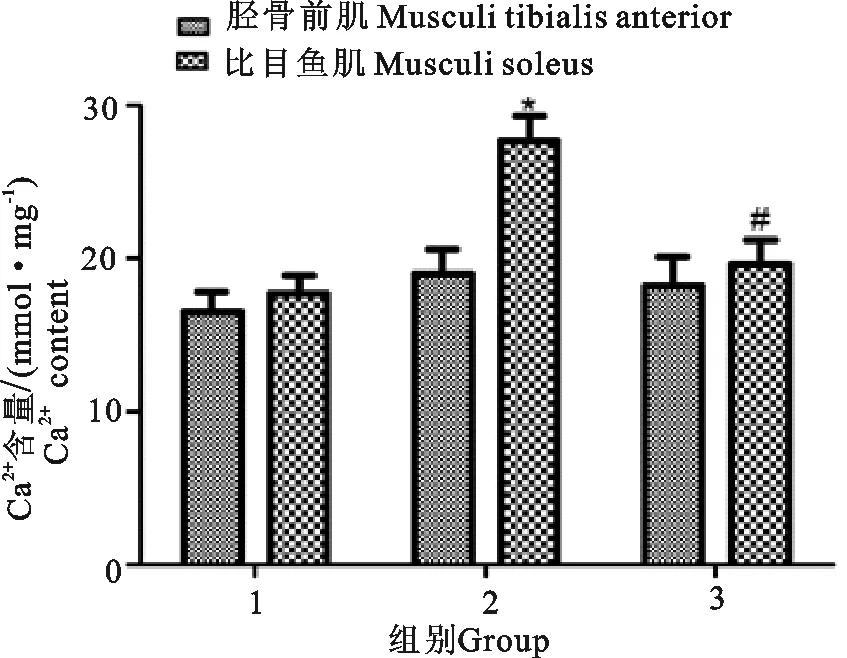
1.对照组;2.一般运动组;3.强运动组;*P<0.05 vs 对照组;#P<0.01 vs 一般运动组
1.Control group;2.General exercise group;3.Strong exercise group;*P<0.05 vs control group;#P<0.01 vs group
图3运动对大鼠肌肉组织中钙离子含量的影响
Fig.3 Effect of exercise on the content of calcium in muscle tissue of rats
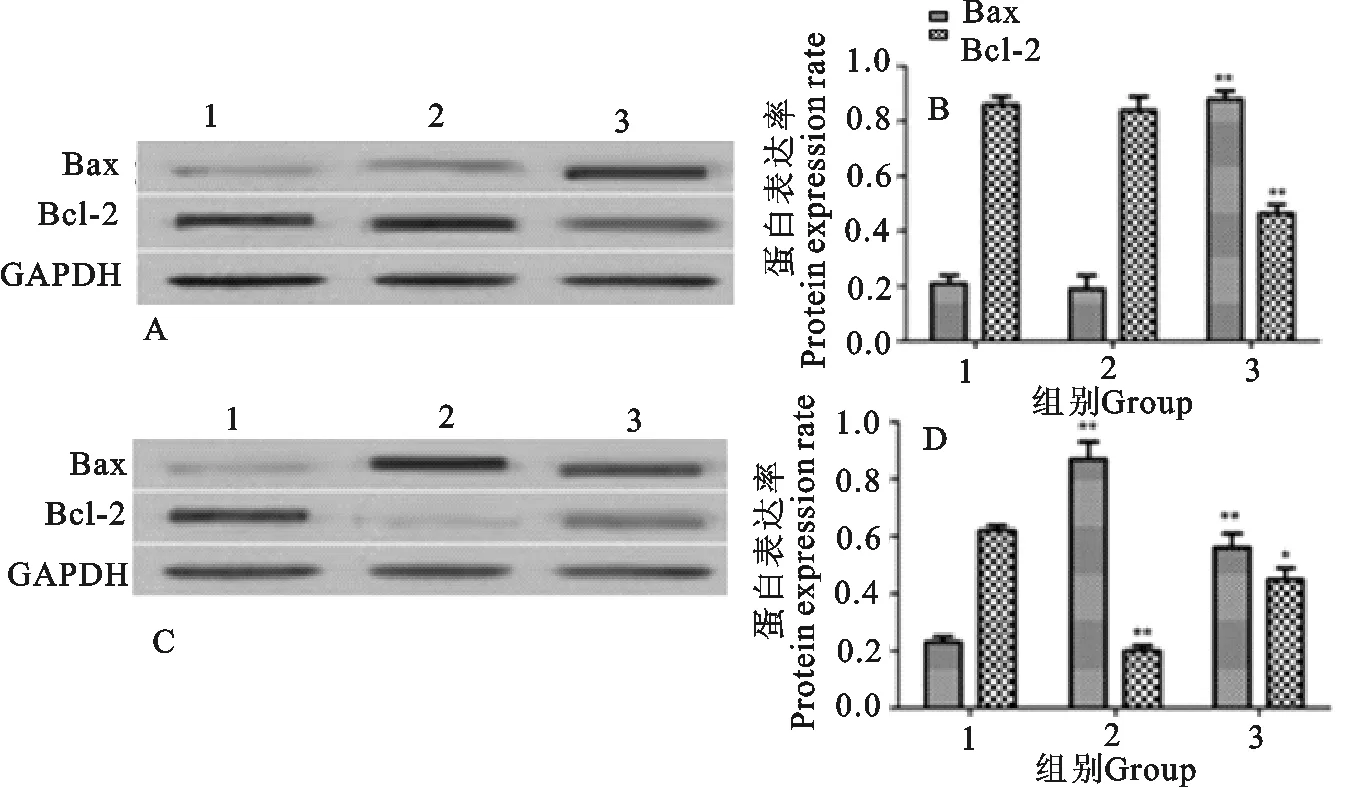
A.胫骨前肌Western blot结果;B.胫骨前肌蛋白表达率;C.比目鱼肌Western blot结果;D.比目鱼肌蛋白表达率;1.对照组;2.一般运动组;3.强运动组;*P<0.05 vs 对照组;**P<0.01 vs 对照组
A.Western blot results of anterior tibial muscle;B.Protein expression rate of tibialis anterior muscle;C.Western blot results of soleus muscle;D.Protein expression rate of soleus muscle;1.Control group;2.general exercise group;3.Strong exercise group;*P<0.05;vs control group;**P<0.01 vs control group
图4运动对大鼠肌肉组织中Bax、Bcl-2表达影响
Fig.4 Effect of exercise on the expression of Bax and Bcl-2 in muscle tissue of rats
3 讨论
在哺乳动物中,肌肉的发育与肌细胞凋亡具有密切关系。缺血再灌注、肌肉营养不良等均可以引发骨骼肌细胞凋亡。近年的研究发现,不同的运动方式、运功强度、运动时间均可以不同程度的影响骨骼肌细胞的凋亡[8]。慢性心衰患者由于运动量的减少,有50%的患者出现不同程度的骨骼肌细胞凋亡[9]。一次性高强度负荷运动训练可以引发细胞凋亡。长期的高强度负荷训练适应不会引发肌肉组织的炎症,坏死的细胞可以经过凋亡被清除。大鼠运动后48 h和0 h,骨骼肌均出现了明显的细胞凋亡[10]。
大鼠骨骼肌中的比目鱼肌和胫骨前肌含有的Ⅰ型肌纤维大约为87%和2%,是典型的大鼠慢肌和快肌[11]。本研究中,大鼠经过一般运动强度和高强度运动后0 h,分别取大鼠比目鱼肌和胫骨前肌,经TUNEL检测细胞凋亡。结果发现,经过一般运动强度的大鼠比目鱼肌中出现了明显的细胞凋亡,胫骨前肌细胞细胞凋亡情况没有变化。而经过高强度运动训练的强运动组大鼠比目鱼肌和胫骨前肌中细胞凋亡均明显上升,与对照组相比差异显著(P<0.01)。结果还显示,一般运动组比目鱼肌细胞凋亡情况高于强运动组。这提示,一般运动强度更容易引起慢肌细胞凋亡。
氧自由基参与细胞凋亡过程[12]。有研究表明,氧自由基可以在体外诱导细胞凋亡[13]。在运动过程中,机体内的代谢增多,能量的消耗也逐渐增多。为了满足代谢的需求,机体耗氧量增加,线粒体内的磷酸化过程也呈上升趋势[14]。氧自由基的产生与线粒体电子传递过程有关[15]。SOD的活性和MDA的含量可以间接反映氧自由基的水平[16]。本研究发现,一般运动组比目鱼肌中的SOD活性高于对照组和强运动组,与一般运动组胫骨前肌相比明显增高。强运动组比目鱼肌和胫骨前肌中的SOD活性没有明显差异。一般运动组大鼠胫骨前肌中的MDA含量高于比目鱼肌。这表明,一般运动强度更容易使慢肌产生自由基,而快肌对氧自由基的抵御水平高于慢肌。
钙离子水平在细胞信号转导过程中发挥关键作用[17]。钙离子浓度的变化调控着多种病理及生理活动[18]。细胞维持正常的生理功能的基础是钙离子浓度的稳定。运动过程中,肌肉的收缩与细胞钙离子浓度有关[19]。钙离子浓度与细胞凋亡有关,多数报道表明钙离子浓度升高会导致细胞凋亡。在某些特殊情况下,钙离子浓度的升高对细胞凋亡起到抑制作用[20]。本研究结果发现,运动后大鼠比目鱼肌和胫骨前肌中的钙离子浓度均有所上升,一般训练后比目鱼肌的钙离子浓度上升最为明显。
Bcl-2蛋白家族在细胞凋亡过程中发挥重要作用。Bcl-2和Bax都属于Bcl-2蛋白家族的成员[21]。Bcl-2在细胞凋亡过程中发挥抑制作用,Bax在细胞凋亡过程中发挥促进作用[22]。本研究用Western blot检测了大鼠比目鱼肌和胫骨前肌中的Bcl-2、Bax水平。结果发现,一般运动组比目鱼肌中的Bax水平增高,Bcl-2水平降低。这提示,运动引起的骨骼肌细胞凋亡与Bcl-2、Bax有关。
综上所述,一般强度竭力运动后,慢肌和快肌都出现细胞凋亡且慢肌的细胞凋亡最为明显。一般运动强度比高强度运动更容易引发慢肌的细胞凋亡。其作用机制可能与细胞中氧自由基水平、钙离子含量、Bcl-2、Bax水平有关。本研究为进一步研究运动与骨骼肌细胞凋亡奠定了基础。
[1] Brünker P,Wartha K,Friess T,et al.RG7386,a novel tetravalent FAP-DR5 antibody,effectively triggers FAP-dependent,avidity-driven DR5 hyperclustering and tumor cell apoptosis[J].Mol Cancer Therapeut,2016,15(5):946-957.
[2] Christensen C S,Christensen D P,Lundh M,et al.Skeletal muscle to pancreatic β-cell cross-talk:The effect of humoral mediators liberated by muscle contraction and acute exercise on β-cell apoptosis[J].J Clin Endocrinol Metabol,2015,100(10):E1289-E1298.
[3] Paula F M M,Leite N C,Vanzela E C,et al.Exercise increases pancreatic β-cell viability in a model of type 1 diabetes through IL-6 signaling[J].FASEB J,2015,29(5):1805-1816.
[4] Kim T W,Kim C S,Kim J Y,et al.Combined exercise ameliorates ovariectomy-induced cognitive impairment by enhancing cell proliferation and suppressing apoptosis[J].Menopause,2016,23(1):18-26.
[5] Wan J,Benkdane M,Teixeira-Clerc F,et al.M2 Kupffer cells promote M1 Kupffer cell apoptosis:a protective mechanism against alcoholic and nonalcoholic fatty liver disease[J].Hepatology,2014,59(1):130-142.
[6] Seo T B,Kim T W,Shin M S,et al.Aerobic exercise alleviates ischemia-induced memory impairment by enhancing cell proliferation and suppressing neuronal apoptosis in hippocampus[J].Int Neurourol J,2014,18(4):187-197.
[7] Egan B,Zierath J R.Exercise metabolism and the molecular regulation of skeletal muscle adaptation[J].Cell Metabol,2013,17(2):162-184.
[8] Deshmukh A S,Murgia M,Nagaraj N,et al.Deep proteomics of mouse skeletal muscle enables quantitation of protein isoforms,metabolic pathways,and transcription factors[J].Mol Cell Proteom,2015,14(4):841-853.
[9] Lira V A,Okutsu M,Zhang M,et al.Autophagy is required for exercise training-induced skeletal muscle adaptation and improvement of physical performance[J].FASEB J,2013,27(10):4184-4193.
[10] Nader G A,von Walden F,Liu C,et al.Resistance exercise training modulates acute gene expression during human skeletal muscle hypertrophy[J].J Appl Physiol,2014,116(6):693-702.
[11] Russell A P,Foletta V C,Snow R J,et al.Skeletal muscle mitochondria:a major player in exercise,health and disease[J].Biochim Biophys Acta (BBA)-General Subjects,2014,1840(4):1276-1284.
[12] Wernbom M,Apro W,Paulsen G,et al.Acute low-load resistance exercise with and without blood flow restriction increased protein signalling and number of satellite cells in human skeletal muscle[J].Eur J Appl Physiol,2013,113(12):2953-2965.
[13] Marklund P,Mattsson C M,Whlin-Larsson B,et al.Extensive inflammatory cell infiltration in human skeletal muscle in response to an ultraendurance exercise bout in experienced athletes[J].J Appl Physiol,2013,114(1):66-72.
[14] Russell A P,Lamon S,Boon H,et al.Regulation of miRNAs in human skeletal muscle following acute endurance exercise and short-term endurance training[J].J Physiol,2013,591(18):4637-4653.
[15] Cartee G D,Hepple R T,Bamman M M,et al.Exercise promotes healthy aging of skeletal muscle[J].Cell Metabol,2016,23(6):1034-1047.
[16] Hoffman N J,Parker B L,Chaudhuri R,et al.Global phosphoproteomic analysis of human skeletal muscle reveals a network of exercise-regulated kinases and AMPK substrates[J].Cell Metabol,2015,22(5):922-935.
[17] Zampieri S,Pietrangelo L,Loefler S,et al.Lifelong physical exercise delays age-associated skeletal muscle decline[J].J Gerontol Series A:Biol Sci Med Sci,2015,70(2):163-173.
[18] Anderson D M,Anderson K M,Chang C L,et al.A micropeptide encoded by a putative long noncoding RNA regulates muscle performance[J].Cell,2015,160(4):595-606.
[19] Vaughan R A,Gannon N P,Barberena M A,et al.Characterization of the metabolic effects of irisin on skeletal muscle in vitro[J].Diabet,Obesity Metabol,2014,16(8):711-718.
[20] Edgett B A,Foster W S,Hankinson P B,et al.Dissociation of increases in PGC-1β and its regulators from exercise intensity and muscle activation following acute exercise[J].PLoS One,2013,8(8):e71623.
[21] 吕冬霞,罗文哲,张淑红,等.毛尖蘑粗多糖对 H22 荷瘤小鼠的抑廇作用及 Bcl-2 表达的影响[J].中国老年学杂志,2016,36(2):48-49.
[22] 王立新,王元松,田风胜,等.复荣通脉胶囊对糖尿病大鼠坐骨神经 Bax 及 Bcl-2 表达的影响[J].中国医药导报,2016,13(12):24-27.
EffectofExerciseonCellApoptosisandCa2+ContentinRatSkeletalMuscle
WANG Hai-sheng1,WANG Zhi-yong1,JIANG Huan-huan2
(1.DepartmentofPublicPhysicalEducation,HebeiNorthUniversity,Zhangjiakou,Hebei,075000,China; 2.DepartmentofPharmacy,SecondAffiliatedHospitalofHebeiNorthUniversity,Zhangjiakou,Hebei,075000,China
To investigate the effect of exercise on the apoptosis of skeletal muscle cells and the content of Ca2+in rat skeletal muscle,the rats were divided into control group, exercise group and strong exercise group,the rats in control group
normal activities,the running speed in general exercise group rats was 18 m/min,and in strong exercise group rats was 25 m/min.The rats in general exercise group and exercise group were strong running to exhaustion.To detect the apoptosis of rat soleus muscle and anterior tibial muscle cells,the SOD activity,MDA content and Ca2+content in rat sera and rat hind limb tissue homogenate,and the expression levels of Bax and Bcl-2 in rat muscle tissue were detected.The apoptosis rate of the rats in the general exercise group was significantly higher than that in the control group (P<0.01).The SOD activity was significantly higher in the general exercise group than in the control group,the difference was significant (P<0.01);The SOD activity in the muscle of the strong exercise group was significantly lower than that in the general exercise group,and the difference was significant (P<0.01).The levels of MDA in the serum of general exercise group and strong exercise group were significantly lower than those in control group,and the difference was significant (P<0.01).The MDA levels in the anterior tibial muscle and the skeletal muscle of the general exercise group were significantly higher than those in the control group,and the difference was significant (P<0.01).The levels of Ca2+in the general exercise group was significantly higher than that in the control group,and the difference was significant (P<0.05).The level of Bax expression in general exercise of soleus muscle was significantly higher than that in the control group was significantly lower than that in the control group,the difference was significant (P<0.01).The expression of Bcl-2 in rat soleus muscle in general exercise group was significantly lower than that in the control group,the difference was significant (P<0.01).The general exercise is more likely to lead to the apoptosis of the muscle cells of soleus muscle.The mechanism may be related to the Ca2+concentration,the level of oxygen free radicals,Bax and Bcl-2 expressions.
exercise;apoptosis;soleus muscle;anterior tibial muscle
2016-09-04
王海生(1978-),男,河北张家口人,讲师,硕士,主要从事体育教育训练研究。
S852.21
:A
:1007-5038(2017)09-0078-06
