金边黄杨和金心黄杨叶绿素合成与叶绿体结构分析
2017-09-15朱雪云李建谋王海燕孔凡芹
朱雪云,李建谋,王海燕,孔凡芹
金边黄杨和金心黄杨叶绿素合成与叶绿体结构分析
朱雪云,李建谋,王海燕,孔凡芹
(武汉生物工程学院园林系,湖北武汉 430415)
【目的】本文探索了金边黄杨和金心黄杨彩叶形成的机理。【方法】利用分光光度计和电子显微镜等,对金边黄杨和金心黄杨叶片黄色和绿色组织的叶绿素含量和叶绿体超微结构进行检测。【结果】黄色组织的叶绿素a和叶绿素b含量均显著低于绿色组织和对照大叶黄杨。黄色组织中叶绿素合成中间产物原卟啉IX(ProtoIX)、Mg-ProtoIX以及Pchlide的含量急剧降低。超微结构观察发现黄色组织的叶绿体数量减少,内膜排列紊乱,缺乏有序的基粒类囊体。【结论】黄色组织叶绿素含量降低的原因可能是粪卟啉原Ⅲ(CoprogenⅢ)向原卟啉IX(ProtoIX)合成过程出现障碍所致。
金边黄杨;金心黄杨;黄色组织;叶绿素;叶绿体结构
【研究意义】金边大叶黄杨(Euonymus japonicus L.var.aureamarginatus)和金心大叶黄杨(E.japonicus L.var.aureovariegatus)(以下简称金边黄杨和金心黄杨)是卫矛科卫矛属大叶黄杨(E.japonicus L.)的2个变种[1]。金边黄杨叶缘为黄色,中央为绿色;而金心黄杨叶片中心呈黄色,叶缘为绿色。它们属于镶边类彩叶植物。彩叶植物因其特殊的叶片颜色而具有较高的观赏价值,然而我国原产彩叶植物品种较少,彩叶形成机理和育种体系尚未建立[2]。【前人研究进展】彩叶形成的遗传因素主要归纳为以下几种:核基因突变、转座子插入导致基因重组、质体发生突变、形成植物嵌合体、半配合遗传等[3-5]。Chen等[6]总结前人的研究将彩叶的形成机制归纳为2种,一种是由核基因发生突变导致叶片一部分组织或细胞产生有缺陷的叶绿体,但绿色部分和白色(黄色)部分的遗传背景是一致的,而突变表型只局限在白色或黄色组织中[7];另一种机制是白色(黄色)组织与绿色组织的遗传组成(核基因或质基因)不同,白色(黄色)组织具有突变的基因型而绿色组织具有野生型基因型,嵌合体[8]、转座子删除或插入[9]属于此种情况。尽管彩叶植物的遗传模式各异,但叶片彩斑形成归根结底是色素分布不均导致。叶片黄-绿(白-绿)彩斑与叶绿体色素相关。而叶绿体色素含量的变化主要与叶绿体色素合成和降解代谢,或者与叶绿体的发育、结构及其蛋白质的异常有关。【本研究切入点】本研究对金边黄杨和金心黄杨彩叶叶绿素合成过程以及叶绿体结构进行分析,初步掌握其彩叶形成的生理生化特点。【拟解决的关键问题】为彩叶形成的分子机制研究奠定基础。
1 材料与方法
1.1 供试材料
选择长势一致的金边黄杨(Euonymus japonicus L.var.aureamarginatus)、金心黄杨(E.japonicus L. var.aureovariegatus)和大叶黄杨(E.japonicus L.) (对照)当年生枝条形态学上端的第二对完全展开的成熟叶片为试材。各项指标测定时,将金边黄杨和金心黄杨叶片的绿色和黄色组织切分开,分别进行测定。
1.2 研究方法
1.2.1 叶绿体色素含量测定 取0.1 g叶片剪碎研磨加入少量95%的乙醇混合至匀浆,转入离心管并定体积至10 mL,于8000 r/min的转速下离心15 min,在波长665、649和470 nm下测定吸收值,计算叶绿素a、叶绿素b和类胡萝卜素的含量。
1.2.2 δ-氨基乙酰丙酸(ALA)的测定 ALA的提取及其含量测定按照王凌健等[10]方法,分别称取金边和金心黄杨叶片绿色和黄色组织各0.2 g,加入4 %的三氯乙酸充分研磨,8000 r/min离心5 min,取1 mL提取液加入500μl NaAc(1 M)和50μl乙酰丙酮,沸水浴10 min后冷却到室温,再8000 r/min离心5 min,取1.5mL上清液加入1.5 mL Ehrlich-Hg试剂在黑暗中反应15min后,在553 nm处测定吸光值。
1.2.3 胆色素原(PBG)的测定 PBG的含量测定按照Bogorad[4]方法,分别称取金边和金心黄杨叶片绿色和黄色组织各0.2 g,液氮研磨后,加入5 mL提取缓冲液(0.6 mol·L-1Tris,0.1M EDTA,pH8.2)充分研磨后,12 000 r/min离心10 min,取1.5 mL上清液加入1.5 mL Ehrlich-Hg,在黑暗中反应15 min,553 nm处测定吸光值。
1.2.4 尿外啉原Ⅲ(UrogenⅢ)和粪外啉原Ⅲ(CoprogenⅢ)的测定 尿卟啉原Ⅲ和粪卟啉原Ⅲ含量的测定按照Bogorad[11]方法,称取叶片绿色和黄色组织各0.2 g,液氮研磨后,加入5 mL磷酸缓冲液(0.067 M pH 6.8),12 000 r/min离心10 min,取2.5 mL上清加入150μl1%的Na2S2O3,剧烈震荡,光照20min,用冰醋酸(1 mol/L)调pH到3.5,然后用乙醚萃取,分层后,测定水相在405.5 nm处吸光值,得UrogenⅢ。测定醚相的399.5 nm处的吸光值,得CoprogenⅢ。
1.2.5 原外啉IX(ProtoIX)、Mg-原外啉IX(Mg-ProtoIX)、原叶绿素酸酯(Pchlide)含量的测定 采用Hodgins和van Huystee的方法[12],分别取0.2 g,绿色和黄色叶片组织,加入5 mL 80%的丙酮研磨,在12 000 r/min、4℃下离心10 min,取上清液,用80 %的丙酮稀释到25 mL,测定575、590和628 nm的吸光值。
1.3 数据处理分析
使用SPSS统计分析软件对数据进行方差分析和差异显著性分析。叶绿素合成各中间产物均以大叶黄杨(视为100%)为参照计算相对含量。
2 结果与分析
2.1 金边黄杨和金心黄杨叶绿体色素含量分析
与大叶黄杨叶片相比,金边黄杨和金心黄杨叶片的黄色组织中叶绿素a、b及类胡萝卜素的含量均显著低于大叶黄杨和绿色组织的含量(表1~2)。这一结果与肉眼观察的现象一致。
2.2 金边和金心黄杨叶绿素合成中间产物分析
大叶黄杨为对照,绿色和黄色组织各中间产物含量均以相对含量表示。绿色组织各中间产物的含量相对稳定,而黄色组织叶绿素合成过程中各中间产物的相对含量变化幅度较大。金边黄杨黄色组织的δ-氨基乙酰丙酸(ALA)、胆色素原(PBG)、粪卟啉原Ⅲ(CoprogenⅢ)的含量显著低于绿色组织。特别是由CoprogenⅢ向ProtoIX转变时出现急剧降低现象(图1)。金心黄杨黄色组织中间产物的变化趋势与金边黄杨类似,但黄色组织ALA的含量却远远高于绿色组织,从PBG开始黄色组织各中间产物的含量出现下降趋势,至原卟啉IX(ProtoIX)陡然下降。由此可见,2种彩叶植物黄色组织的叶绿素含量降低可能是由于在代谢层面上由CoprogenⅢ向ProtoIX合成过程出现障碍。

表1 金边黄杨成熟叶片黄色和绿色组织中叶绿体色素含量Table 1 Chlorophyll contents in both green and yellow tissues of E.japonicus var.Aureamarginatus
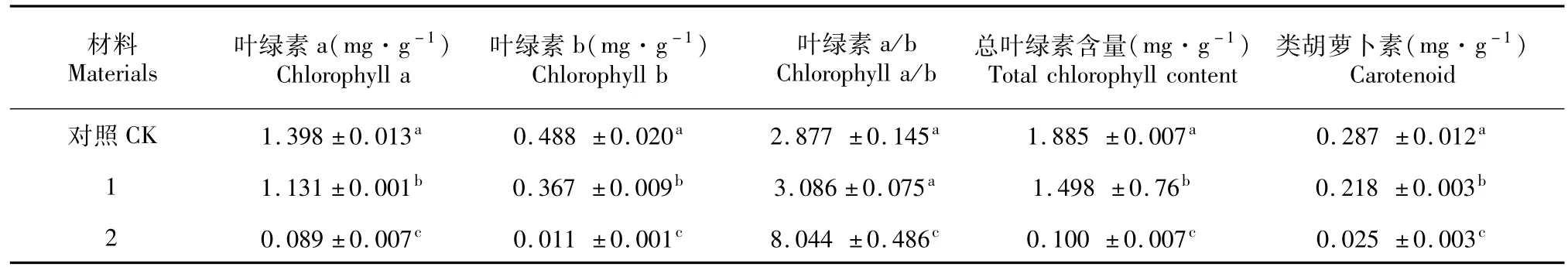
表2 金心黄杨成熟叶片黄色和绿色组织中叶绿体色素含量Table 2 Chlorophyll contents in both green and yellow tissues of E.japonicus var.Aureovariegatus
2.3 金边和金心黄杨绿色和黄色组织中叶绿体形态结构分析
利用透射电子显微镜分别观察了金边黄杨和金心黄杨绿色和黄色组织中叶绿体形态结构和类囊体的垜曡程度。通过观察发现黄色组织的细胞内叶绿体的数量普遍较少,而且叶绿体中内膜排列紊乱,缺乏有序的基粒类囊体,且嗜锇颗粒多而大,甚至出现空泡现象(图2)。光合作用相关的色素、蛋白质和酶将失去其依存的场所。
3 讨 论
目前,对金边黄杨和金心黄杨彩叶形成的机理研究国内外报导较少。2种彩叶植物的黄色组织叶绿素和类胡萝卜素的含量相比正常的绿色组织和大叶黄杨均明显降低。这与张开明等[13]和庄猛等[14]对金边黄杨色素测定结果相符。再次说明金边黄杨绿色和黄色组织颜色差异的直接原因是叶绿素的含量降低。然而,导致叶绿素含量降低的原因涉及方面较广,十分复杂。可能是由于叶绿素在合成过程中某一环节受阻,可能是叶绿素降解过程加速,也可能是叶绿体发育或结构异常等等。
不少报道显示,彩叶和黄化突变体叶绿素含量降低是由于叶绿素合成过程受阻引起[15-17]。为进一步搞清楚叶绿素含量降低的原因,本研究对叶绿素合成的过程进行了分析。分别测定了叶绿素合成中几个关键的中间产物,δ-氨基乙酰丙酸(ALA)、胆色素原(PBG)、尿卟啉原Ⅲ(UrogenⅢ)、粪卟啉原Ⅲ(CoprogenⅢ)、原卟啉IX(ProtoIX)、Mg-原卟啉IX (Mg-ProtoIX)、原叶绿素酸酯(Pchlide)等成分在黄色组织中的含量变化。相比绿色组织和大叶黄杨叶片,黄色组织的ALA、PBG、UrogenⅢ和CoprogenⅢ相对含量均有降低现象,但从ProtoIX开始,Mg-ProtoIX以及Pchlide减少的幅度陡然上升。结果说明黄色组织的叶绿素合成过程受阻,且受阻位点可能在CoprogenⅢ和ProtoIX之间的反应环节上。刘彩云[18]对白肋型烟草叶绿素合成过程分析发现合成过程的后期中间产物ProtoIX、Mg-ProtoIX和Pchlide的含量均显著低于对照,与本研究的受阻位点一致。类似的研究结果在芥菜型油菜黄化突变体L638-y叶绿素合成中出现[16]。高等植物叶绿素生物合成由16种酶参与完成,而由CoprogenⅢ到ProtoIX的转变是在粪卟啉原氧化脱羧酶和原卟啉原氧化酶的催化下完成[19]。推测这一反应环节中相关的酶也许存在活性降低或表达量降低的可能性。
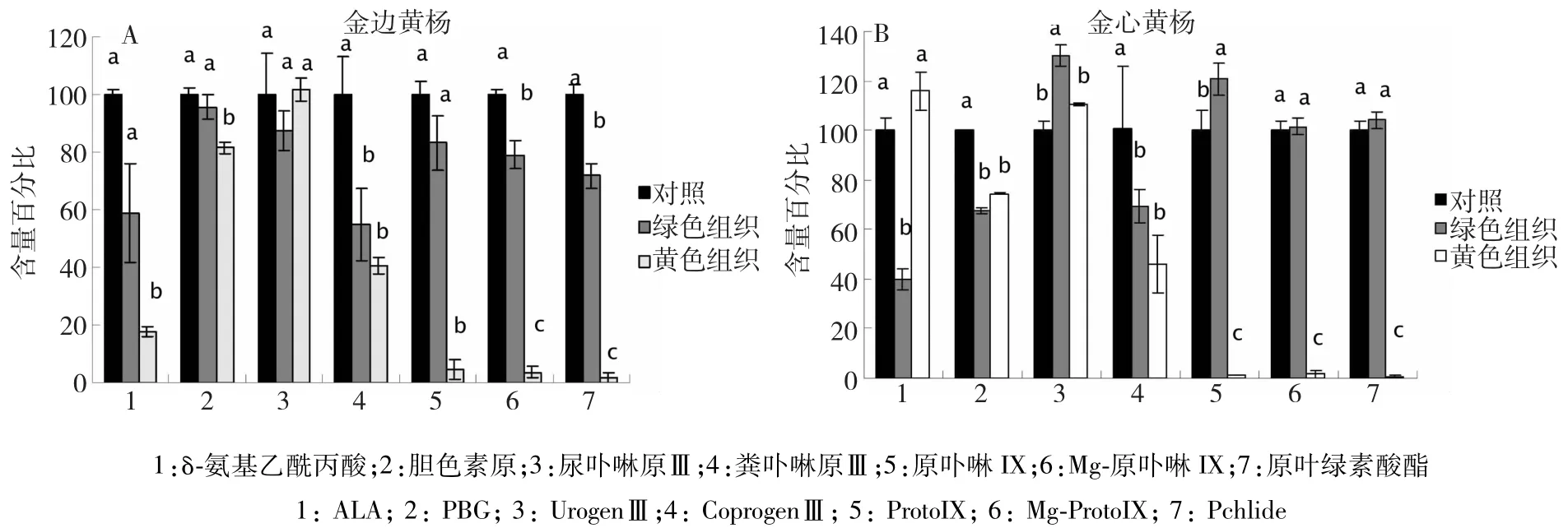
图1 金边黄杨(A)和金心黄杨(B)绿色和黄色组织叶绿素合成中间产物先对含量分析Fig.1 Analysis of the chlorophyll biosynthesis intermediatesboth E.japonicus.var.Aureamarginatus(A)and E.japonicus var.Aureovariegatus(B)
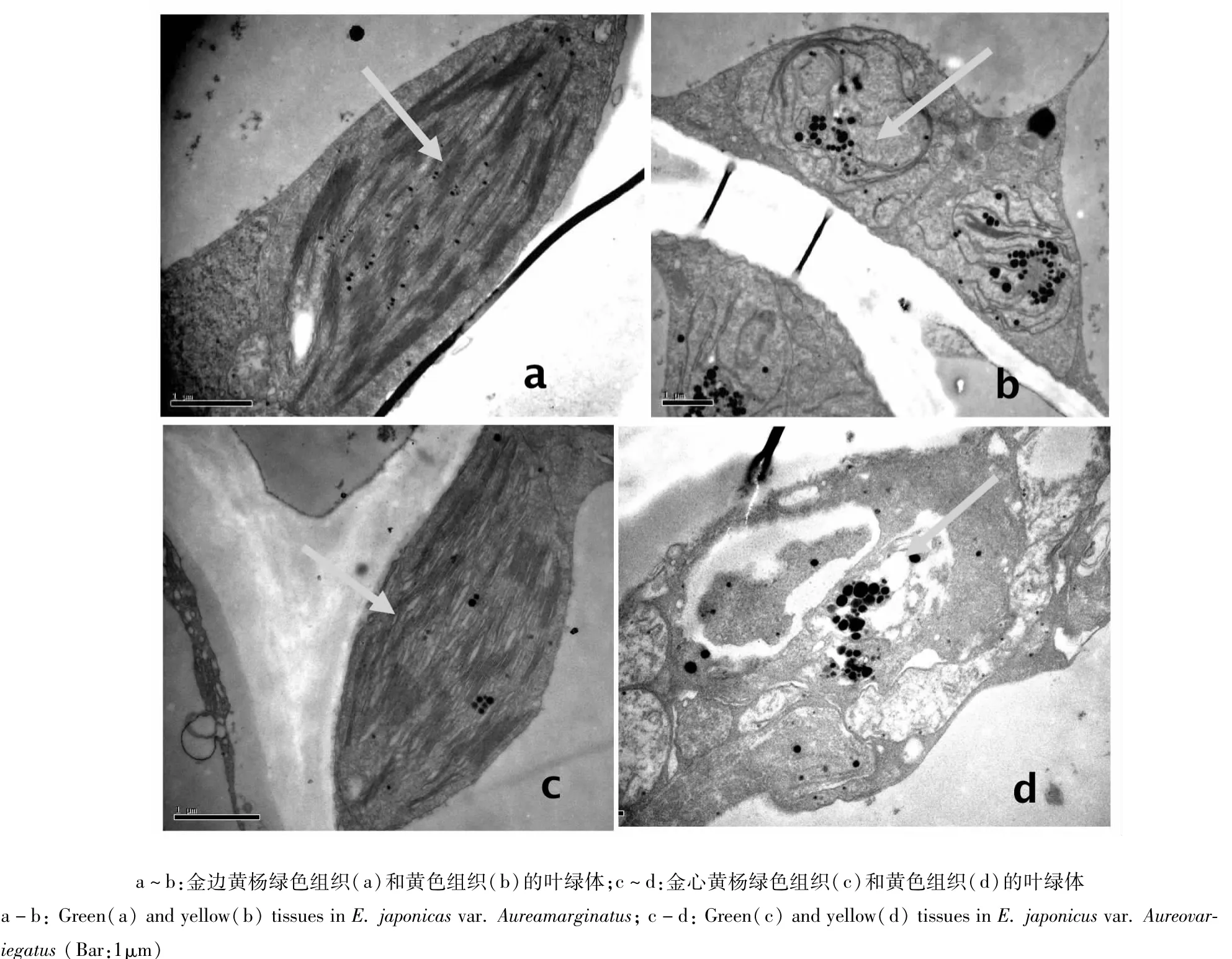
图2 金边黄杨和金心黄杨绿色和黄色组织中叶绿体的形态结构Fig.2 Chloroplastmicrostructure in green and yellow tissues of E.japonicas var.Aureamarginatus and E.japonicus var.Aureovariegatus
叶片黄化的另一可能原因就是叶绿体结构和发育出现问题。叶绿体类囊体膜是一个由各种叶绿素——蛋白质复合体高度有组织性构成的体系[20]。主要有光系统系Ⅰ(PSI)、光系统Ⅱ(PSII)及捕光色素复合体(LHC)等。这些复合体中光合色素可以达到35%[21]。有研究指出光合作用相关蛋白质的明显减少引起叶绿素合成缺陷[22]。因此,与叶绿素结合的蛋白质如果出现含量降低、缺失或结构异常等变异很可能间接引起叶绿素含量降低。拟南芥LHCs蛋白质显著降低甚至缺失导致基粒类囊体的垛叠出现异常同时引起叶绿素缺失[23]。油菜叶绿素缺失突变体的LHCs、PSI、PSII、细胞色素复合体b6/f(Cyt b6f)以及叶绿体ATP合酶的丰度都出现了不同程度的降低[24]。本研究对金边和金心黄杨绿色和黄色组织中的叶绿体分别进行观察。结果显示,黄色组织中叶绿体内膜没有进行有序折叠,也无明显的基粒结构,显然在结构上属于不正常的叶绿体。叶绿体的基粒类囊体是光系统Ⅰ和光系统Ⅱ,以及色素-蛋白复合体实现功能必需依附的场所,由此可以推测黄色组织的光合作用和能力较低。这在庄猛等[14]的研究中得到印证。同时也说明基粒类囊体的缺失与色素含量降低存在正相关现象。有报道认为,叶绿体结构与叶绿素合成之间关系主要存在2种可能,一种是催化叶绿素合成的酶基因突变使叶绿素合成受阻,而膜结构发育受阻只是叶绿素缺乏和叶绿素合成受阻的多效性反应;另一种可能是基因突变导致膜发育受阻,造成膜上酶复合体缺失而使叶绿素合成阻滞[25]。本研究中,黄色组织叶绿体结构异常与叶绿素含量降低之间如何相互影响以及它们之间的因果关系还有待进一步研究。
4 结 论
综上所述,金边黄杨和金心黄杨彩叶产生的直接原因是因为叶绿素含量降低所致。而引起叶绿素含量降低的生理代谢问题产生在叶绿素合成过程中粪卟啉原Ⅲ(CoprogenⅢ)到原卟啉IX(ProtoIX合)成过程。
[1]中国植物志[EB/OL].http://frps.eflora.cn/frps/Euonymus%20 japonicus.
[2]程金水.园林植物遗传育种学[M].北京:中国林业出版社,2000:33-44.
[3]姜卫兵,庄 猛,韩浩章,等.彩叶植物呈色机理及光和特性研究进展[J].园艺学报,2005,32(2):352-358.
[4]洪 丽,王金刚,龚束芳.彩叶植物叶色变化及相关影响因子研究进展[J].东北农业大学学报,2010,41(6):152-156.
[5]田立娟,赵瑞艳,翟登攀.彩叶植物的彩叶形成研究进展[J].黑龙江农业科学,2010(2):118-120.
[6]Kusumi K,Komori H,Satoh H&Iba K.Characterization of a zebra Mutant of Rice with Increased Susceptibility to Light Stress[J]. Plant Cell Physiol.,2000,41(2):158-164.
[7]刘 生,魏祥进,邵高能,等.一个水稻“斑马叶”叶色突变体基因zebraleaf2(zl2)的图位克隆[J].中国水稻科学,2013,27(3): 231-239.
[8]Chen M,Choi Y D,Voytas D F,etal.Mutations in the Arabidopsis VAR2 locus cause leaf variegation due to the loss of a chloroplast FtsH protease[J].Plant Journal,2000,22:303-313.
[9]Tilney-Bassett R A E.Genetics of variegated plants[A].In Birky C W,Perlman PW,Byers T J,etal.Genetics and Biogenesis ofMitochonoria and Choloplasts[C].Columbus:Ohio State University Press,1975:268-308.
[10]王凌健,倪迪安,叶叙丰,等.植物叶片中δ-氨基乙酰丙酸的测定[J].植物生理学通讯,1997,35(6):439-441.
[11]Bogorad L.Porphyrin synthesis[J].Methods Enzymo,1962(5): 885-891.
[12]Hodgins R,van Huystee R B.Rapid simultaneous estimation of protoporphyrin and Mg-protophyrins in higher plants[J].Journal of Plant Physiology,1986,125:311-323.
[13]张开明,王 珂,祝亚军,等.金边黄杨和大叶黄杨的光能吸收分配特征及其机制分析[J].河南农业大学学报,2014,48(4): 429-434.
[14]庄 猛,姜卫兵,花国平,等.金边黄杨与大叶黄杨光合特性比较[J].植物生理学通讯,2006,42(1):39-42.
[15]刘中华,计玮玮,鲁 聪,等.彩叶富贵竹叶绿素生物合成代谢的研究[J].安徽农业科学,2009,37(19):8963-8964,8985.
[16]吕 明.芥菜型油菜黄化突变体1638-y叶片缺绿的生化机制探讨[D].西北农林科技大学硕士学位论文,2010.
[17]徐冬平.一份玉米全生育期黄花材料的初步研究[D].四川农业大学硕士学位论文,2013.
[18]刘彩云.普通烟草中的白肋型烟草叶色性状遗传及其质体色素差异性研究[D].中国农业科学院博士学位论文,2013.
[19]Chekunova E M.Genetic Control of the Chlorophyll Metabolism [J].Russian Journal of Genetics,2014,4(5):351-367.
[20]Ewa J,Joanna S,Waldemar M.Organization and functionality of chlorophyll-protein omplexes in thylakoid membranes isolated from Pb-treated Secale cereale[J].Journal of Photochemistry and Photobiology B:Biology,2013,125:98-104.
[21]Croce R,van Amerongen H.Light-harvesting and structural organization of photosystem II:from individual complexes to thylakoid membrane[J].Journal Photochem Photobiol,B:Biol.2011,104: 142-153.
[22]Zhou Y,Gong Z,Yang Z,et al.Mutation of the light-induced yellow leaf1 gene,which encodes a geranylgeranyl reductase,affects chlorophyll biosynthesis and light sensitivity in rice[J].PLoSOne,2013,8(9):1-14.
[23]Kim E H,Li X P,Razeghifard R,etal.Themultiple rolesof lightharvesting chlorophyll a/b-protein complexes define structure and optimize function of Arabidopsis chloroplasts:a study using two chlorophyll b-less mutants[J].Biochimica et Biophysica Acta,2009,1787:973-984.
[24]Chu P,Yan G X,Yang Q,et al.iTRAQ-based quantitative proteomics analysis of Brassica napus leaves reveals pathways associated with chlorophyll deficiency[J].Journal of Proteomics,2015,113: 244-259.
[25]William C T,Alice B,Robert A M.Use of nuclearmutants in the analysis of chloroplast Development[J].Devel Genet,1987(8): 305-320.
(责任编辑 陈 虹)
Analysis of Chlorophyll Biosynthesis and Chloroplast M icrostructure in Euonymus japonicus.var.Aureamarginatus and E.japonicus var.Aureovariegatus
ZHU Xue-yun,LIJian-mou,WANG Hai-yan,KONG Fan-qin
(Wuhan Bioengineering Institute,Landscape Gardening Department,HubeiWuhan 430415,China)
【Objective】In this paper,themechanism of the colored leaf in Euonymus japonicus.var.Aureamarginatus and E.japonicus var. Aureovariegatus were studied.【Method】The spectrophotometry and electron microscope technique were used,and their chlorophyll contents and chloroplast structurewere detected.【Result】The contentof chlorophyll in the yellow tissuesof both E.japonicus.var.Aureamarginatus and E.japonicus var.Aureovariegatus were much lower than the green tissues and the control E.japonicus.Furthermore,the intermediate products in the chlorophyll biosynthesis processwere analyzed,which indicated that Protoporphyrin IX weremarkedly decreased in yellow tissues of both varietas than green tissues and the control.For another,therewere few normal thylakoids in the chloroplastof yellow tissues of both varietas by transmission electronmicroscope analysis.【Conclusion】The chlorophyll biosynthesiswere blocked in coproporphyrinogenⅢconverted to Protoporphyrin IX in the yellow tissues.
Euonymus japonicus.var.Aureamarginatus;Euonymus japonicus var.Aureovariegatus;Yellow tissue;Chlorophyll;Chloroplast structure
S687
A
1001-4829(2017)8-1767-05
10.16213/j.cnki.scjas.2017.8.012
2016-07-20
武汉市教育局项目(2010097);国家自然科学基金(31401920);武汉市属高校产学研结合项目(201435)
朱雪云(1981-),女,河北邯郸人,博士,副教授,研究方向植物遗传育种,E-mail:zhuxueyun1981@163.com。
