褪黑素对局灶性脑缺血大鼠扩散加权成像及脑组织中Fas、FasL、活性Caspase-3蛋白表达的影响
2017-09-15王海宇陈岚芬王晓莉闫少珍牟青杰赵岩松
王海宇,陈岚芬,王晓莉,2*,闫少珍,牟青杰,赵岩松
(1.潍坊医学院医学影像学系,山东 潍坊 261053;2.潍坊医学院附属医院影像中心,4.眼科,山东 潍坊 261031;3.潍坊医学院临床医学院血液科,山东 潍坊 261053)
褪黑素对局灶性脑缺血大鼠扩散加权成像及脑组织中Fas、FasL、活性Caspase-3蛋白表达的影响
王海宇1,陈岚芬1,王晓莉1,2*,闫少珍1,牟青杰3,赵岩松4
(1.潍坊医学院医学影像学系,山东 潍坊 261053;2.潍坊医学院附属医院影像中心,4.眼科,山东 潍坊 261031;3.潍坊医学院临床医学院血液科,山东 潍坊 261053)
目的基于大脑中动脉栓塞(MCAO)模型,探讨褪黑素(MT)对局灶性脑缺血大鼠脑DWI及脑组织中Fas、FasL、活性Caspase-3蛋白表达的影响。方法将80只SD大鼠随机分为Sham组(n=16)、MCAO组(n=32)及MT组 (n=32)。MCAO组及MT组建立大鼠MCAO模型后,于脑缺血再灌注(IR)前后30 min,分别腹腔注射生理盐水与MT;Sham组进行假手术操作,腹腔注射生理盐水。对各组大鼠进行行为学评分,于MCAO组及MT组中选取评分为1~3分者纳入研究。分别于假手术或IR后6 h、24 h、72 h、7天,行大鼠脑DWI扫描,计算相对DWI信号强度(rDWI-SI);并于每一时间点各组随机选取大鼠进行Fas、FasL及活性Caspase-3免疫组化染色观察,并比较各组Fas、FasL、活性Caspase-3阳性细胞数(个/mm2)。结果最终Sham组16只、MCAO组29只、MT组30只大鼠纳入研究。3组间大鼠行为学评分差异具有统计学意义(χ2=50.125,P<0.01),MT组及MCAO组行为学评分均高于Sham组(P均<0.01),MT组行为学评分低于MCAO组(P<0.01)。IR后6 h、24 h、72 h、7天,MCAO组及MT组rDWI-SI值均高于Sham组假手术后相应时间rDWI-SI值(P均<0.01);IR后6 h、24 h、72 h,MCAO组rDWI-SI值均高于MT组(P均<0.05);IR后7天MT组与MCAO组间rDWI-SI值差异无统计学意义(P>0.05)。IR后6 h、24 h、72 h,MT组及MCAO组Fas、FasL染色及活性Caspase-3染色阳性细胞数均较Sham组增多(P均<0.01),MT组较MCAO组减少(P<0.05);IR后7天,3组间阳性细胞数差异无统计学意义(P>0.05)。结论在大鼠局灶性脑缺血损伤模型中,MT可有效减低rDWI-SI值,并可抑制Fas、FasL、活性Caspase-3蛋白表达。
扩散磁共振成像;脑缺血;褪黑素
脑缺血后恢复血液灌注,对脑组织会造成更严重的损伤,即缺血再灌注(ischemia reperfusion, IR)损伤。局灶性脑缺血损伤的形成与神经细胞凋亡密切相关[1]。通过DWI在活体组织内检测水分子弥散运动,可早期、准确发现脑缺血性病灶。褪黑素(N-acetyl-5-methoxytryptamine, MT)是一种广谱抗氧化剂和有效的自由基清除剂,可通过抗氧化、抗凋亡、抗炎等多种途径起到神经保护作用[2]。本课题组前期研究[3]发现利用DWI技术可反映MT对脑缺血后神经保护作用,但其减轻细胞凋亡、促进神经修复的机制尚不明确。本实验于建立大鼠大脑中动脉栓塞(middle cerebral artery occlusion, MCAO)模型前后注射MT,对大鼠做行为学评分,并通过DWI技术观察脑组织信号,分析DWI信号变化情况,进一步结合免疫组织化学染色探讨MT对局灶性脑缺血细胞凋亡的影响。
1 材料与方法
1.1大鼠MCAO模型建立及分组 成年雄性SD大鼠80只购自济南实验动物和动物实验中心,并由其授权使用[批号SCXK(鲁2015-0001)],体质量280~320 g,平均(296.37± 9.48)g。采用随机数字表法随机分为3组,于腹腔注射10%水合氯醛(剂量3.5 ml/kg体质量)麻醉后分别对各组进行不同操作。对MCAO组32只大鼠采用Longa等的方法[4]并结合本课题组前期实验[3,5-6]的经验建立MCAO模型,于IR前后30 min分别腹腔注射生理盐水(剂量5 ml/kg体质量);对MT组32只大鼠建立MCAO模型,于IR前后30 min分别腹腔注射MT(剂量5 ml/kg体质量);对Sham组16只大鼠分离右侧颈总动脉后缝合,手术前后30 min分别腹腔注射生理盐水(剂量为5 ml/kg体质量)。
1.2行为学评价 待大鼠麻醉清醒,采用Longa等[4]的方法对3组大鼠进行行为学评分并记录神经功能缺失症状:0分,无行为学异常改变;1分,梗死对侧前肢屈曲呈抱拳样;2分,梗死对侧肢体肌力及侧推力减弱;3分,行走时向对侧转圈或倾倒;4分,意识障碍、瘫痪或死亡。将MCAO组及MT组中评分为1~3分者纳入研究。
1.3MR检查 各组大鼠均于假手术或IR后6 h、24 h、72 h、7天行脑冠状位DWI扫描,采用GE Signa Excite HDXT 3.0T MR扫描仪,腹腔注射10%水合氯醛(剂量3.5 ml/kg体质量)进行麻醉后,将大鼠俯卧位放置于腕关节线圈内。DWI扫描参数:b=0、1 000 s/mm2,TR 2 400 ms,TE 94.5 ms,NEX 3,矩阵160×160,层厚3 mm,层间距0.2 mm。
利用GE AW 4.2工作站及Functool图像后处理软件进行图像分析,选择脑缺血损伤最大层面,于患侧病灶中心和对侧镜像区分别放置3个面积为2 mm2的ROI,测量病变侧及对侧镜像区DWI信号强度(diffusion weighted imaging signal intensity, DWI-SI)值并计算其平均值。而后计算相对DWI信号强度(relative diffusion weighted imaging signal intensity, rDWI-SI),即病变侧与对侧镜像区DWI-SI的比值。
1.4Fas、FasL、活性Caspase-3免疫组化染色观察 分别于假手术或IR后6 h、24 h、72 h、7天进行组织学观察。Sham组各时间点随机选取4只大鼠;MCAO组术后6 h随机选取8只大鼠,24 h、72 h、7天各随机选取7只大鼠;MT组6 h、24 h随机选取8只大鼠, 72 h、7天随机选取7只大鼠。腹腔注射10%水合氯醛(剂量3.5 ml/kg体质量)麻醉后,采用生理盐水及4%多聚甲醛进行心脏灌注,断头取脑后以4%多聚甲醛固定,将大鼠脑组织包埋并制成5 μm切片。进行Fas、FasL及Caspase-3免疫组化染色后,观察染色情况并于高倍镜(×400)下随机选取梗死灶5个视野,利用CellSens Dimension 1.6软件测量图片面积,计算Fas、FasL、活性Caspase-3阳性细胞数(个/mm2),取平均值。
1.5统计学分析 采用SPSS 22.0统计学分析软件,计量资料以±s表示。大鼠行为学评分比较采用Kruskal-WallisH秩和检验;rDWI-SI值及免疫组化阳性细胞数的比较采用单因素方差分析,方差齐时组间两两比较采用LSD法,方差不齐时采用Tamhane's法。P<0.05为差异有统计学意义。
2 结果
2.1行为学评分 麻醉清醒后,Sham组16只大鼠行为学评分均为0分,神经功能正常;MCAO组3只、MT组2只大鼠评分为4分,不纳入实验;最终Sham组16只、MCAO组29只、MT组30只大鼠纳入研究。3组大鼠行为学评分差异有统计学意义(χ2=50.125,P<0.01);Sham组大鼠评分保持稳定,无神经功能缺失症状;MCAO组和MT组大鼠行为学评分均明显高于Sham组(P均<0.01),MT组行为学评分低于MCAO组(P<0.01),见图1。
2.2DWI分析 Sham组DWI未见异常信号。MCAO组及MT组患侧大脑皮质及纹状体DWI呈明显高信号(图2A);IR后6~72 h,MT组异常信号范围较MCAO组减小(图2B)。IR后6 h、24 h、72 h,MCAO组及MT组rDWI-SI值均随时间延长呈升高趋势,于72 h达到峰值,而后逐渐减低。MCAO组及MT组IR后6 h、24 h、72 h、7天rDWI-SI值均高于Sham组假手术后相应时间rDWI-SI值(P均<0.01);IR后6 h、24 h、72 h,MCAO组rDWI-SI值均高于MT组(P均<0.05);IR后7天,MT组与MCAO组间rDWI-SI值差异无统计学意义(P>0.05)。见表1。
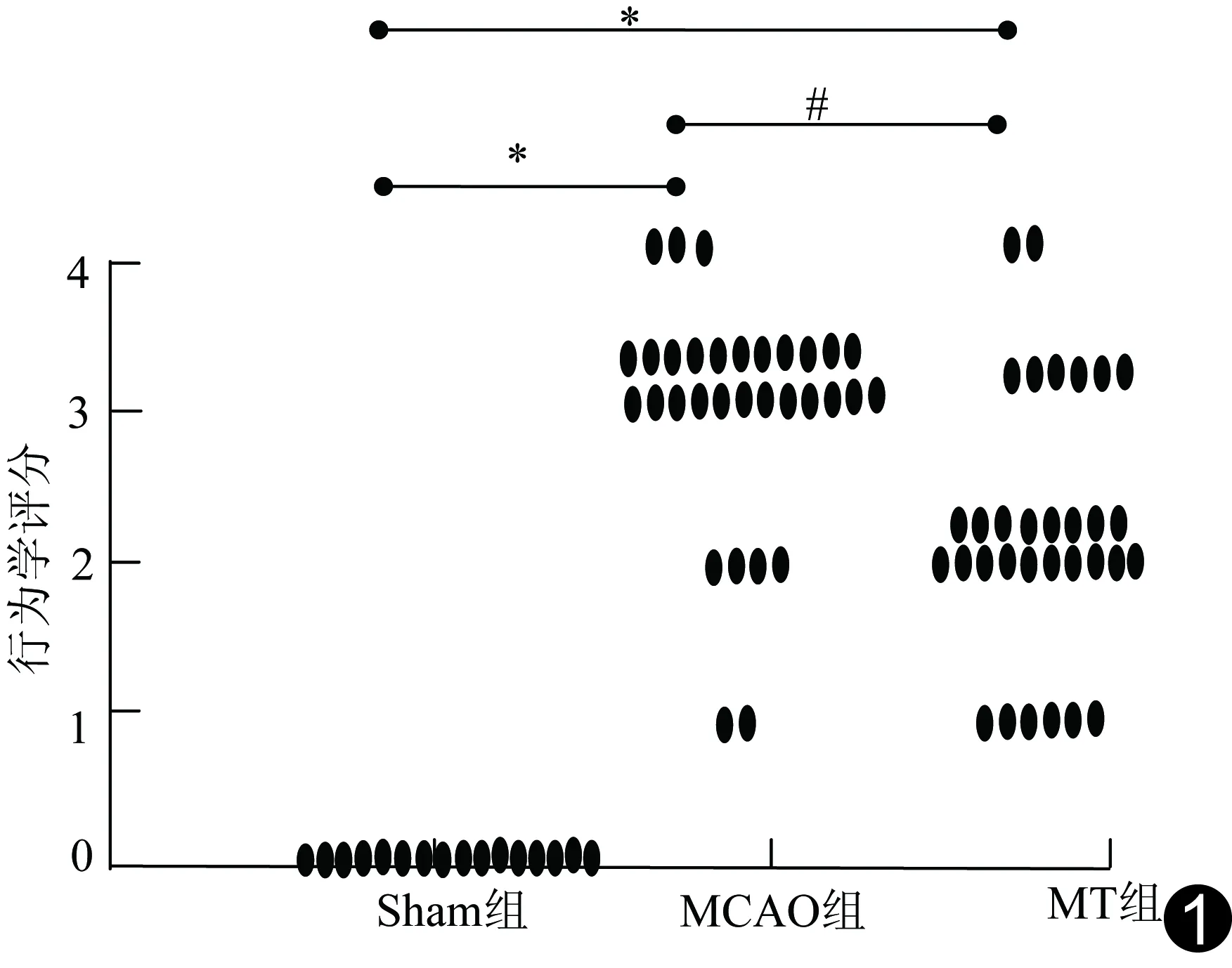
图1 各组大鼠行为学评分比较 (与Sham组比较,*:P<0.01;#:与MCAO组比较,P<0.01)
2.3免疫组化
2.3.1Fas、FasL染色 Sham组脑皮质细胞排列整齐、走行规律,Fas、FasL标记细胞较少,间隙无水肿。IR后6~72 h,MT组及MCAO组皮质细胞皱缩变形,Fas、FasL阳性细胞增多,排列紊乱,组织间隙水肿较重,阳性细胞与Sham组比较差异均有统计学意义(P均<0.01)。MT组皮质细胞排列较规律,周围水肿轻,阳性细胞数较MCAO组减少(P均<0.05)。IR后7天,3组间阳性细胞数差异无统计学意义(P>0.05)。见表2、3,图3、4。
表1 各组大鼠IR后不同时间点rDWI-SI值比较(±s)
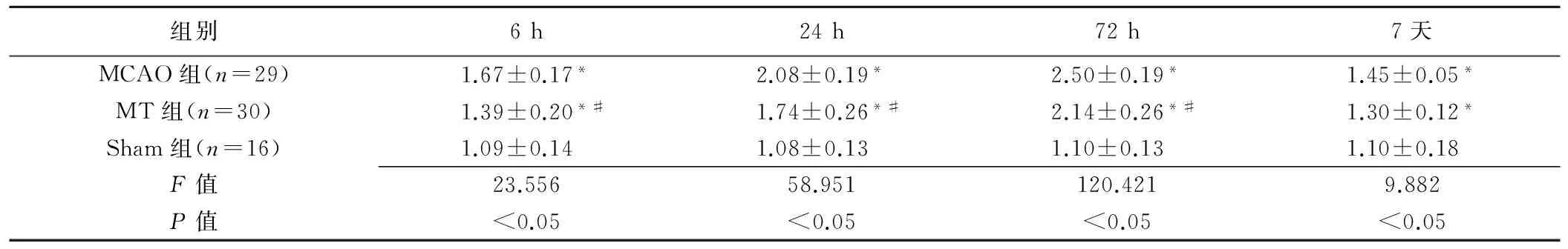
表1 各组大鼠IR后不同时间点rDWI-SI值比较(±s)
组别6h24h72h7天MCAO组(n=29)1.67±0.17*2.08±0.19*2.50±0.19*1.45±0.05*MT组(n=30)1.39±0.20*#1.74±0.26*#2.14±0.26*#1.30±0.12*Sham组(n=16)1.09±0.141.08±0.131.10±0.131.10±0.18F值23.55658.951120.4219.882P值<0.05<0.05<0.05<0.05
注:*:与Sham组比较,P<0.01;#:与MCAO组比较,P<0.05
2.3.2活性Caspase-3染色 Sham组海马CA1区细胞排列整齐、紧密,仅见少数活性Caspase-3细胞。IR后6 h,MT组及MCAO组CA1区细胞皱缩变形,间隙增宽,活性Caspase-3细胞增多;IR后24、72 h阳性细胞数进一步增多,细胞形态更加不规则,水肿进一步加重,部分细胞呈空泡样改变。MCAO组及MT组IR后6、24、72 h阳性细胞数均较Sham组假手术后相应时间增多,差异均有统计学意义(P均<0.05);但MT组细胞排列较为规律,周围水肿较轻,活性Caspase-3阳性细胞数较MCAO组减少(P均<0.05)。IR后7天,3组间阳性细胞数差异无统计学意义(P>0.05)。见表4、图5。
3 讨论
目前认为局灶性脑缺血损伤涉及细胞凋亡、自由基损伤、氧化应激、Ca+超载、炎症等多种因素,各因素相互作用,构成复杂的级联损伤反应,加重神经功能损伤[1]。急性应激状态时机体MT浓度降低、功能紊乱,MT对局灶性脑缺血损伤中具有神经保护作用[7]。本实验采用DWI技术观察MT对局灶性脑缺血大鼠的影响,结合行为学评分、Fas、FasL、活性Caspase-3免疫组织化学染色,探讨MT治疗局灶性脑缺血的神经保护作用机制。
行为学评分是对MCAO模型重要且极易获得的参考指标,可用于评价神经功能损伤及修复情况。本实验研究结果表明,MT组和MCAO组行为学评分均不同程度增高,但MT组行为学评分低于MCAO组,提示MT组神经功能恢复更快,MT治疗可起到神经保护的作用。DWI技术已在缺血性脑卒中的早期发现及早期诊断中得到广泛应用,可准确评估机体水分子的弥散运动。rDWI-SI值可用以判断急性脑缺血损伤且具有较大潜力[8]。本研究发现,MT组及MCAO组rDWI-SI值明显升高,于IR后72 h达到峰值,此后逐渐减低,这可能由于缺血早期,脑血流量降低,细胞缺血缺氧,细胞外水分子进入细胞内,细胞毒性水肿导致DWI-SI升高,而随着缺血再灌注时间进一步延长,血脑屏障进一步破坏,细胞外间隙水分子弥散强度降低,此时DWI-SI值有所下降。此外,本研究中MT组rDWI-SI值低于MCAO组,提示MT可减轻局灶性脑缺血异常水分子弥散运动,抑制缺血损伤反应。
表2 各组大鼠IR后不同时间点Fas阳性细胞数比较(个/mm2,±s)

表2 各组大鼠IR后不同时间点Fas阳性细胞数比较(个/mm2,±s)
组别6h24h72h7天MCAO组(n=29)322.80±35.23*436.99±43.50*498.47±70.99*153.71±28.00MT组(n=30)223.98±40.04*#270.09±46.97*#333.78±38.51*#127.36±21.40Sham组(n=16)116.57±19.26117.98±22.47118.58±31.44120.78±22.78F值49.61582.95272.4852.588P值<0.05<0.05<0.05>0.05
注:*:与Sham组比较,P<0.01;#:与MCAO组比较,P<0.05
表3 各组大鼠IR后不同时间点FasL阳性细胞数比较(个/mm2,±s)

表3 各组大鼠IR后不同时间点FasL阳性细胞数比较(个/mm2,±s)
组别6h24h72h7天MCAO组(n=29)289.86±45.67*346.96±50.67*426.01±66.51*109.80±17.36MT组(n=30)191.05±39.28*#283.27±52.31*#351.35±32.01*#96.62±19.64Sham组(n=16)82.26±18.3481.66±15.9374.66±21.1287.86±11.85F值40.79251.76487.1822.210P值<0.05<0.05<0.05>0.05
注:*:与Sham组比较,P<0.01;#:与MCAO组比较,P<0.05
表4 各组大鼠IR后不同时间点活性Caspase-3阳性细胞数比较(个/mm2,±s)

表4 各组大鼠IR后不同时间点活性Caspase-3阳性细胞数比较(个/mm2,±s)
组别6h24h72h7天MCAO组(n=29)118.23±18.65**174.33±22.89**227.67±17.65**79.19±14.47MT组(n=30)93.49±15.91*#125.38±20.26**#193.02±22.37**#76.99±13.33Sham组(n=16)72.14±8.3468.94±10.8368.74±15.3165.74±12.06F值11.90239.663100.1201.466P值<0.05<0.05<0.05>0.05
注:*:与Sham组比较,P<0.05,**:P<0.01;#:与MCAO组比较,P<0.05

图2 大鼠MACO模型建立后72 h DWI图 A.MCAO组右侧大脑半球可见大片状高信号; B.MT组右侧大脑半球异常信号范围较小 图3 大鼠MACO模型建立后72 h大脑皮质Fas免疫组化染色图(×400) A.MCAO组阳性细胞增多,水肿较重; B.MT组细胞排列较规律,阳性细胞较少,水肿减轻 图4 大鼠MACO模型建立后72 h大脑皮质FasL免疫组化染色图(×400) A.MCAO组阳性细胞增多,水肿较重; B.MT组细胞排列较规律,阳性细胞较少,水肿减轻 图5 大鼠MACO模型建立后72 h海马区活性Caspase-3免疫组化染色图(×400) A.MCAO组细胞皱缩变形,活性Caspase-3阳性细胞较多; B.MT组活性Caspase-3阳性细胞较少
Fas、FasL可调控细胞凋亡信号传导,减轻组织神经功能损害[9]。本研究结果显示,IR后6 h、24 h、72 h MT组和MCAO组阳性细胞增多,提示凋亡细胞数明显增加,组织水肿严重,但MT组阳性细胞数较MCAO组减少,表明MT能阻断Fas、FasL凋亡通路,减少神经细胞凋亡,促进神经功能恢复,与王晓天等[10]的研究结果相符。Fas、FasL相协同,可改变机体内环境激活Caspase,促进细胞凋亡。Caspase-3作为Caspase家族最重要的成员之一,是调控多条凋亡途径的关键蛋白,其激活将促进细胞凋亡[11]。有研究[12]表明,Caspase-3激活将发生一系列损伤反应,引起梗死灶及缺血半暗带区大量迟发性细胞凋亡。而在缺血性神经损伤过程中,抑制Caspase-3 活化可产生神经保护作用[13]。本研究发现MT可减少活性Caspase-3表达,从而抑制损伤级联反应,发挥神经修复功能。
综上所述,神经行为学评分结合DWI对评估神经功能恢复具有重要意义。DWI显示MT可使rDWI-SI值减低。MT可通过降低Fas、FasL蛋白的表达,抑制活性Caspase-3的活化,减轻局灶性脑缺血大鼠缺血侧脑组织神经细胞的凋亡,具有神经保护作用。
[1] Yasuda N, Ishii T, Oyama D, et al. Neuroprotective effect of nobiletin on cerebral ischemia-reperfusion injury in transient middle cerebral artery-occluded rats. Brain Res, 2014,1559:46-54.
[2] Bavithra S, Selvakumar K, Sundareswaran L, et al. Neuroprotective effect of melatonin against PCBs induced behavioural, molecular and histological changes in cerebral cortex of adult male Wistar rats. Neurochem Res, 2017,42(2):428-438.
[3] 蔡立珍,闫少珍,王晓莉,等.MRI-DWI评估褪黑素对脑缺血再灌注损伤保护作用的实验研究.临床放射学杂志,2015,34(12):1999-2002.
[4] Longa EZ, Weinstein PR, Carlson S, et al. Reversible middle cerebral artery occlusion without carniectomy in rats. Stroke, 1989,20(1):84-91.
[5] 闫少珍,王晓莉,赵月华,等.DWI评估N-乙酰-5-羟色胺对脑缺血再灌注大鼠脑水肿的影响.中国医学影像技术,2016,10(32):1475-1479.
[6] Zhao Y, Wang X, Dong P, et al. Bone marrow derived mesenchymal stem cells alleviated brain injury via down-regulation of interleukin-1β in focal cerebral ischemic rats. Am J Transl Res, 2016,8(3):1541-1550.
[7] Koh PO. Melatonin regulates the calcium-buffering proteins, parvalbumin and hippocalcin, in ischemic brain injury. J Pineal Res, 2012,53(4):358-365.
[8] Madai VI, Galinovic I, Grittner U, et al. DWI intensity values predict flair lesions in acute ischemic stroke. PLoS One, 2014,9(3):e92295.
[9] Niu FN, Zhang X, Hu XM, et al. Targeted mutation of Fas ligand gene attenuates brain inflammation in experimental stroke. Brain Behav Immun, 2012,26(1):61-71.
[10] 王晓天,刘晓梅,尤红娟,等.P38MAPK介导的Fas/FasL凋亡通路在缺血性脑损伤中的作用研究.中国医药指南,2014,12(31):1-2.
[11] Yin X, Yin Y, Cao FL, et al. Tanshinone IIA attenuates the inflammatory response and apoptosis after traumatic injury of the spinal cord in adult rats. PLoS One, 2012,7(6):e38381.
[12] Zhao LD, Wang JH, Jin GR, et al. Neuroprotective effect of Buyang Huanwu Decoction against focal cerebral ischemia/reperfusion injury in rats-time window and mechanism. J Ethnopharmacol, 2012,140(2):339-344.
[13] Chelluboina B, Klopfenstein JD, Gujrati M, et al. Temporal regulation of apoptotic and anti-apoptotic molecules after middle cerebral artery occlusion followed by reperfusion. Mol Neurobiol, 2014,49(1):50-65.
Effects of melatonin on diffusion weighted imaging and expression of Fas, FasL, cleaved Caspase-3 proteins in rats of focal cerebral ischemia
WANG Haiyu1, CHEN Lanfen1, WANG Xiaoli1,2*, YAN Shaozhen1, MU Qingjie3, ZHAO Yansong4
(1.Department of Medical Imaging, Weifang Medical University, Weifang 261053, China; 2.Medical Imaging Center, 4.Department of Ophthalmology, the Affiliated Hospital of Weifang Medical University, Weifang 261031, China; 3.Department of Hematology, Clinical Medicine College of Weifang Medical University, Weifang 261053, China)
ObjectiveBased on middle cerebral artery occlusion (MCAO) model, to investigate the effects of melatonin (MT) on DWI and expression of Fas, FasL and cleaved Caspase-3 proteins in rat model with focal cerebral ischemia.MethodsEighty SD rats were randomly divided into Sham group (n=16), MCAO group (n=32) and MT group (n=32). The rats in sham group were treated with sham-operation. And the rats in MCAO and MT groups were peritoneally injected with saline and MT respectively. The behavioral scores were assessed in the three groups. The rats in MCAO and MT group with the behavioral scores of 1—3 points were selected in the study. The DWI relative signal intensity (rDWI-SI), Fas, FasL and cleaved Caspase-3 proteins were respectively examined by MR scaning and immunohistochemical staining in all rats of each group at 6 h, 24 h, 72 h and 7 days after ischemia reperfusion (IR) or sham-operation. And the DWI and immunohistochemical results for each group were compared.ResultsAt last, there were 16 rats in sham group, 29 rats in MCAO group and 30 rats in MT group, respectively. There was significant difference of the behavioral scores among the three groups (χ2=50.125,P<0.01). The behavioral scores of MT and MCAO groups were higher than those of sham group (allP<0.05). And the behavior scores of the MT group were lower compared with MCAO group after IR. Compared with the rDWI-SI values measured at 6 h, 24 h and 72 h, 7 days in sham group, the rDWI-SI values of MT and MCAO groups were significantly higher (allP<0.01). And the rDWI-SI was higher in MCAO group than those in MT group at 6 h, 24 h and 72 h after IR (allP<0.01). And there was no significant difference of rDWI-SI at 7 days after IR between MT and MCAO groups (P>0.05). The immunohistochemical staining results showed that the number of Fas, FasL and cleaved Caspase-3 positive cells in MCAO and MT groups were significantly higher than those in sham group (allP<0.01). And there were less Fas, FasL and cleaved Caspase-3 positive cells in MT groups compared with MCAO group (allP<0.05) at 6 h, 24 h and 72 h after IR. There was no significant difference of Fas, FasL and cleaved Caspase-3 positive cells among the three groups at 7 days after IR (P>0.05).ConclusionMT can effectively alleviate the rDWI-SI value and inhibit the expression of Fas, FasL and cleaved Caspase-3 proteins in rats of focal cerebral ischemia.
Diffusion magnetic resonance imaging; Brain ischemia; Melatonin
山东省自然科学基金(ZR2014HQ077、ZR2014JL049)、国家自然科学基金(81000268)。
王海宇(1992—),男,山东日照人,在读硕士。研究方向:脑损伤疾病的影像学研究。E-mail: wanghy_wfmc@163.com
王晓莉,潍坊医学院医学影像学系,261053; 潍坊医学院附属医院医学影像中心,261031。E-mail: wxlpine@163.com
2017-01-12 [
] 2017-06-26
10.13929/j.1003-3289.201701073
R-332; R445.2
A
1003-3289(2017)09-1309-06
