肝脂肪变对HBV转基因小鼠肝组织学进展的影响及分子机制的研究
2017-09-15柳银兰刘静陆璐庄振杰罗燕施军平
柳银兰 刘静 陆璐 庄振杰 罗燕 施军平⋆
肝脂肪变对HBV转基因小鼠肝组织学进展的影响及分子机制的研究
柳银兰 刘静 陆璐 庄振杰 罗燕 施军平⋆
目的 探讨肝脂肪变对HBV转基因小鼠肝组织学进展的影响及肝脏脂质代谢和纤维化相关的关键信号分子基因表达的变化。方法 用H&E染色、血生化检测及荧光定量PCR的方法,比较高脂饮食和普通饮食喂养HBV转基因小鼠肝脏病理、生化指标及脂质代谢和纤维化相关基因的表达变化。结果 高脂饲料喂养使HBV-DNA下降(P<0.05),肝组织NAS病理评分增加(P<0.05),PPARα、SMAα、Coll-I、TGFβ1、SMAD3表达增高,PPARγ、SMAD7表达降低。结论 高脂饮食可影响HBV转基因小鼠肝组织学进展,其影响可能与SMAα、Coll-I、核因子PPARα、TGFβ1/SMAD3基因表达上调及SMAD7、PPARγ下调有关。
高脂饮食 肝脂肪变 乙型肝炎病毒 转基因
乙型肝炎病毒(HBV)慢性感染系一进展性疾病,约15%~40%的慢性HBV感染者最终将进展为肝硬化、肝衰竭和肝细胞癌(HCC)而致死[1]。非酒精性脂肪肝(NAFLD)是由各种致病因子所致的肝内脂肪变,是一种与胰岛素抵抗、脂代谢紊乱和遗传易感密切相关的代谢应激性肝脏损伤,目前已成为全球重要的公共健康问题之一[2]。与慢性乙型肝炎(CHB)一起构成慢性肝病的两大主要病因。2011年4月至2012年10月作者通过实验,探讨肝脂肪变对HBV转基因小鼠肝组织学进展的影响及脂肪变关键信号分子基因表达的变化。
1 材料与方法
1.1 实验动物与分组 4周龄BALB/c HBV转基因小鼠50只,体重18~22g,雌雄各半,由广州空军458医院提供。高脂组小鼠30只予以高脂饲料喂养,正常组小鼠20只予以普通饲料喂养。24周末随机处死高脂组、正常组小鼠各10只,经肝组织及血清学检测确认目标模型建立。造模成功后将高脂组小鼠再随机分为模型组和对照组,每组各10只,模型组小鼠继以高脂饲料喂养,对照组改以普通饲料喂养,正常组小鼠维持原普通喂饲,连续72周(含造模24周)。
1.2 观察标本采集 分别于第24、72周末禁食不禁水12h后,眼球采血后处死小鼠,3000r/min离心10min分离血清,-20℃保存用于血清学指标检测。迅速分离整个肝脏称重后,于肝右叶中部切取肝组织3mm×3mm×6mm,以4%多聚甲醛固定(以pH7.4的PBS配制),逐级酒精二甲苯脱水,常规石蜡包埋切片用于病理检查及免疫组化染色。
1.3 指标检测及方法 (1)一般情况:称重1次/周,观察体质量、食欲行为、状态、毛发、小鼠死亡情况;实验结束后处死小鼠称肝脏湿重,并计算肝指数(肝重/体质量×100%)。(2)病理组织学检查:常规HE染色,光镜下观察小鼠肝细胞脂肪变性程度、气球样变性、小叶内及汇管区炎症程度以评定NAFLD活动度计分(NAS),脂肪肝病理组织学诊断参考非酒精性脂肪性肝炎(NASH)临床研究网络病理委员会制定的NAFLD组织学评分系统[3]。见表1。(3)血清生化指标检测:采用BECKMAN 5400全自动生化仪测定血清丙氨酸转氨酶(ALT)、天冬氨酸转氨酶(AST)、总胆固醇(TC)、甘油三酯(TG)、空腹血糖(FBG)的含量或活性;其中ALT、AST活性采用速率法;TC、TG含量采用双试剂酶法;FBG含量采用过氧化物酶-氧化酶法进行检测。(4)HBV-DNA 及各信号分子基因表达的检测:Trizol法提取总RNA,应用英俊MMLT-V逆转录试剂盒将总RNA逆转录为cDNA,取1μlcDNA 为模板,加入2×SYBR Super Mix 12.5μl,引物终浓度为400μM,加水使反应终体积为25μl。引物序列见表2,由生工生物工程有限公司合成。以Actin 为内参,mRNA 与内参相对表达量用2-ΔΔCt值表示。

表1 NAFLD组织学评分系统

表2 荧光定量PCR引物序列
1.4 统计学方法 采用SPSS17.0统计软件。计量数据用(x±s)表示,组间比较采用单因素方差分析,以P<0.05为差异有统计学意义。
2 结果
2.1 血清生化指标 高脂喂养24周后,BALB/c HBV转基因小鼠体质量较正常组明显升高,血清ALT、TC、TG水平较正常组明显增加,差异有统计学意义(P<0.05),两组AST、FBG水平差异无统计学意义(P>0.05)见表3。喂养72周后,模型组、对照组及正常组小鼠血清ALT、AST、TC、TG、FPG水平差异无统计学意义(P>0.05)。见表4。
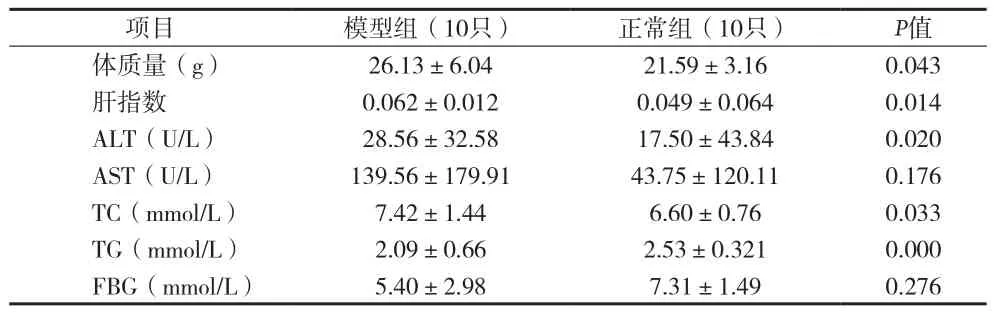
表3 24周后各组实验小鼠一般情况、体质指标和生化指标比较(x±s)
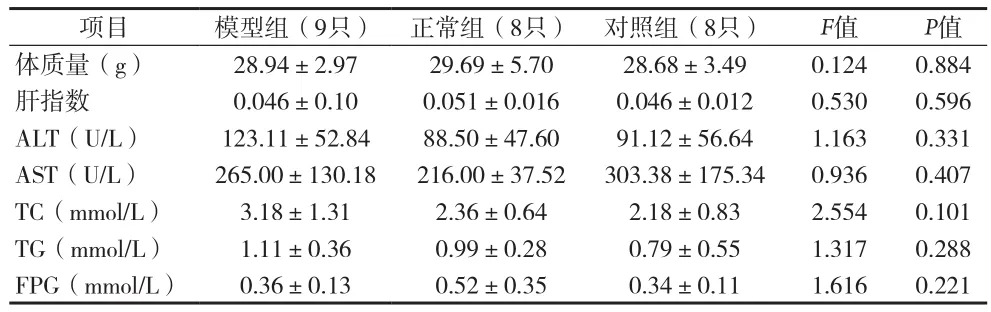
表4 72周各组实验小鼠一般情况、体质指标和生化指标比较(x±s)
2.2 各组小鼠血清HBV-DNA水平 24周末模型组和正常组BALB/c HBV转基因小鼠血清HBV-DNA均阳性,正常组HBV-DNA水平明显高于模型组,差异有统计学意义(P<0.05);72周末模型组、正常组及对照组小鼠血清HBV-DNA均阳性,模型组小鼠血清HBV-DNA水平明显低于对照组及正常组(P<0.05)。见表5。

表5 小鼠血清HBV-DNA水平比较[Log10 copies/mL,(x±s)]
2.3 小鼠肝脏病理学变化 高脂喂养24周后,小鼠肝组织HE染色示肝细胞无明显脂肪变性和小叶内淋巴细胞浸润,模型组与对照组NAS积分差异无统计学意义(P>0.05)。72周末,模型组小鼠肝组织HE染色示肝细胞明显大泡性脂肪变性和小叶内淋巴细胞浸润,NAS积分较对照组及正常组高,差异有统计学意义(P<0.05)。见表4。

表4 小鼠肝组织NAFLD活动度积分比较(x±s)
2.4 小鼠肝组织各基因mRNA 的表达 72周模型组PPARα、SMAα、Coll-I、TGFβ1、SMAD3 mRNA表达较正常组明显增高,差异有统计学意义(P<0.05);PPARγ、SMAD7表达较正常组明显降低,差异有统计学意义(P<0.05);各信号分子异常表达在对照组出现改善,其中PPARα、PPARγ、SMAD7表达接近于正常组,差异无统计学意义(P>0.05)。见图1。

图1 各组小鼠72周时肝脏目标基因表达
3 讨论
CHB和NAFLD已逐渐成为威胁我国人民健康的两大肝病。Fan[4]等研究报道CHB与NAFLD并存患者愈来愈多,已成为国人常见的慢性肝病。研究显示,NAFLD和CHB之间可能存在复杂的相互作用,NAFLD合并CHB在危险因素、疾病进展和转归预后等方面不同于单纯的NAFLD或CHB[5]。然而,目前尚无针对HBV慢性感染合并NAFLD建立的成熟动物模型,相关发病机制无法进一步深入研究。本资料结果显示小鼠体质量较初始明显升高,各项生化指标与正常组小鼠相比明显升高,血清HBVDNA检测阳性,光镜下发现肝细胞明显脂肪变性,肝小叶内淋巴细胞浸润明显,纤维化不明显,NAS评分接近NASH,故而认定高脂喂养HBV转基因小鼠可建立慢性HBV携带合并NAFLD小鼠模型。
肝脂肪变性常发生于慢性病毒性肝炎,即CHB和慢性丙型肝炎(CHC)。目前研究多认为感染丙型肝炎病毒(HCV)基因3 型的人肝脏脂肪变可直接归因于丙型肝炎病毒,其机制与HCV 核心蛋白抑制微粒体甘油三酯转运蛋白(MTP)活性,干扰极低密度脂蛋白(VLDL)在肝内的装配和分泌有关[6]。且HCV 核心蛋白与载脂蛋白AⅡ(Apo AⅡ)相互作用形成异二聚体,干扰破坏肝细胞中脂类代谢的正常通路,导致肝细胞脂肪变[7]。HCV Ⅰ型和Ⅳ型的感染,胰岛素抵抗和氧化应激可能促使脂肪酸重新生物合成,损伤线粒体β氧化作用,并干扰甘油三酯的组装和合成[8]。本资料结果显示24周末模型组与正常组小鼠各项血清生化指标差异有统计学意义,而72周末三组小鼠血清生化指标差异无统计学意义,提示HBV病毒感染可能影响肝脏脂肪代谢,从而导致肝细胞脂肪变。本资料中,高脂饲料喂养HBV转基因小鼠72周后,模型组小鼠肝组织SMAα、Coll-I基因表达较正常组增高提示纤维化进程的启动,核因子PPARα上调、PPARγ下调、TGFβ1/SMAD3上调及SMAD7下调参与其肝组织学病变的进展,提示高脂饮食会加重HBV慢性感染合并NAFLD的进展;对照组各信号分子基因表达较模型组有所改善,与正常组基本接近,提示调整饮食可减缓HBV慢性感染合并NAFLD的进展,也印证HBV慢性感染合并NAFLD的治疗首要是改变生活方式,调整饮食结构。
[1] 刘萱,贾继东.乙型肝炎病毒感染的自然病程.中华肝脏病杂志,2006,14(3):210-211.
[2] Affo S,Morales-Ibanez O,Rodrigo-Torres D,et al. CCL20 mediates lipopolysaccharide induced liver injury and is a potential driver of inflammation and fibrosis inalcoholic hepatitis.Gut,2014,23(1):32-36.
[3] Altlparmak E,Kokdu S,Yalinkilic M,et al.Viral and host causes of fatty liver in chronic hepatitis B.World J Gastroenterol, 2005, 11:3056-3059.
[4] Fan JG.Farrell GC.Epidemiology of non-alcoholic fatty liver disease in China.Hepamol,2009,50:204-210.
[5] Yen SL,Chiu YT,Lin YC,et al.Obesity and hepatitis B infection are associated with increased risk of metabolic syndrome in university freshmen.Int Obes(Lond),2008,32:475-480.
[6] Perlemuter G,Sabile A,Letteton P,et al. Hepatitis C virus core protein inhibits microsomal triglyceride transfer protein activity and very low density lipoprotein secretion:a model of viral-related steatosis.Faseb J,2002,16(2):185-194.
[7] Shi ST,Polyak SF,Tu H,et al. Hepatitis C virus NS5 colocalizes with the core protein on lipid drop lets and nteracts with apolipop roteins.Virology,2002,292:198-210.
[8] Bjornsson E,Angulo P. Hepatitis C and steatosis.Arch Med Res,2007,38:621-627.
Objective To investigate how hepatic steatosis affects the pathologic progression of HBV transgenic mice and the alteration in expression of key molecule related to lipid metabolism and fibrosis. Method H&E staining,biochemistry test and realtime PCR were employed to study the changes caused by high fat diet in liver pathology,serum biochemistry,lipid metabolism and fibrosis related gene expression. Results High fat diet decreased HBV-DNA level and increased the NAS score(P<0.05),the expression levels of PPARα、SMAα、Coll-I、TGFβ1、SMAD3 were upregulated and PPARγ、SMAD7 were downregulated. Conclusion The effect of liver steatosis on the pathology progression of HBV transgenic mice is related to the upregulation of SMAα、Coll-I、PPARα、TGFβ1/SMAD3 and downregulation of SMAD7、PPARγ.
High fat diet Liver steatosis HBV transgenic mouse
浙江省自然科学基金项目(LQ17H070002);杭州市科技发展计划基金项目(20140633B09)
300014 杭州师范大学附属医院
*通信作者
